1例婴儿感染H9N2亚型禽流感病毒特征分析
2017-11-20黄一伟陈柏塘张恒娇谢群李文超李成华张斯钰黄超洋邓志红张红
黄一伟 陈柏塘 张恒娇 谢群 李文超 李成华 张斯钰 黄超洋 邓志红 张红
410005 长沙,湖南省疾病预防控制中心(黄一伟、张恒娇、李文超、张斯钰、黄超洋、邓志红、张红);423000 郴州市疾病预防控制中心(陈柏塘、谢群、李成华)
1例婴儿感染H9N2亚型禽流感病毒特征分析
黄一伟 陈柏塘 张恒娇 谢群 李文超 李成华 张斯钰 黄超洋 邓志红 张红
410005 长沙,湖南省疾病预防控制中心(黄一伟、张恒娇、李文超、张斯钰、黄超洋、邓志红、张红);423000 郴州市疾病预防控制中心(陈柏塘、谢群、李成华)
目的对1株从11月龄感染人禽流感的婴儿中分离的H9N2亚型禽流感病毒进行全基因组特征分析,推测可能的感染来源。方法从流感哨点监测医院采集流感样病例咽拭子标本,采用细胞分离方法分离流感病毒,对细胞分离物采用血凝试验、血凝抑制试验和荧光PCR的方法进行流感病毒的型别和亚型的鉴定,并对分离的病毒进行全基因组序列测序,对测定的核酸序列和推导的氨基酸序列采用生物信息学软件构建进化树进行比对分析。结果从1例婴儿流感样病例采集的标本中分离到1株季节性流感无法分型的流感病毒,经过荧光PCR方法分型,确认为H9N2亚型禽流感病毒,病例确诊为人感染H9N2禽流感病例。流行病学调查显示,病例无明确的禽类接触史和暴露史。病毒经全基因组测序得到8条基因序列,Blast分析表明片段均为禽源,与湖南省活禽市场外环境中分离的H9N2亚型禽流病毒的核苷酸同源性为97.5%~99.8%,未发现与人流感病毒发生基因片段重配。病毒属于基因型G57,推导的氨基酸序列分子特征分析显示病毒为典型的禽类中H9N2亚型禽流感病毒特征。结论虽然病例无明确的禽类接触史和暴露史,但分子溯源表明可能的感染来源仍为禽类。
禽流感是由甲型流感病毒引起的一种禽类传染性疾病,引起该疾病病毒的某些亚型如H5、H7和H9亚型可偶尔突破宿主屏障感染人类。其中H9N2亚型病毒在活禽批发和零售市场中广泛存在,是一种低致病性禽流感病毒,H9N2亚型禽流感病毒在新型禽流感病毒如H7N9和H10N8亚型的病毒产生过程中扮演着基因骨架的角色[1-2]。因此,H9N2亚型禽流感逐渐受到越来越多的关注。
最早的人感染H9N2禽流感实验室确诊病例出现在1998年,郭元吉等[3]从广东省的5名流感样病例采集的标本中分离出5株病毒。随后在中国香港、孟加拉等地出现了一些零星病例的报道[4-6]。一些血清学研究表明人感染H9N2禽流感病毒的情况可能比报道的更多[7-8]。由于H9N2病毒突破宿主屏障感染人只导致轻微的临床症状,因此存在一定的隐蔽性。2013年湖南省报告了全省首例人感染H9N2禽流感病例[9]。本研究是2015年湖南省发现的另外一例感染H9N2亚型的病例,病例具有特殊性,为小于1岁的婴儿,为了进一步追溯其可能的感染来源,本研究对从病例中分离的病毒进行全基因组序列测定和分析。
1 材料与方法
1.1标本采集郴州市第一人民医院作为流感监测哨点医院,根据原卫生部办公厅印发的《全国流感监测方案(2010年版)》[10]要求,每周采集流感样病例咽拭子标本送郴州市疾病预防控制中心实验室进行流感病毒分离试验。标本严格按照中国疾病预防控制中心《全国流感监测技术指南》[11]的要求采集和检测,咽拭子标本采集后,放入含采样液3 ml采样管中,4 ℃ 48 h内运送至实验室。标本采集获得患者家属知情同意。本研究通过湖南省疾病预防控制中心伦理委员会审查同意。
1.2病毒分离和鉴定实验室收到标本后立即进行检测或保存于-70 ℃直至检测。经鉴定流感病毒阳性且使用红细胞凝集抑制试验方法无法鉴定到季节性流感亚型的细胞上清液使用实时荧光RT-PCR方法再进行其他流感和禽流感病毒亚型的鉴定,具体步骤:取细胞培养上清液采用QIAamp Viral RNA Mini Kit试剂盒(QIAgen,Germany)提取核酸,核酸使用荧光RT-PCR法检测A和B型,以及H1、H3、H5、H7、H9和N2亚型。检测试剂为SuperScript III Platinum One-Step qRT-PCR试剂盒(Invitrogen,USA),试验步骤和反应条件参考试剂盒说明书。
1.3基因组测序经分离鉴定出的H9N2亚型禽流感毒株进行全基因组测序。毒株核酸提取和扩增采用QIAamp Viral RNA Mini Kit(QIAgen,Germany)与One step RT-PCR Kit(QIAgen,Germany)试剂盒,测序在AB 3730测序仪上完成,引物序列见参考文献[12]。
1.4数据分析序列比对采用Muscle软件,默认参数。进化树构建使用MEGA 6.06软件,采用最大似然法,采用Tamura-Nei模型,Bootstrap为1 000,其他为默认参数。辅助进化树构建和氨基酸位点比对的其他毒株序列从GenBank上下载。用于氨基酸位点比对的H9N2病毒为从湖南省活禽市场外环境标本中分离的毒株[13],包括:A/Envir-onment/Hunan/18556/2014、A/Environment/Hunan/27408/2014、A/Environment/Hunan/27420/2014、A/Environment/Hunan/28034/2014、A/Environment/Hunan/18355/2014、A/Environment/Hunan/18498/2014、A/Environment/Hunan/21403/2014、A/Environment/Hunan/18489/2014、A/Environment/Hunan/18370/2014、A/Environment/Hunan/25998/2014和A/Environment/Hunan/28028/2014。
2 结果
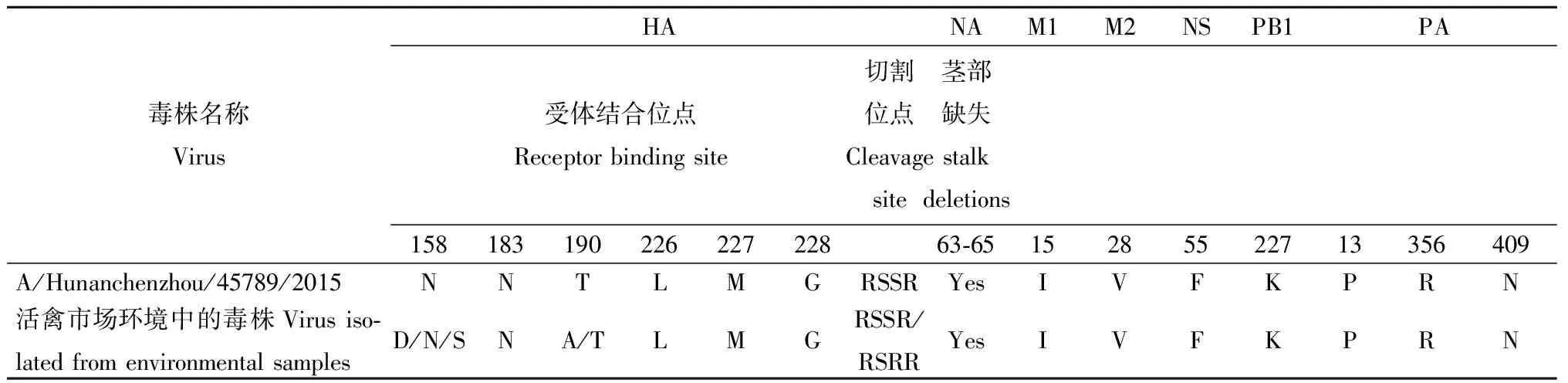
表1 分离的H9N2亚型禽流感病毒与环境中病毒的蛋白质关键位点比较

图1 1株从婴儿中分离的H9N2禽流感病毒HA、NA、PB2和PB1基因系统进化树Fig.1 Phylogenetic analysis of the HA, NA, PB2 and PB1 gene segments of the avian influenza H9N2 viruses isolated from an infant
2.1病例患儿,女,11个月龄,于2015年10月27日起发热,体温39.2 ℃;于28日在郴州市第一人民医院儿童医院就诊,当日除发热咽部红肿外还出现腹泻症状。血常规检查结果:白细胞7.9×109/L,中性粒细胞4.72×109/L,淋巴细胞2.18×109/L,单核细胞0.90×109/L,单核细胞比例11.8%,C反应蛋白12.88 mg/L。同时,作为流感样病例采集患儿的咽拭子标本。患儿体温28日晚恢复正常,29日起腹泻症状逐渐减轻,11月1日痊愈。流行病学调查显示,病例发病前10 d内未到过农贸市场、未接触过家禽和鸟类、无明确的禽类接触史和暴露史。
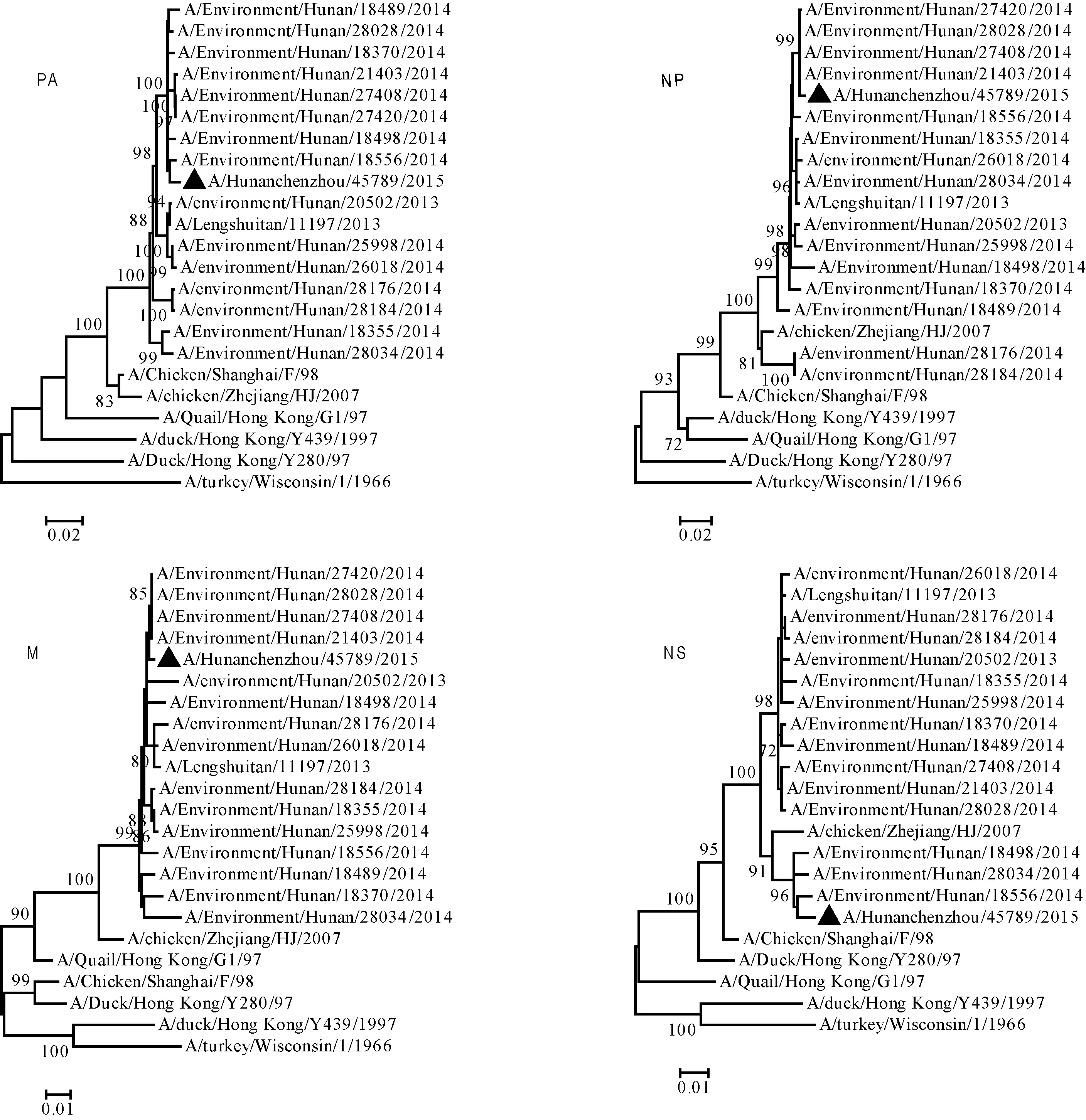
图2 1株从婴儿中分离的H9N2禽流感病毒PA、NP、M和NS基因系统进化树Fig.2 Phylogenetic analysis of the PA, NP, M and NS gene segments of the avian influenza H9N2 viruses isolated from an infant
2.2病毒分离和基因序列分析病例咽拭子经过2代MDCK细胞分离培养鉴定出流感病毒,经季节性流感血清鉴定试剂盒鉴定季节性流感A型H1亚型、H3亚型,B型Yamagata系和Victoria系均为阴性。故采用荧光PCR方法进行分型,结果A型、H9亚型和N2亚型为阳性,确认为H9N2亚型禽流感病毒,病毒命名为A/Hunanchenzhou/45789/2015。病毒经过全基因组测序,8条序列通过美国国立生物技术信息中心网站Blast分析表明,片段与禽类/环境中分离的H9N2亚型禽流感病毒99%同源。8条基因片段均是禽源,与湖南省活禽市场环境中分离的H9N2病毒同源性较高,与湖南活禽市场外环境中分离的H9N2病毒A/environment/Hunan/28028/2014同源性为97.5%~99.8%,未发现与人流感病毒发生基因片段重配。进一步构建基因进化树分析显示(图1A和1B),HA和NA基因属于Y280分支,8条基因片段共同分析,在进化树中与A/chicken/Zhejiang/HJ/2007在同一分支中,表明病毒为基因型G57(图1和图2)[14]。
2.3氨基酸位点分析对病毒核苷酸推导的氨基酸序列进行分子特征分析,与环境中分离株相比,本次人中分离的病毒在HA分子受体结合位点158位、190位以及HA分子切割位点上不同,见表1。HA分子连接肽位点为R-S-S-R结构。HA分子的受体结合位点,226位为氨基酸L,NA分子有63-65位点的缺失,未发现奥司他韦耐药性位点。M2分子115位为N的位点显示病毒表现为对金刚烷胺类药物的抗性。
3 讨论
2013年,湖南省通过流感哨点监测发现了全省首例H9N2病例,2015年,通过同样途径再次发现一例H9N2病例。病例的临床表现为典型上呼吸道症状,对从病例中分离的H9N2亚型禽流感病毒进行全基因组测序,分析显示,病毒全部8条基因片段与当前活禽市场中分离的禽流感病毒序列高度同源。与2013年发现的病例相比,本研究病例具有以下三个特点:一是患者年龄小,为不满1岁婴儿,目前是湖南省确诊年龄最小的人禽流感病例。二是流行病学调查未发现可能的感染来源。病例年龄较小,活动范围和能力有限,并无活禽市场暴露史。三是基因组序列分析显示与2013年病例的病毒序列以及环境中分离的H9N2病毒高度同源,未发生基因重配,病毒序列和推导的氨基酸序列未出现明显的变化。
本研究报道的H9N2人禽流感病例为不满1岁婴儿,2013年湖南省发现的首例病例为7岁儿童,近期我国安徽、江西、广东等多省报道的人感染H9N2禽流感,病例也均为儿童,这与H5N1和H7N9禽流感在人群年龄分布上存在差异[15-16]。H5N1在中国大陆地区主要感染青壮年,H7N9则主要感染中老年人。但由于目前国内对于H9N2在儿童中感染情况缺乏全面深入的研究报道,因此现有研究显示的H9N2易感染儿童这一特点,究竟是否确实是儿童对H9N2病毒更为易感,或者仅仅是因为成人感染H9N2后症状轻微导致就诊率低,还值得进一步研究。分离到的病毒分子特征分析显示HA分子连接肽位点为陆地禽类病毒特征,HA分子的受体结合位点表现出病毒对于人类受体亲和性的特征[17],病毒表现为对金刚烷胺类药物的抗性,但未发现奥司他韦耐药性位点。病毒为典型的禽类中H9N2亚型禽流感病毒特征。
虽然前述研究表明从患者体内分离的病毒与活禽市场中病毒高度同源,但流行病学调查并未发现直接的感染途径。尽管一般认为活禽市场禽流感病毒污染严重[18],活禽市场暴露史是人感染禽流感的风险因素之一,但仍有很大一部分病例未发现暴露源。本研究报道的病例为婴儿,活动范围受限,没有明显的活禽市场暴露史。虽然分子溯源显示其可能的感染来源仍为禽类,但人感染禽流感的途径仍存在很多未知因素,这也需要我们继续深入探索。
本研究病例拓宽了我们对人禽流感的认知领域,禽流感病毒以不经意的方式感染人类,如果患者仅表现为轻症,很可能并不会前去医院就诊,受限于目前的流感监测体系,感染病例很难全部被实验室诊断。而禽流感病毒一旦与人流感病毒发生重配,就可能产生新型的流感病毒,存在引发流感大流行的未知风险。不断出现的人禽流感病例,提示人感染禽流感病毒的风险持续存在。只有不断加强监测,及时发现病例,及早对传染病进行控制,防止二代病例的发生,同时通过对病例中分离的病毒进行基因分析,发现可能的变异位点,才能为流感大流行预测预警提供科学依据。
[1] Gao R, Cao B, Hu Y, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med, 2013, 368(20): 1888-1897. doi: 10.1056/NEJMoa1304459.
[2] Chen H, Yuan H, Gao R, et al. Clinical and epidemiological characteristics of a fatal case of avian influenza A H10N8 virus infection: a descriptive study[J]. Lancet, 2014, 383(9918): 714-721. doi: 10.1016/S0140-6736(14)60111-2.
[3] 郭元吉,李建国,程小雯,等. 禽H9N2亚型流感病毒能感染人的发现[J]. 中华实验和临床病毒学杂志,1999, 13(2): 105-108. doi:10.3760/cma.j.issn.1003-9279.1999.02.001.
[4] Uyeki TM, Chong YH, Katz JM, et al. Lack of evidence for human-to-human transmission of avian influenza A (H9N2) viruses in Hong Kong, China 1999[J]. Emerg Infect Dis, 2002, 8(2): 154-159. doi: 10.3201/eid0802.010148.
[5] Peiris M, Yuen KY, Leung CW, et al. Human infection with influenza H9N2[J]. Lancet, 1999, 354(9182): 916-917. doi: 10.1016/S0140-6736(99)03311-5.
[6] Shanmuganatham K, Feeroz MM, Jones-Engel L, et al. Antigenic and molecular characterization of avian influenza A(H9N2) viruses, Bangladesh[J]. Emerg Infect Dis, 2013, 19(9): 1393-1402. doi: 10.3201/eid1909.130336.
[7] Coman A, Maftei DN, Krueger WS, et al. Serological evidence for avian H9N2 influenza virus infections among Romanian agriculture workers[J]. J Infect Public Heal86th, 2013, 6(6): 438-447. doi: 10.1016/j.jiph.2013.05.003.
[8] Pawar SD, Tandale BV, Raut CG, et al. Avian influenza H9N2 seroprevalence among poultry workers in Pune, India, 2010[J]. PLoS One, 2012, 7(5): e36374. doi: 10.1371/journal.pone.0036374.
[9] Huang Y, Li X, Zhang H, et al. Human infection with an avian influenza A (H9N2) virus in the middle region of China[J]. J Med Virol, 2015, 87(10): 1641-1648. doi: 10.1002/jmv.24231.
[10] 中华人民共和国卫生部. 卫生部办公厅关于印发《全国流感监测方案(2010年版)》的通知[EB/OL].(2010-09-10)[2017-08-10]. http://www.moh.gov.cn/jkj/s3577/201009/3fa356d0f4834d408fde6c12891a6482.shtml
[11] 中国疾病预防控制中心. 中国疾病预防控制中心关于印发全国流感监测技术指南的通知[EB/OL].(2011-08-15)[2017-08-10]. http://www.chinaivdc.cn/cnic/zyzx/jcfa/201605/t20160520_129702.htm
[12] Dugan VG, Chen R, Spiro DJ, et al. The evolutionary genetics and emergence of avian influenza viruses in wild birds. PLoS Pathogens, 2008, 4(5):e1000076. doi: 10.1371/journal.ppat.1000076.
[13] Huang Y, Zhang H, Li X, et al. Detection and Genetic Characteristics of H9N2 Avian Influenza Viruses from Live Poultry Markets in Hunan Province, China. PLoS One, 2015, 10(11): e0142584. doi: 10.1371/journal.pone.0142584.
[14] Pu J, Wang S, Yin Y, et al. Evolution of the H9N2 influenza genotype that facilitated the genesis of the novel H7N9 virus[J]. Proc Natl Acad Sci U S A, 2015, 112(2): 548-553. doi: 10.1073/pnas.1422456112.
[15] 胡明霞,赵科伕,张文艳. 安徽省1例H9N2流感病例及回顾性分析[J].安徽医学,2016,37(2):214-216. doi: 10.3969/j.issn.1000-0399.2016.02.028.
[16] 游胜,冯秀,刘晓青,等. 江西省首例人感染H9N2 禽流感病例流行病学调查[J]. 现代预防医学,2017,44(5):782-784.
[17] Matrosovich MN, Krauss S, Webster RG. H9N2 influenza A viruses from poultry in Asia have human virus-like receptor specificity[J]. Virology, 2001, 281(2): 156-162. doi: 10.1006/viro.2000.0799.
[18] 王笑笑,程伟,余昭,等. 浙江省冬春季涉禽场所禽流感病毒污染特征及影响因素研究[J]. 中华预防医学杂志,2016,50(3):250-254. doi: 10.3760/cma.j.issn.0253-9624.2016.03.012.
2017-07-04)
(本文编辑:唐浏英)
CharacteristicsofanavianinfluenzaA(H9N2)virusisolatedfromaninfant
HuangYiwei,ChenBaitang,ZhangHengjiao,XieQun,LiWenchao,LiChenhua,ZhangSiyu,HuangChaoyang,DengZhihong,ZhangHong
HunanProvincialCenterforDiseaseControlandPrevention,Changsha410005,China(HuangYW,ZhangHJ,LiWC,ZhangSiyu,HuangCY,DengZH,ZhangH);ChenzhouCenterforDiseaseControlandPrevention,Chenzhou423000,China(ChenBT,XieQ,LiCH)HuangYiweiandChenBaitangcontributedequallytothearticle
ZhangHong,Email: 931525821@qq.com
ObjectiveTo analyze the genome characteristics of an avian influenza A (H9N2) virus isolated from an 11-month-old infant, and to look for possible sources of infection.MethodsThroat swabs were collected from an infant with influenza-like illness in influenza sentinel surveillance hospitals and isolated for influenza viruses using cells. The isolates were identified for influenza virus types and subtypes by the method of hemagglutination assay, hemagglutination inhibition assay and fluorescence PCR. Whole genome sequencing of the isolated virus was carried out. The genome nucleic acid sequences and the deduced amino acid sequences were analyzed by comparing the phylogenetic trees which were constructed by bioinformatics software.ResultsA seasonal un-typed influenza virus was isolated from the infant with influenza like illness. With fluorescent PCR method , it was identified as H9N2 subtype of avian influenza virus and the case was confirmed as a human infected with an avian influenza A(H9N2) virus. Epidemiological studies revealed that the case had no clear history of poultry contact and exposure. Blast analysis shows that eight segments of the viral genome are avian origin, and 97.5%-99.8% homology with that of viruses isolated from the live-poultry markets. The virus belongs to G57 genotype, deduced amino acid sequence analysis shows that the virus has typical low pathogenic avian influenza characteristics.ConclusionsAlthough the case does not have a clear history of contact or exposure to poultry, molecular traceability suggests that possible sources of infection may be still from poultry.
Avian Influenza; Infant; H9N2; Nucleotide sequence
黄一伟与陈柏塘对本文有同等贡献
张红,Email: 931525821@qq.com
10.3760/cma.j.issn.1003-9279.2017.05.009
禽流感;婴儿;H9N2;核苷酸序列
湖南省科技厅资助一般项目(2014SK3246);湖南省卫生厅重点课题(A2011-006)
FundprogramsHunan Provincial Science and Technology Department Research Project (2014SK3246), Hunan Provincial Health and Family Planning Commission Key Research Project (A2011-006).
