APE1基因(Asp148Glu)多态性与结直肠癌易感性之间关系的Meta分析
2017-11-02于海跃刘正昊崔君鹏刘宝林
于海跃 刘正昊 崔君鹏 刘宝林
APE1基因(Asp148Glu)多态性与结直肠癌易感性之间关系的Meta分析
于海跃 刘正昊 崔君鹏 刘宝林
目的对APE1基因(Asp148Glu)多态性与结直肠癌易感性之间的关系进行Meta分析。方法在PubMed,CNKI,MEDLINE等数据库中查找APE1基因多态性与结直肠癌发生易感性之间关系的研究。检索自数据库建立至今全部已发表的相关文献,根据确定的准入标准对文献进行筛选,提取资料,对纳入文献的时效性,权威性等进行评价。应用RevMan 5.3软件进行Meta分析。APE1基因分为AA,A/G,GG型,构建以A为显性基因模型,则进行AA,A/G与GG的比较;构建以A为隐性基因模型,则进行GG,G/A与AA的比较。结果符合标准文献4篇,均为病例-对照研究,共计3397例。其中结直肠癌1492例,对照组1905例。分析显示显性基因模型OR=1.44,95%CI(1.22,1.70),P<0.05;隐性基因模型OR=1.17,95%CI(1.02,1.36),P<0.05。结论无论隐性及显性基因模型,APE1基因(Asp148Glu)的基因型A均促进结直肠癌的发生发展。
结直肠癌; APE1; Meta分析
肿瘤的发生发展与多种因素有关,包括饮食、环境、遗传等各种因素,结直肠癌的发病机制仍不完全清楚。基因的多态性与结直肠癌易感性之间的关系是研究的热点。APE1基因是14q11.2-q12上长度为2.21kb的一个包含有5个外显子及4个内含子的片段。同时编码317个氨基酸蛋白质[1-2]。APE1具有3'磷酸二脂酶活性可有效去除3'端磷酸甘油酯基团。他通过水解5'端骨架,来启动DNA碱基切除修复(BER)[3]。同时,APE1/Ref-1也起到氧化还原剂的作用,维持癌症发生发展过程中例如ap-1,核因子-κB,myb,缺氧诱导因子-1α,HLF,PAX和p53与低活跃状态[1,2,4-6]。有研究显示,在APE1 Asp148Glu的Glu等位基因和hOGG1 Ser326Cys多态性的Cys等位基因的个体中观察到,结直肠癌增加的风险表明多种基因-基因相互作用。这种BER中的基因间相互作用,可能暗示炎症过程及氧化压力在结肠癌中的作用。APE1 Asp148Glu及hOGG1 Ser326cys基因被认为是BER途径的一部分,用于修复氧化损伤[7]。我们对APE1(Asp148Glu)基因多态性与结直肠癌易感性之间的关系进行Meta分析,将同质性研究行定量合并,从而确定APE1(Asp148Glu)基因的多态性与结直肠癌易感性之间的关系。
材料与方法
一、检索策略
主要检索APE1(Asp148Glu)基因多态性与结直肠癌易感性之间的关系。从PubMed,CNKI等数据库搜索已公开发表的全部研究。以“APE1”和“colorectal”为主题词进行搜索,无语言限制,出版日期截止至2017年4月,同时检索纳入研究的参考文献。如出现多篇文献出现相同数据或数据重叠,则纳入数据量最大或最新发表的文献。
二、文献的纳入与排除标准
文献纳入标准仅限于全部已公开发表的文献,同时使用有效的分子生物学方法检验基因型,选取围绕APE1(Asp148Glu)基因型多态性与结直肠癌易感性之间关系的病例对照研究。文献报告应全面清楚,可计算出各个基因型的详细人数及OR值。对重复报告、质量较差等无法利用的文献予以排除,不纳入综述或摘要类文献。
三、数据提取
使用保准数据提取表进行数据提取,由两位作者独立提取,交叉核对,对异议处进行讨论解决。提取的信息包括第一作者,出版年份,种族,病例组及对照组样本容量以及NOS评分。
四、文献质量评价
使用NOS量表作为纳入文献质量评价尺度,评价内容包括:病例确定是否恰当,病例的代表性,对照的选择,对照的定义,组间可比性,对照组及病例组是否采用了相同的确定方法。6~9分为高质量(或低偏倚风险)的研究,4~5分为中度偏倚风险,1~3分为具有高度偏倚风险。本研究以结直肠癌作为疾病的“端点”,因引用文献数较少,未利用漏斗图评价潜在的发表偏倚。
五、统计学分析
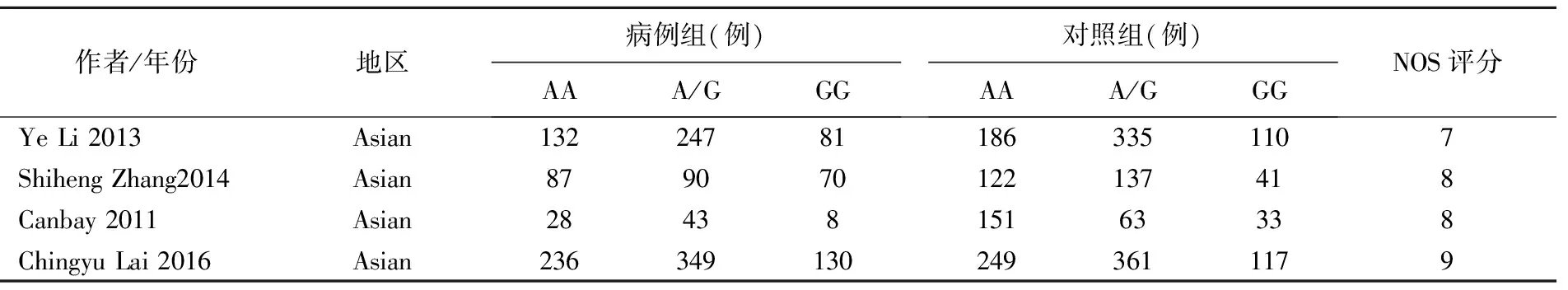
表1 纳入文献的一般资料
采用RevMan 5.3软件进行Meta分析,以OR及其95%CI作为效应分析统计量。以卡方检验,I2检验进行合并数据异质性评估,若P>0.1,则认为合并数据同质性较好,采用固定效应模型合并后分析。反之,使用随机效应模型。根据I2值评估异质性程度,I2<25%可认为低度异质性,I2在25%~50%之间认为中度异质性,I2>75%可认为高度异质性。因引用文献较少,未采用漏斗图检测发表偏倚。数据合并统计分析采用隐性基因模型和显性模型。采用双侧检验,若P<0.05 则认为差异有统计学意义。
结 果
一、文献检索
初步检索出相关文献37篇,PubMed33篇,CNKI4篇,经过筛选最终有4篇符合标准,均为英文文献,均符合准入标准[1,8-10]。筛选流程见图1。
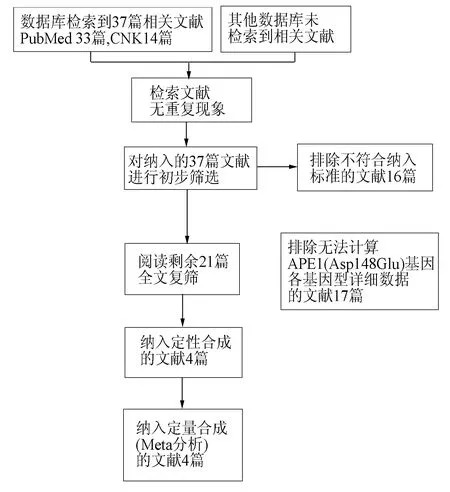
图1 文献筛选流程及结果图
二、文献评价
纳入的4篇文献经过NOS评分,均大于6分,皆可纳入。文献基本信息提取见表1。
三、纳入文献的特征
4篇参考文献均为病例-对照研究,共计3406例,其中1501例结直肠癌病例,1905例对照组病例。筛选过程中有因无APE1(Asp148Glu)数据信息,无法提取APE1(Asp148Glu)基因型相关数据,APE1与其他因素结合对结直肠癌易感性的影响,非APE1(Asp148Glu)基因多态性研究等相关文献而被排除。
四、Meta分析结果
本次研究共纳入4篇病例对照试验研究,包括1501例病例及1905例对照。荟萃分析结果如图2~3所示。根据异质性检验合并数据,两种模型I2均较大,均选择随机效应模型。APE1(Asp148Glu)基因多态性与结直肠癌易感性之间的关系,两种模型结论相同,结果均显示两者之间有直接相关。因纳入文献数过少,未进行漏斗图检验发表偏倚结果。

图2 显性基因模型
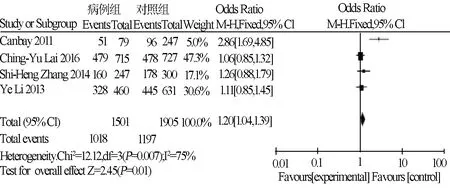
图3 隐性基因模型
讨 论
我们对APE1(Asp148Glu)基因多态性与结直肠癌易感性之间的试验研究进行Meta分析,结果显示,APE1(Asp148Glu)基因多态性与结直肠癌易感性呈直接相关关系。本次研究结果主要在亚洲人中成立,未纳入其他人种。
碱基切除修复始于DNA磷酸二酯链5'端至一个无嘧啶位点,然后聚集DNA聚合酶β和DNA连接酶Ⅲ,其中APE1基因在启动碱基切除修复至关重要[11-12]。众所周知,APE1等位基因的变异包括外显子5中天冬氨酸变成谷氨酸,而这可能与对电离辐射及患癌危险因素高度敏感有关[1,6,12-13],部分功能研究证实这一观点。功能研究显示,APE1 148Glu等位基因改变了核酸内切酶及DNA结合活性,从而削弱了与其他碱基切除修复蛋白的传达能力,增加了暴露在电离辐射时的有丝分裂延迟[6,8]。考虑到APE1在多种生物学功能中的重要作用,例如基因转录及DNA修复,APE1 Asp148Glu多态性可能调节结直肠癌发展的风险在生物学上是合理的。有研究表明,APE1(Asp148Glu)及hOGG1(ser326cys)基因被认为是BER途径的一部分,用于修复氧化损伤。最近在健康受试者中突出了这些基因多态性与功能表达之间的关系,表明两个多态性的变异等位基因与显著降低的BER率相关[7,14]。有研究指出,乳腺癌病例中延长的细胞周期延迟与APE1 Asp 148 Glu XRCC1 ARG399Gln 等位基因变异数量有关[6]。此外,APE1的转录增加在具有OGG1 326 ser等位基因的结直肠癌病人中被观察到。这些结果表明,APE1(Asp148Glu)多态性可能是导致肿瘤发生的其他基因的协同因子[15-16]。
结直肠癌的发生发展是一个复杂的过程,与环境、饮食、习惯及基因等多种因素有关。本Meta分析结果表明,APE1(Asp148Glu)基因多态性与结直肠癌易感性之间呈直接相关关系,无论是显性基因模型或者隐性基因模型,基因型A都可增加结直肠癌易患性,同时APE1通过多种复杂机制参与到结直肠癌的发生发展过程。
APE1基因作为DNA碱基切除修复基因,多种因素可引起其发生变异,从而导致APE1基因原有功能发生变化,继而引起细胞发生多方面生化及生物学行为改变。根据实验分析推测APE1变异可通过改变癌症发生发展过程中的部分相关因子ap-1,核因子-κB,myb,缺氧诱导因子-1α,HLF,PAX和p53的活跃性、长期慢性炎症刺激对细胞功能及细胞生物学行为的影响、电离辐射下细胞有丝分裂改变以及BER基因相关功能之间的关系改变来促进结直肠癌的发生发展。APE1(Asp148Glu)基因型多态性与结直肠癌易患性呈直接相关关系,未来是否可将其纳入为结直肠癌一项辅助检查指标,需进行更多实验对肿瘤的分型、浸润深度、淋巴结转移程度以及病人年龄、性别等进行详细的分组及分析研究,以证实APE1(Asp148Glu)基因型在结直肠癌筛查及诊断中的意义。
本研究未纳入欧洲、非洲等其他地区及人种的数据,并且纳入文献数目较少,且纳入病例皆为病例对照研究,无法控制各种偏倚因素,降低了研究分析的可靠性,分析过程中有较多混杂因素。仍需大样本及多种人种实验研究来确证此结论。
[1] Shi-Heng Zhang,Lin-Ang Wang,Zheng Li,et al.APE1 polymorphisms are associated with colorectal cancer susceptibility in Chinese Hans[J].World J Gastroenterol ,2014, 20(26):8700-8708.
[2] Li Z,Guan W,Li MX,et al.Genetic polymorphism of DNA baseexcision repair genes (APE1,OGG1 and XRCC1) and their correlation with risk of lung cancer in a Chinese population[J].Arch Med Res,2011, 42:226-234.
[3] Kelley MR,Parsons SH.Redox regulation of the DNA repair function of the human AP endonuclease Ape1/ref-1[J].Antioxid Redox Signal,2001,3:671-683.
[4] Lo YL,Jou YS,Hsiao CF,et al.Apolymorphism in the APE1 gene promoter is associated with lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2009,18:223-229.
[5] Chen PL,Yeh KT,Tsai YY,et al.XRCC1,but not APE1 and hOGG1 gene polymorphisms is a risk factor for pterygium[J].Mol Vis,2010,16:991-996.
[6] Hu JJ,Smith TR,Miller MS,et al.Amino acid substitution variants of APE1 and XRCC1 genes associated with ionizing radiation sensitivity[J].Carcinogenesis,2001,22:917-922.
[7] Weiss JM,Goode EL,Ladiges WC,et al.Polymorphic variation in hOGG1 and risk of cancer:a review of the functional and epidemiologic literature[J].Mol Carcinog,2005,42:127-141.
[8] Emel Canbay,Bedia Cakmakoglu,Umit Zeybek,et al.Association of APE1 and hOGG1 polymorphisms with colorectal cancer risk in a Turkish population[J].Current Medical Research & Opinion Vol.27,No.7,2011,1295-1302.
[9] Ye Li ,Shuying Li,Zhiwei Wu,et al.Polymorphisms in genes of APE1,PARP1,and XRCC1:risk and prognosis of colorectal cancer in a northeast Chinese population[J].Med Oncol,2013,30:505.
[10] Ching-Yu Lai,Ling-Ling Hsieh,Reiping Tang,et al.Association between polymorphisms of APE1 and OGG1 and risk of colorectal cancer in Taiwan[J].World J Gastroenterol,2016, 22(12):3372-3380.
[11] Bennett RA,Wilson DM,Wong D,Demple B.Interaction of human apurinic endonuclease and DNA polymerase beta in the base excision repair pathway[J].Proc Natl Acad Sci USA,1997,94:7166-7169.
[12] Zhou B,Shan H,Su Y,et al.The association of APE1 -656T>Gand 1349 T>G polymorphisms and cancer risk:a meta-analysis based on 37 case-control studies[J].BMC Cancer,2011,11:521.
[13] Au WW.Heritable susceptibility factors for the development of cancer[J].J Radiat Res,2006,47 Suppl B:B13-B17.
[14] Vodicka P,Stetina R,Polakova V,et al.Association of DNA repair polymorphisms with DNA repair functional outcomes in healthy human subjects[J].Carcinogenesis,2007,28:657-664.
[15] Obtulowicz T,Swoboda M,Speina E,et al.Oxidative stress and 8-oxoguanine repair are enhanced in colon adenoma and carcinoma patients[J].Mutagenesis,2010,25:463-471.
[16] Hadi MZ,Coleman MA,Fidelis K,et al.Functional characterization of Ape1 variants identified in the human population[J].Nucleic Acids Res,2000,28:3871-3879.
AssociationbetweenAPE1(Asp148Glu)genepolymorphismandcolorectalcancersusceptibilityameta-analysis
YUHaiyue,LIUZhenghao,CUIJunpeng,etal.
(DepartmentoftheGeneralSurgery,ShengjingHospital,ChinaMedicalUniversity,Shenyang110001,China)
ObjectiveTo preliminary discuss the relationship between APE1(Asp148Glu) gene polymorphism and colorectal cancer susceptibility.MethodsDatabases including PUBMED,CNKI,MEDLINE as well as others were searched for the studies in the field of APE1(Asp148Glu) polymorphism and colorectal cancer susceptibility.Then we searched all of the relevant literature from the data of their establishment to April 4,2017,screened the literature according to established access criteria,extracted useful information and evaluated the timeliness and authority of the literature.We used the RevMan 5.3 software to perform the meta-analysis.And finally we had included in 4 case-control studies,involving 3397 cases in total(1492 cases in colorectal cancer group and 1905 cases in control group).APE1 gene is divided into AA,A/G,GG type,If we set A as dominant gene,genotyping can be combined to compare AA+A/G with GG.If we set A as recessive gene,genotyping can be combined to compare GG+A/G with AA.ResultsMeta-analysis showed that A was a dominant gene[OR=1.44,95% CI (1.22,1.70),P<0.05]; A was a recessive gene[OR=1.17,95% CI (1.02,1.36),P<0.05 ].ConclusionRegardless of recessive and dominant gene model,the genotype A of APE1 gene (Asp148Glu) promotes the development of colorectal cancer.
colorectal cancer; APE1; Meta-analysis
2017-04-13)
(本文编辑:杨泽平)
10.3969/j.issn.1005-6483.2017.10.015
110001 辽宁沈阳,中国医科大学附属盛京医院普外科
刘宝林,Email:liubl55@hotmail.com
