阿帕替尼治疗三线或以上晚期肺腺癌的近期疗效观察
2017-10-17王剑英王丽萍
聂 芳 王 颖 王剑英 王丽萍
(包头市肿瘤医院胸部肿瘤内科,内蒙古 包头 014040)
阿帕替尼治疗三线或以上晚期肺腺癌的近期疗效观察
聂 芳 王 颖 王剑英 王丽萍
(包头市肿瘤医院胸部肿瘤内科,内蒙古 包头 014040)
目的 观察甲磺酸阿帕替尼治疗化疗失败的晚期肺腺癌的临床疗效及不良反应。方法 28例患者接受甲磺酸阿帕替尼治疗,500毫克/次,1次/天,口服,若出现严重不可耐受的不良反应,改为250 mg/d,并维持治疗,通过影像学检查评价近期疗效。结果 28例接受甲磺酸阿帕替尼靶向治疗的晚期腺癌患者中,完全缓解(CR)0例,部分缓解(PR)8例,稳定(SD)14例,进展(PD)6例,总有效率为28.6%(8/28),疾病控制率78.6%(22/28)。且肺癌不同转移部位对预后影响均无统计学意义(P均>0.05)。不良反应主要是高血压及蛋白尿,发生率分别为67.9%和46.4%。结论 甲磺酸阿帕替尼治疗三线或以上晚期肺腺癌患者近期疗效较好,不良反应可以耐受及控制,可在临床使用并研究其长期疗效及远期不良反应。
阿帕替尼;晚期肺腺癌;临床疗效;不良反应
根据世界卫生组织的数据统计,目前肺癌的发病率和病死率仍居各种肿瘤之首,约占全部恶性肿瘤的19%,其中非小细胞肺癌(NSCLC)在肺癌中占70%~80%,腺癌占多数。由于2/3患者确诊时已失去手术机会,1/2伴有局部或远处转移,多数患者一般状况欠佳[1]。在我国,晚期肺腺癌患者的主要治疗方式为化疗、放疗及靶向治疗。近年来,以新生血管为靶点的靶向药物在晚期腺癌中的应用已成为研究热点。甲磺酸阿帕替尼(Apatinib,艾坦)是新一代小分子血管内皮生长因子受体(VEGFR-2)酪氨酸激酶抑制剂,其主要作用机制是竞争性结合该受体胞内酪氨酸ATP结合位点,高度选择性地抑制VEGFR-2酪氨酸激酶活性,阻断血管内皮生长因子(VEGF)结合后的信号传导,从而强效抑制肿瘤血管生成[2]。研究证实该药对多种恶性肿瘤都有显著疗效[3],而在肺癌治疗中也正在开展更深入研究。我科采用阿帕替尼治疗三线或以上晚期肺腺癌患者,取得一定临床效果,近期疗效显著,现报道如下。
1 资料与方法
1.1 临床资料:包头市肿瘤医院2015年6月至2016年11月期间收治的二线及以上治疗失败的晚期肺腺癌患者28例。男性18例,女性10例。年龄43~84岁,中位年龄60岁。均为Ⅳ期腺癌患者,其中双肺内转移10例,胸膜转移7例,脑转移6例,肾上腺转移3例,骨转移4例,肝转移7例。入选标准:①有明确病例诊断为腺癌。②临床诊断为Ⅳ期患者。

表1 28例患者的基本情况及临床特点[n(%)]
1.2 治疗方法:所有28例患者予甲磺酸阿帕替尼500毫克/次,1次/天,口服,持续应用至疾病进展或患者不能耐受,治疗期间不应用其他抗肿瘤药物。治疗期间每日监测血压,每周复查血常规、尿常规、肝肾功、心电图。监测药物的不良反应情况。治疗4周后行CT检查。根据实体瘤疗效评价标准(RESIST)1.1版标准评价疗效,CR、PR、SD为有效,PD为无效。近期疗效观察终点为治疗后4周,若有效可继续治疗至疾病进展或出现不可耐受的不良反应,但暂不纳入本次评价体系。
1.3 疗效及不良反应评价:患者近期疗效按RESIST标准评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以CR+PR计算总有效率,以CR+PR+SD评价疾病控制率。不良反应根据美国国立研究院通用毒性标准(NCI-CTC)3.0标准进行评价。
1.4 统计学方法:采用SPSS17.0进行统计分析,计量资料采用t检验,计数资料以百分数表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效:28例患者均完成治疗日期4周,均可评价疗效,其中CR 0,PR 8例,SD 14例,PD 6例,总有效率为28.6%(8/28),疾病控制率78.6%(22/28)。
2.2 不同部位预后情况:见表2。
2.3 毒性反应:28例患者在治疗过程中有23例在治疗过程中出现Ⅰ~Ⅱ度不良反应,包括高血压19例,尿蛋白13例,手足综合征9例,尿潜血阳性6例,肝功能胆红素升高2倍以上7例,肾功能肌酐升高5例,心电图ST段异常5例。以上患者的不良反应均经药物治疗或无需特殊处理,均可耐受,不影响后期治疗;2例患者于服用1~2周后出现Ⅲ~Ⅳ度手足综合征,减量至250 mg/d后手足综合征降至Ⅰ~Ⅱ度,对症治疗后可耐受,继续低剂量口服。1例患者出现高血压Ⅳ级、尿蛋白(+++),经积极对症治疗及减量至250 mg/d后好转,继续低剂量口服治疗;1例患者口服药物1周后出现肝功能异常:胆红素升高至4倍以上,给予保肝对症治疗后好转,减量至250 mg/d继续治疗。主要不良反应以高血压(67.9%)及蛋白尿(46.4%)为主。见表3。

表2 不同转移部位预后情况
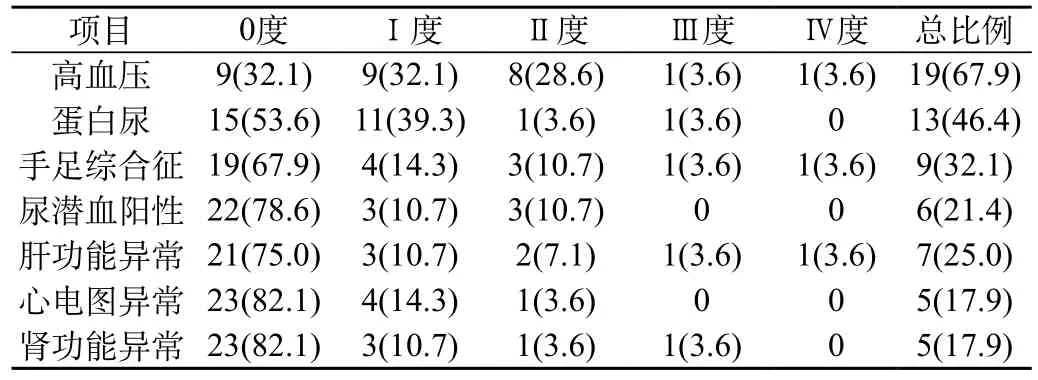
表3 28例患者不良反应状况 [n(%)]
3 讨 论
随着我国社会人口的不断老龄化及肿瘤的高发,在各类恶性肿瘤中,肺癌的发病率及病死率仍居第1位[4],确诊时多为中晚期,多数已失去手术机会,化疗及靶向治疗成为中晚期肺腺癌患者延长生命、改善生活质量的主要治疗方法。由于晚期肺腺癌的治疗方法逐渐增多,二线化疗失败后仍存活的患者也逐渐增多,经靶向药物和化疗药物治疗失败后仍有许多患者体力评分良好,ECOG评分为0~2分的患者仍有强烈的治疗欲望,后续治疗方案选择成为近来关注的热点。
根据NCCN和中国肺癌诊疗指南,目前国内的晚期NSCLC主要通过药物治疗。含铂类的双药治疗方案已成为标准的一线治疗。对于检测证实的表皮生长因子(EGFR)突变患者,可选择靶向药物治疗。二线治疗可选择的药物多西他赛、培美曲塞或靶向药物EGFR-TKI单药治疗。三线药物可选择EGFR-TKI治疗或进行临床试验[5-7]。
目前,针对EGFR突变NSCLC患者的治疗,已取得令人瞩目的进展。EGFR小分子抑制剂厄洛替尼、吉非替尼、阿法替尼等,能明显延迟EGFR突变阳性的NSCLC的疾病进展[8-10]。而经EGFR小分子抑制剂治疗进展的NSCLC患者,亦可从一线及二线化疗中获益。
针对VEGF的单克隆抗体贝伐单抗联合铂类化疗方案用于一线治疗非小细胞肺癌的适应证已获FDA批准,联合使用后能明显延长患者总生存期[11-13]。抗血管生成大分子抗体(Ramucirumab)及小分子抑制剂(Nintedanib)与多西他赛联用在晚期肺癌中取得了较好的临床效果,显著延长了肺腺癌患者的生存期[14-15]。这些结果提示抗肿瘤血管生成药物在治疗晚期NSCLC中的疗效,为抗肿瘤血管生成药物在三、四线NSCLC治疗提供了依据。
阿帕替尼(Apatinib)是2014年我国自主研发的口服小分子抗血管生成药物,可以选择性结合并抑制VEGFR-2,从而抑制肿瘤血管生成,抑制肿瘤生长[2]。血管内皮生长因子(VEGF)及其受体VEGFR介导的信号传导通路在调控肿瘤血管生成过程中发挥着重要作用,在VEGFR中,VEGFR-2被认为与肿瘤血管生成关系最为密切[7]。在多数实体恶性肿瘤组织中,VEGFR较正常组织高表达[11]。同时研究表明VEGF与VEGFR-2结合后发生一系列的生物调控机制,增强血管通透性、诱导内皮细胞增殖并促进其迁移,在肺癌发展中起重要作用,与肿瘤的恶性程度及预后关系密切[12]。目前阿帕替尼已用于晚期胃癌或胃食管结合部腺癌三线及三线以上治疗[2],但目前尚无治疗晚期肺癌的临床指征。
本项研究纳入的病例均为三线或三线以上腺癌患者,研究结果显示,阿帕替尼在晚期腺癌治疗中的近期疗效显著,客观有效率达28.6%,疾病控制率达78.6%,同时还显示不同部位转移瘤对药物治疗近期疗效无显著影响。本研究中,阿帕替尼的不良反应主要为高血压、蛋白尿、手足综合征,大部分为Ⅰ~Ⅱ度毒性反应,经减量及对症治疗可耐受,与既往研究结果相近[2]。因纳入病例较少、观察时间较短,该结果还有待进一步观察及论证。
综上所述,阿帕替尼治疗晚期肺腺癌有显著近期疗效,且耐受性良好,其主要不良反应为高血压、蛋白尿、手足综合征,不良反应较轻微,能够改善部分患者生活质量,是晚期肺腺癌的三线或三线以上治疗的一种有效手段。但是,目前该药物尚未进入临床指南用药,对于晚期肺腺癌的治疗仍在探索阶段,也有相关临床试验正在进行中[16],因此还需要更多和更大样本的临床研究来证实其疗效及安全性。
[1] 周际昌.实用肿瘤内科学[M].北京:人民卫生出版社,1997:23.
[2] 秦叔逵,李进.阿帕替尼治疗胃癌的临床应用专家共识[J].临床肿瘤学杂志,2015,(9):841-847.
[3] Li J,Zhao X,Chen L,et al.Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients With advanced malignancies[J].BMC Cancer,2010,10:529.
[4] 陈万青,郑荣寿,曾红梅,等.2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2015,24(1):1-10.
[5] 非小细胞EGFR原发性肺癌诊疗规范(2011年版)[S].2011.
[6] 2014年NCCN非小细胞肺癌指南[S].2014.
[7] Goel HL,Mercurio AM.VEGF targets the tumour cell[J].Nat Rev Cancer,2013,13(12):871-882.
[8] Tony MD,Mok S,Wu YL,et al.Gefitinib or Carboplatin–Paclitaxel in Pulmonary Adenocarcinoma[J]..N Engl J Med,2009,361(10):947-957.
[9] Zhou C,Wu YL,Chen G,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutationpositive non-small-cell lung cancer (OPTIMAL,CTONG-0802):a multicentre,open-label,randomised,phase 3 study[J].Lancet Oncol,2011,12(8):735-742.
[10] Sequist LV,Yang JC,Yamamoto N,et al.Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J].J Clin Oncol,2013,31(27):3327-3334.
[11] Youssoufian H,Hicklin DJ,Rowinsky EK.Review:monoclonal antibodies to the vascular endothelial growth factor receptor-2 in cancer therapy[J].Clin Cancer Res,2007,13(18):5544s-5548s.
[12] Takahashi T,Yanmaguchi S,Chida K,et al.A single autophosphorylation site Of PLC-gamma and DNA synthesis in vascular endothelial cells[J].EMBO J,2001,20(11):2768-2778.
[13] Sandler A,Gray R,Perry MC,et al.Paclitaxel–Carboplatin Alone or with Bevacizumab for Non–Small-Cell Lung Cancer[J].N Engl J Med,2006,355(24):2542-2550.
[14] Reck M,Kaiser R,Mellemgaard A,et al.Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1): a phase 3,doubleblind,randomised controlled trial[J].Lancet Oncol,2014,15(2):143-155.
[15] Garon EB,Ciuleanu TE,Arrieta O,et al.Ramucirumab plus docetaxel versus placebo plus doc etaxel for second-line treatment of stage IV non-small-cell lungcancer after disease prog ression on platinum-based therapy (REVEL): a multicenter,doubleblind,randomised phase 3 trial[J].Lancet,2014,384(9944):665-673.
[16] 丁琳,江志敏,李怀,等.晚期非小细胞肺癌抗血管生成治疗:文献复习几病例报道[J].岭南现代临床外科,2015,15(6):656-660.
R734.2
B
1671-8194(2017)26-0157-03
