我国猪传染性胃肠炎的流行现状及实验室诊断技术研究进展
2017-10-12祖立闯刘爱华王金良沈志强
祖立闯,王 芳,刘爱华,王金良,李 峰,沈志强,
(1.山东绿都生物科技有限公司,山东 滨州 256600;2.山东省滨州市动物疫病预防与控制中心,滨州 256600;3.山东省利津县畜牧局,利津 257400;4.山东省滨州畜牧兽医研究院,滨州 256600)
我国猪传染性胃肠炎的流行现状及实验室诊断技术研究进展
祖立闯1,王 芳2,刘爱华3,王金良4,李 峰4,沈志强1,4
(1.山东绿都生物科技有限公司,山东 滨州 256600;2.山东省滨州市动物疫病预防与控制中心,滨州 256600;3.山东省利津县畜牧局,利津 257400;4.山东省滨州畜牧兽医研究院,滨州 256600)
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)引起猪的以腹泻、呕吐、脱水、逐渐消瘦为主要特征的一种急性、高度接触性肠道传染病[1],各年龄段的猪群均易感,对仔猪的危害最大,仔猪日龄越低死亡率越高,存活的仔猪生长发育严重受阻,生长缓慢,饲料转化率明显降低,生产性能下降[2],给我国养猪业带来了严重的经济损失。笔者就目前我国TGE的流行现状及各种实验室诊断技术的最新研究进展进行综述,旨在掌握我国猪群中TGE的流行现状与流行特点,为逐步提高我国TGE实验室诊断水平,以及为我国TGE的综合防控提供参考。
1 病毒分离鉴定情况
如表1所示,自2006年以来的近10年中,我国研究学者先后在我国四川、福建、吉林、陕西、甘肃、黑龙江、江苏、山东、辽宁、河北等10个省共分离鉴定出17株TGEV,TGEV强毒株的感染由中部地区逐步向东部沿海以及北方地区逐步扩散,现在我国大部分养猪密集地区均已有TGEV病毒感染并成功分离毒株的报道。
2 流行病学监测情况
近10年我国研究学者对国内TGEV的感染情况进行了大量的流行病学监测,笔者通过对监测结果的整理与汇总,分析出近10年中我国猪群TGEV流行的几个显著特点。
2.1 流行范围广
如表2所示,TGEV的流行已经遍布了我国黑龙江、贵州、福建、广西、北京、河北、安徽、浙江、江苏、青海、河南、广东、辽宁、山东、内蒙古、上海、江西、四川、山西、吉林、陕西等21个省市。
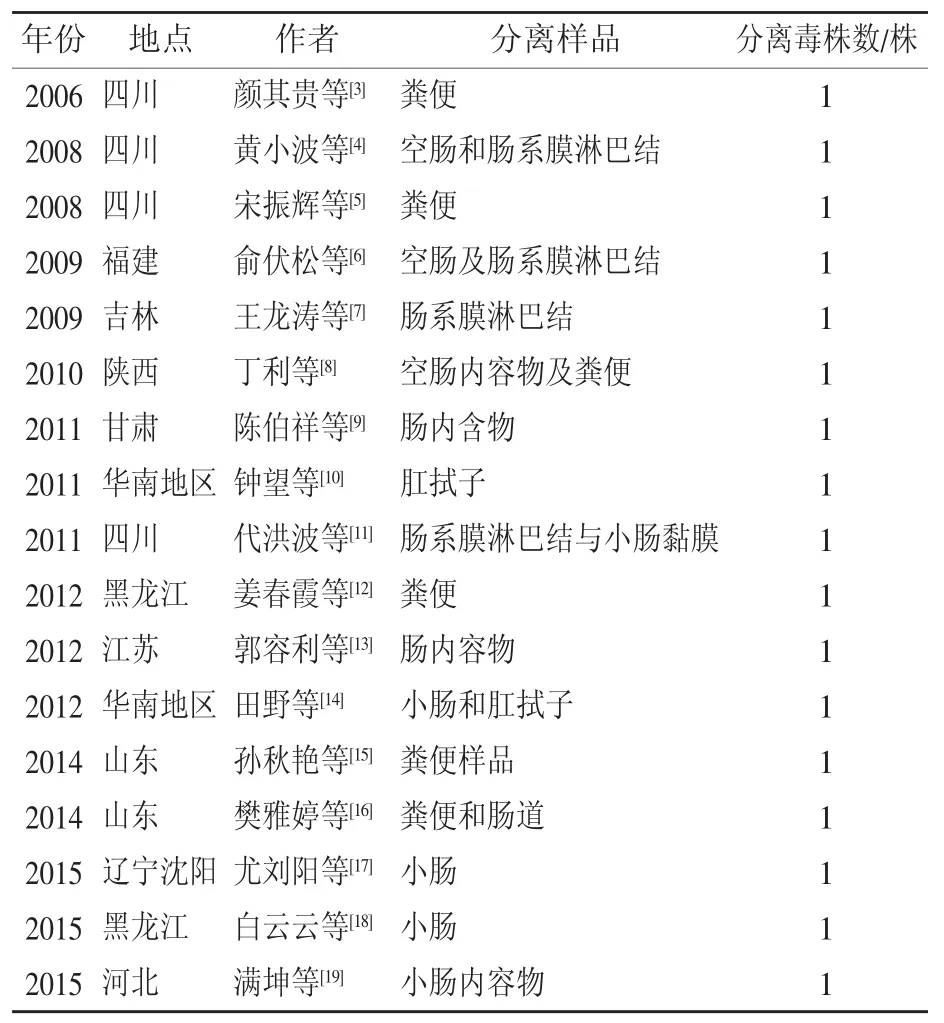
表1 近10年TGEV病毒分离鉴定情况汇总
2.2 感染率整体不高
如表2所示,在2007—2016年的39篇流行病学监测文献中,TGEV整体阳性感染率在0~31.86%范围内,其中阳性感染率超过10%的流行病学监测文献仅有10篇,而阳性感染率在5%~10%的文献有12篇,阳性感染率低于5%的文献达17篇,阳性感染率在10%以下文献占总文献的74.36%,表明TGEV在我国发病猪群中的感染率整体稳定在较低水平,这与我国对TGEV防控工作的重视密不可分。
2.3 隐性感染普遍存在
如表2所示,2008—2009年贵州省健康猪群中TGEV抗体阳性率为0.41%,2015—2016年陕西省健康猪群中TGEV抗体阳性率为5.36%,2016年河南省健康猪群中TGEV抗体阳性率为1.5%,2012—2013年北京健康猪群中TGEV病原感染率为2.58%,2016年福建省健康猪群中TGEV病原感染率为28.9%。表明外观健康猪群仍可检测出TGEV病原或抗体,健康猪群中普遍存在TGEV隐性感染。
2.4 区域性流行特点显著
如表2所示,不同地区感染率差异较大,如2012年青海的发病猪样品的感染率达30.0%,而2012年安徽发病猪样品的感染率仅为10.8%;如2016年福建健康猪样品的感染率达28.9%,而2016年河南健康猪样品的感染率仅为1.5%。
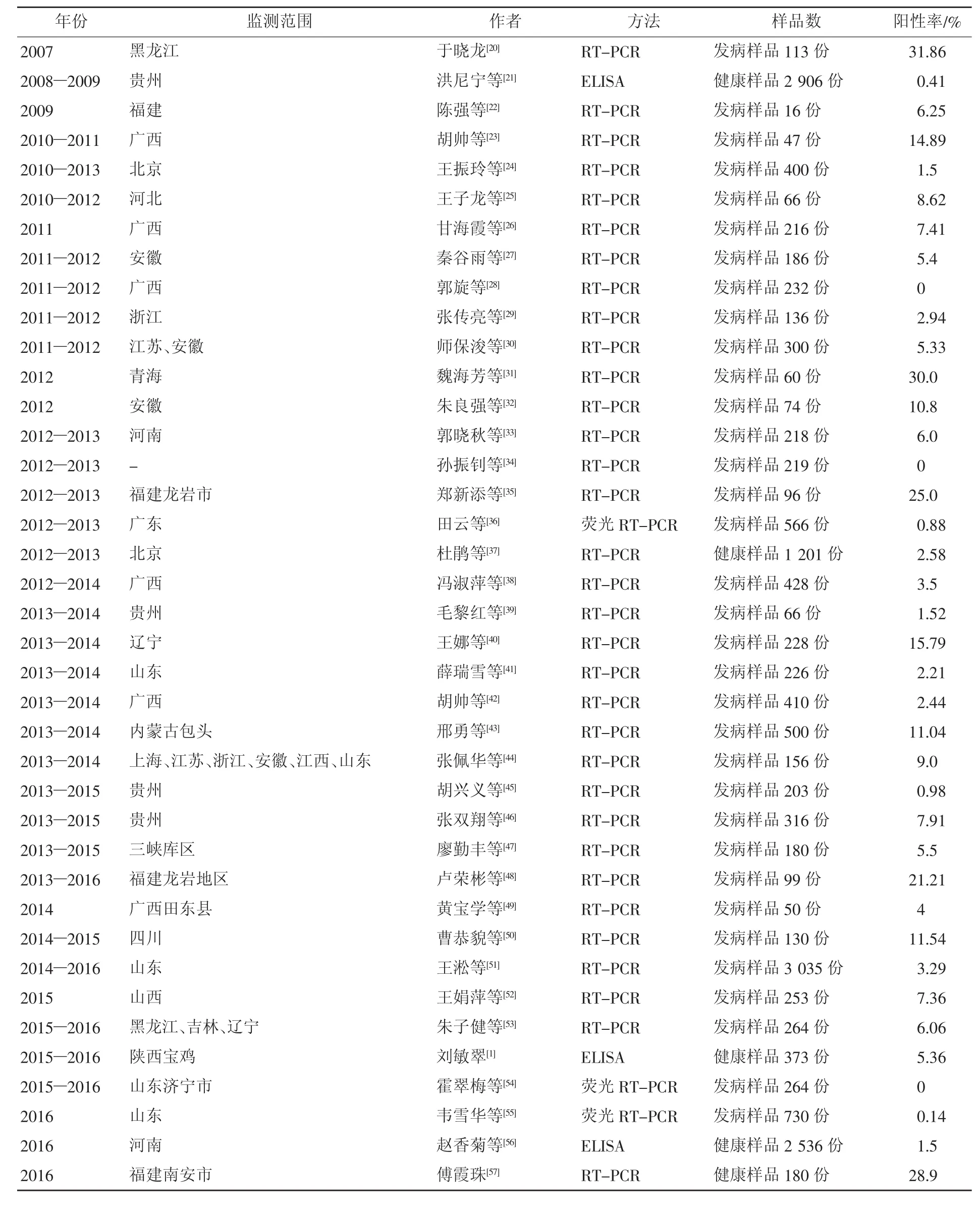
表2 近10年TGEV流行病学监测情况汇总
2.5 与其它病原的混合感染情况较严重
如表3所示,TGEV与猪流行性腹泻病毒(PEDV)、猪轮状病毒(PoRV)、猪嵴病毒(PKV)普遍存在二重、三重的混合感染,其中在部分不同地区与PEDV的二重混合感染率最高达29.2%,与PEDV、PoRV三重混合感染率最高达20.0%,与PEDV、PKV三重混合感染率最高达3.84%,混合感染增加了疫病的诊断与防控难度,造成的经济损失更加巨大,应加强重视。
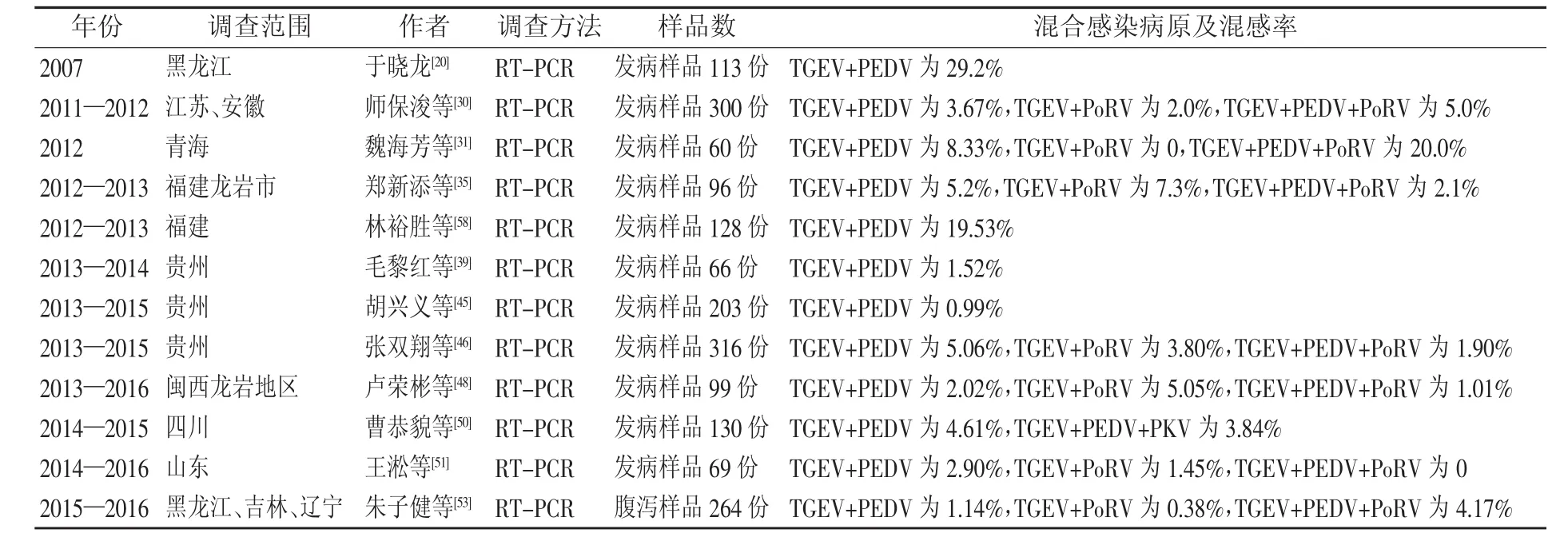
表3 近10年我国猪群TGEV与其它致病原混合感染情况汇总
3 实验室诊断技术
TGEV与PEDV、PoRV等疫病的临床表现极其相似,均表现为呕吐、水样腹泻、脱水、逐渐消瘦等特征,且TGEV经常与PEDV、PoRV等疫病混合感染,增加了TGEV临床诊断的难度,故目前对TGEV感染的确诊主要依靠实验室诊断技术,包括病毒的分离与鉴定、分子生物学和免疫学诊断技术。
3.1 病毒的分离与鉴定
病毒分离与鉴定方法一直是动物病毒病实验室确诊的经典方法,但该方法存在试验周期长,操作较繁琐,不适合临床快速诊断。满坤等[19]将采集的病死猪小肠内容物处理后接种ST细胞,经过12代盲传后开始出现细胞颗粒增多、圆缩、损伤和脱落等典型细胞病变,分离病毒被TGEV特异性血清中和后接种细胞不出现细胞病变,仔猪口服分离病毒后出现水样腹泻、粪便呈乳白色或黄绿色、呕吐、脱水等症状,经过对分离病毒的ORF3基因序列进行分析证实分离毒株为TGEV。
3.2 分子生物学诊断技术
3.2.1 RT-PCR及多重RT-PCR方法 RT-PCR首先以病毒的基因组RNA为模板进行反转录合成cDNA,再以cDNA为模板进行PCR扩增,是疾病病原检测中最常用的一种分子生物学诊断技术。多重RT-PCR方法是在单一RT-PCR检测方法的基础上建立起来的,可在同一个反应体系中加入多对引物同时对多个目的基因进行扩增,可在一次PCR反应过程中检测到多个致病原。张作华等[59]根据TGEV N基因序列设计了1对特异性引物,建立了检测TGEV的RT-PCR方法,该方法检测猪瘟病毒(CSFV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)、PEDV均为阴性,可检测到1×10-3μg/μL的TGEV RNA,通过对126份临床疑似为TGEV感染病料的检测证明该RT-PCR检测方法可用于临床上TGEV感染引起的传染病病原学检测。李丽敏等[60]分别针对PEDV和TGEV的N基因、PoRV的VP7基因设计引物,建立了检测PEDV、TGEV和PoRV的多重RT-PCR方法,该方法检测猪繁殖与呼吸综合征病毒(PRRSV)、CSFV、PRV及PCV2等病毒均为阴性,可以检测到PEDV、TGEV和PoRV的最低核酸浓度分别为16.07、803.9和321.5 μg/L,该多重RT-PCR和PEDV、TGEV、PoRV单项RT-PCR的符合率分别为96.77%、93.54%和93.54%,该多重RT-PCR能够快速鉴别检测PEDV、TGEV和PoRV 3种病毒,可用于PEDV、TGEV与PoRV的临床快速鉴别诊断和流行病学调查。
3.2.2 荧光RT-PCR及多重荧光RT-PCR方法 荧光定量RT-PCR技术融汇了常规RT-PCR技术灵敏、快速、特异的特点以及光谱技术的高敏感性和高精确定量的优点,但该方法对仪器设备和操作人员技术水平要求均较高。李子祥等[61]针对TGEV S基因的保守序列设计引物,优化反应体系和扩增条件,建立了基于SYBR GreenⅠ染料的实时荧光定量PCR检测方法,该方法标准曲线线性关系良好(r=0.997),扩增效率高,检测灵敏度可达10拷贝/μL,该方法检测124份临床疑似TGEV病料,阳性率为13.7%,可用于兽医临床上TGEV的快速检测和流行病学分析。许梦怡[62]分别根据TGEV、PEDV、PoRV的M、M、VP2基因序列,设计了3对质粒标准品引物和3组荧光RT-PCR引物和探针,通过优化引物、探针浓度和退火温度,成功建立了3种病毒的TaqMan探针荧光定量PCR方法。该方法对TGEV、PEDV、PoRV的检测灵敏度分别为2.49拷贝/μL、4.36拷贝/μL、4.96拷贝/μL。组内和组间重复试验的变异系数均不超过5%,检测PRV、PCV1、PRRSV等病毒均为阴性,在40份临床病料样品检测中三重荧光RT-PCR方法的检测结果与单一荧光RT-PCR方法一致,三重荧光RT-PCR方法具有很好的临床应用价值。
3.2.3 RT-LAMP方法 环介导等温扩增方法(LAMP)是2000年以后发展起来的一种新型核酸扩增技术,只需在恒温条件下就能完成扩增反应,不需要特殊仪器设备,并且扩增结果可通过反应体系的浊度或加入染料来直观判断,特别适合在现场和基层部门应用,但LAMP方法容易形成气溶胶污染,造成假阳性的结果。高睿泽等[63]根据TGEV N基因序列设计2对RT-LAMP引物,建立针对TGEV的RT-LAMP快速检测方法,该方法在63℃恒温下作用50 min,使TGEV获得了高效率特异性扩增,检测PEDV等其它猪易感病毒均为阴性,可检测到131.4fg/μL的目标病毒,比普通RT-PCR的灵敏度高3个数量级,反应结束后加入SYBR GreenⅠ在紫外灯下观察颜色变化,阳性扩增产物呈现绿色荧光,该RTLAMP对40份临床样品的检测结果与RT-PCR和ELISA的符合率均为100%,为TGE的临床快速诊断与流行病学调查提供了一种简单、快速和高效的技术手段。
3.2.4 基因芯片方法 基因芯片技术是近年来迅速发展起来的一门新技术,在基片上点阵排列一系列靶基因,与荧光素等标记的探针分子在同一条件下进行核酸杂交,经过共聚焦激光扫描仪扫描、利用数据分析软件获得杂交结果,具有自动化、平行性和高通量等潜在优势,能同时对多种疾病进行检测。滑翔等[64]分别根据 PEDV 基因(S、M)、TGEV 基因(S、N)、PoRV 基因(VP7、NSP4)的保守区设计引物扩增靶基因,进行PEDV-TGEV-PoRV的cDNA阵列设计,构建了能够扩增PEDV、TGEV、PoRV的cDNA芯片,该cDNA芯片检测PRRSV、CSFV、猪乙型脑炎病毒(JEV)、PRV均为阴性,芯片的最低检测质量浓度为20 pg/μL,同一张芯片可重复使用至少7次,该PEDV-TGEV-PoRV诊断cDNA芯片具有良好的特异性、灵敏性和重复性,为PEDV、TGEV、PoRV的鉴别诊断提供了新的高通量检测技术。
3.3 免疫学诊断技术
3.3.1 ELISA方法 酶联免疫吸附试验(ELISA)是继免疫荧光和放射性同位素免疫技术之后发展起来的一种新型的免疫酶技术,该方法具有特异性高、敏感性强、重复性和稳定性好、操作简便、快速等特点,非常适用于临床大批量样品的检测。ELISA方法可用于测定抗原,也可用于测定抗体,主要有直接法、间接法、夹心法、竞争法(阻断法),其中间接ELISA检测抗体和双抗夹心ELISA检测抗原是动物疫病检测中最常用的二种方法。
(1)间接ELISA方法。间接ELISA方法中首先用特异性抗原包被固相载体,加入待测抗体(一抗),待测抗体与包被固相抗原发生特异性结合;再加入酶标记的抗体(酶标二抗),酶标抗体与待测抗体发生特异性结合,再加入底物显色液,底物显色液与酶标抗体发生特异性结合,最后显色颜色的深浅与待测抗体的量成正比。徐向伟等[65]将TGEV的N基因片段克隆到pET-28a载体中,转化至大肠杆菌BL21感受态细胞中进行诱导表达,以纯化的重组N蛋白作为包被抗原,建立了检测TGEV抗体的间接ELISA方法,该 ELISA方法检测 PEDV、CSFV、PRRSV、口蹄疫病毒(FMDV)、PCV2等 5种病毒阳性血清均为阴性,该方法操作简便、特异性好、敏感性高,可用于大规模临床样品的检测。
(2)双抗夹心ELISA方法。双抗夹心ELISA方法中首先用捕获抗体包被固相载体,加入待测抗原,待测抗原与捕获抗体发生特异性结合,再加入检测抗体(标记抗体),检测抗体与待测抗原发生特异性结合,形成抗体-抗原-标记抗体免疫复合物,再加入底物显色液,底物显色液与检测抗体发生特异性结合,最后显色颜色的深浅与待测抗原的含量成正比。屈月等[66]以抗TGEV N蛋白单克隆抗体为包被抗体,纯化的抗TGEV N蛋白多克隆抗体为检测抗体,建立了TGEV双抗体夹心ELISA方法,该ELISA的重复性变异系数小于10%,检测PEDV、猪细小病毒(PPV)、CSFV、PoRV 等均为阴性,对 22份临床猪粪便样品的阳性检出率为22.7%,与常规RT-PCR的符合率达81.8%,该双抗体夹心ELISA方法检测TGEV具有较高的特异性和敏感性,可以用于TGEV的病原学检测。
3.3.2 IPMA方法 免疫过氧化物酶单层细胞试验(IPMA)是在感染病毒的多孔细胞培养板中加入待检标本,再加入标有辣根过氧化物酶抗免疫球蛋白特异抗体,经底物显色后利用光学显微镜即可观察结果。朱蕴暖等[67]以TGEV N蛋白的单克隆抗体为一抗,羊抗小鼠IgG-HRP为二抗,AEC过氧化物酶底物为显色液,建立了检测TGEV的IPMA方法。该方法中一抗的最佳使用浓度为0.5 ng/μL,二抗的最佳稀释倍数为1∶2 000倍,经AEC显色后TGEV感染的阳性细胞呈红棕色,能检测到101TCID50的病毒,检测常见的PEDV、PoRV和PCV2等猪病病原均为阴性,为TGEV的实验室诊断及TGEV在感染细胞中的定位和动态分布提供有效的检测手段。
3.3.3 免疫胶体金方法 免疫胶体金技术是结合胶体金标记技术和免疫检测技术发展起来的一种新型检测技术,其以胶体金作为示踪标志物,将其标记抗原或抗体后形成标记物,样品中的待测物与标记物形成的络合物通过层析作用在层析材料上泳动,与层析材料上针对该待测物的受体发生免疫反应形成免疫复合物,免疫复合物中的胶体金大量聚集形成肉眼可见的红色或粉红色斑点。具有简便、快速、不需仪器设备、结果判断直观、无污染等优点,在动物疫病诊断尤其是基层兽医实验室现地诊断中得到了广泛应用。常亮等[68]采用柠檬酸钠还原法制备胶体金颗粒,用TGEV单克隆抗体标记并包被在玻璃纤维膜上,另外将纯化的TGEV单克隆抗体和羊抗小鼠抗体包被在硝酸纤维膜上,组装成TGEV快速检测试纸条,该试纸条检出TGEV最低量为150 μg/mL,而检测CSFV、PRRSV、大肠杆菌及沙门氏菌均为阴性,试纸条在常温下可保存1年。胶体金试剂条具有快速、灵敏、特异、操作简便等特点,非常适用于基层单位。
3.3.4 IFA方法 间接免疫荧光(IFA)检测方法可利用抗原抗体反应进行组织或细胞内抗原的定位,且该方法具有特异性强、敏感性高和操作简便等特点,在病原检测、病毒感染及致病机理研究中得到广泛应用。朱蕴暖等[69]将TGEV接种PK-15细胞后,以抗TGEV N蛋白的单克隆抗体为一抗,荧光素FITC标记的山羊抗小鼠IgG为二抗,通过反应条件优化,建立了TGEV的IFA检测方法。该方法检测常见的PEDV、PoRV和 PCV2等猪病病原均为阴性,为TGEV的临床鉴别诊断提供了一种免疫学诊断技术。
4 小结与展望
现阶段的流行现状分析表明TGEV在我国猪群中呈散发性、区域性流行,其整体感染率一直稳定在较低水平,表明我国采取的TGE综合防控措施发挥了功效,但分析中发现TGEV的隐性感染以及与其它致病原的混合感染均普遍存在,应加强重视。对于TGEV的各种实验室诊断技术,病毒分离鉴定、IPMA、IHA、基因芯片方法均存在试验条件要求高、操作复杂、过程繁琐、费用成本高等条件限制,不利于基层实验室快速检测。RT-LAMP和胶体金方法对仪器设备要求较低,但敏感性太高,易导致假阳性。RT-PCR、ELSA方法操作简单、检测快速、高通量,是目前TGEV诊断和流行病学监测使用的主要方法,但RT-PCR方法对扩增产物进行电泳时需使用溴化乙锭(EB),对环境和人体健康产生一定的威胁。荧光RT-PCR方法弥补了常规RT-PCR不能定量以及EB的污染问题,但对仪器、试剂、操作人员技术水平要求均较高,有条件的实验室可选择使用。相信随着分子生物学和免疫学检测技术的不断完善与标准化,以及我国对TGE研究的不断深入和防控措施的不断完善,TGE的各种实验室诊断技术必将会走向不断成熟与完善,TGE的流行也将会得到进一步控制,从而逐步实现TGEV在我国的净化。
[1] 刘敏翠.宝鸡市2015~2016年猪传染性胃肠炎血清学调查与分析[J] .农民致富之友,2017(12):253.
[2] 黄虎翼.猪传染性胃肠炎及综合防控措施[J] .中国畜牧兽医文摘,2016,32(9):153.
[3] 颜其贵,欧洋,郭万柱,等.猪传染性胃肠炎病毒SC-1株的分离与基因 7 的克隆分析[J] .中国兽医学报,2007,27(5):613-616.
[4] 黄小波,曹三杰,文心田,等.猪传染性胃肠炎病毒SC-H株的分离与鉴定[J] .黑龙江畜牧兽医,2008(8):58-61.
[5] 宋振辉,郭万柱.猪传染性胃肠炎病毒的分离鉴定及全基因组序列分析[J] .病毒学报,2008,24(5):364-368.
[6] 俞伏松,王劭,陈仕龙,等.猪传染性胃肠炎病毒福建株的分离鉴定[J] .福建农业学报,2012,27(11):1160-1164.
[7] 王龙涛,葛晨霞,王翠瑜,等.猪传染性胃肠炎病毒吉林株的分离鉴定及S基因的克隆与序列分析 [J] .中国兽医学报,2010,30(10):1277-1281.
[8] 丁利,陈光达,许信刚,等.猪传染性胃肠炎病毒陕西株的分离鉴定[J] .中国兽医杂志,2011,47(10):9-12.
[9] 陈伯祥,杨明,郭慧琳,等.猪传染性胃肠炎pl株的分离与鉴定[J] .国外畜牧学(猪与禽),2011,31(6):73-74.
[10] 钟望,田野,牛晓芸,等.猪传染性胃肠炎病毒NC株的分离鉴定及生物学特性试验[J] .中国兽医杂志,2012,48(11):13-17.
[11] 代洪波,陈蕾,朱玲,等.猪传染性胃肠炎病毒四川株的分离鉴定与一步生长曲线的测定[J] .中国兽医科学,2012,42(12):1224-1229.
[12] 姜春霞,马广鹏,姜艳平,等.猪传染性胃肠炎病毒LJ-12株的分离与鉴定[J] .畜牧与兽医,2013,45(3):47-50.
[13] 郭容利,倪艳秀,温立斌,等.猪传染性胃肠炎病毒江苏株的分离与鉴定及其S基因序列分析[J] .华北农学报,2013,28(5):74-79.
[14] 田野,苏丹萍,钟望,等.猪流行性腹泻病毒的分离及RT-PCR方法的建立[J] .猪业科学,2013,30(2):94-95.
[15] 孙秋艳,郭洪梅,沈美艳,等.猪传染性胃肠炎病毒的分离鉴定及 S 基因进化分析[J] .动物医学进展,2015,36(7):7-12.
[16] 樊雅婷,张志,吴发兴,等.猪传染性胃肠炎病毒流行株的分离鉴定及其S基因序列分析[J] .黑龙江畜牧兽医,2015(21):32-35.
[17] 尤刘阳,苏丹萍,宋亚兵,等.猪传染性胃肠炎病毒SY株的分离鉴定及 S基因的序列分析[J] .中国兽医科学,2016,46(5):579-585.
[18] 白云云,葛旭影,高睿泽,等.猪传染性胃肠炎病毒的分离鉴定及其S基因分子生物学特征的分析[J] .中国兽医科学,2016,46(3):296-302.
[19] 满坤,于萍萍,汤波,等.猪传染性胃肠炎病毒强毒株的分离鉴定[J] .黑龙江畜牧兽医,2017(11):197-199.
[20] 于晓龙.猪流行性腹泻病毒和猪传染性胃肠炎病毒混合感染的调查[J] .安徽农学通报,2007,13(14):156-157.
[21] 洪尼宁,张登祥,李涛,等.贵州省猪传染性胃肠炎及呼吸冠状病毒病血清学调查[J] .中国畜牧兽医,2010,37(12):180-182.
[22] 陈强,曾丽莉,俞伏松,等.规模化猪场仔猪腹泻4种病原的感染情况调查[J] .福建农业学报,2010,25(1):8-13.
[23] 胡帅,李军,许力干,等.2010-2011年广西规模化猪场主要病毒性疫病流行病学调查[J] .黑龙江畜牧兽医,2013(14):85-86.
[24] 王振玲,赵庶吏,李爽,等.北京地区规模化猪场仔猪腹泻性疾病的病原调查[J] .畜牧与兽医,2015,47(11):118-120.
[25] 王子龙,韩庆安,王玉清,等.河北省猪病毒性腹泻流行病学调查[J] .黑龙江畜牧兽医,2014(10):59-60.
[26] 甘海霞,梁晟,韦显凯,等.2011年广西猪群猪流行性腹泻和猪传染性胃肠炎调查[J] .动物医学进展,2012,33(10):125-127.
[27] 秦谷雨,杨勇,李郁,等.安徽省仔猪腹泻5种病毒感染情况的调查研究[J] .动物医学进展,2012,33(12):59-63.
[28] 郭旋,陈静,刘欢,等.广西仔猪腹泻病毒病原流行病学调查[J] .南方农业学报,2013,44(1):155-160.
[29] 张传亮,陈星宇,赵灵燕,等.浙江省猪病毒性腹泻流行病学调查及防控对策[J] .中国动物检疫,2013,30(7):47-48.
[30] 师保浚,赵津,张小敏,等.2011—2012年江苏和安徽两省部分猪场主要疫病流行病学调查[J] .畜牧与兽医,2013,45(5):69-71.
[31] 魏海芳,王鸿忠.青海省部分地区PEDV、TGEV和RV感染情况调查与分析[J] .动物医学进展,2013,34(9):133-136.
[32] 朱良强,占松鹤,何长生,等.安徽部分地区冬春季仔猪腹泻的流行病学调查与分析[J] .畜牧与兽医,2013,45(8):36-38.
[33] 郭晓秋,曲哲会,陈宏智,等.豫南地区规模化猪场仔猪腹泻病毒性病原感染情况调查[J] .畜牧与兽医,2015,47(7):113-115.
[34] 孙振钊,赵伟男,王靖飞.猪腹泻病例中PEDV、TGEV及PRV的感染调查[J] .动物医学进展,2014,35(5):132-135.
[35] 郑新添,吴天兴,戴爱玲,等.龙岩市仔猪病毒性腹泻检测与分析[J] .中国兽医杂志,2014,50(10):36-38.
[36] 田云,焦颖,王福广,等.2012-2013年广东猪流行性腹泻流行情况调查报告[J] .广东畜牧兽医科技,2015,40(5):18-21.
[37] 杜鹃,韦海涛,周德刚,等.北京地区猪主要病毒性腹泻疾病的流行病学调查[J] .中国兽医杂志,2015,51(3):24-26.
[38] 冯淑萍,梁丹洁,李春英,等.广西地区2012~2014年仔猪腹泻流行病学调查与分析[J] .上海畜牧兽医通讯,2016(1):38-39.
[39] 毛黎红,王开功,周碧君,等.贵州省部分地区规模化猪场仔猪4种致猪腹泻病病毒感染调查[J] .动物医学进展,2015,36(5):121-124.
[40] 王娜,高慎阳,蒋红,等.辽宁省仔猪病毒性腹泻的病原学调查[J] .黑龙江畜牧兽医,2015(2):64-66.
[41] 薛瑞雪,田野,田夫林,等.山东省部分地区仔猪病毒性腹泻流行病学调查[J] .中国预防兽医学报,2015,37(4):254-257.
[42] 胡帅,周庆安,李军,等.2013-2014年广西省主要猪病毒性传染病流行病学调查[J] .中国畜牧兽医,2016,43(6):1618-1623.
[43] 邢勇,李玉娟.包头地区猪病毒性腹泻的流行病学调查[J] .黑龙江畜牧兽医,2016(18):137-138.
[44] 张佩华,倪建平,缪德年,等.华东地区猪病毒性腹泻感染状况调查[J] .上海畜牧兽医通讯,2017(2):25-27.
[45] 胡兴义,张双翔,金志强,等.贵州地区仔猪病毒性腹泻流行病学调查[J] .中国预防兽医学报,2016,38(7):542-545.
[46] 张双翔,胡兴义,唐宇,等.贵州省仔猪病毒性腹泻病原学调查[J] .贵州畜牧兽医,2016,40(6):8-10.
[47] 廖勤丰,李文娟,向邦全,等.三峡库区仔猪传染性腹泻病原调查[J] .中国兽医杂志,2017,53(4):9-12.
[48] 卢荣彬,陈健,林花,等.龙岩地区仔猪病毒性腹泻发病率调查[J] .黑龙江畜牧兽医,2016(22):1-3.
[49] 黄宝学,蒙振亩,韦显凯,等.田东县猪病毒性腹泻疫情流行病学调查与防控对策[J] .黑龙江畜牧兽医,2016(6):104-106.
[50] 曹恭貌,张斌,岳华,等.四川部分猪场 PEDV、TGEV、GARV和 PKV 感染状况调查[J] .动物医学进展,2016,37(1):118-122.
[51] 王淞,曾昊,陈智,等.山东省猪腹泻病例中PEDV、TGEV和PRV 的感染调查与分析[J] .中国畜牧兽医,2017,44(7):2165-2170.
[52] 王娟萍,刘文俊,米瑞娟,等.山西省猪流行性腹泻流行病学调查[J] .畜牧与兽医,2016,48(9):116-118.
[53] 朱子健,闫丽辉,鞠妍,等.2015~2016年我国东北地区猪病毒性腹泻流行病学调查 [J] .中国预防兽医学报,2017,39(5):356-360.
[54] 霍翠梅,郝晴晴,吕玉星.2015年-2016年济宁地区导致猪腹泻的病毒性病原调查报告[J] .当代畜牧,2016(15):38.
[55] 韦雪华,汪洋,李玉杰,等.2016年山东省猪病毒性疫病的病原学检测[J] .中国动物检疫,2017,34(4):13-15.
[56] 赵香菊,王留.河南省猪传染性胃肠炎血清流行病学调查分析[J] .山东畜牧兽医,2016,37(7):57-58.
[57] 傅霞珠.南安市规模养殖场猪传染性胃肠炎感染状况分析[J] .中国动物保健,2016,18(11):85-86.
[58] 林裕胜,王隆柏,吴学敏,等.2012-2013年福建省猪流行性腹泻流行病学调查[J] .福建畜牧兽医,2013,35(6):16-18.
[59] 张作华,曲哲会,陈宏智,等.猪传染性胃肠炎病毒RT-PCR检测方法的建立与初步应用[J] .黑龙江畜牧兽医,2015(3):131-133.
[60] 李丽敏,朱卫霞,王晓波,等.猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪A型轮状病毒多重RT-PCR方法的建立及其应用[J] .中国兽医学报,2016,36(2):216-220.
[61] 李子祥,邵春艳,徐琦,等.猪传染性胃肠炎病毒实时荧光定量PCR检测方法的建立及应用[J] .河南农业科学,2017,46(3):129-133.
[62] 许梦怡.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪轮状病毒多重荧光RT-PCR检测方法的建立[D] .扬州:扬州大学,2016.
[63] 高睿泽,白云云,李训良,等.猪传染性胃肠炎病毒RT-LAMP检测方法的建立及应用[J] .中国兽医科学,2015,45(6):572-577.
[64] 滑翔,胡中凯,黄小波,等.检测猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪轮状病毒的cDNA芯片的构建[J] .畜牧兽医学报,2015,46(12):2235-2242.
[65] 徐向伟,李彬,孙冰,等.猪传染性胃肠炎病毒重组N蛋白间接ELISA抗体检测方法的建立[J] .畜牧与兽医,2016,48(5):31-38.
[66] 屈月,葛俊伟,唐丽杰,等.猪传染性胃肠炎病毒双抗体夹心ELISA 检测方法的建立[J] .中国预防兽医学报,2013,35(5):364-368.
[67] 朱蕴暖,张鑫,朱向东,等.猪传染性胃肠炎病毒免疫过氧化物酶单层细胞试验原位检测方法的建立[J] .中国预防兽医学报,2017,39(3):237-239.
[68] 常亮,陈伯祥,杨明,等.猪传染性胃肠炎免疫胶体金诊断试剂条的研制[J] .畜牧兽医杂志,2014,33(6):22-24.
[69] 朱蕴暖,张鑫,朱向东,等.猪传染性胃肠炎病毒间接免疫荧光检测方法的建立[J] .中国兽医科学,2017,47(1):109-113.
(编辑:郭玉翠)
S858.28
A
1002-1957(2017)05-0123-06
2017-08-09
山东省自然科学基金资助项目(ZR2016CM35);山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-08-17)
祖立闯(1981-),男,黑龙江宾县人,助理研究员,硕士,主要从事动物疫病诊断技术研究工作.E-mail:zulichuang2008@126.com
