曲酸对关中黑猪精液常温保存的影响
2017-10-12侯震坤刘兆军谢景兴杨公社庞卫军
侯震坤,魏 宁,刘兆军,谢景兴,杨公社,庞卫军
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
曲酸对关中黑猪精液常温保存的影响
侯震坤,魏 宁,刘兆军,谢景兴,杨公社,庞卫军
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
研究将抗氧化剂曲酸(Kojic acid)应用到关中黑猪精液的常温保存中,通过渗透压、精子活率、质膜完整率、顶体完整率和总抗氧化能力(T-AOC)等指标检测,探究曲酸对精子的保护作用,为关中黑猪精液稀释粉的研发提供技术支持。试验结果显示,BTS稀释液中添加0.1 g/L浓度以内的曲酸能够有效提高精子质膜、顶体完整性,提升精子的总抗氧化能力。其中0.04 g/L浓度组保存效果最好,保存第5天时精子活率为61.45%,可将精子有效保存时间延长2 d,0.06 g/L浓度组与之差异不显著(P>0.05)。综上所述,在BTS液中添加0.04 g/L曲酸能够对精子常温保存起到最佳的抗氧化保护效果。研究对解决猪精液常温保存中精子的氧化损伤问题具有重要参考意义,同时为自主研发稀释粉产品提供试验依据。
曲酸;关中黑猪;猪精液;常温保存
AbstractIn this study,antioxidant kojic acid were applied to the preservation of Guanzhong black pig semen at room temperature.Osmotic pressure,sperm viability,plasma membrane integrity,acrosome integrity and total antioxidant capacity(T-AOC)and some other detection indexes were experimented to explore the efficacy of kojic acid on the protection of semen,this study was aimed to provide a theoretical support for the research of dilution powder for Guanzhong black pig semen.The following are the main results in this study:BTS extenders solution with less than 0.1 g/L kojic acid can significantly improve the sperm plasma membrane,acrosome integrity,enhance the total antioxidant capacity of sperm(P<0.05),especially 0.04 g/L group has the best performance for the sperm viability was 61.45%at the 5th day which can prolong the sperm storage time for another 2 days.In addition,the sperm preservation effect of 0.06 g/L group was not significantly different with 0.04 g/L group(P>0.05).In summary,adding 0.04 g/L kojic acid in BTS solution had the best antioxidation protection effect on sperm preservation at room temperature.The results of this study are of great significance to solve the problem of sperm oxidative damage in porcine semen preservation at room temperature,and provide experimental basis for independent diluted powder research.
Key wordskojic acid;Guanzhong black pig;boar semen;room temperature preservation
活性氧(ROS)是精子生理过程的正常副产物,在获能、顶体反应和确保受精的协调信号事件中起重要作用[1]。然而,ROS和抗氧化系统之间的不平衡是引起氧化应激(OS)的重要原因,表现为过氧化损伤,最终可能导致雄性不育[2]。公猪精子质膜富含多不饱和脂肪酸,对OS特别敏感,并且由于精液的处理和加工过程,增加了ROS水平升高的几率[3-4]。尽管类似于许多其他细胞类型,精子同样具有自带的细胞内抗氧化酶系统,但并不能完全保护细胞膜免受OS的影响,因此,精子受益于它们浸浴的精浆中的抗氧化成分[5]。当精子射出体内后,精子的生存环境发生极大变化,尤其是经过稀释后的精液,精浆中酶等保护物质经过几倍甚至10余倍的稀释,部分精浆中的稀精子段在采精时甚至被舍弃,这无疑会削弱精子抗氧化能力。因此,添加外源性抗氧化剂来保护精子在常温液态状态下的存活并保证其在一定期限内具有使卵子受精的能力是至关重要的,也是当今猪精液商业化生产交易和运输常态下的必要需求[6]。
曲酸(Kojic acid)是由几种真菌产生的真菌代谢物,具有很强的抗氧化活性和酪氨酸酶抑制活性,通常用作皮肤美白研究中的阳性对照[7]。其广泛用于防止水产品的酶促褐变,西兰花、菠萝蜜等蔬菜水果的保鲜保水[8-9]。此外,曲酸能够增加大肠杆菌内外膜的通透性,加速细菌的死亡[10]。目前,曲酸在猪精液常温保存上的应用还少见报道。
本试验探讨稀释液中添加曲酸对关中黑猪精子的保护效果,通过保存过程中精子活率、质膜和顶体完整性以及精子总抗氧化能力的测定,分析曲酸作为抗氧化剂添加的可行性。
1 材料与方法
1.1 试验时间、地点与试验动物
试验于2016年9月至2017年3月在西北农林科技大学进行。试验用种公猪精液采自西北农林科技大学三站猪场的3头年龄分别为1.4岁、1.5岁、2岁的成年关中黑猪种公猪。
1.2 主要试剂及仪器
曲酸,葡萄糖,果糖,柠檬酸钠,氯化钾,碳酸氢钠,Rh123(罗丹明),碘化丙啶(PI),异硫氰酸荧光素/花生凝集素联合染色(FITC-PNA)试剂盒,丙二醛(MDA)测试试剂盒,总抗氧化能力(T-AOC)测试试剂盒,多功能酶标仪Synergy H1,精子密度仪Modelo V11,猪精液计算机辅助分析系统HVIESSW V8.0(CASA),紫外光分光光度计,恒温数显水浴锅HHS21-4-S,17℃恒温冰箱;全自动冰点渗透压仪Osmopro 3250。
1.3 试验方法
1.3.1 猪精液的采集 通过双层手套手握法进行采精,并用3层滤纸过滤后将富含精子的部分收集于保温杯中。
1.3.2 猪精液的稀释和分装 采精完毕后,立即送至实验室进行稀释分装。稀释前分别用精子密度仪和快速pH试纸检测精子密度和pH。将之前溶解好并预热过的BTS稀释液与精液共同置于37℃的水浴锅中水浴5 min,避光,使二者温度相近。随后用烧杯称量精液量并记录,将稀释液缓慢倒入精液中,按1∶4比例进行等温稀释。之后精液转移至50 mL离心管中,在室温下放置2 h使其温度缓慢降至室温,再转移到17℃恒温冰箱中常温保存,精液保存期间每天摇匀1次。
1.3.3 试验分组 预试验分为6组,BTS稀释液中曲酸的添加浓度分别为 0、0.1、0.2、0.4、0.8、1.6 g/L。正式试验分为6组,BTS稀释液中曲酸的添加浓度分别为 0、0.02、0.04、0.06、0.08、0.10 g/L。
1.3.4 精子活率的检测 精子活率定义为沿直线前进运动的精子数占总精子数的百分比。采用CASA系统自动检测精子活率。进行精子活率检测前,每组分别取1 mL精液于1.5 mL离心管中放入37℃水浴锅中预热10 min。检测时吸取10 μL精液样品滴于载玻片上,将载玻片放置于显微镜物镜下的恒温载物台上预热30 s,恒温载物台温度设置为37℃,随后用计算机自动分析系统(CASA)进行检测计算。精子活率每隔24 h检测1次,直到活率低于60%为止。
1.3.5 渗透压的测定 通过渗透压仪测定各组精液的渗透压。
1.3.6 精子质膜完整性检测 按柠檬酸钠7.35 g/L、果糖13.5 g/L配制柠檬酸钠-果糖低渗液(现配现用),待溶液溶解后,从各试验组中吸取1 mL精液,分别加入9 mL柠檬酸钠-果糖低渗液,在37℃条件下水浴30 min,期间不时轻晃试管,以免精子沉积造成膜损伤,影响结果。之后用微量移液器吸取15 μL,先在40倍视野下找到精子,后在400倍光学显微镜下观察精子弯尾率,计算在200个精子中尾部弯曲的精子所占比例,记录数据。
1.3.7 精子顶体完整性检测 使用荧光染料异硫氰酸荧光素-花生凝集素(FITC-PNA)对精子进行染色,检测顶体完整率。在荧光显微镜下可以观察到两种类型精子:a)精子顶体前部呈现完整的明亮绿色荧光,即顶体完整的精子。b)顶体前部荧光残缺或无荧光,即顶体破损或丢失的精子。
1.3.8 精液总抗氧化能力(T-AOC)测定 总抗氧化能力(T-AOC)测试使用总抗氧化能力测试盒(A015-2 ABTS快速法100T)测定(南京建成生物工程研究所生产)。
1.4 统计分析
试验所得数据经Excel 2013初步整理后,采用SPSS 18.0统计软件进行分析,以平均数±标准误表示,用One-way ANOVA进行方差分析与显著性检验,P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 曲酸对关中黑猪精子活率的影响
2.1.1 预试验中不同浓度曲酸对关中黑猪精子活率的影响 由表1可知,当曲酸的添加量超过0.10 g/L 时,精子活率降低;曲酸添加量为 0.10 g/L时,精子活率略优于对照组,但是差异不显著(P>0.05)。由此推测曲酸的最适添加浓度范围在0~0.10 g/L。
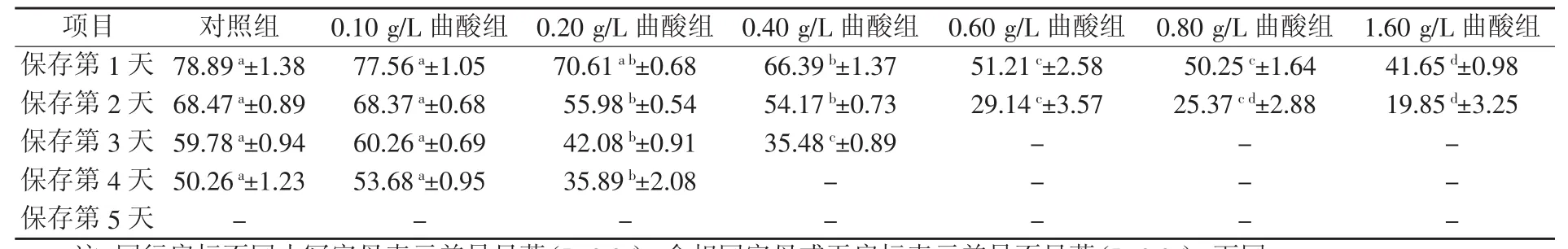
表1 预试验中不同浓度曲酸对关中黑猪精子活率的影响(n=3) %
2.1.2 正式试验中不同浓度曲酸对关中黑猪精子活率的影响 由表2可知,精子保存至第3天时,对照组精子活率即下降到60.62%,与0.10 g/L曲酸组差异不显著(P>0.05),与 0.02 g/L 曲酸组、0.04 g/L 曲酸组、0.06 g/L 曲酸组、0.08 g/L 曲酸组差异显著(P<0.05)。自保存第4天起,对照组精子活率与所有试验组差异显著。保存至第5天时,除添加0.04 g/L曲酸组精子活率为61.45%,高于60%,其余所有组精子活率均低于60%。综合来看,0.04 g/L曲酸组对精子活率保存效果最好。
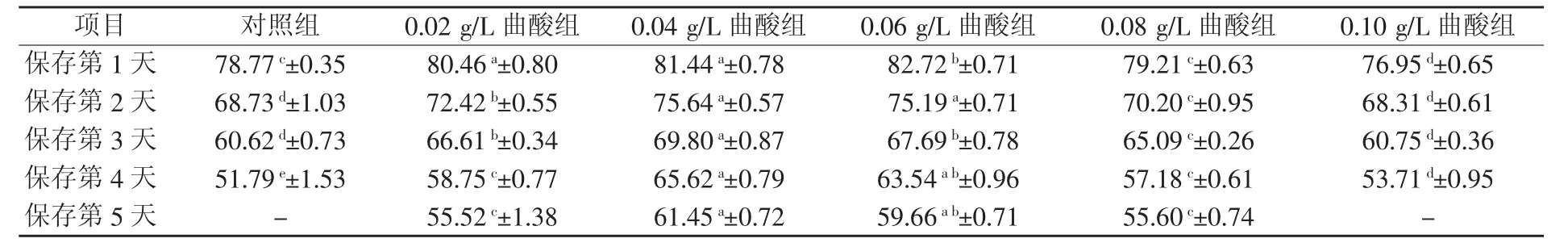
表2 正式试验中不同浓度曲酸对关中黑猪精子活率的影响(n=5) %
2.2 曲酸对稀释液渗透压的影响
由表 3 得知,不同浓度(0~1.60 g/L)曲酸对 BTS稀释液渗透压影响极小,各组间均无显著差异。
2.3 曲酸对关中黑猪精子质膜完整性的影响
由表4可知,对照组精子质膜完整性自保存第1天起就与各试验组有显著差异(P<0.05),并且这种显著差异保持到精液保存的第5天。在保存5天期间内,试验组质膜完整性最高的组别有所不同,第1天、第3天为曲酸0.06 g/L组最高,第2天、第4天、第5天为曲酸0.04 g/L组最高。保存至后期,0.04 g/L曲酸组对精子质膜完整性保护效果最好。

表3 BTS稀释液中添加不同浓度曲酸后的渗透压 mOsm/kg
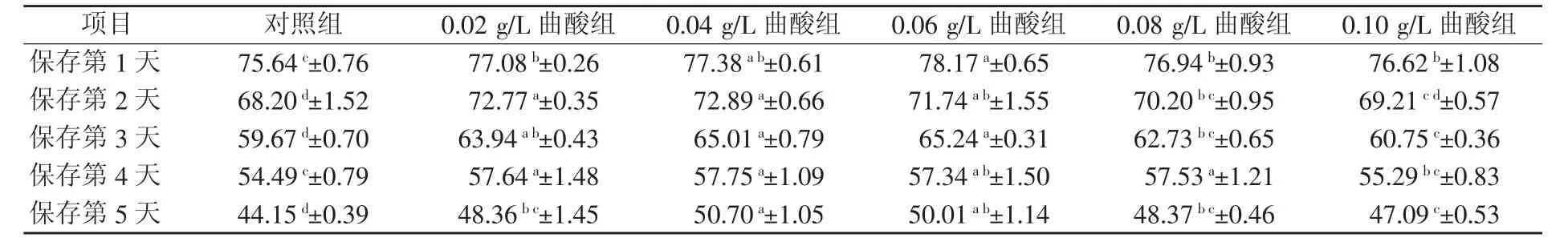
表4 不同浓度曲酸对关中黑猪精子质膜完整性的影响(n=5) %
2.4 曲酸对关中黑猪精子顶体完整性的影响
由表5可知,在精子保存第1天时,所有组别的顶体完整率均无显著差异。从保存第2天起,试验组开始显示出优势:保存第2天0.04 g/L曲酸组顶体完整性显著高于对照组(P<0.05),并且显著性持续到保存第5天。0.10 g/L曲酸组对精子顶体完整性有不利影响。添加曲酸0.04 g/L对精子顶体完整性保护效果最好。
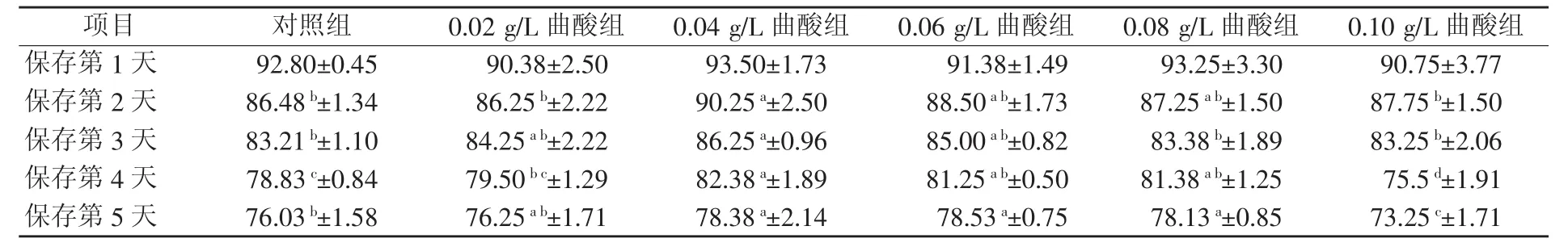
表5 不同浓度曲酸对关中黑猪精子顶体完整性的影响(n=5) %
2.5 曲酸对关中黑猪精子总抗氧化能力的影响
由表6可知,精液保存第3天,添加曲酸组精子总抗氧化能力均高于对照组,除0.02 g/L曲酸组与对照组差异不显著外(P>0.05),其余试验组均显著高于对照组(P<0.05),其中 0.04 g/L 曲酸组 T-AOC值最高,0.06 g/L曲酸组次之。保存至第5天,添加曲酸的试验组T-AOC值均高于对照组,但各组间差异不显著(P>0.05)。

表6 不同浓度曲酸对关中黑猪精液T-AOC的影响(n=5) U/mL
3 讨论
公猪精浆中含有抗氧化酶,保护细胞免受氧化应激。但在稀释的商品猪精液中,原始的抗氧化酶水平大幅降低,在长达3~5 d甚至更长时间的常温保存过程中,精子仅靠自身的抗氧化系统不足以抵御生存环境和长时间的保存运输所带来的氧化应激,因此稀释液中添加抗氧化剂是降低精子氧化损伤重要手段。
试验发现,不同个体公猪射出的新鲜精液渗透压也存在差异,虽然这种差异不大一般不超过10 mOsm/kg。Fraser等(2001)也发现相同的现象,并认为个别公猪精子之间存在渗透反应的差异,但具体机制还不清楚[10]。Fraser等(2001)还发现渗透压影响精子的膜完整性[11]。本试验表明,不同浓度曲酸(0~1.60 g/L)添加对稀释液的渗透压影响极小,因此,各项精液质量检测指标的差异可以排除与曲酸浓度导致的渗透压变化有关。
预试验的结果表明,曲酸添加浓度不宜超过0.10 g/L。精子活率即沿直线前进运动的精子百分比,是精子运动性能最直接的表现形式。在CASA系统下由计算机自动检测精子的运动性能,结果更为准确,同时也避免了检查者主观情感上带来的判别误差[12]。曲酸添加浓度在0.10 g/L内,对精子表现出较好的保存效果:所有试验组精子活率均高于对照组,且0.04 g/L曲酸组、0.06 g/L曲酸组效果最好,从保存第3天开始显著高于其他组并延续到保存第5天。与活率相似的结果也出现在精子质膜完整性上,0.04、0.06 g/L曲酸组明显对质膜的保护效果要更为优秀。本试验精子质膜完整性在数值上整体低于范晓腾(2016)试验中相同保存时间精子质膜完整性,原因在于检测手段的差别。本试验采用低渗肿胀试验(HOST)观察精子在低渗状态下的弯尾率,范晓腾的试验采用PI/SYBR-14联合荧光染色。
有趣的是,本试验用FITC-PNA荧光染色观察检测发现精子在保存期间顶体完整性的变化与活率、质膜等指标相比在数值上的变化较小,这与谢东淇(2016)的试验结果相似,但添加曲酸组仍然显示出优异性,0.04、0.06、0.08 g/L曲酸组3组对顶体完整性的保护作用明显强于其他组,曲酸高于0.08 g/L对顶体完整性有不利影响,具体原因还需进一步研究。
精子的总抗氧化能力(T-AOC)检测是检测抗氧化剂是否有效的重要参考指标[13]。本试验结果显示精子保存至第3天时,添加曲酸试验组的精子T-AOC值显著高于对照组,充分体现了曲酸的抗氧化效果。第5天时,添加曲酸试验组虽然整体上T-AOC值高于对照组,但各组间无显著差异,这可能与本试验精液中未加入抗菌剂导致细菌大量增殖有关。
4 结论
BTS稀释液中添加0.1 g/L浓度以内的曲酸能够有效提高精子质膜、顶体完整性,提升精子的总抗氧化能力,其中0.04 g/L质量浓度保存效果最显著,可将精子有效保存时间延长2 d。
[1] Bansal A K,Bilaspuri G S.Impacts of oxidative stress and antioxidants on semen functions[J] .Veterinary Medicine International,2010(12):7.
[2] Guthrie H D,Welch G R.Determination of intracellular reactive oxygen species and high mitochondrial membrane potential in Percoll-treated viable boar sperm using fluorescence-activated flow cytometry[J] .Journal of animal science,2006,84(8):2089-2100.
[3] Cerolini S,Maldjian A,Surai P,et al.Viability,susceptibility to peroxidation and fatty acid composition of boar semen during liquid storage[J] .Animal reproduction science,2000,58(1):99-111.
[4] Radomil L,Pettitt M J,Merkies K M,et al.Stress and dietary factors modify boar sperm for processing[J] .Reproduction in domestic animals,2011,46(s2):39-44.
[5] Juyena N S,Stelletta C.Seminal plasma:an essential attribute to spermatozoa[J] .Journal of andrology,2012,33(4):536-551.
[6] Riesenbeck A.Review on international trade with boar semen[J] .Reproduction in domestic animals,2011,46(s2):1-3.
[7] Pintus F,Matos M J,Vilar S,et al.New insights into highly potent tyrosinase inhibitors based on 3-heteroarylcoumarins:Anti-melanogenesis and antioxidant activities,and computational molecular modeling studies[J] .Bioorganic&Medicinal Chemistry,2017,25(5):1687-1695.
[8] 何世微,陶毅明,王贵平,等.曲酸对菠萝蜜多酚氧化酶的抑制作用和抑菌实验[J] .食品工业科技,2015,36(11):159-161.
[9] 李庆鹏,崔文慧,郭芹,等.曲酸处理对鲜切西兰花品质及生理变化的影响[J] .核农学报,2014,28(9):1664-1668.
[10] Liu X,Xia W,Jiang Q,et al.Effect of kojic acid-grafted-chitosan oligosaccharides as a novel antibacterial agent on cell membrane of gram-positive and gram-negative bacteria[J] .Journal of bioscience and bioengineering,2015,120(3):335-339.
[11] Fraser L,Gorszczaruk K,Strzeek J.Relationship between motility and membrane integrity of boar spermatozoa in media varying in osmolality[J] .Reproduction in Domestic Animals,2001,36(6):325-329.
[12] Knox R V.Artificial insemination in pigs today[J] .Theriogenology,2016,85(1):83-93.
[13] 谢东淇,苏泽智,郝阳毅,等.猪精液中菌落种类的鉴定及药敏试验[J] .中国畜牧杂志,2016,52(9):66-69.
(编辑:富春妮)
Effects of Kojic Acid on the Quality of Boar Semen of Guanzhong Black Pig during Room Temperature Preservation
HOU Zhenkun,WEI Ning,LIU Zhaojun,XIE Jingxing,YANG Gongshe,PANG Weijun
(College of Animal Science and Technology,Northwest A&F University,Yangling 712100,China)
S828.3
A
1002-1957(2017)05-0037-04
2017-08-05
国家生猪产业技术体系(CARS-36);西北农林科技大学试验示范站(基地)科技成果推广项目(TGZX2015-18)
侯震坤(1993-),男,河南焦作人,在读硕士研究生,主要从事猪人工授精技术的研究工作.E-mail:rensh102257@163.com
庞卫军(1972-),教授,博士生导师,研究方向为肌肉生物学与猪遗传改良.E-mail:pwj1226@nwafu.edu.cn
