胰腺转移性透明细胞性肾细胞癌6例并文献复习
2017-09-19郭春雨何妙侠郑建明
韩 换,郭春雨,何妙侠,郑建明
·短篇论著·
胰腺转移性透明细胞性肾细胞癌6例并文献复习
韩 换,郭春雨,何妙侠,郑建明
目的探讨胰腺转移性透明细胞性肾细胞癌(clear cell renal cell carcinoma, CCRCC)的临床病理学特征、诊断、鉴别诊断。方法分析6例胰腺转移性CCRCC的临床病理特征并复习相关文献。结果6例胰腺转移性CCRCC中男性2例,女性4例;发病年龄61~79岁,中位年龄68.8岁;肿瘤位于胰头1例,胰体尾5例;转移病变距肾癌切除术后时间1~10年不等,平均6.2年。术前患者均表现为胰腺占位,无特异性临床表现。术前影像学示3例胰腺单发占位,3例胰腺多发占位,其中1例伴肝转移。6例患者均行胰腺肿瘤根治切除手术,常规病理检查示肿瘤边界清楚,直径1.3~4 cm不等。形态学观察大部分肿瘤组织呈巢状、腺泡状、乳头状排列,肿瘤细胞圆形、卵圆形,核偏小居中,核仁隐约可见;胞质丰富,胞质透明,部分嗜酸性,间质血窦丰富。免疫表型:ABC、CD10、Pax-8、CA9、CAM5.2、CK8/18、EMA、vimentin均阳性,CA-199、CgA、TFE-3均阴性,Ki-67增殖指数2%~50%。结合既往肾癌病史,均诊断为胰腺转移性CCRCC。3例患者分别于胰腺肿瘤根治切除后1、6、17个月死亡;其余3例术后随访9、15、23个月均存活,未见肿瘤复发和转移。结论胰腺转移性CCRCC临床表现无特异性,术前诊断困难。既往病史对诊断有提示作用,最终确诊仍依赖术后病理诊断,手术完整切除为最佳治疗方案。
肾肿瘤;透明细胞性肾细胞癌;胰腺转移;免疫组织化学
胰腺肿瘤中转移性肿瘤临床较少见,由于缺乏特征性表现,发病隐匿,易导致病情延误,甚至误诊。目前,国内外报道仅数十例。本文着重分析6例胰腺转移性透明细胞性肾细胞癌(clear cell renal cell carcinoma, CCRCC)的临床病理特征,并复习相关文献进行讨论,以提高临床与病理医师对胰腺转移性CCRCC的认识水平。
1 材料与方法
1.1材料收集2012~2016年第二军医大学第一附属医院长海医院病理科诊断的6例胰腺转移性CCRCC,复习临床及影像学资料、病理形态及免疫表型,电话及门诊随访患者术后生存情况。
1.2方法肿瘤切除标本均经10%中性福尔马林固定,常规脱水、石蜡包埋,HE染色,光镜观察。免疫组化采用EnVision法染色,具体操作步骤严格按试剂盒说明书进行。选用抗体包括CK8/18、ABC、CD10、Pax-8、CA9、CAM5.2、EMA、vimentin、CA-199、CgA、Syn、TFE-3和Ki-67,所有抗体均购自DAKO公司。
2 结果
2.1临床特点6例胰腺转移性CCRCC中,男性2例,女性4例,发病年龄61~79岁,中位年龄68.8岁。肿瘤1例位于胰头,5例位于胰体尾,转移病变距肾癌切除术后时间1~10年,平均6.2年。患者术前多表现为胰腺占位,并无特异性临床表现。影像学检查示3例为胰腺单发占位,3例为胰腺多发占位,其中1例伴肝脏转移。超声检查示胰腺肿瘤多为边界清晰的低回声圆形肿块。CT或MRI检查示肿瘤为血供丰富的肿块影(图1)。6例患者均接受胰腺肿瘤根治切除手术,位于胰头者1例行胰头十二指肠切除,位于胰体尾者5例均行胰体尾加脾脏切除。术后随访:3例分别为术后1、6、17个月死亡,其余3例术后分别随访9、15、23个月均存活(截止2016年9月),未见肿瘤复发和转移(表1)。
2.2病理检查眼观:所有病例肿瘤均位于胰腺内,呈单发或多发,直径1.3~4 cm,切面灰白或灰红色,实性,质偏硬,与周围组织界限较清晰(图2)。镜检:肿瘤组织呈巢状或腺泡状分布,肿瘤细胞圆形、卵圆形,胞质丰富,胞质透明,部分嗜酸性,核仁隐约可见,间质血窦丰富。肿瘤组织呈浸润性生长,局部可见出血(图3)。
2.3免疫表型所有病例肿瘤细胞中CK8/18、ABC(图4A)、CA9(图4B)、CD10、Pax-8、CAM5.2、EMA、vimentin均阳性,CA-199、CgA、Syn、TFE-3均阴性;Ki-67增殖指数2%~50%。
3 讨论
胰腺转移性肿瘤临床少见,占所有胰腺恶性肿瘤的2%~5%[1]。胰腺常见的转移性肿瘤有肾细胞癌(renal cell carcinoma, RCC)、恶性黑色素瘤、结直肠癌、肺癌、乳腺癌和间叶源性恶性肿瘤等[2],RCC是胰腺最常见的转移性肿瘤[3],其中又以CCRCC最常见[1]。RCC主要通过血道或淋巴道发生转移[4]。RCC可以转移到胰腺任何位置,最常见转移至胰腺头部,其次为胰腺尾部,再次为胰腺体部[5],本组1例转移性CCRCC位于胰腺头部,5例转移性CCRCC位于胰腺体尾部。胰腺转移性RCC与胰腺原发肿瘤相比,多发占位比例较高,达20%~45%[1]。本组6例患者,3例为单发转移灶,3例为多发转移灶,其中1例伴肝转移。CCRCC Fuhrman分级任何级别均可发生胰腺转移,但是Fuhrman分级越高,转移的可能性越大[6]。本组6例胰腺转移性CCRCC,其中Ⅳ级1例、Ⅲ级2例、Ⅱ级2例、Ⅰ级1例。对于原发肿瘤位于左肾或是右肾更易转移至胰腺,文献报道差异无显著性[5]。本组4例原发灶位于右肾,2例原发灶位于左肾。55%的胰腺转移性CCRCC在早期无任何临床表现,未引起全身性症状,常常是在术后体检影像学检查偶然发现胰腺占位性病变,而胰腺其他转移性肿瘤全身临床表现常比较明显[7]。本组6例中2例患者在术前检查有不同程度的腹部胀痛及不适,其余4例患者术前检查均未见明显异常,均在常规体检中偶然发现胰腺占位性病变。如果无明确的CCRCC临床病史,从患者临床表现和影像学检查较难鉴别胰腺原发肿瘤和胰腺转移性CCRCC[2]。影像学检查有一定的诊断价值,胰腺转移性CCRCC的超声表现多为边界清晰的低回声圆形肿块,CT表现以丰富的血供肿块影为特征,增强动脉期明显强化[8],这可与乏血供的胰腺其他肿瘤鉴别。胰腺转移性CCRCC与胰腺血管瘤、胰腺神经内分泌肿瘤以及原发性胰腺透明细胞癌相似,均为富血供肿瘤,超声及CT成像相似[9]。胰腺转移性CCRCC病灶直径1.5~12 cm[10],肿瘤边界较清楚,切面可呈金黄色、灰褐色、灰白色,可见出血、坏死或囊性。本组6例CCRCC胰腺转移灶直径1.3~4 cm,平均2.43 cm,转移灶均局限于胰腺内。80.95%的转移性CCRCC肿瘤镜下表现和原发灶肿瘤表现类似[11],可呈巢团状、片状、条索状排列,肿瘤间质血窦丰富等。
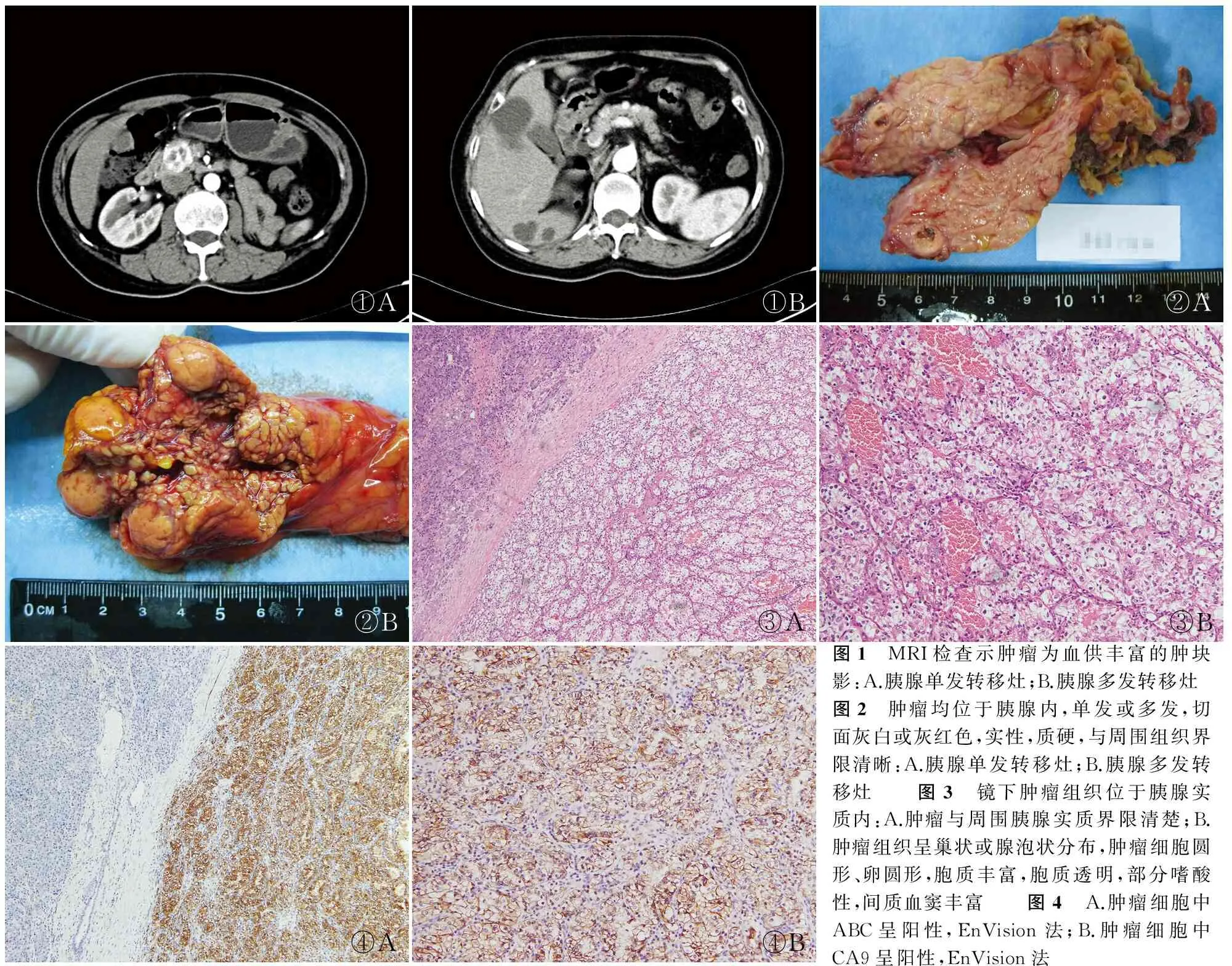
①A①B②A②B③A③B④A④B图1 MRI检查示肿瘤为血供丰富的肿块影:A.胰腺单发转移灶;B.胰腺多发转移灶图2 肿瘤均位于胰腺内,单发或多发,切面灰白或灰红色,实性,质硬,与周围组织界限清晰:A.胰腺单发转移灶;B.胰腺多发转移灶 图3 镜下肿瘤组织位于胰腺实质内:A.肿瘤与周围胰腺实质界限清楚;B.肿瘤组织呈巢状或腺泡状分布,肿瘤细胞圆形、卵圆形,胞质丰富,胞质透明,部分嗜酸性,间质血窦丰富 图4 A.肿瘤细胞中ABC呈阳性,EnVision法;B.肿瘤细胞中CA9呈阳性,EnVision法

表1 胰腺转移性CCRCC临床资料、手术及随访情况
CCRCC转移至胰腺主要需与以下肿瘤鉴别。(1)胰腺透明细胞癌:属于胰腺导管腺癌的变异亚型,尽管胰腺透明细胞癌和胰腺转移性CCRCC镜下均由不同程度异型的透明细胞排列呈腺管状或巢团状,但胰腺透明细胞癌一般都还存在典型胰腺导管腺癌的区域[12]。肿瘤细胞胞质内糖原反应阳性更能证明是胰腺转移性CCRCC,因为胰腺透明细胞癌胞质内没有黏蛋白和糖原[12]。在较难辨别的情况下,免疫组化标记CD10和Pax-8阳性支持胰腺转移性CCRCC的诊断[13]。(2)胰腺神经内分泌肿瘤透明细胞型:特别是在von Hippel-Lindau综合征中肿瘤细胞与胰腺转移性CCRCC非常相似,肿瘤细胞排列呈条索状、巢团状、肾小管状等,中央可见出血,与CCRCC相似[14]。尽管如此,胰腺神经内分泌肿瘤细胞典型的排列成缎带样、花环状以及脑回状,易引起注意;且胰腺神经内分泌肿瘤透明细胞型的免疫组化标记Syn和CgA均阳性,更易与胰腺转移性CCRCC鉴别。(3)胰腺浆液性囊腺瘤实体型:当肿瘤细胞胞质透亮、胞界清楚时,与胰腺转移性CCRCC相似[15]。肿瘤组织中出血和肿瘤细胞有异型性,更倾向于诊断为胰腺转移性CCRCC,肿瘤细胞免疫组化标记CA9、CD10、Pax-8等肾肿瘤细胞抗原阳性,支持CCRCC转移至胰腺的诊断。(4)胰腺实性假乳头状肿瘤透明细胞型:有时与胰腺转移性CCRCC光镜下难以鉴别[16],胰腺实性假乳头状肿瘤患者发病年龄为30岁以前,胰腺转移性CCRCC患者大部分为老人。另外,胰腺实性假乳头状肿瘤免疫组化标记Syn、β-catenin均阳性,胰腺转移性CCRCC中Syn、β-catenin均阴性[16]。(5)胰腺血管周上皮样细胞肿瘤:胰腺血管周上皮样细胞肿瘤临床罕见,光镜下和胰腺转移性CCRCC有相似的组织学特点,镜下肿瘤细胞胞质糖原丰富,细胞多边形至圆形,胞界清楚排列呈巢状,间质薄壁血管丰富[17]。单靠大体和光镜下较难鉴别,往往需要借助免疫组化辅助鉴别,免疫组化标记HMB-45、SMA均阳性支持胰腺血管周上皮样细胞肿瘤的诊断[18],而CK、CD10以及Pax-8均阳性则支持胰腺转移性CCRCC的诊断[13]。(6)胰腺转移性黑色素瘤:呈明显的多形性,其黏附性差,肿瘤细胞异型性明显,胞质空泡化,含有核内假包涵体,由于这些肿瘤细胞缺乏黑色素沉着,类似于透明细胞肿瘤。然而,肿瘤细胞免疫组化标记HMB-45、Melan-A和S-100蛋白均阳性;而在CCRCC中均阴性,有助于胰腺转移性CCRCC与胰腺转移性黑色素瘤鉴别[19]。
胰腺转移性CCRCC具有特征性的诊断标准:(1)患者有相关CCRCC的病史,最明显的是影像学示肾脏完好无缺失,则更加支持胰腺原发肿瘤诊断;(2)病理形态与CCRCC相似;(3)肾肿瘤特异性免疫组化标记CD10、CA9、Pax-8、ABC等均阳性;(4)肿瘤组织其他免疫组化标记CgA、β-catenin、SMA等均阴性。
根据最新胰腺外科手术进展,当患者只有胰腺转移灶时,单纯手术切除胰腺孤立性转移性RCC灶,是目前比较受欢迎的治疗方式[20]。Kassabian等[21]认为,手术切除时如条件允许,应当保留部分胰腺内分泌功能,以提高患者术后生活质量。使用舒尼替尼化疗治疗转移性CCRCC对患者有效[22],一般不选择化疗,只有非常高危的患者才考虑使用放疗[1]。本组6例患者均行胰腺肿瘤根治切除手术,位于胰头者1例行胰头十二指肠切除术,位于胰体尾者5例均行胰体尾加脾脏切除术,均保留部分胰腺功能。CCRCC转移至胰腺平均是在肾原发肿瘤10年以后,临床需密切随访CCRCC术后的患者[23]。有文献报道胰腺单发转移CCRCC和胰腺多发CCRCC患者生存期无明显差异[5,23]。本组6例患者在术后1~10年的随访中,平均6.2年出现胰腺转移。3例分别为胰腺肿瘤切除术后1、6、17个月死亡,余3例术后随访9、15、23个月均存活,未见肿瘤复发和转移。死亡3例患者中2例为胰腺多发转移灶,其中1例伴肝转移者术后1个月死亡,提示多发转移灶预后较差。胰腺转移性CCRCC术后并发症和胰腺其他转移性肿瘤的术后并发症发生率并无明显差异[24]。文献报道[25]胰腺单发RCC转移比其他原发肿瘤转移至胰腺有更好的预后。
胰腺转移性RCC临床少见,胰腺转移性CCRCC则更为罕见,其临床表现隐匿,缺乏特异性。诊断依据:CCRCC病史+光镜下组织学形态+免疫组化诊断(Pax-8、CA9、CD10)+适当鉴别诊断免疫表型(CgA、β-catenin、SMA),即可做出明确诊断。
[1] Ballarin R, Spaggiari M, Cautero N,etal. Pancreatic metastases from renal cell carcinoma: the state of the art[J]. World J Gastroenterol, 2011,17(43):4747-4756.
[2] Sperti C, Moletta L, Patane G. Metastatic tumors to the pancreas: the role of surgery[J]. World J Gastrointest Oncol, 2014,6(10):381-392.
[3] Wente M N, Kleeff J, Esposito I,etal. Renal cancer cell metastasis into the pancreas: a single-center experience and overview of the literature[J]. Pancreas, 2005,30(3):218-222.
[4] Hoo K K, Gaitor J, Lin O, Reid M D. Secondary tumors involving the thyroid gland: a multi-institutional analysis of 28 cases diagnosed on fine-needle aspiration[J]. Diagn Cytopathol, 2015,43(11):904-911.
[5] Benhaim R, Oussoultzoglou E, Saeedi Y,etal. Pancreatic metastasis from clear cell renal cell carcinoma: outcome of an aggressive approach[J]. Urology, 2015,85(1):135-140.
[6] Maeda H, Okabayashi T, Kobayashi M,etal. Emergency pancreatoduodenectomy for pancreatic metastasis from renal cell carcinoma in a patient with von Hippel-Lindau disease: a case report[J]. Dig Dis Sci, 2006,51(8):1383-1387.
[7] Tosoian J J, Cameron J L, Allaf M E,etal. Resection of isolated renal cell carcinoma metastases of the pancreas: outcomes from the Johns hopkins hospital[J]. J Gastrointest Surg, 2014,18(3):542-548.
[8] Palmowski M, Hacke N, Satzl S,etal. Metastasis to the pancreas: characterization by morphology and contrast enhancement features on CT and MRI[J]. Pancreatology, 2008,8(2):199-203.
[9] 张 宝,丁 军,付卫光. 胰腺透明细胞癌1例报道[J]. 中国实验诊断学, 2011,15(8):1409.
[10] Thompson L D, Heffess C S. Renal cell carcinoma to the pancreas in surgical pathology material[J]. Cancer, 2000,89(5):1076-1088.
[11] 褚 菁,韩桂燕,张 伟,等. 转移性透明细胞性肾细胞癌42例临床病理分析[J]. 临床与实验病理学杂志, 2016,32(4):384-387.
[12] Kim L, Liao J, Zhang M,etal. Clear cell carcinoma of the pancreas: histopathologic features and a unique biomarker: hepatocyte nuclear factor-1beta[J]. Mod Pathol, 2008,21(9):1075-1083.
[13] Truong L D, Shen S S. Immunohistochemical diagnosis of renal neoplasms[J]. Arch Pathol Lab Med, 2011,135(1):92-109.
[14] Hoang M P, Hruban R H, Albores-Saavedra J. Clear cell endocrine pancreatic tumor mimicking renal cell carcinoma: a distinctive neoplasm of von Hippel-Lindau disease[J]. Am J Surg Pathol, 2001,25(5):602-609.
[15] Machado M C, Machado M A. Solid serous adenoma of the pancreas: an uncommon but important entity[J]. Eur J Surg Oncol, 2008,34(7):730-733.
[16] Albores-Saavedra J, Simpson K W, Bilello S J. The clear cell variant of solid pseudopapillary tumor of the pancreas: a previously unrecognized pancreatic neoplasm[J]. Am J Surg Pathol, 2006,30(10):1237-1242.
[17] Martignoni G, Pea M, Reghellin D,etal. PEComas: the past, the present and the future[J]. Virchows Arch, 2008,452(2):119-132.
[18] Hornick J L, Fletcher C D. PEComa: what do we know so far?[J]. Histopathology, 2006,48(1):75-82.
[19] Baehner F L, Ng B, Sudilovsky D. Metastatic balloon cell melanoma: a case report[J]. Acta Cytol, 2005,49(5):543-548.
[20] Cheng S K, Chuah K L. Metastatic renal cell carcinoma to the pancreas: a review[J]. Arch Pathol Lab Med, 2016,140(6):598-602.
[21] Kassabian A, Stein J, Jabbour N,etal. Renal cell carcinoma metastatic to the pancreas: a single-institution series and review of the literature[J]. Urology, 2000,56(2):211-215.
[22] Chara L, Rodriguez B, Holgado E,etal. An unusual metastatic renal cell carcinoma with maintained complete response to sunitinib treatment[J]. Case Rep Oncol, 2011,4(3):583-586.
[23] Sellner F, Tykalsky N, De S M,etal. Solitary and multiple isolated metastases of clear cell renal carcinoma to the pancreas: an indication for pancreatic surgery[J]. Ann Surg Oncol, 2006,13(1):75-85.
[24] Adler H, Redmond C E, Heneghan H M,etal. Pancreatectomy for metastatic disease: a systematic review[J]. Eur J Surg Oncol, 2014,40(4):379-386.
[25] Konstantinidis I T, Dursun A, Zheng H,etal. Metastatic tumors in the pancreas in the modern era[J]. J Am Coll Surg, 2010,211(6):749-753.
时间:2017-7-18 11:52 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170718.1152.017.html
上海市卫计委薄弱学科建设计划(2015ZB0202)
第二军医大学第一附属医院长海医院病理科,上海 200433
韩 换,女,硕士研究生。Tel:(021)31162266,E-mail:hhuan1992@163.com 郑建明,男,教授,主任医师,博士生导师,通讯作者。 E-mail: jmzheng1962@163.com
R 735.9
:B
1001-7399(2017)07-0781-04
10.13315/j.cnki.cjcep.2017.07.017
接受日期:2017-05-12
