鱼鳔糖胺聚糖的提取及其吸湿保湿性能评价
2017-09-18,,,,2,*,,,
,, ,,2,*,,,
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,水产品深加工广东省高等学校重点实验室,广东湛江 524088;2.中山市淡水产品技术服务协同创新中心,广东中山 528436; 3.中山火炬职业技术学院,广东中山 528436)
鱼鳔糖胺聚糖的提取及其吸湿保湿性能评价
屈义1,周斯仪1,冯陶1,钟赛意1,2,*,谌素华1,苏伟明1,吴小禾2,3
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,水产品深加工广东省高等学校重点实验室,广东湛江 524088;2.中山市淡水产品技术服务协同创新中心,广东中山 528436; 3.中山火炬职业技术学院,广东中山 528436)
以鱼鳔为原料,通过枯草中性蛋白酶和胰蛋白酶双酶酶解提取糖胺聚糖,在单因素实验的基础上采用响应曲面法对提取条件进行优化,通过理化分析及UV、IR分析其性质和化学结构特征,并评价其吸湿保湿性。结果表明:酶法提取鱼鳔糖胺聚糖的最佳工艺条件:料液比1∶20 g∶mL、酶解时间4 h,酶解温度50 ℃,酶用量7%,酶解pH8,最优条件下鱼鳔糖胺聚糖粗品得率为1.19%,糖胺聚糖含量为19.09%;红外吸收光谱检测表明,其具有典型的糖胺聚糖特征吸收峰,且含有α糖苷键的吡喃糖环结构;鱼鳔糖胺聚糖具有良好的吸湿保湿性,总体吸湿保湿性优于壳聚糖、海藻酸钠等常规保湿剂。综上表明,鱼鳔糖胺聚糖作为一种天然的保湿剂具有一定的应用前景。
鱼鳔,糖胺聚糖,提取工艺,理化及结构特征,吸湿性,保湿性
鱼鳔(Swim bladder),又称鱼肚或鱼泡,为胶质囊状物,是鱼游泳时的水中深浅位置调节器。在我国汉代就有鱼鳔作为药材的记载;唐朝时期,鱼鳔已作为贡品之一,与燕窝、鱼翅齐名,素有“海洋人参”之誉。中医认为鱼鳔具有滋阴养血、补肾固精、嫩肤养颜、抗癌等功效。我国作为世界水产第一大国,拥有丰富的鱼鳔资源,但目前缺乏对鱼鳔中功效因子的研究与开发。
前人研究表明鱼鳔的主要营养成分为高级胶原蛋白、糖胺聚糖和多种维生素及钙、锌、铁、硒等多种微量元素,其中糖胺聚糖含量丰富,约占鱼鳔干重的8.9%[1]。目前,国内外对鱼鳔的研究主要集中在营养成分分析、蛋白提取及活性研究等方面,如段振华[2]分析评价了不同来源的鱼鳔的营养成分。辛昭[3]证明大黄鱼鱼鳔多糖对CCl4致肝损伤有良好的预防作用。索华义[4]发现黄鱼鱼鳔多糖可以诱导结肠癌HCT-116细胞的凋亡;然而关于鱼鳔糖胺聚糖的分离提取及其结构性质的研究未见任何报道。作为海洋生物中含量丰富的生物活性物质,已经发现糖胺聚糖在抗癌、抗肿瘤、抗病毒、抗血栓等方面表现较强的活性,展现出良好的应用开发前景,有望成为新型的海洋药物和功能性保健食品的原料来源[5]。同时,糖胺聚糖分子中含有大量羧基和羟基等亲水性官能团,使其具备一些优良的理化性质,如强吸水性、乳化性和成膜性等[6]。有些多糖,如壳聚糖、透明质酸等已经广泛应用于保健品、食品、化妆品等行业[7]。本实验以鱼鳔为原料,采用酶法提取糖胺聚糖,对其提取工艺进行优化,并初步分析鱼鳔糖胺聚糖的基本理化性质及结构特征,同时首次对其吸湿保湿性能进行评价,旨在为鱼鳔功效因子的研究与开发,以及鱼鳔糖胺聚糖作为天然保湿因子应用于功能食品和化妆品中提供一定的理论依据。
1 材料与方法
1.1材料与仪器
鳘鱼鱼鳔 市售干品;枯草芽孢杆菌中性蛋白酶(酶活力150 U/mg)、胰蛋白酶(酶活力250 U/mg) 均购自上海源叶生物;D-葡萄糖醛酸、牛血清白蛋白 均购自中国医药集团上海化学试剂公司;肝素钠、Folin-酚试剂盒 均购自北京鼎国昌盛生物技术有限责任公司;阿利新兰 8GX(进口分装) 购自上海蓝季科技发展有限公司;盐酸、氢氧化钠、氯化钠、氯仿、正丁醇、三氯乙酸、无水乙醇、丙酮、咔唑、浓硫酸、苯酚、葡萄糖、四硼酸钠、明胶、氯化钡、无水乙酸钠、硫酸钾等试剂 均为国产分析纯试剂。
UV-2550紫外可见分光光度计 日本岛津公司;Bruker Tensor-27傅里叶红外光谱仪 德国 Bruker公司;FD8508真空冷冻干燥机 韩国ilshin公司;EYELA旋转蒸发仪 日本ELELA;5810R高速台式冷冻离心机 Eppendorf;V-5000可见分光光度计 上海元析仪器有限公司;PHS-3C精密pH计 上海雷磁仪器厂。
1.2实验方法
1.2.1 鱼鳔基本成分分析 粗蛋白质含量的测定参照GB 5009.5-2010《食品中蛋白质的测定》,采用凯氏定氮法;粗脂肪含量的测定参照GB/T 5009.6-2003《食品中脂肪的测定》,采用索氏抽提法;水分含量的测定参照GB 5009.3-2010《食品中水分的测定》,采用105 ℃烘干恒质量法;灰分含量的测定参照GB 5009.4-2010《食品中灰分的测定》,采用炉550 ℃灼烧法;多糖含量的测定参照GB/T9695.31-2008《肉制品总糖含量的测定》,采用苯酚-硫酸法;总糖胺聚糖含量测定,采用阿利新蓝法[8]。
1.2.2 糖胺聚糖提取工艺优化
1.2.2.1 原料预处理 将鱼鳔置于50 ℃烘箱中干燥72 h,用高速旋转粉碎机粉碎鱼鳔成粉末状(粒度为200目),放在干燥器中备用。
1.2.2.2 糖胺聚糖提取工艺流程 鱼鳔粉→双酶酶解(酶由枯草杆菌中性酶和胰蛋白酶按照1∶1酶活比混合组成)→沸水浴灭酶(100 ℃,10 min)→离心取上清液(6000 r/min,10 min)→醇沉(60%醇量(V/V),4 ℃,24 h)→离心收集沉淀(3000 r/min,10 min)→无水乙醇和丙酮交替洗涤2次→冷冻干燥→鱼鳔糖胺聚糖F0。
1.2.2.3 单因素实验 料液比对鱼鳔糖胺聚糖粗品得率和含量的影响:取50 g鱼鳔粉,分别按照1∶10、1∶20、1∶30、1∶40 (g/mL)的料液比加蒸馏水,加入质量分数为1%的混合酶,调节溶液pH为8,在50 ℃条件下酶解4 h,其它操作同1.2.2.2,计算鱼鳔糖胺聚糖粗品得率和含量的乘积Y值(×10-4)。
酶解时间对鱼鳔糖胺聚糖粗品得率和含量的影响:取50 g鱼鳔粉,加入1 L蒸馏水,加入质量分数为1%的混合酶,调节溶液pH为8,在50 ℃条件下分别酶解1、2、3、4、5、6 h,其它操作同1.2.2.2,计算鱼鳔糖胺聚糖粗品得率和含量的乘积Y值(×10-4)。
酶用量对鱼鳔糖胺聚糖粗品得率和含量的影响:取50 g鱼鳔粉,加入1 L蒸馏水,分别加入质量分数为1%、2%、3%、4%、5%、6%、7%的混合酶,调节溶液pH为8,在50 ℃条件下酶解4 h,其它操作同1.2.2.2,计算鱼鳔糖胺聚糖粗品得率和含量的乘积Y值(×10-4)。
酶解温度对鱼鳔糖胺聚糖粗品得率和含量的影响:取50 g鱼鳔粉,加入1 L蒸馏水,分别加入质量分数为6%的混合酶,调节溶液pH为8,分别在30、40、50、60、70 ℃条件下酶解4 h,其它操作同1.2.2.2,计算鱼鳔糖胺聚糖粗品得率和含量的乘积Y值(×10-4)。
酶解pH对鱼鳔糖胺聚糖粗品得率和含量的影响:取50 g鱼鳔粉,加入1 L蒸馏水,分别加入质量分数为6%的混合酶,调节溶液pH为6.0、7.0、8.0、9.0、10.0,在50 ℃条件下酶解4 h,其它操作同1.2.2.2,计算鱼鳔糖胺聚糖粗品得率和含量的乘积Y值(×10-4)。
1.2.2.4 Box-Behnken实验设计 在单因素实验结果的基础上,根据Box-Behnken实验设计原理,考察酶用量(A)、酶解pH(B)、酶解温度(C)3个因素,以糖胺聚糖粗品得率(%)和糖胺聚糖含量(%)的乘积Y(×10-4)为响应值指标,采用Design Expert 8.05 软件对实验数据进行回归分析。Box-Behnken 实验设计水平见表1。

表1 Box-Behnken实验因素及水平Table 1 Factors and levels of response surface design
1.2.2.5 糖胺聚糖含量测定 采用阿利新蓝法测定糖胺聚糖含量。准确称取0.10 g肝素钠标准品,用蒸馏水定容至100 mL,配制成1 mg/mL的肝素钠标准溶液。向15% H3PO4与2% H2SO4的混合溶液中加入0.110 g阿利新蓝,充分溶解后定容至100 mL。
分别吸取0、0.02、0.04、0.06、0.08、0.1 mL肝素钠标准溶液于试管中,补水至0.1 mL,加入1.5 mL阿利新蓝染色液进行染色,室温静置10 min,在波长490 nm处比色测定吸光度,得到标准曲线回归方程为:Y=0.002X-0.0011,R2=0.9999;Y为吸光度,X为肝素钠含量(mg/mL)。

表2 鱼鳔主要成分组成Table 2 Main components of swim bladder
式(1)
式中:C:糖胺聚糖浓度(mg/mL);V:糖胺聚糖体积(mL);N:稀释倍数;M:称取糖胺聚糖质量(g)。
式(2)
式中:M:糖胺聚糖质量(g);M0:鱼鳔粉质量(g)。
1.2.3 Sevag法脱蛋白 将糖胺聚糖粗品配成1%的溶液,离心(3000 r/min,10 min)去沉淀,用氯仿∶正丁醇=4∶1混合物,按糖胺聚糖溶液∶Sevag试剂=5∶1的比例剧烈振摇30 min,离心(3600 r/min,10 min)脱蛋白,重复多次直至蛋白质层去除完全[9]。将糖胺聚糖溶液流水透析48 h,浓缩、冷冻干燥,得到初步纯化的糖胺聚糖F1。
1.2.4 鱼鳔糖胺聚糖的化学组成分析 多糖含量的测定采用苯酚-硫酸法;蛋白质含量的测定采用Folin-酚法[10];糖胺聚糖含量的测定采用阿利新蓝法;己糖醛酸含量的测定采用硫酸咔唑法;硫酸基含量的测定采用BaCl2-gel比浊法[11]。
1.2.5 鱼鳔糖胺聚糖的紫外光谱扫描 分别称取脱蛋白前后的糖胺聚糖5 mg,用蒸馏水配成1 mg/mL的溶液,在200~800 nm范围内进行紫外光谱扫描。
1.2.6 鱼鳔糖胺聚糖的红外光谱扫描 将干燥后的样品与溴化钾压制成薄片,在4000~500 cm-1范围内扫描。
1.2.7 鱼鳔糖胺聚糖的吸湿保湿特性研究
1.2.7.1 吸湿性的测定 鱼鳔糖胺聚糖的吸湿性测定[12]在恒温恒湿条件下进行,将碳酸钾饱和溶液和硫酸铵饱和溶液分别置于干燥器内,控制环境温度为20 ℃,制成相对湿度(RH)分别为43%和81%的环境。将鱼鳔糖胺聚糖F1、海藻酸钠、壳聚糖及数个规格相同的称量瓶在50 ℃条件下干燥至质量恒定。精确称取0.1 g样品置于称量瓶中,以丙三醇、壳聚糖、海藻酸钠为对照,将称量瓶敞口放置在相对湿度分别为43%和81%的干燥器中,密封干燥器。放置3、6、12、24、36、48、60、72 h后,称量其质量变化,按式(3)计算吸湿率:
式(3)
式中:M0为吸湿前各样品的质量(g);Mt为吸湿不同时间后各样品的质量(g)。
1.2.7.2 保湿性的测定 鱼鳔糖胺聚糖的吸湿性测定在恒温的干燥环境下进行。控制环境温度为20 ℃,在干燥器底部加入200 g变色硅胶。将鱼鳔糖胺聚糖F1、对照品及数个规格为20 mL的小烧杯置于干燥箱中,50 ℃干燥至质量恒定。准确称取鱼鳔糖胺聚糖F1、丙三醇、海藻酸钠、壳聚糖各0.1 g,分别加水10 mL配制成质量浓度为1 mg/mL的溶液。配制完成的溶液均敞口置于恒温密闭硅胶干燥器中。放置4、12、24、36、48、60、72、84、96 h后,称量其质量变化,按式(4)计算保湿率:
式(4)
式中:M0为吸湿前各样品的质量(g);Mt为吸湿不同时间后各样品的质量(g)。
1.3数据处理
Microsoft Excel 2007软件作图;Design Expert 8.05统计软件拟合实验数据。
2 结果与分析
2.1鱼鳔基本成分分析
鱼鳔的基本成分分析结果见表2,糖胺聚糖含量达1.77%±0.07%。
2.2单因素实验
2.2.1 料液比对鱼鳔糖胺聚糖粗品得率和含量的影响 由图1可知,随着提取溶剂用量的增加,Y值也逐渐增大,在料液比为1∶20时Y值达到最大;继续增大溶剂使用量时,Y值反而略显下降,且过大的溶剂使用量不利于后续的分离、浓缩、醇沉等工艺,故选择1∶20的料液比。
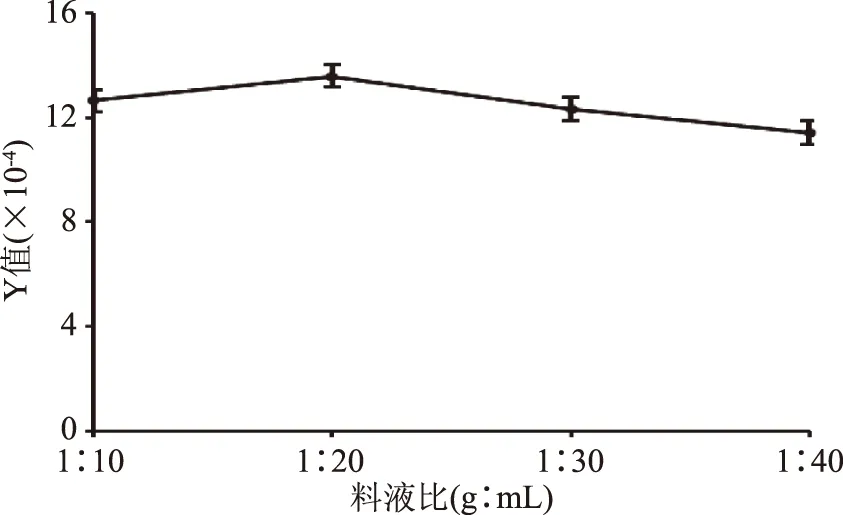
图1 料液比对鱼鳔糖胺聚糖提取的影响Fig.1 Effect of material/liqried rations on the extraction yeild of glycosaminoglycan from swim bladder
2.2.2 酶解时间对鱼鳔糖胺聚糖粗品得率和含量的影响 由图2可以看出,酶解时间在1~4 h范围内,Y值随着酶解时间的延长而呈现逐渐增长的趋势;4 h时Y值最大,继续延长酶解时间,Y值则表现下降趋势,这可能是由于长时间的提取反应导致蛋白酶结构的变化,进而造成酶活性位点被破坏,致使提取效率降低[13]。

图2 酶解时间对鱼鳔糖胺聚糖提取的影响Fig.2 Effect of enzymolysis time on the extraction yeild of glycosaminoglycan from swim bladder
2.2.3 酶用量对鱼鳔糖胺聚糖粗品得率和含量的影响 由图3可知,Y值随着酶用量的增多而增大,酶用量7%时依然表现出一定的上升趋势,但是当酶用量从5%提高到6%时,Y值提高7.7%,6%酶用量提高到7%时Y值提高5%,由此可以看出随着酶用量的增加,Y值的增加幅度反而呈现下降趋势;同时,考虑到枯草中性蛋白酶和胰蛋白酶的经济成本较高,故选择6%酶用量。
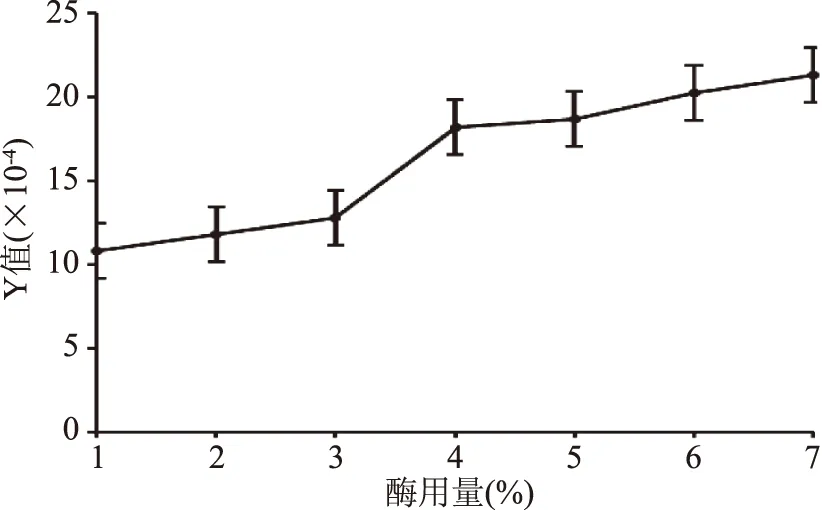
图3 酶用量对鱼鳔糖胺聚糖提取的影响Fig.3 Effect of enzyme dosage on the extraction yeild of glycosaminoglycan from swim bladder
2.2.4 酶解温度对鱼鳔糖胺聚糖粗品得率和含量的影响 由图4可知,在50 ℃之前,Y值随着酶解温度的升高而逐渐提高;当酶解温度达到50 ℃时,Y值最大;继续提高酶解温度时,Y值则表现出逐渐下降的趋势,这是因为枯草中性蛋白酶和胰蛋白酶的活性在50 ℃时最佳,过低或者过高的提取温度都会影响二种酶的活性。
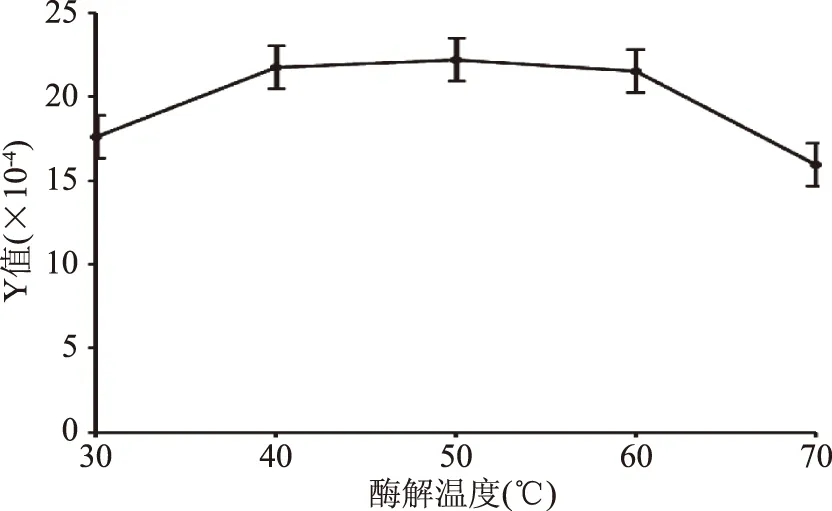
图4 酶解温度对鱼鳔糖胺聚糖提取的影响Fig.4 Effect of enzymolysis temperature on the extraction yeild of glycosaminoglycan from swim bladder
2.2.5 酶解pH对鱼鳔糖胺聚糖粗品得率和含量的影响 由图5可知,酶解pH在8之前,Y值随着酶解pH的增大而增大,并在酶解pH为8时达到最大值;继续提高酶解pH,Y值则表现出明显的下降趋势。由此可知,在本酶解过程中,溶液pH为8时提取效果最好,即枯草中性蛋白酶和胰蛋白酶这两种混合酶的最适酶解pH为8,过酸、过碱都会影响两种酶的活性。
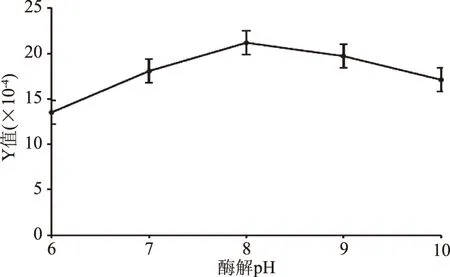
图5 酶解pH对鱼鳔糖胺聚糖提取的影响Fig.5 Effect of enzymolysis pH on the extraction yeild of glycosaminoglycan from swim bladder
2.3响应面实验
2.3.1 Box-Behnken实验分析方案及结果 根据单因素实验结果,采用响应面中的Box-Behnken模型进行二次旋转多元回归方程设计,共计15个实验点,12个分析因子,3个零点。考虑到料液比和酶解时间这2个单因素对酶法提取糖胺聚糖的影响相对于其它3个单因素来说稍弱,以及实验数据及实际情况,故选择酶用量、酶解温度、酶解pH这3个因素为自变量,糖胺聚糖粗品得率和糖胺聚糖含量的乘积Y值(×10-4)为响应值进行Box-Behnken 实验。对实验数据进行回归拟合,得到Y值对于各因素回归方程:
Y=22.66-1.30A+0.36B+0.41C-1.04AB+0.13AC-1.04BC-1.03A2-2.43B2-0.51C2。
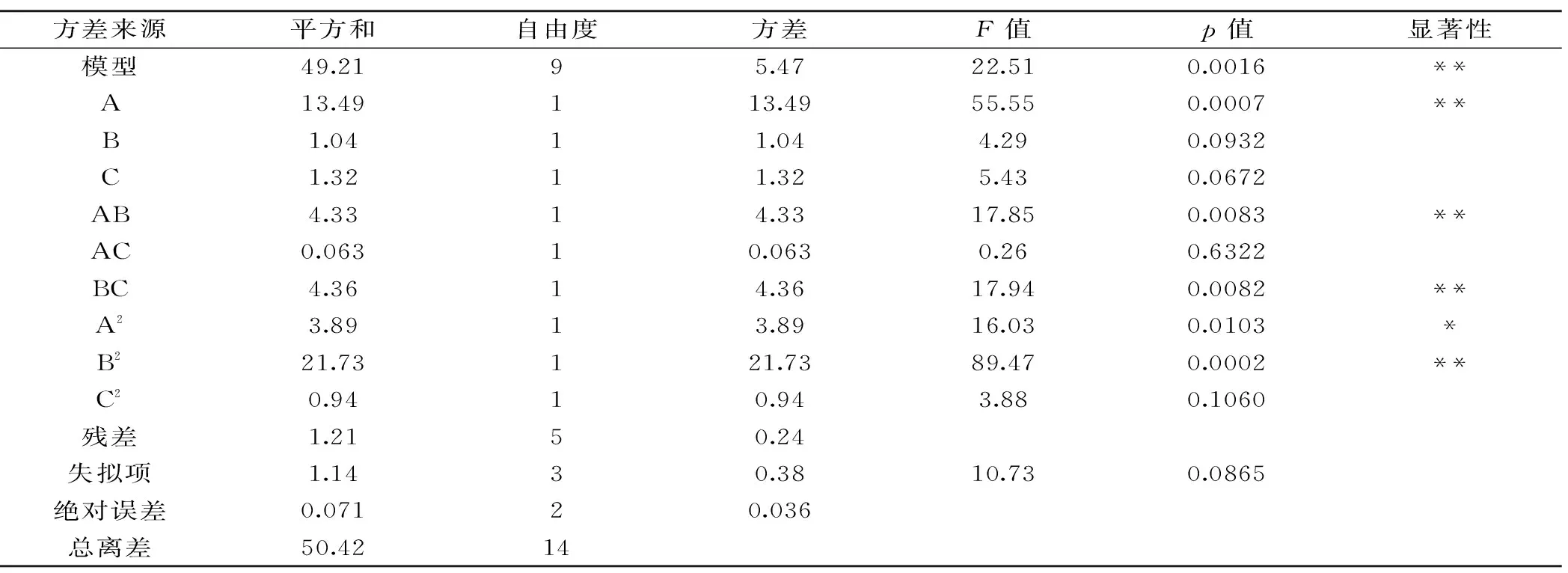
表4 糖胺聚糖提取参数ANOVA 分析结果Table 4 ANOVA of the constructed regression model of glycosaminoglycan sample
注:**p<0.01为极显著;* p<0.05为差异显著。

表3 响应面实验分析方案及实验结果Table 3 Response surface design arrangement and experimental results
2.3.2 回归方程拟合及方差分析 由表4可知,整体模型的p值小于0.01,表明该模拟二次方程极显著,失拟项p值不显著,说明该实验方法是可行的。回归方程的拟合度可通过复相关系数R2和校正决定系数来验证,本次实验校正决定系数为0.9326,表明鱼鳔糖胺聚糖提取工艺中约有93%的变异分布在这3个单因素中;复相关系数R2是0.9759,则表明鱼鳔糖胺聚糖提取工艺的实际值和预测值有较好的拟合相关性。因此,可以利用该回归方程来分析和预测鱼鳔糖胺聚糖的最佳提取工艺。方程一次项中A为极显著因素,B、C为不显著因素,同时根据F值也可以判断出这三个因素对鱼鳔糖胺聚糖提取效果的影响为A>C>B;AB、BC 交互作用极显著,AC交互作用不显著;方程二次项中B2极显著,A2显著,C2不显著,表明这3个单因素对响应值的影响不是简单的线性关系,二次项和交互作用均对响应值有较大影响。
2.3.3 响应面图分析 利用 Design-Expert 8.05 软件得到的响应面图可以用来研究各个自变量的交互作用并确定各个自变量对于最大响应值的最优水平。由响应面回归分析和回归方程拟合绘制出的响应面分析图见图6。

图6 交互作用对于鱼鳔糖胺聚糖提取影响的响应面图Fig.6 Response surface plots for the interaction effects on the extraction yeild of glycosaminoglycan from swim bladder
图6(a)可以看出,酶用量和酶解pH这二个因素的交互作用极显著。随着酶用量和酶解pH的变化,Y值也随之变化,且当酶用量和酶解pH达到一定值时,Y值达到最大值。图6(b)可以看出,酶解温度和酶用量的交互作用不显著。图6(c)可以看出,酶解温度和酶解pH的交互作用极显著。当酶解温度趋于50 ℃、酶解pH趋于8时,Y值达到最大值。
2.4验证实验
综上分析可以得知回归方程存在极大值点,即理论最优提取条件为酶用量7%,酶解pH7.85,酶解温度50.12 ℃;在此条件下,Y值为23.14(×10-4)。为了验证本实验响应面法的可行性,将实际操作修正为酶解温度50 ℃、酶用量7%、酶解pH8,重复三次平行实验,得到糖胺聚糖粗品的得率平均值为1.19%,糖胺聚糖平均含量为19.09%,因此三次平行实验得到的平均Y值为22.72×10-4;与其它文献报道的数据相比,周小双[14]从合浦珠母贝中提取糖胺聚糖的粗品得率为0.518%,糖胺聚糖含量为10.9%,Y值为5.23×10-4;董晓静[15]从波纹巴菲蛤中提取糖胺聚糖的Y值为41.3×10-4;孙晓鹏[16]从四角蛤蜊中提取的糖胺聚糖Y值为4.49×10-4;李瑞[17]从翡翠贻贝中提取糖胺聚糖的Y值为25.5×10-4;许江鹭[18]从泥螺中提取糖胺聚糖的Y值为26.5×10-4,这说明从鱼鳔中提取糖胺聚糖的方法还是可行的;同时,经过响应面回归方程的拟合出的理论值和实际值相吻合,证明响应面法可以有效的优化鱼鳔糖胺聚糖的提取工艺。
2.5鱼鳔糖胺聚糖的理化性质及结构分析
2.5.1 鱼鳔糖胺聚糖的理化性质分析 由表5可知,鱼鳔糖胺聚糖的粗品经过Sevag法脱蛋白后,糖胺聚糖含量和多糖含量分别增加48.6%、28.3%,蛋白质含量降低64.9%,说明Sevag法具有较好的脱蛋白效果。

表5 各组分的成分分析(%)Table 5 The chemical composition of different types of polysaccharides(%)
2.5.2 紫外-可见光光谱 鱼鳔糖胺聚糖F0和F1的紫外扫描图谱如图7所示。从图7中可以看出,鱼鳔糖胺聚糖粗品F0在260~280 nm范围内有明显的吸收峰,说明粗品中蛋白质含量较多;经过初步纯化后,鱼鳔糖胺聚糖精制品F1在260~280 nm范围内的吸收明显减弱,未除尽的蛋白质可能和糖胺聚糖结合,以蛋白聚糖的形式存在;对比鱼鳔糖胺聚糖脱蛋白前后的紫外扫描图可以发现精制品中的蛋白质含量较低,这与多糖基本组分测定时粗品中蛋白质含量明显高于精制品的结果一致,说明Sevag法可以很好地脱除鱼鳔糖胺聚糖中的蛋白质。

图7 鱼鳔糖胺聚糖组分的紫外吸收光谱图Fig.7 UV spectra of glycosaminoglycan from swim bladder
2.5.3 红外光谱分析糖胺聚糖的结构 鱼鳔糖胺聚糖粗品和精制品的红外扫描光谱见图8,二条红外光谱的峰型基本相同,说明Sevag法脱蛋白没有破坏糖胺聚糖的结构。鱼鳔糖胺聚糖粗品及精制品在3315.571 cm-1和3406.223 cm-1处都出现较宽的峰,说明存在糖类的-OH;在2920.171 cm-1处出现中等强度吸收峰是由-CH3的C-H对称伸缩振动产生的;在2850 cm-1处出现弱的吸收峰是由-CH3的C-H反对称伸缩振动产生的;1654.892 cm-1和1652.963 cm-1处有吸收,说明存在酰胺基的C=O伸缩振动;在1415.724 cm-1和1413.795 cm-1处的小峰是由糖类的C-H变角振动产生的;在1230.561 cm-1和1226.703 cm-1处出现的弱吸收峰是由磺酰基的S=O伸缩振动引起的,以上符合糖胺聚糖的特征。另外,1051.184 cm-1和1045.298 cm-1处出现强的吸收峰是吡喃糖环中醚键的伸缩振动和O-H键的变角弯曲引起的;840.948 cm-1处出现吸收峰,890~900 cm-1区段无明显吸收,表明鱼鳔糖胺聚糖以α型吡喃糖苷为主[19-20]。
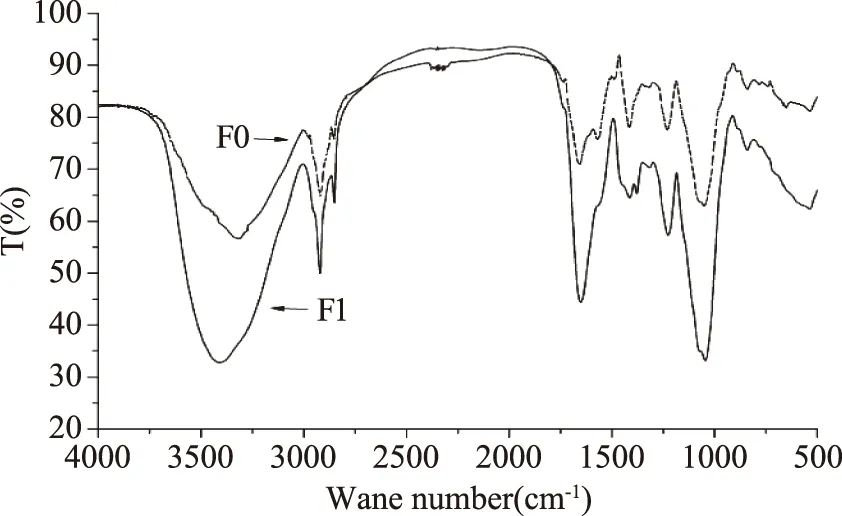
图8 鱼鳔糖胺聚糖组分的傅里叶红外吸收光谱图Fig.8 FT-IR spectra of glycosaminoglycan from swim bladder
将鱼鳔糖胺聚糖和鱼皮硫酸皮肤素[21]的红外光谱图对比,发现二者的红外吸收波段基本相同,且峰的强弱也十分相似,故可以判定鱼鳔中含有硫酸皮肤素;肝素红外吸收特征峰的波段是860 cm-1和940 cm-1[22],鱼鳔糖胺聚糖在840.948 cm-1处出现吸收峰,890~900 cm-1区段无明显吸收,说明鱼鳔糖胺聚糖可能含有肝素;硫酸软骨素的红外吸收特征峰[23]的波段是725、852、930 cm-1,鱼鳔糖胺聚糖仅在840.948 cm-1处出现吸收峰,说明鱼鳔糖胺聚糖可能含有硫酸软骨素;透明质酸标准品[24]则分别在3410、1615、1050、1565、1410、1315、1380 cm-1出现红外吸收峰,与鱼鳔糖胺聚糖的红外吸收光谱图对比,发现鱼鳔糖胺聚糖可能含有透明质酸;对比鱼鳔糖胺聚糖和从牦牛肺中提取的硫酸乙酰肝素[25]的红外光谱图发现,鱼鳔糖胺聚糖也可能含有硫酸乙酰肝素。
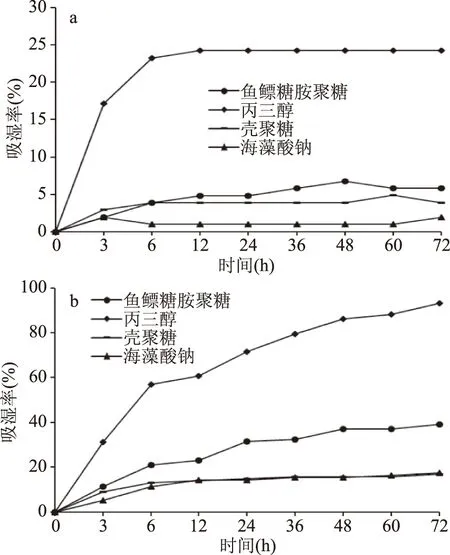
图9 相对湿度43%(a)和81%(b)条件下糖胺聚糖和常规保湿剂的吸湿率对比Fig.9 Hygroscopicity of glycosaminoglycan compared with traditional humectant at RHs=43%(a)and 81%(b)
2.6鱼鳔糖胺聚糖的吸湿性和保湿性测定
2.6.1 吸湿性测定 如图9a所示,在低湿度(43%)条件下,鱼鳔糖胺聚糖的吸湿率高于壳聚糖和海藻酸钠,低于丙三醇。6 h前,鱼鳔糖胺聚糖、壳聚糖、海藻酸钠的吸湿率随着吸湿时间的延长而逐渐增长,6 h后,鱼鳔糖胺聚糖、壳聚糖、海藻酸钠的吸湿基本饱和,此时,鱼鳔糖胺聚糖的吸湿率为5.8%,壳聚糖和海藻酸钠的吸湿率分别为3.9%和1.9%;丙三醇在12 h后达到最大吸湿率24.2%,并持续保持该吸湿能力。在高湿度(81%)条件下,鱼鳔糖胺聚糖、壳聚糖、海藻酸钠的吸湿率在0~6 h内增加较快,其中鱼鳔糖胺聚糖的吸湿率高于壳聚糖和海藻酸钠;6 h后,壳聚糖、海藻酸钠的吸湿率略微增加并达到最大值,分别为16.8%和17.3%;鱼鳔糖胺聚糖和丙三醇的吸湿率继续保持增长趋势,48 h后,鱼鳔糖胺聚糖和丙三醇的吸湿率基本饱和,吸湿率分别为39.1%和93.1%。戴宏杰等对拟目乌贼生殖腺碱提多糖的吸湿性进行研究,在RH=81%条件下吸湿32 h后达到最大吸湿率16.3%,低于鱼鳔糖胺聚糖的最大吸湿率39.1%。同时,根据文献报道[26],透明质酸、鲨鱼软骨素这2种化妆品常用生物多糖的在同等条件下的吸湿性也低于本研究所得到的鱼鳔糖胺聚糖,表明鱼鳔糖胺聚糖具有较强的吸湿性,具有开发为保湿剂的潜力。
2.6.2 保湿性测定 鱼鳔糖胺聚糖、常规保湿剂(丙三醇、壳聚糖、海藻酸钠)在硅胶干燥环境中的保湿性见图10。由图10可知,随着保湿时间的延长,鱼鳔糖胺聚糖和常规保湿剂(丙三醇、壳聚糖、海藻酸钠)的保湿率均表现出逐渐下降的趋势。在96 h时鱼鳔糖胺聚糖的保湿率为82%,和丙三醇、壳聚糖、海藻酸钠的保湿率相当,且在整个保湿过程中,鱼鳔糖胺聚糖和丙三醇、壳聚糖、海藻酸钠的变化曲线十分相似,保湿率也较为接近,说明鱼鳔糖胺聚糖作为天然提取物,保湿性能良好,应用前景十分可观。
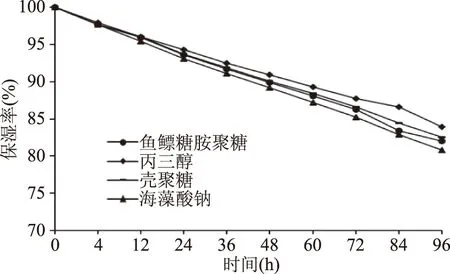
图10 糖胺聚糖和常规保湿剂的保湿率对比Fig.10 Moisture retention ability of glycosaminoglycan from swim bladder compared with traditional humectants
3 结论
利用响应面法优化鱼鳔糖胺聚糖提取工艺,最佳工艺条件为料液比1∶20、酶解时间4 h,酶解温度50 ℃,酶用量7%,酶解pH8,在此条件下糖胺聚糖粗品得率为1.19%,糖胺聚糖含量为19.09%,Y值为22.72×10-4。通过对鱼鳔糖胺聚糖的基本结构测定可知:Sevag法可以在不损坏糖胺聚糖结构的基础上,达到良好的除蛋白效果;鱼鳔糖胺聚糖主要是硫酸皮肤素组成。鱼鳔糖胺聚糖在保湿吸湿实验中表现出良好的效果,能够在减缓水分散失速率的同时,也具有良好的吸湿能力,其总体吸湿保湿性优于壳聚糖、海藻酸钠等常规保湿剂,可进一步开发为天然保湿因子或功能性添加剂应用于功能食品和化妆品等领域。
[1]邬冠鹏. 鱼鳔肽的开发与利用[C]. 亚太多肽学会多肽抗肿瘤国际论坛论文集,2004:4.
[2]段振华,汪菊兰,殷安齐,等. 几种鱼鳔的营养成分分析与评价[J]. 食品研究与开发,2007,28(10):62-65.
[3]Zhao X,Qing Y,LI G J,et al. Preventive effects of the polysaccharide of Larimichthys crocea swim bladder on carbon tetrachloride(CCl4)-induced hepatic damage[J]. Science Direct,2015,13(7):521-528.
[4]Suo H Y,Song j l,Zhou Y L,et al. Induction of apoptosis in HCT-116 colon cancer cells by polysaccharide of Larimichthys crocea swim bladder[J]. Oncology Letters,2014,12(2):972-978.
[5]孙晓朋. 四角蛤蜊糖胺聚糖的提取、纯化及生理活性研究[D]. 天津:天津科技大学,2011.
[6]张水华. 食品分析[M]. 北京:中国轻工业出版社,2007:48-170.
[7]戴宏杰,孙玉林,杨梅语,等. 拟目乌贼生殖腺碱提多糖的抗氧化及吸湿保湿特性[J]. 食品科学,2016,37(2):31-38.
[8]张惟杰. 糖复合物生化研究技术[M].(第二版). 杭州:浙江大学出版社,1999:413-414.
[9]李知敏,王伯初,周菁,等. 植物多糖提取液的几种脱蛋白方法的比较分析[J]. 重庆大学学报:自然科学版,2004,27(8):57-59.
[10]宿玮,常耀光,薛长湖,等. 海地瓜多糖中蛋白含量测定方法比较[J]. 食品科学,2011,32(2):201-204.
[11]Dodgson K S,Price R G. A note on the determination of the ester sulphate content of sulphated polysaccharides[J]. Biochemical Journal,1962,84(1):106-110.
[12]高瑞英,张秀宇,慕丹,等. 透明质酸等化妆品用生物活性多糖吸湿保湿性能测定[J]. 广东化工,2009,36(10):230-232.
[13]郑磊. 鹿茸糖胺聚糖的提取、分离纯化及结构分析[D]. 哈尔滨:东北林业大学,2010.
[14]周小双,王锦旭,杨贤庆,等. 响应面法优化合浦珠母贝糖胺聚糖提取工艺[J]. 食品与发酵工业,2016,42(1):238-243.
[15]董晓静. 波纹巴非蛤糖胺聚糖抗氧化与降血脂活性研究[D]. 湛江:广东海洋大学,2010.
[16]袁春营,崔青曼,孙晓朋,等. 响应面法优化四角蛤蜊糖胺聚糖提取工艺研究[J]. 食品工业,2011(11):18-21.
[17]李瑞,吴红棉,范秀萍,等. 响应面法优化翡翠贻贝糖胺聚糖提取工艺的研究[J]. 现代食品科技,2010,26(2):175-179,202.
[18]许江鹭,崔青曼,袁春营,等. 响应面法优化泥螺糖胺聚糖提取工艺研究[J]. 安徽农业科学,2012(6):3559-3561.
[19]Yong Pan,Shiwu Dong,Yong Hao,et al. Ultrasonic-assisted extraction process of crude polysaccharides from Yunzhi mushroom and its effect on hydroxyproline and glycosaminoglycan levels[J]. Carbohydrate Polymers,2010(81):93-96.
[20]Li G Y,Chen S G,Wang Y M,et al. A novel glycosaminoglycan-like polysaccharide from abalone Haliotis discus hannai Ino:Purification,structure identification and anticoagulant activity[J]. International Journal of Biological Macromolecules,2011(49):1160-1166.
[21]廖文娟.鮟鱇鱼皮硫酸皮肤素的提取、纯化、结构和活性研究[D]. 浙江:浙江工商大学,2008.
[22]张万忠,胡晓东,刘宁,等. 低分子肝素的制备与纯化[J]. 沈阳化工学院学报:自然科学版,2003,17(2):114-117.
[23]郑江,关瑞章,黄世玉. 鲟鱼和鲨鱼硫酸软骨素红外光谱特性的比较研究[J]. 光谱学与光谱分析,2008,28(1):106-109.
[24]张效良,刘隆跃,吴功柱,人脐带透明质酸制备及理化性质分析[J]. 中国药房,1999,10(1):10-11.
[25]姬胜利,张琳,迟延青,等. 不同来源的硫酸乙酰肝素的制备及理化性质研究[J]. 中国生化药物杂志,2004,25(1):13-15.
[26]高瑞英,张秀宇,慕丹,等. 透明质酸等化妆品用生物活性多糖吸湿保湿性能测定[J]. 广东化工,2009,36(10):230-232.
Extractionofglycosaminoglycansfromswimbladderandevaluationofthecapacitiesofitshygroscopicityandmoistureretention
QUYi1,ZHOUSi-yi1,FENGTao1,ZHONGSai-yi1,2,*,CHENSu-hua1,SUWei-ming1,WUXiao-he2,3
(1.College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Guangdong Provincial Engineering Technology Research Center of Marine Food,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China; 2.Zhongshan Collaborative Innovation Center of Technical Services for Industry of Freshwater Products,Zhongshan 528436,China; 3.Zhongshan Torch Polytechnic,Zhongshan 528436,China)
The extraction process of glycosaminoglycan from swim bladder via enzymatic hydrolysis by pancreatin and neutral protease ofBacillussubtiliswere optimized by response surface methodology based on single factor experiments,the physic-chemical characters and structure properties were analyzed by UV and IR spectroscopy,and the evaluation of the capacities of hygroscopicity and moisture retention were conducted in this investigation. The results showed that the optimum processing conditions of enzyme hydrolysis was solid-liquid ration of 1∶20 g∶mL,enzymolysis time of 4 h,enzymolysis temperature of 50 ℃,enzyme dosage of 7%,and the enzmolysis pH of 8.0. Under these optimum conditions,the yield and content of glycosaminoglycan were of 1.19%,19.09%. Moreover,the IR spectrum showed that the extracted glycosaminoglycan had typical characteristic absroption peaks of polysaccride,and comprised a pyranose ring structure having anαglycosidic bond. Finally,the extracted glycosaminoglycan had excellent capacities of hygroscopicity and moisture retention,which were superior to those of the conventional humectants,such as chitosan and sodium alginate. These results clearly established the possibility that swim bladder glycosaminoglycan could be effectively employed as a moisturizer.
swim bladder;glycosaminoglycan;extraction process;physic-chemical characters and structure properties;hygroscopicity;moisture retention
2017-02-13
屈义(1992-),女,硕士研究生,研究方向:海洋多糖的研究与开发,E-mail:qy7626@126.com。
*通讯作者:钟赛意(1979-),男,博士,副教授,研究方向:食品功能因子开发及功效评价,E-mail:zsylxc@126.com。
广东省高等教育“创新强校工程”专项资金(GDOU2016050203);2017年广东省海洋和渔业发展专项资金生物医药与功能性制品研发2;中山市淡水产品技术服务协同创新中心项目(2016C1007)。
TS201.1
:A
:1002-0306(2017)16-0118-08
10.13386/j.issn1002-0306.2017.16.023
