外源NO对伽师瓜AOX基因克隆表达及抗氰呼吸的影响
2017-09-18,·,,,,,*
,·,, , , ,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091)
外源NO对伽师瓜AOX基因克隆表达及抗氰呼吸的影响
敬媛媛1,阿塔吾拉·铁木尔2,+,胡江伟2,魏佳2,张平2,吴斌2,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091)
为了探究外源一氧化氮(nitric oxide,NO)熏蒸处理对伽师瓜(CucumismeloL.)采后贮藏过程中AOX基因表达及抗氰呼吸途径的影响,以伽师瓜为试材,采用外源60 μL/L NO熏蒸3 h,以不充入NO气体作为对照,在(5±0.5) ℃条件下贮藏49 d。根据甜瓜基因组数据库,通过EST设计引物,克隆获得伽师瓜AOX基因全长序列。得到的基因片段同其他物种的AOX基因具有高度的同源性,命名为CmAOX。通过拼接获得AOX基因的cDNA全长序列,基因cDNA全长为1300 bp,开放阅读框架为1042 bp,拟编码346个氨基酸,预测分子量为39606.6 Da,等电点为9.00。该基因已在GeneBank登录,登录号为:KM273124。通过荧光定量分析及抗氰呼吸速率的测定表明,经60 μL/L NO处理果实的CmAOX的表达量和抗氰呼吸速率明显高于对照果实。说明NO处理对伽师瓜采后贮藏过程中抗氰呼吸途径的影响可能与其调控AOX基因的表达密切相关。
伽师瓜,一氧化氮,抗氰呼吸,克隆,基因表达
高等植物线粒体电子传递链[1]主要有两条途径,一条是对氰化物敏感的细胞色素途径,另一条是抗氰呼吸途径(或称交替途径),对氰化物不敏感,是由线粒体内膜上的末端氧化酶AOX(交替氧化酶)所催化的。细胞色素呼吸途径产生的能量同ATP的合成偶联,而抗氰呼吸途径中电子由泛醌分支处直接传递给AOX,氧化生成水,不生成ATP,能量以热的形式释放[2]。在正常情况下植物以细胞色素呼吸途径为主,在植物受到多种化学因子、低温胁迫、伤诱导、病原体侵染和缺磷等环境或生理条件影响时,会诱导抗氰呼吸作用的增强[3]。抗氰呼吸途径末端的交替氧化酶(AOX)在植物生长发育的各个生理过程及植物对环境的适应过程中起到重要作用。AOX在果蔬中是由核基因编码的双核铁羧基蛋白质多基因家族,分为两个亚家族,AOX1和AOX2,编码蛋白分子质量在32~39 kDa之间,一般都具有4个外显子和3个内含子,单子叶和双子叶植物中都有AOX1家族,但AOX2家族仅存在于双子叶植物[4]。AOX的表达受到多种生物和非生物胁迫所诱导,关于AOX的生物学功能和抗氰呼吸途径的关系一直是植物生理学领域中研究的热门课题。
一氧化氮(nitric oxide,NO)是一种普遍存在于动植物体内的信号分子,参与调控植物的生长发育、光合作用、呼吸作用等过程[5]。Zottini等[6]利用硝普钠(SNP)作为NO供体处理胡萝卜悬浮细胞的研究表明,SNP处理会引起细胞总呼吸速率的下降,这主要源于其对细胞色素呼吸途径的抑制,而抗氰呼吸途径不仅没有下降,反而升高,并且AOX表达加强。汤红官等[7]在NO对玉米幼苗根系呼吸作用的影响的研究中也发现,NO能够有效促进玉米幼苗根系抗氰呼吸容量。目前,关于NO处理对伽师瓜采后AOX基因表达的影响与抗氰呼吸关系的研究未见报道。本研究以伽师瓜为试材,提取果肉总RNA,采用RT-PCR结合RACE技术扩增AOX基因全长序列,进一步探究NO处理对伽师瓜采后AOX基因表达和抗氰呼吸途径的影响,从分子水平揭示以AOX为中心的抗氰呼吸调控网络对于果实采后贮藏保鲜的研究具有十分重要的意义。
1 材料与方法
1.1材料与仪器
伽师瓜 采自库车县商品瓜基地,选择个体一致,带T型蔓的果柄、无机械损伤、无病虫害的果实,外套发泡网装箱,防止运输过程中碰撞损伤,采后立即运回新疆农业科学院农产品贮藏与加工研究所;大肠杆菌 DH5α、克隆载体pMD18-T easy TakaRa公司;M-MLV反转录酶、dNTPs、Taq酶、Olig(dT)18、DL2000 DNA Marker、质粒提取试剂盒、胶回收试剂盒 TianGen公司;氯化钠、乙二胺四乙酸、Tris、十二烷基硫酸钠、焦碳酸二乙酯、琼脂糖、酵母粉、胰蛋白胨、琼脂粉 Sigma公司。
5417R型台式低温高速离心机、5331型PCR仪 德国Eppendorf公司;ES-315立式全自动高压灭菌锅 日本TOMY公司;DYY-11、DYY-2D电泳仪 北京六一仪器厂;FireReader系列紫外透射/凝胶成像系统 英国UVI 公司;IM-F124制冰机 日本SANYO公司。
1.2实验方法
1.2.1 伽师瓜的处理方法 采用60 μL/L NO密封熏蒸伽师瓜3 h,以密封不充入NO气体为对照,置于(5±0.5) ℃贮藏49 d。将果实直径最大部位的果肉切成大小均匀的小块,用液氮进行速冻,置于超低温冰箱中备用。
1.2.2 伽师瓜果实总RNA的提取 采用酚氯仿法[8]提取果实RNA。取1.5 g左右的样品,在研钵中加液氮,快速研磨,置于2 mL 无RNA酶的离心管中,加入650 μL酚氯仿和650 μL RNA提取液,再加入200 μL预冷处理的无水乙醇,进行旋涡振荡10 s,4 ℃离心(12000 r/min,10 min),取上清液650 μL,加入650 μL 4 mol/L LiCl(4 ℃),放置于1.5 mL无RNA酶的尖头离心管中,静置于-80 ℃超低温冰箱中沉淀3 h,4 ℃离心(12000 r/min,10 min),倒上清液,沉淀用70%乙醇清洗1~2次,置于-20 ℃冰箱中静置,4 ℃离心(12000 r/min,10 min),倒上清液,沉淀用无水乙醇清洗,自然干燥后,加30 μL ddH2O,置于-80 ℃保存。用Eppendorf Biophotometer紫外分光光度计和1%琼脂糖凝胶电泳检测所提取RNA的纯度和完整性。
1.2.3AOX基因片段的克隆 以总RNA为模板,采用一步法按照M-MLV反转录酶标准体系合成cDNA第一链作为PCR模板,通过GenBank查找已登录的植物AOX的氨基酸序列,用DNAstar软件比对分析,根据相近种属的保守区域设计简并引物:AOX-F:5′-CACCTTAATGTGCGAGTC-3′;AOX-R:5′-CACCTTAATGTGCGAGTC-3′。PCR反应程序为:94 ℃预变性3 min,1个循环;94 ℃变性1 min、52 ℃退火45 s、72 ℃延伸60 s,32个循环;72 ℃延伸10 min,1个循环。PCR产物用1.2%琼脂糖凝胶电泳进行检测,并参照Tiangen DNA回收试剂盒说明书进行回收纯化送往上海生工生物技术有限公司测序。
1.2.4 伽师瓜果实AOXcDNA全长序列的克隆与分析 按照1.2.3片段测序结果设计目的基因的RACE特异性引物:GSP1:GATCACAGTGCAGGGAGTCTTT,GSP2:CATGACCATGATTGAGCTTGTG。按照TAKARA公司的RACE试剂盒进行巢式PCR扩增3′末端和5′末端,扩增体系及扩增条件均按照说明书进行操作。巢式PCR产物经检测、纯化回收后连接到pMD18-T载体,转化到大肠杆菌DH5α感受态细胞中,在涂有IPTG/X-gal的含AMP的LB平板上、37 ℃倒置培养过夜,随机挑取白色阳性克隆通过1.0%琼脂糖电泳观察鉴定菌落PCR结果,由上海生工生物技术有限公司测序。
利用DNAstar软件对测序得到的AOX基因中间片段和3′末端、5′末端进行拼接,然后提交 NCBI(http://www.ncbi.nlm.nih.gov)进行Blast X及Blast N分析。根据甜瓜基因组(https://melonomics.net)中筛选出AOX基因,利用Primer Premier 5.0软件在读码框两侧设计引物,分别为:UP-P:TGGACAAT CCGAGAGTAAT;DN-P:TGCTAGTAAACTTATG AGGC。PCR扩增,反应体系同片段的扩增,克隆得到包含完整ORF的全长序列;与PMD18-T 载体连接,转化大肠杆菌DH5(,筛选阳性克隆保存菌液并送样测序。利用DNAstar软件ORF分析;BLAST(http://www.ncbi.nlm.nih.gov/BLAST)进行序列相似性分析;利用ClustalW(http://www.ebi.ac.uk/clustalw/index.html)、MEGA和DNAstar软件进行序列比对和进化树构建。
1.2.5 实时荧光定量PCR分析 使用罗氏LightCycler® 96 SW 1.1进行qRT-PCR检测,反应体系(25.0 μL)包括2.0 μL cDNA,9.5 μL dd H2O,上下游引物各0.5 μL(浓度为10 μmol·L-1)和12.5 μL Master(Roche)。qRT-PCR程序为:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 20 s,经40个循环。每个样品反复3次。以伽师瓜Actin基因(GenBank登录号:FJ763186.1)作为内参,设计内参引物:上游引物序列(Forward):5′-CTGGTGTGATGGTTGGAATGG-3′,下游引物序列(Reverse):5′-GGTTGAGTGG TGCTTCAGTAAG-3′。参照获得的AOX基因序列,按照qRT-PCR引物设计的原则设计特异性引物:AOX基因上游引物序列(Forward):5′-GCC TTCTTTGTGCTCTACTTGAT-3′,AOX基因下游引物序列(Reverse):3′-CCGAATGACTGTGATAACA TCCTT-5′。对上述特异性引物经RT-PCR反应,得到PCR产物,测序后与目的基因比对,确定为目的基因上的片段。利用2-ΔΔCT法计算AOX基因的相对表达量。以采收后未处理的样本为参照,将其AOX的表达量值转化成1,其他各时间点样品的基因表达量与其进行比较,即获得相对表达值。
1.2.6 伽师瓜果实抗氰呼吸速率的测定 参照徐飞[9]方法并稍作修改。取0.2 g 1 mm2的伽师瓜果肉小片,加入终浓度2 mL 1 mmol/L NaN3用OXYTHERM氧电极进行AP途径呼吸强度的测定。
2 结果与分析
2.1伽师瓜总RNA电泳图
从果肉组织中提取高质量RNA是进行基因表达水平分析的首要步骤,而RNA质量标准需从纯度和完整性两个方面判断。如图1所示,伽师瓜果实总RNA的条带清晰,28S条带的亮度是18S的两倍,无明显拖尾现象,表明RNA没有降解;经紫外分光光度计检测,A260/A280分别为1.92、1.87、1.89、1.97,说明RNA的质量和纯度符合反转录和PCR的要求。

图1 伽师瓜总RNA电泳图Fig.1 Total RNA electrophoregram of Jiashi muskmelon注:1,2:对照组;3,4:NO处理组。
2.2 RT-PCR扩增伽师瓜果实AOX基因片段
如图2所示,以对照组和60 μL/L NO处理组伽师瓜果实总RNA反转录产物为模版,用设计的特异性引物通过改变退火温度扩增中间片段,都扩增得到308 bp的片段。
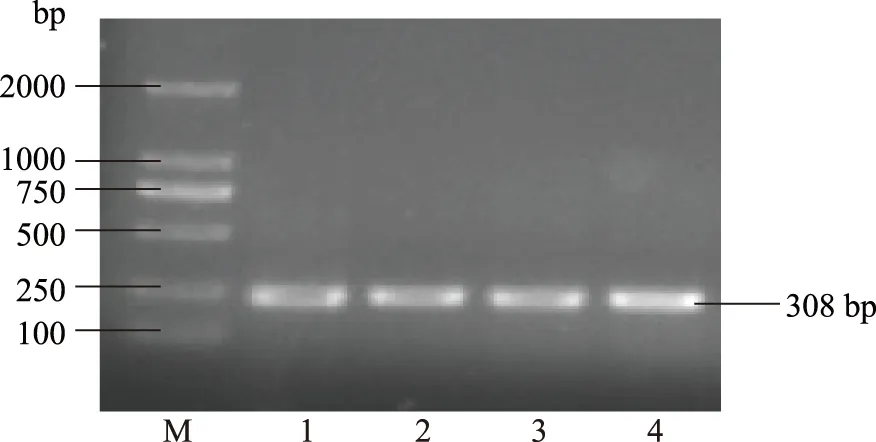
图2 伽师瓜果实AOX基因的中间片段电泳图Fig.2 Electrophoregram of AOX gene fragments of Jiashi muskmelon 注:M:Marker;1,2:对照组;3,4:NO处理组。
2.3伽师瓜果实AOX基因cDNA全长扩增
如图3所示,按照测序得到的伽师瓜果实AOX基因片段、3′末端、5′末端,最终获得1300 bp全长序列,命名为CmAOX。用引物UP-P和DN-P,以伽师瓜果实总RNA反转录产物为模版,扩增得到包括完整ORF的全长序列(1300 bp)。对开放式阅读框(ORF)进行预测,发现其编码一个1042 bp的完整开放阅读框。基因进行分析,拟编码346个氨基酸,预测分子量为39606.6 Da,等电点9.00。稳定参数为38.00,为稳定蛋白。CmAOX蛋白富含丙氨酸(8.1%)、精氨酸(7.5%)、谷氨酰胺(7.8%)、亮氨酸(8.7%)、缬氨酸(8.1%)等,这可能是所有AOX蛋白都具有的特征。目前该基因已在GeneBank登录,登录号为:KM273124。
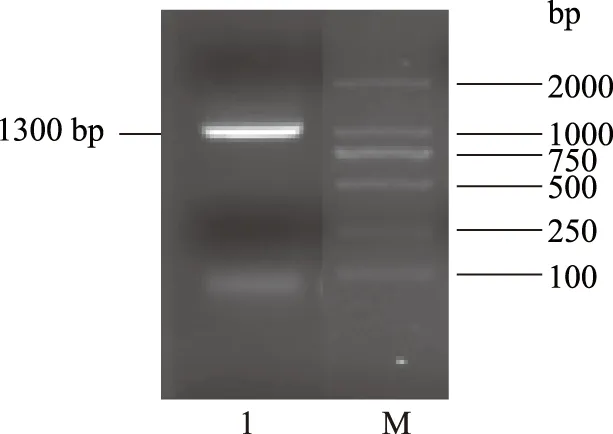
图3 伽师瓜果实AOX基因全长电泳图Fig.3 Electrophoregram of full-length AOX gene of Jiashi muskmelon注:M:Marker;1:NO处理组伽师瓜果实总RNA反转录产物。
2.4序列分析
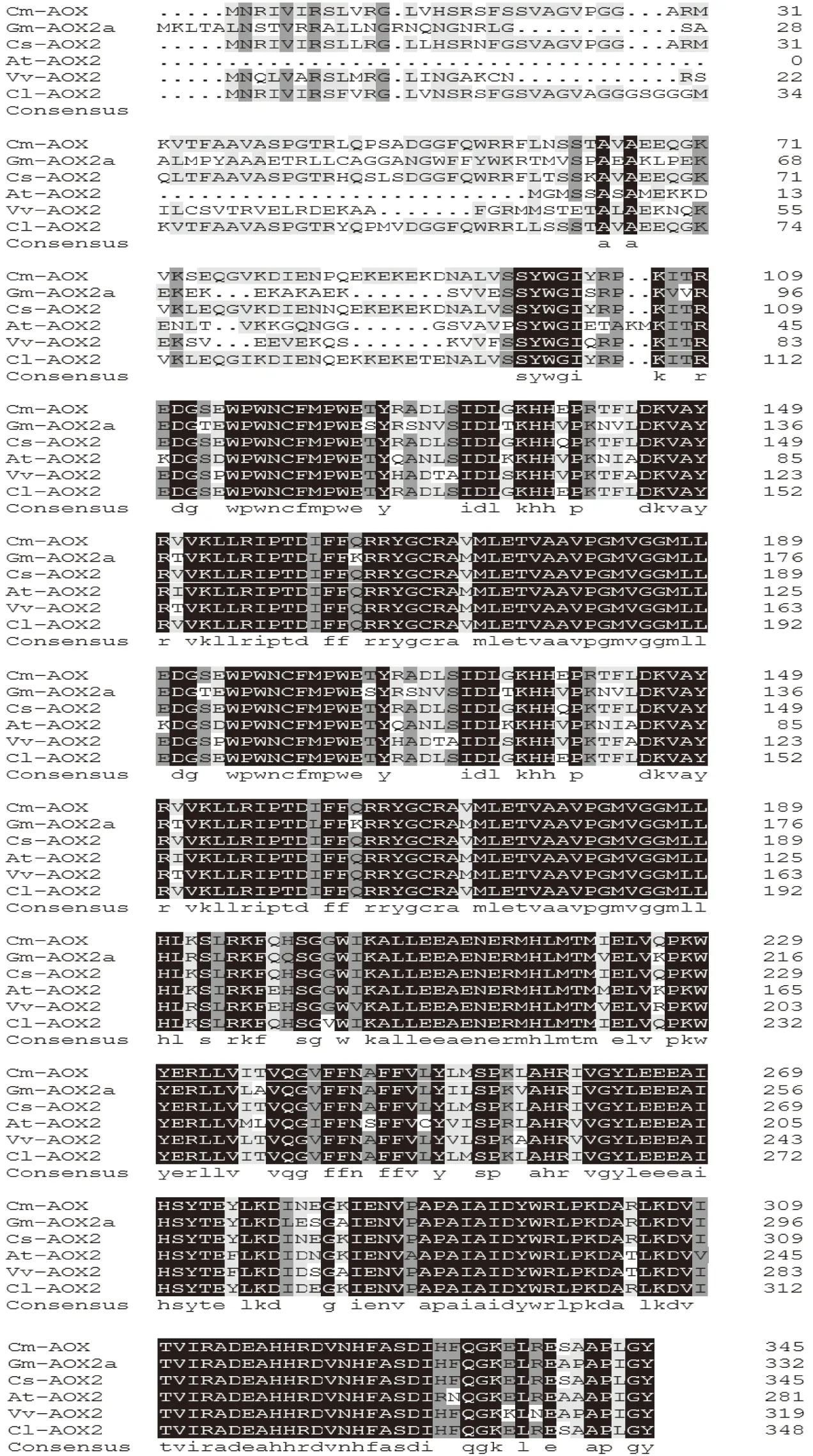
图4 伽师瓜果实AOX基因氨基酸序列比对Fig.4 Alignment of AOX gene amino acid sequence in Jiashi muskmelon注:阴影部分为相同碱基。
2.4.1CmAOX基因的氨基酸序列比对分析 如图4所示,用DNAMAN将伽师瓜交替氧化酶CmAOX基因编码的氨基酸序列与其他物种AOX2基因的氨基酸序列进行同源性比较。结果发现伽师瓜CmAOX基因所推导的氨基酸序列同黄瓜AOX2(Cucumis sativus,AAP33163.2),西瓜AOX2(Citrullus lanatus,AEN99850.1),大豆AOX2基因(Glycine max,AAP68984.1),拟南芥AOX2基因(Arabidopsis thaliana,BAB09852.1),葡萄AOX2基因(Vitis vinifera,NP_001268001.1)均达到70%以上的同源性。AOX编码的核苷酸序列与其他物种的核苷酸序列在GenBank中BLASTn同源比对发现,CmAOX和很多核糖核苷酸序列高度同源,如和西瓜AOX2(91%)、黄瓜AOX2(98%)、西葫芦AOX(89%)、烟草AOX2(79%)以及欧李(78%)等。尽管AOX蛋白序列的组成和大小各异,但是结果表明在氨基酸序列中存在高等植物AOX蛋白质的主要功能域,分别是:保守的铁离子结合区域(EXXH,FXHR 和 EEE-Y);可能同二硫键的聚合相关的丝氨酸残基(C126和C176);可能参与金属离子结合的组氨酸残基(H144,H197,H224,H265,H326和H331),这些结构特点可能与其功能特性有一定联系。这些结果表明CmAOX属于伽师瓜的AOX基因家族。

图5 伽师瓜果实AOX基因与其它果实氨基酸序列同源性进化分析Fig.5 Phylogenetic tree analysis of the deduced amino acid sequences homolog of Jiashi muskmelon AOX gene with related fruit species
2.4.2 伽师瓜交替氧化酶基因CmAOX的进化树分析 如图5所示,用MEGA软件将甜瓜CmAOX基因推导的氨基酸序列与西瓜、黄瓜、拟南芥等27个物种在GenBank数据库中登录的具有完整编码区的AOX氨基酸序列进行比对分析,构建系统进化树。研究发现本文的甜瓜交替氧化酶基因CDS区与同为葫芦科的黄瓜AOX2基因同源性高达99%。与西瓜AOX2基因同源性达85%,与小麦、水稻、胡萝卜等同源性都大于60%以上,由此可以推断出AOX基因在不同物种中有较强的保守性。通过进化树也可以看到AOX2基因与葫芦科的黄瓜聚为一类,由此推断已成功克隆出伽师瓜交替氧化酶基因家族中的AOX基因。
2.4.3 CmAOX蛋白的三维结构预测 用SWISS-MODEL能够预测CmAOX蛋白的3D结构。CmAOX的3D结构是基于动物源AOX2蛋白晶体结构对CmAOX蛋白的结构域的3D结构进行同源建模预测(图6A),同时也预测了拟南芥AOX2蛋白(AAY7882.1)的3D结构(图6B),CmAOX和AtAOX2的3D结构相似度为42.92%,显示了该蛋白与AtAOX2的结构不同但是含有相同的保守区域。
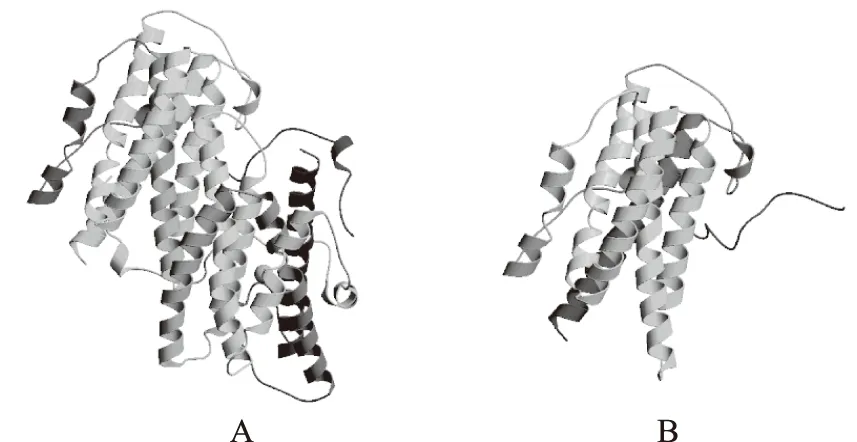
图6 CmAOX(A)和AtAOX2(B)蛋白的三维结构预测Fig.6 Three dimensional structure prediction of CmAOX protein(A)and AtAOX2 protein(B)
2.5 NO处理对伽师瓜果实AOX基因表达的影响
伽师瓜在5 ℃贮藏条件下CmAOX基因的表达如图7所示,对照果实和60 μL/L NO处理果实的CmAOX表现出先上升后下降的表达模式,60 μL/L NO处理可明显促进CmAOX的表达,并且NO处理果实的CmAOX表达量最大值比对照果实提前7 d出现。在贮藏第28 d,经60 μL/L NO处理果实的CmAOX表达量为对照果实的4.73倍(p<0.01)。说明NO处理能够诱导果实AOX基因的上调表达。
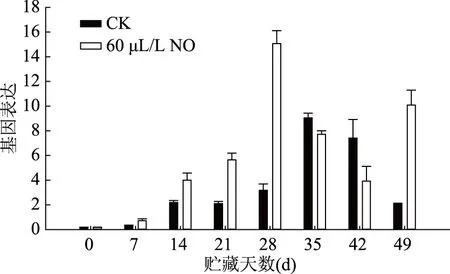
图7 NO处理对伽师瓜果实AOX基因表达的影响Fig.7 Effects of NO treatment on the expression of AOX gene in Jiashi muskmelon

图8 NO处理对伽师瓜果实抗氰呼吸速率的影响Fig.8 Effects of NO treatment on the cyanide resistant respiration rate in Jiashi muskmelon
2.6 NO处理对伽师瓜果实抗氰呼吸速率的影响
如图8所示,伽师瓜在5 ℃贮藏条件下抗氰呼吸速率呈先上升后下降的趋势,这与果实CmAOX的表达模式相同,在整个贮藏期间,60 μL/L NO处理果实的抗氰呼吸速率明显高于对照果实。在贮藏第14 d,伽师瓜果实的抗氰呼吸速率达到最大值,经60 μL/L NO处理果实的抗氰呼吸速率比对照果实高了36.4%(p<0.01)。说明NO处理能够诱导果实抗氰呼吸速率的增加。
3 讨论
核基因编码的AOX基因是存在于植物线粒体中交替氧化酶基因家族中的重要基因,关于AOX基因克隆表达的研究越来越多。目前,已成功地从拟南芥、水稻、烟草、番茄、大豆、红掌、西瓜、葡萄中分离得到交替氧化酶基因的cDNA[10]。本研究从伽师瓜中分离得到了伽师瓜交替氧化酶基因的cDNA全长序列,命名为CmAOX(GenBank登录号:KM273124),伽师瓜的交替氧化酶基因CDS区序列与同为葫芦科的黄瓜AOX2基因(黄瓜,AAP33163)表现出最高的同源性,可达99%。将CmAOX基因的氨基酸序列与其他物种进行同源性分析发现,不同物种的AOX2存在许多完全相同的功能位点,这些位点在AOX1中同样存在,且也是完全保守的。这表明AOX氨基酸序列主要差异是在N端的104个氨基酸序列,而在C端的氨基酸序列却很保守,不同物种AOX基因对底物的选择性和功能的不同有可能都是由N端非保守的氨基酸序列决定的[11]。将来自不同物种的交替氧化酶基因进行对比构建树状图,通过进化树分析发现AOX在不同物种中具有较强的保守性,这与李严曼等[12]在西瓜交替氧化酶AOX2基因的克隆与分析的研究结果一致。对CmAOX和AtAOX2蛋白的三维结构进行预测,发现CmAOX和AtAOX2蛋白有着相同的保守区域,说明不同物种AOX基因的保守区域可能相同。
众多研究发现,AOX基因能够响应许多环境胁迫和外源信号分子,在多种逆境和生长发育中AOX的mRNA、蛋白质都和抗氰呼吸的变化有着十分紧密的联系[13]。Li等[14]在关于水稻的研究中发现,过表达OsAOX1a基因可以提高水稻的耐冷性。Clifton[15]和Saisho等[16]研究了拟南芥中AOX的5个基因(AOX1a,AOX1b,AOX1c,AOX1d和AOX2),发现它在不同途径的诱导表达水平存在着差异,也具有组织特异性。冯汉青等[17]研究发现水稻叶片中编码交替氧化酶AOX基因在不同的坏境和化学试剂处理下有着不同的表达特性。王健[18]利用Northern杂交分析研究发现大豆AOX1a基因在防御反应中起一定的作用,可以被水杨酸、H2O2、柠檬酸盐强烈诱导表达,但被CoCl2抑制表达。Belozerova等[19]水杨酸对黄羽扇豆呼吸途径的影响的研究中,表明水杨酸能够诱导黄羽扇豆AOX基因的表达。本实验结果也表明,经NO处理的伽师瓜果实CmAOX基因的相对表达量和抗氰呼吸速率都明显高于对照果实,并且有着相同的变化趋势。前期研究也表明,60 μL/L NO处理能够提高果实的抗氧化能力,抑制果实的呼吸速率和乙烯释放量,抑制可溶性固形物、可滴定酸含量的下降,较好地保持果实的硬度[20]。因此推测NO可能作为信号分子是调控果实抗氰呼吸的关键因子,其具体的调控机制可能与AOX基因的表达有着紧密联系,并且可能通过调控果实的呼吸作用增强果实对逆境的抵抗能力,从而提高果实的贮藏品质。但关于NO诱导果实抗氰呼吸增强的具体作用元件及调控机制还有待于进一步研究。
4 结论
以伽师瓜果实总RNA反转录产物为模板,克隆得到1个AOX基因片段(1300 bp),命名为CmAOX(GenBank登录号:KM273124)。推导的氨基酸序列与黄瓜AOX2基因同源性高达99%,可将其归为交替氧化酶基因家族中的AOX2基因。同其他物种的比对分析发现,AOX2基因在不同的物种中具有较强的保守性。
经60 μL/L NO处理果实的CmAOX基因相对表达量和抗氰呼吸速率明显高于对照果实,说明NO处理能够诱导伽师瓜贮藏过程中抗氰呼吸速率的增加及AOX基因上调表达。这表明NO处理对伽师瓜采后贮藏过程中抗氰呼吸途径的影响可能与其调控AOX基因的表达密切相关。
[1]徐婷,李华,鲁姗姗,等. 线粒体电子传递呼吸链及其生物学意义的研究进展[J]. 复旦学报:医学版,2015,42(2):250-255.
[2]冯汉青,管东东,焦青松,等. 光照下菜豆叶片抗氰呼吸与光合作用关系的分析[J]. 植物生态学报,2015,39(1):104-109.
[3]Jian W,Zhang D W,Zhu F,et al. Nitrate reductase-dependent nitric oxide production is required for regulation alternative oxidase pathway involved in the resistance to Cucumber mosaic virus infection in Arabidopsis[J]. Plant Growth Regulation,2015,77(1):99-107.
[4]郭芹,李庆鹏,靳婧,等. 交替氧化酶在果蔬抗氰呼吸途径的调控机制[J]. 生物技术进展,2013(6):412-415.
[5]FORESI N,MAYTA M L,LODEYRO A F,et al. Expression of the tetrahydrofolate-dependent nitric oxide synthase from the green alga Ostreococcus tauri increases tolerance to abiotic stresses and influences stomatal development in Arabidopsis[J]. Plant Journal,2015,82(5):806-821.
[6]ZOTTINI M,FORMENTIN E,SCATTOLIN M,et al. Nitric oxide affects plant mitochondrial functionalityinvivo[J].FEBS Letters,2002,515:75-78.
[7]汤红官,张满效,何元庆. UV-B和NO对玉米幼苗根系呼吸作用的影响[J]. 兰州大学学报:自然科学版,2010,46(2):51-55,65.
[8]SAH S K,KAUR G,KAUR A. Rapid and reliable method of high-quality RNA extraction from diverse plants[J]. American Journal of Plant Sciences,2014,5(21):3129-3139.
[9]徐飞. 交替氧化酶在果实成熟、种子萌发和植物抗逆反应中的作用研究[D]. 成都:四川大学,2012.
[10]刘慧春,田丹青,刘建新,等. 红掌交替氧化酶基因克隆及其在低温胁迫下的表达分析[J]. 核农学报,2013,27(10):1464-1472.
[11]NOGALES A,NOCEDA C,RAGONEZI C,et al. Functional marker development from AOX genes requires deep phenotyping and individualized diagnosis[M]. Alternative respiratory pathways in higher plants,2015:273-280.
[12]李严曼,朱磊,杨景华,等. 西瓜交替氧化酶AOX2基因的克隆与分析[J]. 果树学报,2011(5):909-914.
[13]冯汉青,王婉,王玉佩,等. ZnCl2胁迫下抗氰呼吸对烟草细胞活力和过氧化氢水平的影响[J]. 陕西师范大学学报:自然科学版,2015,43(1):70-74.
[14]LI C R,LIANG D D,XU R F,et al. Overexpression of an alternative oxidase gene,OsAOX1a,improves cold tolerance inOryzasativaL.[J]. Genetics & Molecular Research,2013,12(4):5424-5432.
[15]CLIFTON R,LISTER R,PARKER K L,et al. Stress-induced co-expression of alternative respiratory chain components inArabidopsisthaliana[J]. Plant Molecular Biology,2006,58:193-212.
[16]SAISHO D,NAMBARA E,NAITO S,et al. Characterization of the gene family for alternative oxidase fromArabidopsisthaliana[J]. Plant Molecular Biology,1997,35:585-596.
[17]冯汉青,汤淑珍,李淮. 不同光强下交替氧化酶基因修饰的两种拟南芥叶片叶绿素荧光特性的变化[J]. 广西植物,2013,33(5):679-684.
[18]王健. 心叶烟交替氧化酶基因NgAOX1的分离及其表达特性分析[D]. 泰安:山东农业大学,2009.
[19]BELOZEROVA N S,BAIK A S,BUTSANETS P A,et al. Effect of salicylic acid on the alternative pathway of yellow lupine respiration[J]. Russian Journal of Plant Physiology,2014,1(61):38-46.
[20]胡江伟,周江,朱璇,等. 一氧化氮对新疆伽师瓜果实采后贮藏品质的影响[J]. 食品工业科技,2015,36(13):352-356.
EffectofexogenousnitricoxideoncloningandexpressionofAOXgeneandcyanideresistantrespirationinJiashimuskmelon
JINGYuan-yuan1,Atawulla·Tiemu2,+,HUJiang-wei2,WEIJia2,ZHANGPing2,WUBin2,*
(1.College of Food Science and Pharmaceutical Science,Xinjiang Agricultural University,Urumqi 830052,China; 2.Institute of Agro-products Storage and Processing,Xinjiang Academy of Agricultural Science,Urumqi 830091,China)
The effects of exogenous nitric oxide fumigation on the expression ofAOXgene and the cyanide resistant respiratory pathway in Jiashi muskmelon during the storage were investigated. Jiashi muskmelon(CucumismeloL.)as test materials were fumigated with 60 μL/L NO for 3 hours in sealed boxes,not filled with NO gas as control,and then stored at(5±0.5) ℃ for 49 days. According to the muskmelon genome database,primers were designed by EST,and the full length sequence of Jiashi muskmelonAOXgene was cloned. The cDNA fragment exhibited high homology to the alternative oxidase of other species and could be referred to asCmAOX. The full-length cDNA sequence ofAOXgene was obtained by splicing. The full length cDNA ofCmAOXwas 1300 bp in size with a 1042 bp open reading frame(ORF),and 346 amino acids was encoded. The predicted molecular weight ofCmAOXwas 39606.6 Da,and the isoelectric point was 9.00. The accession number ofCmAOXin GenBank database was KM273124. The cyanide resistant respiration rate of Jiashi muskmelon with the treatment of 60 μL/L NO was found to be significantly higher than that of the control. Real-time PCR showed that the expression ofCmAOXwith the NO treatment of Jiashi muskmelon was significantly higher than that of control muskmelons during the whole storage period. The NO treatment could induce the up regulation ofAOXgene in Jiashi muskmelon during the storage. It was suggested that the effect of NO treatment on the expression ofAOXgene of Jiashi muskmelon may be closely related to cyanide resistant respiration regulation during the storage.
Jiashi muskmelon;nitric oxide;cyanide resistant respiration;clone;expression
2017-01-10 +并列第一作者
敬媛媛(1992-),女,硕士,研究方向:果蔬贮藏保鲜,E-mail:785738415@qq.com。 阿塔吾拉·铁木尔(1988-),男,硕士,研究方向:农产品贮藏与加工,E-mail:1774721748@qq.com。
*通讯作者:吴斌(1973-),男,博士,研究员,研究方向:农产品贮藏与加工,E-mail:42042615@qq.com。
国家自然科学基金(31660478)。
TS255.3
:A
:1002-0306(2017)16-0296-07
10.13386/j.issn1002-0306.2017.16.056
