超高压对鳙鱼肌动球蛋白物化特性的影响
2017-09-18,,,*,,,
, ,,*,, ,
(1.华南农业大学食品学院,广东广州 510642;2.广东省天然活性物工程技术研究中心,广东广州 510642;3.宝健(中国)有限公司,北京 100176)
超高压对鳙鱼肌动球蛋白物化特性的影响
刘春花1,2,梁燕3,+,周爱梅1,2,*,肖苏尧1,2,刘欣1,2,曹庸1,2
(1.华南农业大学食品学院,广东广州 510642;2.广东省天然活性物工程技术研究中心,广东广州 510642;3.宝健(中国)有限公司,北京 100176)
研究不同超高压条件(100、300、500 MPa,保压15、30、45 min)下鳙鱼肌动球蛋白物化特性的改变。结果表明,随着压力和时间的增加,鳙鱼肌动球蛋白的溶解度降低,浊度基本呈上升的趋势,表明肌动球蛋白发生了聚集变性。SDS-PAGE显示超高压引起肌动球蛋白发生交联聚集形成了大分子物质。超高压处理后鳙鱼的Ca2+-ATP酶(Ca2+-ATPase)活性消失,表明肌动球蛋白发生了变性。随着压力的增加和加压时间的延长,肌动球蛋白的表面疏水性增加,表明超高压使蛋白氨基酸的疏水性基团暴露。随着压力的增大,肌动球蛋白的总巯基含量减少,二硫键含量升高,表明肌动球蛋白中的巯基发生氧化,形成了二硫键。鳙鱼肌动球蛋白上述物化特性的改变证明超高压诱导使其构象发生了改变。
超高压,鳙鱼,肌动球蛋白,物化特性
鳙鱼(Arstichthysnobilis)别名花鲢、胖头鱼、黑鲢,是我国淡水鱼养殖业中的“四大家鱼”之一,营养价值高,其产量位于淡水鱼产量的前列[1]。但由于鳙鱼生长在池塘或湖泊中,导致鱼肉本身带有很重的泥土味,口感差,如果仅鲜销会造成附加值低,而且一直以来,消费者有偏爱吃鳙鱼头的习惯,造成鱼身部分价格大跌[2]。因此,如何对鳙鱼进行深加工以提高其商品价值是鳙鱼加工产业链发展的关键问题,而开发鱼糜制品成为解决这一问题的重要途径[3]。但鳙鱼鱼糜形成凝胶的能力差且易凝胶裂化[4],所以研究鳙鱼鱼糜的凝胶特性对实现其综合利用有着重要意义。
高品质鱼糜制品应该具有良好的质构特性、色泽和风味,其中质构特性是最重要的[5]。鱼糜制品的质构特性主要受鱼肉蛋白质凝胶性能的影响,而蛋白质的凝胶性能又与其物化特性密切相关。鱼的肌肉蛋白中,肌原纤维蛋白,特别是肌动球蛋白是决定鱼糜凝胶形成的主要因素[6]。热处理是现在鱼糜凝胶化的主要方法,然而,热处理的凝胶特性却不理想[7]。超高压已被证实能够引起蛋白质分子中氢键、疏水相互作用、静电相互作用等非共价键和二硫键等共价键发生改变,从而引起蛋白质构象的改变,导致蛋白质变性、聚集或凝胶化,进而改变蛋白质的质构特性和功能特性,达到对蛋白质物理改性的作用[8]。很多研究表明,超高压诱导的蛋白凝胶比热诱导蛋白凝胶具有更好的透明度、平滑度、柔软度和质构特性[9]。此外,超高压诱导鱼糜形成凝胶所需时间比热诱导形成凝胶的时间短,同时可以减少热敏性成分的损失以及不良风味的产生[10]。关于超高压对肌肉中肌原纤维蛋白或者肌动球蛋白物化特性的影响,目前国内外已有对鸭肉[11]、猪肉[12]、鸡肉[13]以及水产品如罗非鱼[5]、六齿金线鱼[14]、草鱼[15]、梅鱼[3]、马鲛鱼[16]、三疣梭子蟹[17]、海鲈鱼[18]、秘鲁鱿鱼[19]、鲤鱼[20]、沙丁鱼和明太鱼[21]等很多报道,其中研究比较多的是罗非鱼,而超高压处理对鳙鱼鱼糜肌动球蛋白的物化特性产生怎样的影响,这些影响与蛋白质凝胶形成的关系如何,目前未见系统的报道。因此,本研究从鳙鱼鱼肉中提取肌动球蛋白,检测超高压(100~500 MPa处理15~45 min)诱导的肌动球蛋白物化特性的改变,从而探究肌动球蛋白物化特性的改变与蛋白质凝胶特性的关系,为阐明超高压的凝胶机理提供理论依据,同时为超高压在鱼糜生产中的实际应用提供基础数据。
1 材料与方法
1.1材料与仪器
新鲜鳙鱼 广州百佳连锁超市;三氯乙酸(TCA)、乙二胺四乙酸(EDTA) 上海凌峰化学试剂有限公司;十二烷基硫酸钠(SDS) 广州化学试剂厂;三羟基甲基氨基甲烷(Tris) 上海伯奥生物科技有限公司;考马斯亮兰R250 北京鼎国生物技术有限公司;马来酸 广州化学试剂厂;5′-三磷酸腺苷(ATP)、8-苯胺基-1-萘磺酸(ANS)、脲素、β-巯基乙醇、5,5-二硫代双(2-硝基苯甲酸,DTNB)、牛血清白蛋白(BSA) 均购自Sigma公司;其他试剂 均为分析纯。
FJ200-SH高速分散均质机 上海标本模型厂;Centrifuge 5810R高速台式冷冻离心机 德国Eppendorf;Nor 500磁力搅拌器 德国KIKAL labortechnik;UV-1800PC紫外分光光度计 上海美谱达仪器有限公司;FX-20DU超高压设备 温州贝诺机械有限公司;RF-5301PC荧光分光光度计 岛津制作所;HH-S8水浴锅 金坛市医疗仪器厂;PHS-25C精密pH计 上海康仪仪器有限公司。
1.2实验方法
1.2.1 鳙鱼肌动球蛋白的提取 参考Balange等[22]的方法并稍作改动提取肌动球蛋白。称取一定量鳙鱼肌肉,加入10倍体积冷却的0.6 mol/L、pH7.0的KCl溶液,均质4 min(均质时将样品放在含冰块的泡沫盒中,每均质20 s休息20 s,搅拌时间和间隔时间总共为4 min),然后在5000×g、4 ℃离心30 min,收集上清液并加入3倍的冷却蒸馏水沉淀肌动球蛋白,在5000×g、4 ℃离心20 min收集沉淀,然后加入约20 mL冷却的0.6 mol/L、pH7.0 KCl,并于4 ℃下磁力搅拌30 min以溶解肌动球蛋白,最后于5000×g、4 ℃离心30 min以除去未溶解的蛋白质,上清液即为肌动球蛋白溶液。
1.2.2 鳙鱼肌动球蛋白的超高压处理 将肌动球蛋白(4 mg/mL)灌入肠衣中,于100、300、500 MPa下分别保压15、30、45 min,取出后迅速置于冰水中冷却,获得超高压处理的样品,进行物化特性分析。
1.3测定方法
1.3.1 鳙鱼肌动球蛋白溶解度的测定 参考Riebroy等[23]的方法测定盐溶性蛋白的含量。取5 mL肌动球蛋白溶液在4 ℃下5000×g离心15 min,除去不溶物,用双缩脲法测定蛋白质浓度。超高压处理后的蛋白浓度与处理前的蛋白浓度的百分比为蛋白溶解度。
1.3.2 鳙鱼肌动球蛋白浊度的测定 肌动球蛋白溶液的浊度根据Yarnpakdee等[24]的方法进行测定。取超高压处理后的肌动球蛋白溶液(1 mg/mL),用紫外分光光度计测得的A660即为浊度。
1.3.3 鳙鱼肌动球蛋白的SDS-PAGE分析 参考Benjakul等[25]的方法进行肌动球蛋白的SDS-PAGE分析。其中SDS-PAGE凝胶电泳的浓缩胶浓度为4%,分离胶浓度为10%,电泳分离后用Coomassie Blue R-250染色。
1.3.4 鳙鱼肌动球蛋白Ca2+-ATPase活性的测定 参考Riebroy等[23]的方法进行Ca2+-ATPase活性的测定。将提取出来的蛋白溶液用0.6 mol/L、pH7.0的KCl稀释至4 mg/mL,取0.5 mL蛋白溶液加入0.3 mL 0.5 mol/L、pH7.0 Tris-马来酸溶液、0.5 mL 0.01 mol/L CaCl2溶液、3.45 mL蒸馏水和0.25 mL 20 mmol/L ATP溶液,在25 ℃反应10 min后用2.5 mL 15%三氯乙酸阻断反应。反应完后,反应液在5000×g离心5 min得上清液,采用钼酸铵法测定反应中释放出来的无机磷含量。Ca2+-ATPase活性表示为每毫克蛋白每分钟分解ATP释放的无机磷的微摩尔数,单位为μmol(Pi)/min·mg Pro。
1.3.5 鳙鱼肌动球蛋白表面疏水性的测定 参考Hayakawa等[26]的方法测定表面疏水性。将提取出的肌动球蛋白溶液以10 mmol/L磷酸盐缓冲液(pH6.0,含0.6 mol/L NaCl)稀释成0、0.125、0.25、0.5和1 mg/mL系列浓度,取4 mL稀释后的肌动球蛋白溶液,在20 ℃水浴10 min,加入20 μL 8 mmol/L ANS的0.1 mol/L磷酸盐溶液(pH7.0),反应完后在激发波长374 nm、发射波长485 nm的条件下,用荧光分光光度计测定其荧光强度,以荧光强度对肌动球蛋白浓度作图,并通过线性回归求出其回归方程,用回归方程的斜率来表示鳙鱼肌动球蛋白的表面疏水性(S0ANS)。
1.3.6 鳙鱼肌动球蛋白总巯基含量的测定 参考Benjakul等[27]的方法进行总巯基含量的测定。将肌动球蛋白溶液用0.6 mol/L、pH7.0的KCl稀释至4 mg/mL,取此溶液0.4 mL,加入3.6 mL 0.2 mol/L的Tris-HCl缓冲溶液(含8 mol/L脲素,2% SDS和10 mmol/L EDTA,pH6.8),混匀后加入0.4 mL 0.1% DTNB溶液(用0.2 mol/L Tris-HCl配制,pH7.2)的,在40 ℃反应25 min后用紫外分光光度计于412 nm测吸光度,用0.6 mol/L、pH7.0的KCl同时做一空白实验。巯基含量以mol/105g蛋白质计,计算公式如下:
其中A412表示吸光值;ε表示摩尔消光系数,这里取13600 L·mol-1·cm-1;c表示肌动球蛋白的浓度,为4 mg/mL;D表示稀释因子,其值为11。
1.3.7 鳙鱼肌动球蛋白二硫键含量的测定 参考Yarnpakdee等[24]的方法测定二硫键含量。提取出的肌动球蛋白溶液用0.6 mol/L、pH7.0的KCl溶液稀释至1 mg/mL,取此溶液0.5 mL,加入3 mL pH9.5新配制的NTSB溶液(2-nitro-5-thiosulfobenzoate),混匀后在暗处于室温(25~27 ℃)放置25 min,然后用紫外光栅分光光度计在412 nm测OD值。同时用蒸馏水做空白对照。二硫键含量以mol/105g蛋白质计,计算公式同总巯基含量,不同的是这里ε为13900 L·mol-1·cm-1,c为1 mg/mL,D为7。
1.3.8 蛋白质含量的测定方法 蛋白质含量是以牛血清白蛋白(BSA)作为标准蛋白通过双缩脲方法来测定,得到的蛋白质测定的标准曲线为y=0.051x+0.002(R2=0.999)。
1.4数据统计分析
实验数据采用Origin 8.5软件作图,SPSS Statistics 16.0.1软件进行方差分析,所有实验均重复3次。
2 结果与分析
2.1超高压对鳙鱼肌动球蛋白溶解度的影响
超高压对鳙鱼肌动球蛋白溶解度的影响如图1所示。由图1可知,随着压力的增加和加压时间的延长,鳙鱼肌动球蛋白的溶解度逐渐降低。相同压力下,随着加压时间的延长,鳙鱼肌动球蛋白溶解度呈降低的趋势,其中100 MPa时下降缓慢,变化不显著(p>0.05),300、500 MPa时在加压时间不超过30 min时显著降低(p<0.05),之后缓慢降低(p>0.05),其中500 MPa、45 min时达到最小值87.41%。相同加压时间,高压处理后肌动球蛋白的溶解度比低压处理后的低,这与Ko等[28-29]和Hsu等[30]的研究结果相一致。
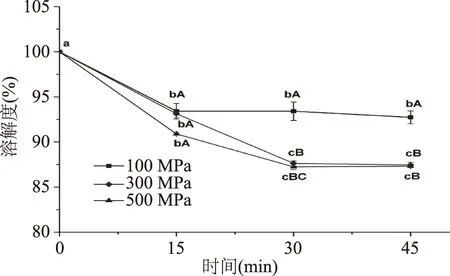
图1 超高压对鳙鱼肌动球蛋白溶解度的影响Fig.1 Effect of ultra-high pressure on the solubility of natural actomyosin extracted from muscle of Arstichthys nobilis注:图中不同的小写字母表示同压力不同时间有显著性差异(p<0.05),不同大写字母表示同时间不同压力下有显著性差异(p<0.05);图2,图4~图7同。
蛋白溶解度大小的变化可以反应单体肌原纤维蛋白向肌原纤维蛋白丝聚集的程度[31]。由结果可知,溶解度的降低表明鳙鱼肌动球蛋白分子经过100 MPa以上高压处理,分子展开,疏水基团暴露在外面,从而水合能力降低并且发生聚集,因此溶解性降低。此外,相同压力下处理时间在30 min内,加压时间的延长也会使肌动球蛋白聚集程度增加,溶解性降低。
2.2超高压对鳙鱼肌动球蛋白浊度的影响
超高压对鳙鱼肌动球蛋白浊度的影响见图2。由图2分析,相同加压时间,随着压力的增大,浊度显著增加(p<0.05)。压力为100 MPa时随着保压时间的延长浊度缓慢增大,但变化不显著(p>0.05);300 MPa时,随着保压时间的延长浊度先显著增加(p<0.05)之后变化不大(p>0.05);500 MPa下随着处理时间的增加也呈现先显著增加(p<0.05)之后变化不大的趋势(p>0.05)。实验结果表明与未处理的肌动球蛋白相比,在适宜的超高压压力(≥300 MPa)下浊度可显著增大,而加压时间对其影响不明显。浊度的增加则表明蛋白分子间相互作用形成了大分子聚集物,导致光散射增加,本实验研究发现,超高压处理可使肌动球蛋白发生聚集,这与Riebroy等[32]的研究结果一致,而且肌动球蛋白在不同超高压条件下处理后的浊度不同,这可能是因为不同超高压条件下肌动球蛋白的聚集敏感性不同造成的[14]。

图2 超高压对鳙鱼肌动球蛋白浊度的影响Fig.2 Effect of ultra-high pressure on the turbidity of natural actomyosin extracted from muscle of Arstichthys nobilis
2.3超高压对鳙鱼肌动球蛋白SDS-PAGE图谱的影响
鳙鱼肌动球蛋白SDS-PAGE图谱如图3所示。由图3可知,肌动球蛋白SDS-PAGE图谱中包含肌球蛋白重链(MHC)和肌动蛋白(Actin)两个主要条带。各组间MHC条带和Actin带强度无明显变化。但发现压力≥300 MPa时,有大分子(>200 kDa)物质出现,这是因为超高压有利于蛋白质的聚集变性,形成大分子蛋白,由于大分子不能通过聚丙烯酸胺凝胶,因此沉积在胶的顶部,并随着压力的增大逐渐增多,说明压力越大,肌原纤维蛋白聚集程度越大,这与Hsu等[6]和Shoji等[33]的研究结果基本一致。实验结果表明,超高压处理能较好地使肌动球蛋白发生交联聚集形成大分子物质,此外Gilleland等[34]研究证明超高压诱导的鱼糜凝胶由二硫键等共价键的交联作用实现。不同的鱼种经超高压处理后MHC带的变化也有所不同,马海建[35]在对草鱼鱼糜肌动球蛋白经超高压处理后,也发现MHC带和Actin带变化不大,与本研究结果一致,而陆海霞等[19]的研究表明,秘鲁鱿鱼肌原纤维蛋白经200 MPa及以上压力处理15 min后其MHC带消失,并认为超高压处理使Actin、MHC和副肌球蛋白按一定的比例聚集交联形成凝胶。

图3 超高压处理下鳙鱼肌动球蛋白的SDS-PAGE图Fig.3 SDS-PAGE pattern of natural actomyosin extracted from muscle of Arstichthys nobilis subjected to high hydrostatic pressure注:0:Marker;1:100 MPa/15 min;2:100 MPa/30 min;3:100 MPa/45 min;4:300 MPa/15 min;5:300 MPa/30 min;6:300 MPa/45 min;7:500 MPa/15 min;8:500 MPa/30 min;9:500 MPa/45 min;10:对照组;MHC:肌球蛋白重链;Actin:肌动蛋白。
2.4超高压对鳙鱼肌动球蛋白Ca2+-ATPase活性的影响
不同处理压力和时间对肌动球蛋白Ca2+-ATPase活性的影响如图4所示,由图4可知,鳙鱼鱼糜肌动球蛋白经超高压处理后,Ca2+-ATPase活性显著降低(p<0.05)。对比各加压样品,相同加压时间,压力越大,Ca2+-ATPase活性下降越明显(p<0.05),其中500 MPa时,Ca2+-ATPase活性消失,表明肌动球蛋白发生变性;相同压力,加压15 min时,Ca2+-ATPase活性显著下降(p<0.05),随后延长加压时间对其下降趋势作用不大(p>0.05)。100、300、500 MPa处理15 min时Ca2+-ATPase活性比新鲜未处理肌动球蛋白下降了39.29%、71.43%、100%,处理30 min分别下降46.43%、75.00%、100%,处理45 min分别下降42.86%、75.00%、100%。以上结果说明Ca2+-ATPase活性在高压处理下较为敏感,易失活。
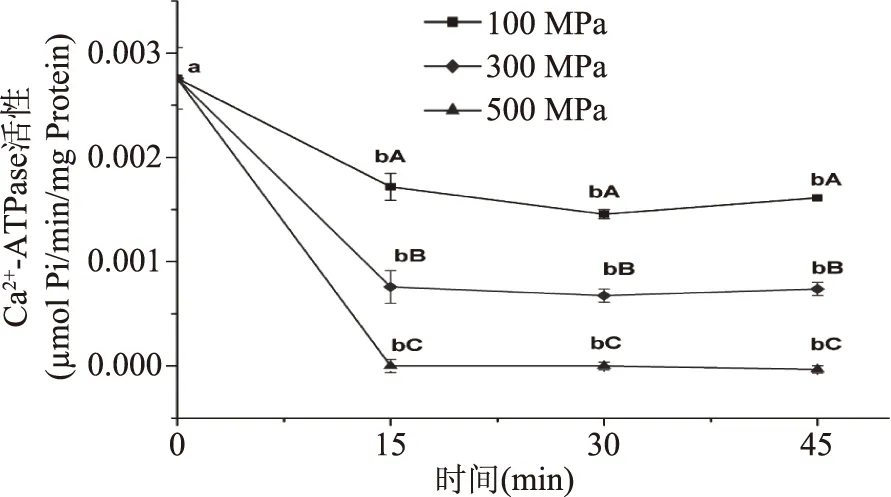
图4 超高压对鳙鱼肌动球蛋白Ca2+-ATPase活性的影响Fig.4 Effect of ultra-high pressure on the Ca2+-ATPase activity of natural actomyosin extracted from muscle of Arstichthys nobilis
Ca2+-ATPase活性是肌球蛋白或肌动球蛋白分子完整程度的标志[26]。其他研究者也有类似的报道。Ko等[36]研究发现虱目鱼肌动球蛋白的Ca2+-ATPase活性在200 MPa处理10 min以上时降低(比新鲜的低20%),而且在300 MPa处理5 min活性丧失,表明肌动球蛋白几乎完全失活(变性)。Ko等[29]报道当罗非鱼肌球蛋白处以100 MPa以上压力时,Ca2+-ATPase活性急剧降低,在100、150和200 MPa保压10 min,活性分别仅保留43%、35%和21%。Ishizaki等[37]报道指出肌肉组织中对压力敏感的组分为肌球蛋白亚基-1(S-1),ATP酶的活性位点位于该区域。S-1在超高压处理下展开并暴露出疏水性基团,同时伴随溶解度降低、α-螺旋含量减少。本研究的结果显示在压力释放后,肌动球蛋白构象发生了不可逆的改变,导致其球状头部结构中与Ca2+-ATPase活性相关的结合位点发生改变,进而引起Ca2+-ATPase活性的降低甚至消失。
2.5超高压对肌动球蛋白表面疏水性的影响
鳙鱼鱼糜肌动球蛋白经过超高压处理后,其表面疏水性的变化结果如图5所示。由结果可知,新鲜的鳙鱼肌动球蛋白经超高压处理后,其表面疏水性显著增加(p<0.05)。相同加压时间条件下,随压力值的增大其表面疏水性增加,100~300 MPa时有显著增加(p<0.05),300、500 MPa处理之间变化不明显(p>0.05)。在一定的压力作用下,保压时间的延长有助于表面疏水性的增大,特别是加压15 min时上升趋势显著(p<0.05),继续增加加压时间对其影响不大(p>0.05)。100、300、500 MPa处理15 min时表面疏水性比未处理时依次增加了约0.56、0.93、0.96倍,处理30 min后依次增加约0.53、1.04、1.11倍,处理45 min后依次增加约0.57、1.07、1.11倍。Ko等[29]对罗非鱼肌动球蛋白超高压处理后研究表面疏水性得到类似的结论,指出高压使表面疏水性增加,是因为压力诱导氨基酸残基暴露在分子表面。Ishizaki等[37]指出,压力对疏水作用的影响可能主要是由于水化压缩性之间的差量导致蛋白分子的展开。疏水区域的暴露是大的肌球蛋白聚集体形成的先决条件。超高压处理中蛋白分子间疏水作用的形成可能是鱼糜凝胶形成的机理之一。本研究也说明超高压凝胶形成与蛋白分子内的疏水相互作用有关,新鲜的鳙鱼肌动球蛋白的疏水性氨基酸一般位于蛋白分子内部,其表面疏水性较低,经过超高压作用后,其表面疏水性明显升高。

图5 超高压对鳙鱼肌动球蛋白表面疏水性的影响Fig.5 Effect of ultra-high pressure on the surface hydrophobicity of natural actomyosin extracted from muscle of Arstichthys nobilis
2.6超高压对鳙鱼肌动球蛋白总巯基含量的影响
超高压对鳙鱼肌动球蛋白总巯基含量的影响由图6所示。由结果可知,与未处理组相比,经超高压处理的鳙鱼肌动球蛋白总巯基含量显著降低(p<0.05)。相同加压时间时,随压力的不断增大,肌动球蛋白总巯基含量显著下降(p<0.05)。相同压力条件下,对比不同加压时间的巯基含量可以发现,15 min处理时,总巯基含量显著下降(p<0.05),延长作用时间其数值差别不大(p>0.05)。压力500 MPa处理45 min时,样品的总巯基含量达到最小值6.582 mol/105g蛋白质。100、300、500 MPa处理15 min,总巯基含量比未处理肌动球蛋白分别下降了17.74%、23.54%、36.72%,处理30 min后分别下降20.49%、23.20%、37.92%,处理45 min后分别下降18.69%、24.52%、40.13%。Hsu等[30]指出当压力高于200 MPa时,罗非鱼肌动球蛋白的总巯基含量随压力的增大而降低,且巯基含量的降低可能与巯基的氧化、二硫键的形成或氢键和疏水作用的形成有关,由此推断本研究中在超高压处理下,鳙鱼肌动球蛋白总巯基含量的下降与分子内、分子间巯基的暴露氧化,二硫键的形成有关,且压力越大,加压时间越长,下降越明显。
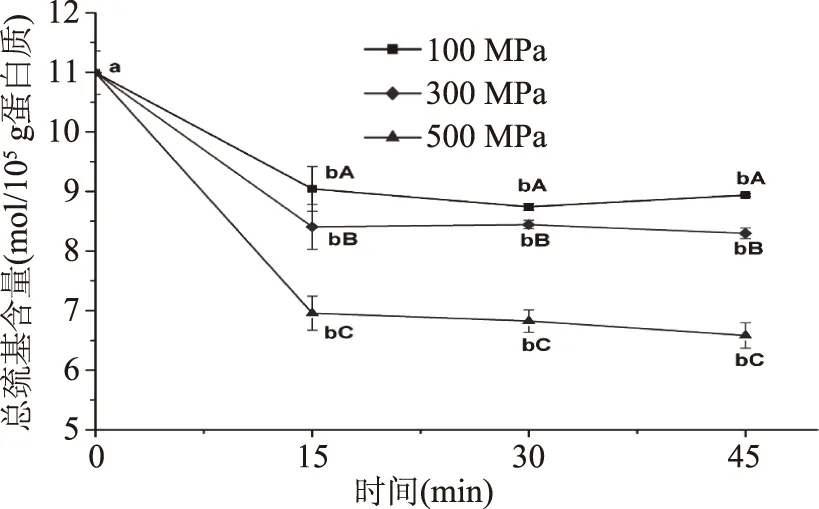
图6 超高压对鳙鱼肌动球蛋白总巯基含量的影响Fig.6 Effect of ultra-high pressure on the total sulfhydryl content of natural actomyosin extracted from muscle of Arstichthys nobilis
2.7超高压对肌动球蛋白二硫键含量的影响
由图7可知,相同加压时间,随着压力的增大,肌动球蛋白二硫键含量呈先增加后降低的变化趋势。加压100 MPa时,随着加压时间的延长,二硫键含量呈先显著降低而后明显增加(p<0.05)的趋势,这可能是因为15 min内的短时间低压处理不足以使氨基酸侧链暴露较多的巯基,因而氧化形成二硫键的巯基含量少,二硫键生成量低,而此时肌动球蛋白内部结构遭到一定程度的破坏,可能造成分子内部的二硫键含量下降,巯基氧化形成二硫键的速度低于分子内部二硫键下降的速度[14],因此表现为100 MPa下15 min内的处理使二硫键含量下降,而加压时间的延长则有利于巯基的氧化,所以导致二硫键含量在加压时间15 min后开始上升。300 MPa处理时,二硫键含量较100 MPa处理组有显著增加(p<0.05),且加压时间对其影响不大(p>0.05),加压15 min时二硫键含量最大。当压力增至500 MPa时,二硫键含量随加压时间的延长先增加后减少。本研究结果表明较高的压力和长时间的加压导致二硫键断裂,不利于二硫键的生成。Stone等[38]指出二硫键的形成虽不是形成凝胶的必需条件,但分子间二硫键的形成,尤其是由肌球蛋白头部S-1部位氧化形成的二硫键,对凝胶的形成有重要贡献。Damodaran等[39]指出二硫键含量的增加有助于延长多肽链的长度,有效多肽链长度的增加有利于凝胶结构的相互间缠绕,且相互交联的蛋白链越长,凝胶性能越强。因此二硫键的形成有利于肌动球蛋白凝胶化,所以要控制适宜的压力和加压时间以促进二硫键的形成。

图7 超高压对鳙鱼肌动球蛋白二硫键含量的影响Fig.7 Effect of ultra-high pressure on the disulfide bond content of natural actomyosin extracted from muscle of Arstichthys nobilis
3 结论
研究表明100~500 MPa的高压可诱导鳙鱼肌肉肌动球蛋白分子构象的改变,从而导致其物化特性的改变,表现在浊度、表面疏水性和二硫键含量的增加,以及蛋白溶解度和总巯基含量的降低,肌动球蛋白发生交联聚集形成大分子物质,Ca2+-ATPase活性的降低乃至丧失。因此,100 MPa以上压力诱导的鳙鱼肌肉肌动球蛋白的变性和聚集,将有助于鱼糜凝胶的形成,疏水相互作用和二硫键可能会发挥主导作用。本研究的结论为以后进一步深入探讨超高压促凝胶的机理提供一定的理论参考,进一步的工作将研究肌动球蛋白的二级结构在高压处理下的变化。
[1]雒莎莎,童彦,Jahangir Muhammad Muzammil,等. 超高压处理对鳙鱼质构特性的影响[J]. 中国食品学报,2012,12(5):182-187.
[2]袁晓晴,孙耀军,刘红梅. 酶解鳙鱼鱼肉蛋白制备ACE抑制肽工艺参数优化[J]. 食品工业科技,2014,35(20):213-216.
[3]胡飞华.梅鱼鱼糜超高压凝胶化工艺及凝胶机理的研究[D]. 杭州:浙江工商大学,2010.
[4]Benjakul S,Chantarasuwan C,Visessanguan W. Effect of medium temperature setting on gelling characteristics of surimi from some tropical fish[J]. Food Chemistry,2003,82(4):567-574.
[5]郭宝颜,梁燕,周爱梅,等. 超高压对罗非鱼肌动球蛋白物化特性的影响[J]. 现代食品科技,2015(6):259-263.
[6]Hsu K,Jyh-Sheng H,Yu C,et al. Changes in conformation and in sulfhydryl groups of actomyosin of tilapia(Orechromisniloticus)on hydrostatic pressure treatment[J]. Food Chemistry,2007,103(2):560-564.
[7]Cao Y,Cheng Y D,Wang X C,et al. Effects of heating methods on gel-forming ability of silver carp(Hypophthalmichthysmolitrix)surimi[J]. Journal of Shanghai Fisheries University,2003,12(S1):107-112.
[8]Chung Y C,Gebrehiwot A,Farkas D F,et al. Gelation of Surimi by High Hydrostatic Pressure[J]. Journal of Food Science,1994,59(3):523-524,543.
[9]梁燕,周爱梅,郭宝颜,等. 超高压对草鱼鱼糜凝胶特性的影响及其机理初探[J]. 食品工业科技,2015,36(1):86-90,96.
[10]周爱梅,林丽英,梁燕,等. 超高压诱导鱼糜凝胶性能的研究[J]. 现代食品科技,2013(9):2058-2062.
[11]李亚楠.鸭肉中肌原纤维蛋白的提取及凝胶特性的研究[D]. 天津:天津商业大学,2012.
[12]Huang Y,Guo L,Xiong S,et al. Property and structure changes of myofibril protein in pork treated by high pressure combined with heat[J]. Food Science and Technology International,2016,22(7):647-662.
[13]Iwasaki T,Yamamoto K. Effect of high hydrostatic pressure on chicken myosin subfragment-1[J]. International Journal of Biological Macromolecules,2002,30(5):227-232.
[14]Zhou A,Lin L,Liang Y,et al. Physicochemical properties of natural actomyosin from threadfin bream(Nemipterusspp.)induced by high hydrostatic pressure[J]. Food Chemistry,2014,156:402-407.
[15]闫春子.超高压处理对淡水鱼冷藏保鲜效果的影响[D]. 无锡:江南大学,2016.
[16]罗晓玲.马鲛鱼鱼糜超高压凝胶化工艺研究[D]. 无锡:江南大学,2010.
[17]周果,杨文鸽,崔燕,等. 超高压处理对三疣梭子蟹感官及其肌原纤维蛋白生化特性的影响[J]. 食品科学,2017:1-8.
[18]郑捷,尚校兰,刘安军. 超高压处理对海鲈鱼鱼肉凝胶形成作用[J]. 食品科学,2013,34(19):88-92.
[19]陆海霞.秘鲁鱿鱼肌原纤维蛋白质凝胶特性的研究[D]. 杭州:浙江工商大学,2009.
[20]Qiu C,Xia W,Jiang Q. Pressure-induced changes of silver carp(Hypophthalmichthys molitrix)myofibrillar protein structure[J]. European Food Research and Technology,2014,238(5):753-761.
[21]Ko W C,Tanaka M,Nagashima Y,et al. Effect of Pressure Treatment on Actomyosin ATPases from Flying Fish and Sardine Muscles[J]. Journal of Food Science,1991,56(2):338-340.
[22]Balange A K,Benjakul S,Maqsood S. Gel Strengthening Effect of Wood Extract on Surimi Produced from Mackerel Stored in Ice[J]. Journal of Food Science,2009,74(8):C619-C627.
[23]Riebroy S,Benjakul S S B P,Visessanguan W,et al. Acid-induced gelation of natural actomyosin from Atlantic cod(Gadusmorhua)and burbot(Lotalota)[J]. Food Hydrocolloids,2009,23(1):26-39.
[24]Yarnpakdee S,Benjakul S S B P,Visessanguan W,et al. Thermal properties and heat-induced aggregation of natural actomyosin extracted from goatfish(Mulloidichthysmartinicus)muscle as influenced by iced storage[J]. Food Hydrocolloids,2009,23(7):1779-1784.
[25]Benjakul S,Visessanguan W,Chantarasuwan C. Effect of porcine plasma protein and setting on gel properties of surimi produced from fish caught in Thailand[J]. Food Science and Technology,2004,37(2):177.
[26]Hayakawa S N S. Relationships of Hydrophobicity and Net Charge to the Solubility of Milk and Soy Proteins[J]. Journal of Food Science,1985,50(2):486-491.
[27]Benjakul S,Seymour T A,Morrissey M T,et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J]. Journal of Food Science,1997,62(4):729-733.
[28]Ko W C,Hwang J S,Jao C L,et al. Denaturation of tilapia myosin fragments by high hydrostatic pressure[J]. Journal of Food Science,2004,69(8):C604-C607.
[29]Ko W C,Jao C L,Hsu K C. Effect of hydrostatic pressure on molecular conformation of tilapia(Orechromisniloticus)myosin[J].Journal of Food Science,2003,68(4):1192-1195.
[30]Hsu K,Ko W. Effect of Hydrostatic Pressure on Aggregation and Viscoelastic Properties of Tilapia(Orechromisniloticus)Myosin[J]. Journal of Food Science,2001,66(8):1158-1162.
[31]Kunihiko S,Shigeo H,Katsuhiro Y,et al. Physicochemical properties and heat-induced gelling of cardiac myosin in model system[J]. Bioscience,Biotechnology and Biochemistry,1985,49(10):2975-2983.
[32]Riebroy S,Benjakul S S B P,Visessanguan W,et al. Comparative study on acid-induced gelation of myosin from Atlantic cod(Gardusmorhua)and burbot(Lotalota)[J]. Food Chemistry,2008,109(1):42-53.
[33]Shoji T,Saeki H,Wakameda A,et al. Gelation of salted paste of Alaska pollack by high hydrostatic pressure and change in myofibrillar protein in it[J]. Nippon Suisan Gakkaishi,1990,56(12):2069-2076.
[34]Gilleland G M,Lanier T C,Hamann D D. Covalent bonding in pressure induced fish protein gels[J]. Journal of Food Science,1997,62(4):713-716,733.
[35]马海建.超高压处理对草鱼鱼肉和鱼糜制品品质的影响[D]. 上海:上海海洋大学,2016.
[36]Ko W C. Effect of high pressure on gelation of meat paste and inactivation of actomyosin Ca-ATPase prepared from milkfish[J].Fisheries Science,1996,62(1):101-104.
[37]Ishizaki S,Tanaka M,Takai R,et al. Stability of fish myosins and their fragments to high hydrostatic pressure[J]. Fisheries Science,1995,61(6):989-992.
[38]Stone A P,Stanley D W. Mechanisms of fish muscle gelation[J]. Food Research International,1992,25(5):381-388.
[39]Damodaran S.Interrelationship of molecular and functional properties of food proteins[C]. In:Kinsella JE,Soucie WG(eds)Food proteins. AOCS,Champaign,IL,1989:21-51.
Effectofultra-highpressureonthephysicochemicalpropertiesofactomyosinfrombigheadcrap(Arstichthysnobilis)
LIUChun-hua1,2,LIANGYan3,+,ZHOUAi-mei1,2,*,XIAOSu-yao1,2,LIUXin1,2,CAOYong1,2
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Guangdong Province Engineering Research Center for Bioactive Natural Products,Guangzhou 510642,China;3.Pro-Health(China)Co.,Ltd.,Beijing 100176,China)
Changes of physicochemical properties in natural actomyosin fromArstichthysnobilisinduced by ultra-high hydrostatic pressure(100,300,500 MPa for 15,30,45 min)were investigated. The results revealed that the solubility of actomyosin decreased while the turbidity increased with the increase of pressure and time,indicating the accumulation of protein aggregates and denaturation. SDS-PAGE showed that ultra-high pressure induced the cross-linking and accumulation of actomyosin to form macromolecular substances. Ca2+-ATPase activity of actomyosin treated by ultra-high pressure was lost,suggesting the denaturation of actomyosin. Surface hydrophobicity of actomyosin increased when the pressure and pressurization time increased,indicating that the exposed hydrophobic residues increased upon application of high pressure. The total sulfhydryl content of actomyosin decreased while the disulfide bond content increased with the increase of pressure,which confirmed that the sulfhydryl group of actomyosin underwent oxidation to form disulfide bonds. These variations in the physicochemical properties demonstrate that the conformation of actomyosin extracted fromArstichthysnobilischanges after ultra-high pressure processing.
ultra-high pressure;Arstichthysnobilis;actomyosin;physicochemical properties
2017-02-23 +并列第一作者
刘春花(1992-),女,硕士研究生,研究方向:食品化学与营养,E-mail:liuch0805@126.com。 梁燕(1988-),女,硕士研究生,研究方向:食品化学与营养,E-mail:liangyanxy@126.com。
*通讯作者:周爱梅(1971-),女,博士,教授,研究方向:水产品及农产品深加工,E-mail:zhouam@scau.edu.cn。
国家自然科学基金资助项目(31101311)。
TS254.1
:A
:1002-0306(2017)16-0029-07
10.13386/j.issn1002-0306.2017.16.007
