自噬下降对β1受体自身抗体诱导的H9c2心肌细胞凋亡的作用
2017-09-06李杨乔爱秀徐云云王晓晖王丽刘慧荣
李杨 乔爱秀 徐云云 王晓晖 王丽 刘慧荣
基础研究
自噬下降对β1受体自身抗体诱导的H9c2心肌细胞凋亡的作用
李杨 乔爱秀 徐云云 王晓晖 王丽 刘慧荣
目的 探讨自噬下降对β1肾上腺素受体自身抗体(β1-AA)诱导的H9c2心肌细胞凋亡的作用。方法 使用1 μM的β1-AA对H9c2心肌细胞进行处理,Real time-PCR检测自噬相关基因LC3 mRNA表达的改变,Western blot检测LC3、Beclin 1以及P62蛋白表达水平的变化;使用流式细胞术、Caspase-3活性检测及Hoechst 33258染色反映细胞凋亡情况;使用经典的自噬抑制剂3-甲基腺嘌呤(3-MA)预处理30 min,以及mTOR通路抑制剂雷帕霉素(RAPA)预处理1 h后,再给予细胞β1-AA处理,检测此时细胞凋亡的变化情况。结果 与对照组相比,1 μM的β1-AA干预H9c2心肌细胞6 h可以明显降低细胞存活率[(83.46±12.87)%比(96.45±6.99)%]。与对照组(1.01±0.14)相比,β1-AA 干预细胞 6 h、12 h、24 h,LC3 mRNA水平依次降低[6 h(0.85±0.11),12 h(0.71±0.10),24 h(0.62±0.07)],LC3Ⅱ和 Beclin 1 蛋白水平依次降低,P62蛋白水平逐渐增加,表明β1-AA可以引起心肌细胞自噬水平逐渐下降。同时发现,与对照组(1.13±0.24)相比,β1-AA干预细胞6 h、12 h,细胞凋亡水平明显升高,分别达到3.21±0.89和2.14±0.24。使用经典自噬抑制剂3-MA预处理心肌细胞30 min抑制自噬后,H9c2心肌细胞凋亡水平较β1-AA单独处理组显著增加[(41.45±6.37)%比(29.55±4.32)%];而使用经典mTOR通路抑制剂RAPA预处理心肌细胞1 h上调自噬后,心肌细胞凋亡水平较β1-AA单独处理组明显下降[(17.36±2.98)%比(29.55±4.32)%],说明自噬水平改变可以影响心肌细胞凋亡水平。结论 自噬下调能够增加β1-AA诱导的H9c2心肌细胞凋亡。
自噬; β1肾上腺素受体自身抗体; H9c2; 凋亡
心功能不全是大多心血管疾病最主要的死亡原因之一[1],其发病机制尚未完全阐明。大量动物实验和人体研究均发现,在心功能不全的过程中存在心肌细胞凋亡,而且心肌细胞凋亡在心功能不全的发生发展过程中起着至关重要的作用;相反,如果抑制细胞凋亡则可有效地防止或减弱心功能不全[2]。因此,有效调控心肌细胞凋亡对于心功能不全的防治有着十分重要的意义。
近年来发现,在40%~60%心功能不全患者血清中可检测到β1肾上腺素受体自身抗体(β1-adrenoceptor autoantibody,β1-AA)[3]。且有研究表明,β1-AA可以通过激活β1肾上腺素受体诱导心肌细胞凋亡[4],进而参与心功能不全的发生发展。然而,β1-AA如何引起心肌细胞凋亡目前仍不十分清楚。
自噬通过降解老化或受损的细胞器及错误折叠或功能异常的蛋白质,促进细胞的自我更新及物质循环,并为细胞提供能量,维持细胞稳态。我们前期研究发现,β1-AA可以引起心肌细胞自噬水平下降[5]。同时有研究表明,自噬参与了细胞凋亡的调控[6]。在某些特定环境下,自噬是一种应激反应,通过抑制凋亡避免细胞死亡[7]。由此可知,自噬在细胞凋亡的发生过程中可能发挥着重要的调控作用。然而自噬是否会对β1-AA诱导的H9c2心肌细胞凋亡产生影响目前尚不清楚。本研究将进一步观察自噬变化对β1-AA诱导的心肌细胞凋亡的影响,为心功能不全患者的防治提供新的理论支持。
1 材料与方法
1.1 主要试剂与仪器 P62(Cell Signaling Technology),Beclin 1 (Cell Signaling Technology),LC3B(Sigma),辣根过氧化物酶标记山羊抗兔二抗(中杉金桥),0.45 μm PVDF 膜(Whatman),RNAiso plus(Takara),Prime Script RT Master Mix(TaKaRa),SYBR Premix Ex TaqTMⅡ(TaKaRa),3-Methyladenine(Sigma),Rapamyein(Gene Operation),Hoechst 33258(Beyotime Biotechnology),Caspase-3活性分光光度法检测试剂盒(Nanjing Biobox Biotech.Co.,Ltd),Mini port垂直电泳仪(BIO-RAD),热循环仪(MJ Research),实时荧光定量 PCR 仪(Stratagene),酶标仪(Molecular Devices)。
1.2 实验分组 实验分为4组:对照组(Control组);β1-AA 组(β1-AA 1 μM 处理细胞 6、12、24 h);3-MA+β1-AA组(3-MA 10 mM预处理细胞30 min后加入 β1-AA 1 μM 处理细胞 6 h);RAPA+β1-AA组(RAPA 100 nM预处理细胞1 h后加入β1-AA 1 μM处理细胞6 h)。
1.3 细胞活性检测 本实验采用CCK-8法检测各组细胞存活率。具体方法是:以大约2×106个细胞/ml的密度将细胞接种在96孔培养板,待细胞贴壁后使用1 μM的β1-AA处理细胞,6 h后更换新鲜培养液 100 μl,加入 5 μl CCK-8,混匀继续培养90 min。观察到溶液颜色变为棕黄色时,用酶标仪在405 nm处检测各组吸光度值。根据各组的吸光度值计算各实验组相对于对照组的细胞存活率。细胞存活率=(实验组OD值-阴性对照组OD值)/(对照组OD值-阴性对照组OD值)。
1.4 Real time-PCR 本实验用Real-time PCR方法检测LC3的mRNA表达水平。具体方法是:6孔板中每孔H9c2心肌细胞用500 μl Trisol试剂裂解,并提取总RNA。0.5 μg总RNA反转为cDNA,选用SYBR Green试剂盒扩增cDNA产物,确认Real-time PCR的扩增曲线和溶解曲线。引物序列如下:LC3(Gen-Bank ID NM_022867.2),上游引物为 5′-AGCTCTGAAGGCAACAGCAACA-3′,下游引 物 为 5′-GCTCCATGCAGGTAGCAGGAA-3′。GAPDH(Gen-Bank ID NM_017008.3),上游引物为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物为5′-ATGGTGGTGAAGACGCCAGTA-3′。 选 用GAPDH作为内参。结果采用相对定量进行计算(2-ΔΔCt法)。
1.5 Western blot 本实验用Western blot方法检测P62、LC3和Beclin 1的蛋白表达水平。具体方法是:加入1 μM β1-AA后在不同时间点收集细胞,加入Western及IP细胞裂解液裂解,冰上静置1 h,细胞刮收集细胞,将细胞悬液收集到1.5 ml的EP管中,12 000 r/min离心15 min,提取上清,用BCA试剂盒进行蛋白定量。选择上样量为30 μg上样并进行SDS-PAGE电泳以及用PVDF膜转膜。再与P62、Beclin 1、LC3B及 β-actin的单克隆抗体进行反应,4℃过夜;选用相应的二抗进行反应。SuperECL Plus(北京普利莱,P1030)超敏发光液发光;将膜置于全自动曝光仪(Bio-Rad,Universal HoodⅢ)内,利用Image Lab软件曝光拍摄条带。Image J软件分析条带的灰度值,将β-actin作为参照,计算不同蛋白的相对表达量。
1.6 Hochest 33258染色 本实验采用Hoechst 33258染色法来检测细胞凋亡情况。正常细胞经Hoechst 33258染色后细胞核呈弥散均匀荧光;细胞出现凋亡时,细胞核可见浓染致密的颗粒块状荧光。具体方法如下:将H9c2心肌细胞接种至六孔板中,细胞贴壁达50%~60%后进行分组加药处理;用PBS清洗2次,每孔加入1 ml Hoechst 33258染色液,置于37℃、5%CO2恒温箱中孵育30 min;取出后弃掉染料,用PBS洗涤2次后每孔加入1 ml PBS,荧光倒置显微镜(Olympus,IX51)观察并拍照。1.7 Caspase-3活性检测 本实验使用Caspase-3活性分光光度法(南京碧波,BA30100)检测Caspase-3的活性来反映凋亡情况。具体方法是:收集细胞时,每孔加入100 μl Lysis Buffer,吹打均匀,冰上裂解,用BCA试剂盒进行蛋白定量。给药组吸取 100 μg 蛋白/50 μl体积(对照组吸取 50 μl裂解液)后,依次加入50 μl 2×反应液(使用前加入0.5 μl DTT/50 μl)、5 μl Ac-DEVD-pNA,37 ℃孵育过夜。在酶标仪405 nm处测定各组吸光度值。Caspase-3活性计算:校正荧光度值=OD诱导组/OD阴性对照;以对照组的活性为1,计算其余各组Caspase-3相对活性。
1.8 统计学方法 采用SPSS 16.0软件对数据进行统计分析。结果以±s表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用最小显著差异法(LSD)法。检验水准α=0.05。
2 结果
2.1 β1-AA对H9c2心肌细胞存活率的影响 β1-AA能够显著降低H9c2心肌细胞存活率。采用CCK-8法检测细胞存活率,结果显示,与对照组H9c2 心肌细胞存活率(96.45±6.99)%相比,1 μM[8]β1-AA作用H9c2心肌细胞6 h细胞存活率出现明显下降,为(83.46±12.87)%。见图 1。
2.2 β1-AA对H9c2心肌细胞自噬水平的影响
LC3Ⅱ是自噬形成的标准蛋白,Beclin 1是参与自噬调控的重要基因,而P62是自噬重要的底物蛋白。本研究采用Real time-PCR法及western blot法检测β1-AA干预H9c2心肌细胞6 h、12 h、24 h时LC3 mRNA水平及LC3、Beclin 1和P62蛋白表达情况。结果显示,与对照组(1.01±0.14)相比,心肌细胞LC3 mRNA水平在β1-AA干预H9c2心肌细胞 6 h 开始下降,6 h(0.85±0.11),12 h(0.71±0.10),24 h(0.62±0.07)。β1-AA 干预 H9c2 心肌细胞 6 h、12 h、24 h以后,LC3Ⅱ与 Beclin 1 蛋白水平依次降低,P62蛋白水平逐渐增加。以上结果提示,β1-AA可以引起心肌细胞自噬水平明显下降。见图2(A、B)。
2.3 β1-AA对H9c2心肌细胞凋亡增加的作用β1-AA在不同时间点刺激H9c2心肌细胞,通过Annexin V-FITC/PI双染流式细胞术、Caspase-3活性检测及Hochest 33258染色来反映心肌细胞凋亡情况。流式细胞分析结果显示,与对照组相比,β1-AA刺激6 h时,处于右上象限与右下象限细胞百分比增加,提示细胞凋亡显著增加(3.21±0.89比1.13±0.24),12 h(2.14±0.24)仍然高于对照组,24 h(1.29±0.19)基本恢复正常。Caspase-3活性检测及Hochest 33258染色均发现,β1-AA可以引起H9c2心肌细胞凋亡增加,并且这种增加在β1-AA作用6 h时最为显著。见图 3(A、B、C)。
2.4 上调或抑制心肌细胞自噬水平对β1-AA诱导的心肌细胞凋亡的影响 本研究采用经典自噬抑制剂3-MA抑制自噬以及mTOR通路抑制剂RAPA上调自噬水平,Annexin V-FITC/PI双染流式细胞术对H9c2心肌细胞凋亡进行检测,结果显示,β1-AA干预心肌细胞6 h后,与对照组相比,处于右上象限与右下象限细胞百分比增加[(29.55±4.32)%比(10.02±3.29)%],表明 β1-AA 作用 6 h能够增加H9c2心肌细胞凋亡;使用经典自噬抑制剂3-MA抑制自噬水平以后发现,处于右上象限和右下象限的细胞百分比进一步增加[(41.45±6.37)%比(29.55±4.32)%],提示凋亡水平进一步增加;而使用mTOR通路抑制剂RAPA上调自噬后则发现,心肌细胞凋亡水平降低[(17.36±2.98)%比(29.55±4.32)%]。以上结果均说明,自噬变化参与了β1-AA诱导的心肌细胞凋亡。见图4。
3 讨论
本研究发现,β1-AA可以降低H9c2心肌细胞存活率,增加凋亡水平。利用Real time-PCR和Western blot方法检测自噬相关基因和蛋白,结果表明,β1-AA诱导H9c2心肌细胞自噬水平明显下降。进一步分析β1-AA引起的H9c2心肌细胞自噬变化与细胞凋亡的关系,结果提示,β1-AA可能通过降低H9c2心肌细胞自噬水平诱导细胞出现凋亡。
β1-AA是针对β1肾上腺素受体细胞外第二环的自身抗体,存在于原发性扩张型心肌病、Chagas心脏病、原发性心电紊乱等多种心血管疾病患者血液中,发挥类β1-AR受体激动剂样的作用进而导致心功能不全。有研究发现,β1-AA可对分离的心肌细胞产生正性肌力效应,导致细胞内cAMP升高,从而使心肌细胞死亡[9]。也有研究报道,β1-AA具有类激动剂样的正性变时效应,使乳鼠心肌细胞跳动频率增加,并且持续6 h不衰减[10]。这都提示β1-AA的存在可能是心功能不全发生发展的危险因素之一。我们之前的研究[11]也发现,β1-AA的长期存在导致大鼠心肌重构和心脏功能受损。本次试验发现,1 μM β1-AA作用H9c2心肌细胞6 h可明显降低细胞存活率,表明β1-AA的存在与心功能不全的发生发展密不可分。
心肌细胞凋亡是心肌细胞死亡的一种重要方式。有研究表明,β1-AA引起的心肌细胞凋亡是导致心功能不全的主要因素之一[12]。β1-AA通过与β1-AR结合,可以发挥类激动剂样作用激活β1-AR,而β1-AR持续过度激活可以引发心肌细胞凋亡[13]。有学者发现,β1-AA可以激活心肌细胞cAMP依赖的蛋白激酶信号通路,引起Caspase-3的活化,从而导致心肌细胞的凋亡[14]。本实验研究也发现,1 μM β1-AA作用6 h时可以引起H9c2心肌细胞凋亡显著增加。但是β1-AA到底如何诱发凋亡目前并不十分清楚。
自噬是溶酶体吞食和降解细胞浆内物质的过程,是细胞依赖溶酶体途径来反复和再回收利用细胞浆内成分的过程[15],这种生物学过程对于细胞维持内环境稳态及能量平衡是十分重要的。研究发现β1-AA与β1-AR细胞外第二环结合发挥类激动剂样作用[16],而β1-AR的激活可以明显影响自噬水平。我们实验室前期研究发现,随着β1-AA刺激时间的延长,心肌细胞自噬水平明显降低,并且参与心功能不全的发生发展[5,17]。本实验研究结果也与前期研究结果一致。β1-AA干预H9c2心肌细胞6 h、12 h、24 h后,LC3 mRNA水平以及LC3和Beclin 1蛋白水平逐渐降低,P62蛋白水平逐渐增加,提示自噬水平逐渐降低。
自噬和凋亡很有可能是被许多因子同时激活的两个基本生物学过程[18]。目前关于自噬与凋亡的关系仍存在争议,但普遍认为二者受共同调节因子的影响,存在交互作用。有研究表明,自噬和凋亡均可引起细胞死亡,且自噬处于凋亡上游信号通路,可通过降解受损的蛋白、减弱DNA损伤等途径抑制凋亡的发生[19]。最新研究发现,在HeLa细胞中Caspase-3引起的Beclin 1裂解会降低自噬,进而引起细胞凋亡[20]。因此,自噬作为维持细胞稳态的机制,可以在某种程度上影响凋亡的发生。由以上实验结果可知,在β1-AA存在的条件下,H9c2心肌细胞凋亡发生增加,而自噬水平下降。那么自噬下降是否与β1-AA诱导的心肌细胞凋亡有关呢?为了进一步证明这一问题,本研究选用RAPA上调自噬,结果发现β1-AA引起的H9c2心肌细胞凋亡水平明显降低;而当使用3-MA抑制自噬后,β1-AA引起的H9c2心肌细胞凋亡水平进一步升高,提示自噬的下调参与了β1-AA诱导的H9c2心肌细胞的凋亡。由此设想,如果我们可以早期合理调控自噬进而适度调控凋亡,则极有可能减少心肌细胞的凋亡,改善心功能,从而为治疗β1-AA阳性心功能不全提供新的方法。
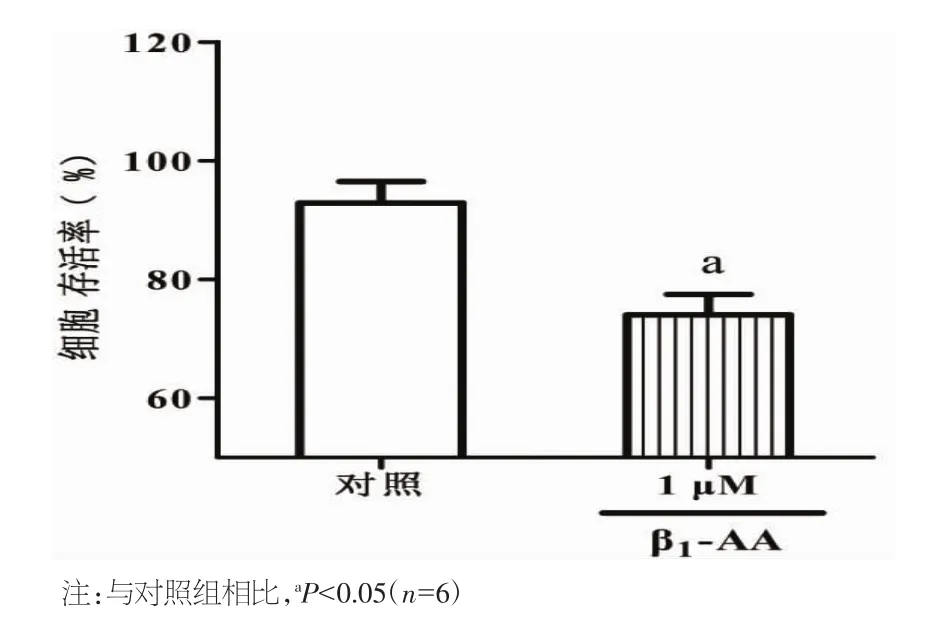
图1 对照组和β1-AA组细胞存活率检测结果分析
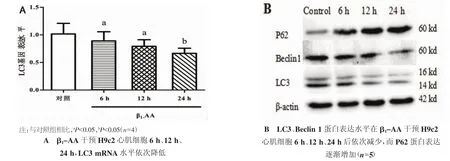
图2 β1-AA诱导H9c2心肌细胞自噬水平下降

A 通过Annexin V-FITC/PI双染流式细胞术结果显示β1-AA作用6 h时明显促进H9c2心肌细胞凋亡

图3 β1-AA引起H9c2心肌细胞凋亡增加
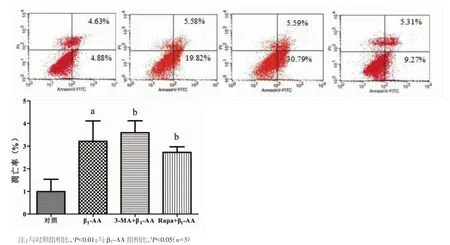
图4 自噬水平的改变能够影响H9c2心肌细胞凋亡的发生
[1]Sun GW,Qiu ZD,Wang WN,et al.Flavonoids Extraction from Propolis Attenuates Pathological Cardiac Hypertrophy through PI3K/AKT Signaling Pathway.Evid Based Complement Alternat Med,2016,2016:6281376.
[2]Andreka P,Nadhazi Z,Muzes G,et al.Possible therapeutic targets in cardiac myocyte apoptosis.Curr Pharm Des,2004,10:2445-2461.
[3]Holthoff HP,Zeibig S,Jahns-Boivin V,et al.Detection of anti-β1-AR autoantibodies in heart failure by a cell-based competition ELISA.Circ Res,2012,111:675-684.
[4]Staudt Y,Mobini R,Fu M,et al.Beta1-adrenoceptor antibodies induce apoptosis in adult isolated cardiomyocytes.Eur J Pharmacol,2003,466:1-6.
[5]Wang L,Hao H,Wang J,et al.Decreased autophagy:a major factor for cardiomyocyte death induced by β1-adrenoceptor autoantibodies.Cell Death Dis,2015,6:e1862.
[6]Fukuda T,Oda K,Wada-Hiraike O,et al.Autophagy inhibition augments resveratrol-induced apoptosis in Ishikawa endometrial cancer cells.Oncol Lett,2016,12:2560-2566.
[7]Maiuri MC,Zalckvar E,Kimchi A,et al.Self-eating and selfkilling:crosstalk between autophagy and apoptosis.Nat Rev Mol Cell Biol,2007,8:741-752.
[8]Wang L,Hao H,Wang J,et al.Decreased autophagy:a major factor for cardiomyocyte death induced by β1-adrenoceptor autoantibodies.Cell Death Dis,2015,6:e1862.
[9]Reina S,Ganzinelli S,Sterin-Borda L,et al.Pro-apoptotic effect of anti-β1-adrenergic receptor antibodies in periodontitis patients.Int Immunopharmacol,2012,14:710-721.
[10]Magnusson Y,Wallukat G,Waagstein F,et al.Autoimmunity in idiopathic dilated cardiomyopathy.Characterization of antibodies against the beta 1-adrenoceptor with positive chronotropic effect.Circulation,1994,89:2760-2767.
[11]Zuo L,Bao H,Tian J,et al.Long-term active immunization with a synthetic peptide corresponding to the second extracellu lar loop of β1-adrenoceptor induces both morphological and functional cardiomyopathic changes in rats.IntJCardiol 2011,149:89-94.
[12]Jane-wit D,Altuntas CZ,Johnson JM,et al.Beta 1-adrenergic receptor autoantibodies mediate dilated cardiomyopathy by agonistically inducing cardiomyocyte apoptosis.Circulation 2007,116:399-410.
[13]Somvanshi RK,Zou S,Qiu X,et al.Somatostatin receptor-2 negatively regulates β-adrenergic receptor mediated Ca(2+)dependent signaling pathways in H9c2 cells.Biochim Biophys Acta,2014,1843:735-745.
[14]Reina S,Ganzinelli S,Sterin-Borda L,et al.Pro-apoptotic effect of anti-β1-adrenergic receptor antibodies in periodontitis patients.Int Immunopharmacol,2012,14:710-21.
[15]Bai W,Chen Y,Sun P,et al.Downregulation of B-cell lym phoma/leukemia-2 by overexpressed microRNA 34a enhanced titanium dioxidenanoparticle-induced autophagy in BEAS-2B cells.Int J Nanomedicine,2016,11:1959-1971.
[16]Tutor AS,Penela P,Mayor F Jr.Anti-beta1-adrenergic receptor autoantibodies are potent stimulators of the ERK1/2 pathway in cardiac cells.Cardiovasc Res,2007,76:51-60.
[17]Wang L,Lu K,Hao H,et al.Decreased autophagy in rat heart induced by anti-β1-adrenergic receptor autoantibodies con tributes to the decline in mitochondrial membrane potential.PLoS One,2013,8:e81296.
[18]Ma K,Zhang C,Huang MY,et al.Crosstalk between Beclin-1-dependent autophagy and caspase dependent apoptosis induced by tanshinoneⅡA in human osteosarcoma MG-63 cells.Oncol Rep,2016,36:1807-1818.
[19]Fukuda T,Oda K,Wada-Hiraike O,et al.Autophagy inhibition augments resveratrol-induced apoptosis in Ishikawa endometrial cancer cells.Oncol Lett,2016,12:2560-2566.
[20]Zhu Y,Zhao L,Liu L,et al.Beclin 1 cleavage by caspase-3 inactivates autophagy and promotes apoptosis.ProtCell 2010,1:468-477.
Decreased autophagy participate in the apoptosis induced by β1adrenergic receptor autoantibodies in H9c2 cells
LI Yang*,QIAO Ai-xiu,XU Yun-yun,et al.*Department of Physiology,Shanxi Medical University,Taiyuan 030001,China
WANG Li,E-mail:mirror0117@126.com;LIU Hui-rong,E-mail:liuhr2000@126.com
ObjectiveTo investigate the role of autophagy in the regulation of apoptosis induced by β1adrenergic receptor autoantibodies(β1-AA)in H9c2 cells.MethodsH9c2 myocardial cells treated with 1 μM β1-AA were processed to detect the changes of autophagy related gene LC3 mRNA expression by Real time-PCR;using western blot to test the varieties of Beclin 1,P62 and LC3 protein expression level;flow cytometry,Caspase-3 activity detection and Hoechst 33258 staining were used to assess cell apoptosis;using classical autophagy inhibitor 3-Methyladenine(3-MA)pretreated cells for 30 min or pretreated with mTOR signaling pathway inhibitor rapamyein(RAPA)for 1 h,then used β1-AA,detecting the changes of apoptosis.ResultsCompared with the control group(96.45±6.99)%,after 1 μM β1-AA acting on H9c2 myocardial cells 6 h,the survival rate of cells significantly reduced to(83.46±12.87)%;as compared to control(1.01±0.14),β1-AA intervened cells for 6 h,12 h and 24 h,LC3 mRNA level was fallen to 0.85±0.11,0.71±0.10,and 0.62±0.07,respectively;also,LC3Ⅱ and Beclin 1 protein level was descended,nevertheless P62 protein level increased gradually,showed that the level of autophagy decreased gradually;at the same time,compared to controls(1.13±0.24),β1-AA acting to cardiomyocytes for 6 h and 12 h,the level of cardiomyocytes apoptosis severally increased to 3.21±0.89 and 2.14±0.24;after preusing classical autophagy inhibitor 3-MA for 30 min to inhibit autophagy,apoptosis of H9c2 myocardial cells increased significantly than only β1-AA treatment group[(41.45±6.37)%vs (29.55±4.32)%],in contrast,after using mTOR signaling pathway inhibitor RAPA for 1 h to upregulate autophagy,apoptosis of H9c2 cardiomyocytes decreased[(17.36±2.98)%vs(29.55±4.32)%],indicated that changes in autophagy can affect H9c2 cells apoptosis.ConclusionReduced autophagy could increase apoptosis induced by β1-AA in H9c2 cells.
Autophagy; β1-adrenergic receptor autoantibodies; H9c2 cell; Apoptosis
国家自然科学基金(项目编号:31401006);山西省应用基础研究项目(项目编号:201601D021146);
030001 山西省太原市,山西医科大学基础医学院生理学系,细胞生理学山西省重点实验室(李杨、刘慧荣),病理教研室(乔爱秀、徐云云、王晓晖、王丽);首都医科大学基础医学院生理学与病理生理学教研室(刘慧荣)
王丽,E-mail:mirror0117@126.com;刘慧荣,E-mail:liuhr2000@126.com
,ebook=93
10.3969/j.issn.1672-5301.2017.03.023
R542.2
A
1672-5301(2017)03-0279-05
2016-11-06)
山西医科大学博士启动基金(项目编号:B03201202)
