甘精胰岛素与非甘精胰岛素对糖尿病患者患前列腺癌风险的荟萃分析
2017-09-03申慧青马志方
曾 胜 申慧青 李 伟 马志方
山西医科大学第一医院泌尿外科(山西太原 030001)
甘精胰岛素与非甘精胰岛素对糖尿病患者患前列腺癌风险的荟萃分析
曾 胜 申慧青 李 伟 马志方*
山西医科大学第一医院泌尿外科(山西太原 030001)
目的甘精胰岛素能增加糖尿病(diabetes Mellitus,DM)患者患前列腺癌(prostate cancer,PCa)风险,但这些研究的结果具有争议性。因此,我们进行了Meta分析,以确定甘精胰岛素是否会增加DM患者PCa的发病率。方法检索Pubmed、Cochrane library和EMbase 3个数据中2000年至2016年的英文文献,收集了甘精胰岛素与DM患者PCa发病风险的相关研究,按纳入与排除标准筛选,并对纳入文献进行质量评价。应用RevMan 5.0软件,用固定效应模型或随机效应模型计算相对风险(RR)和相应的95%可信区间(CI),同时进行亚组分析。结果15篇文献纳入Meta分析,研究对象有647 517 人,其中PCa患者有6 049人。甘精胰岛素与非甘精胰岛素相比,在引起PCa发病率上没有显著差异(RR=1.00,95%CI=0.93~1.08,I2=0%,P=0.95)。结论我们分析的结果表明:甘精胰岛素与非甘精胰岛素相比,不会明显增加2型DM患者患PCa的发病率。但DM患者PCa的发生还受DM严重程度、种族等多种因素的影响,需要更进一步的研究证实。
胰岛素; 糖尿病; 前列腺肿瘤; Meta分析
PCa是欧美国家男性生殖系统中最常见的恶性肿瘤,其死亡率居男性癌症死亡率的第二位,仅次于肺癌[1]。引起PCa的具体原因不清楚,与肥胖、种族、饮食习惯、吸烟、遗传等因素有关,可能还与DM有关[2, 3]。
DM促进PCa发生的原因目前仍不明确,研究发现可能与高血糖、肥胖和高胰岛素血症等因素有关[4,5],而同时治疗DM的药物也引起了人们的关注。研究发现,胰岛素能促进细胞分裂和复制,作为长效胰岛素,甘精胰岛素促进细胞的分裂和增殖的能力更强,还能抑制细胞凋亡,并且相对于胰岛素,甘精胰岛素对胰岛素受体的亲和力更高,而多种癌细胞都表达胰岛素受体。2009年6月欧洲DM学会在线发表了来自德国、瑞典、苏格兰及英国的4项大规模回顾性研究结果,提示使用甘精胰岛素的患者肿瘤发生风险增加,一时间胰岛素及其类似物增加肿瘤发病风险的推测成为国内外学者的关心研究热点[6-9]。随后许多观察性研究调查了甘精胰岛素与PCa发病率的关系,但这些研究结果具有争议性[10-14],同时Karlstad等[15]、Du等[16]Meta分析了甘精胰岛素与PCa发病风险的关系,但是他们纳入的文献数量少,而且Du等纳入的文献里有一篇Meta分析,这在很大程度上降低了研究结果的可信度。所以我们再一次进行Meta分析来评估甘精胰岛素与DM患者PCa发病风险的关系。
资料与方法
一、文献检索和纳入标准
检索Pubmed、Cochrane library和EMbase等数据库。检索时间从2000年到2016年,检索词包括:cancer、cancers、tumor、tumors、carcinoma、neoplasm、neoplasms、neoplasia、glargine、insulin glargine、randonized controlled trial、cohort、case-control studies。为了避免丢失重要文献,没有限制“前列腺”或“PCa”,因为很多研究调查了甘精胰岛素对不同癌症发病风险的影响(不只是对PCa)。检索文献仅限于英文文献。文献筛选先阅读文章标题、摘要,并按照排除标准,在剔除与本研究无关的文献后,获取可能符合的临床随机对照研究、队列研究全文、病例对照研究,我们也手动搜索其他潜在相关研究的文献,与该领域的专家进行了咨询。我们的Meta分析纳入文献遵循以下标准:(1)病例对照研究和临床随机对照研究; (2)患有1型DM或2型DM;(3)有研究DM患者患PCa的风险 ;(4)研究对象分为实验组和对照组。实验组:使用甘精胰岛素的DM患者,对照组:使用非甘精胰岛素的DM患者,见表1。
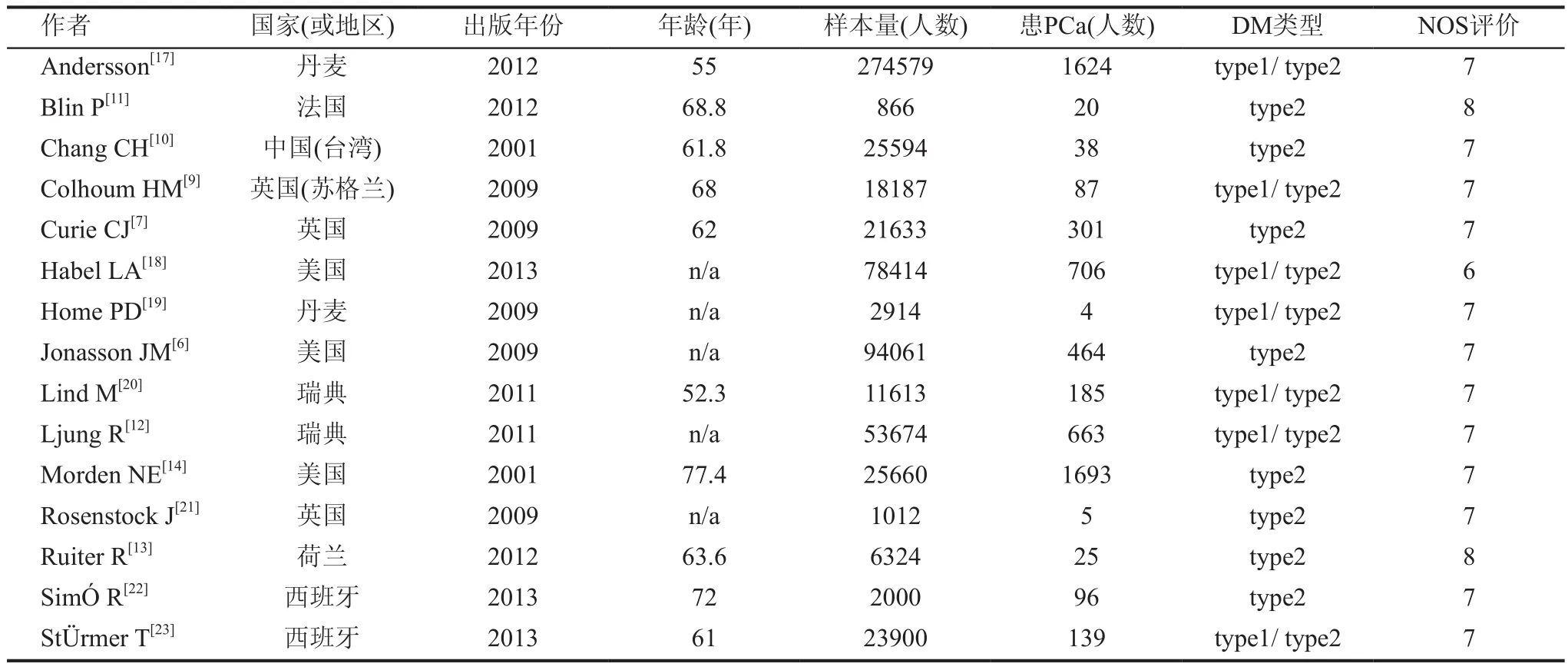
表1 纳入Meta分析的相关文献
二、数据提取
两名研究者(曾胜、申慧青)独立提取数据,讨论分歧,并对所有项目达成共识。我们所提取数据的项目有:第一作者姓名、国家或地区、文献见刊年份、样本量(人)、患PCa(人)、DM类型、偏倚风险评价。这些研究来自于不同的种族和国家,为了尽可能较全面的纳入文献,我们没有限定将要纳入Meta分析的研究的最少样本数。 当两个研究者讨论有分歧时,则与第三位研究者(马志方)一起讨论解决,并达成共识。
三、统计分析
采用Cochrane协作网RevMan 5.0软件,对收集的资料进行分析。通过计算分析相对风险(RR)和相应的95%可信区间(CI)来评估甘精胰岛素与患PCa风险的关系,对于Q检验,P值<0.10,在统计学上认为有显著差异;对于I2检验(I2:0%~25%),在统计学上认为差异不显著(I2:25.1%~50%),认为差异较低(I2:50.1%~75%),认为具有中度差异(I2:75.1%~100%),认为差异性较高。我们用用固定效应模型或随机效应模型来进行统计分析,当I2<50%时,用固定效应模型,反之则用随机效应模型。
此外我们还进行了亚组分析:(1)研究对象的平均年龄(65<、≥65);(2)DM类型(2型DM、 1或2型DM)2个亚组。
结 果
一、检索结果
检索到135篇文献,排除重复文献及阅读文献标题和摘要后有17篇文献初步符合纳入标准,阅读全文后,排除缺失重要数据文献和未能查找到全文文献,最终有15篇文献[6,7,9-14,17-23]符合我们系统评价要求,研究对象共有647 517 人,其中有6 049人患PCa。15篇文献中有11篇文献来自欧洲国家,3篇来自美国,1篇来自中国台湾;研究对象平均年龄≥65岁的有4篇文献,<65岁的有6篇文献(有5篇文献研究对象的平均年龄数据缺失);研究对象患2型DM的文献有9篇,研究对象患1型或2型DM的文献有6篇。偏倚风险评价(newcastle-ottawa scale, NOS)评分最低6分,最高8分(6分的有1篇文献,8分的有3篇文献,其余文献为7分),见图1。
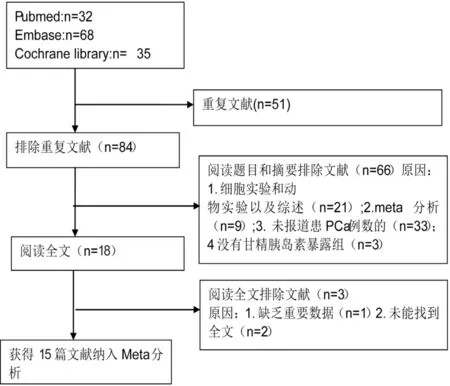
图1 文献筛选流程
二、Meta分析
由于异质性高(图2,RR=0.89,95%CI=0.75-1.05,I2=57%,P=0.003),我们选用随机效应模型,排除Habel LA.et al后,异质性为0(图3,RR=1.00,95%CI=0.93~1.08,I2=0%,P=0.95)。Meta分析结果表明,甘精胰岛素与非甘精胰岛素相比,不明显增加DM患者患PCa的风险。我们还从研究对象的年龄和患糖尿病的类型进行了亚组分析。患者处于年龄段(<65岁或≥65岁)时(图4,I2=33%,P=0.56; I2=0%,P=0.79),甘精胰岛素与非甘精胰岛素相比DM患者患PCa风险没有显著差异。研究对象只患2型DM(图5,I2=0%,P=0.87)时,甘精胰岛素与非甘精胰岛素相比DM患者患PCa风险没有显著差异;而研究对象患有1型DM或2型DM(图5,I2=75%,P=0.0004)时, 甘精胰岛素与非甘精胰岛素相比DM患者患PCa风险增高。

图2 甘精胰岛素VS非甘精胰岛素,DM患者患PCa风险

图3 甘精胰岛素VS非甘精胰岛素,DM患者患PCa风险

图4 年龄,甘精胰岛素VS非甘精胰岛素,DM患者患PCa风险
三、发表偏倚
用漏斗图和Begg检验评估纳入文献的发表偏倚,结果显示P=0.163(P>0.05),不存在发表偏倚,见图6。
讨 论
流行病学研究发现,体内胰岛素生长因子-1(insulin-like growth factor-1, ICF-1)能促进PCa、乳腺癌细胞的增殖,而研究表明甘精胰岛素及胰岛素等能调控ICF-1受体的活性[24]。体外实验表明,甘精胰岛素能促进PCa的PC3等细胞系进行有丝分裂[25]。德国一项研究发现,注射胰岛素的DM患者相对于服用二甲双胍的DM患者,具有更高的患癌率,但是相对胰岛素及其胰岛素类似物,并没有差异[26]。目前大量单个研究大幅报道胰岛素及其类似物使用与癌症风险,但许多研究的方法不一,研究的样本量少,不能得出一个明确可靠的结论,Meta分析可以通过定量的方式,将多个单中心的研究结果进行合并,从而提高结论的可靠性。本研究采用Meta分析的方法比较甘精胰岛素与非甘精胰岛素引起DM患者患PCa的差异。

图5 DM类型,甘精胰岛素VS 非甘精胰岛素,DM患者患PCa风险
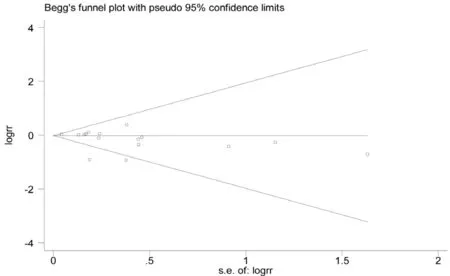
图6 15篇纳入文献的Begg漏斗图
我们进行了Meta分析。异质性高,选用随机效应模型,然而排除Habel等[22]的文献后,异质性为0,说明这篇文献是异质性的主要来源,可能与Habel等设计研究对象纳入标准较低和实验组甘精胰岛素暴露时间短有关。我们研究结果表明甘精胰岛素与非甘精胰岛素相比,DM患者患PCa的发病率并没有显著差异。理论上分析甘精胰岛素的致癌风险时发现,与体外环境不同,甘精胰岛素在体内迅速代谢成为与其本身有同等代谢作用的产物环已基羟甲基衍生物(M1)、羧化衍生物(M2),而后两者与IGF-1受体亲和力很低;体内甘精胰岛素及M1、M2共同起作用的情况下,其总体与IGF-1结合力甚至低于人胰岛素;且体内自身的IGF-1有更强的竞争性结合IGF-1受体的能力,也不支持甘精胰岛素致癌的可能性[27]。同时我们还亚组分析了年龄、DM类型对患PCa风险的影响。结果表明:患者处于<65岁或≥65岁年龄段时, 甘精胰岛素与非甘精胰岛素相比,DM患者患前列腺癌风险没有显著差异。PCa在老年人中高发,在55岁以下很少发生,这与年龄的变化从而影响生理代谢系统有关。但近年来PCa的发生越来越年轻化,可能与生活方式的改变和PSA筛查率的提高有关[28]。根据DM类型的不同进行亚组进行分析,当研究对象只患2型DM时,结果表明甘精胰岛素相对非甘精胰岛素不会增加PCa发病风险,但研究对象未区分DM类型时,分析结果表明,甘精胰岛素相对非甘精胰岛素会增加PCa风险。DM类型不同对PCa发病风险的影响也不同,Kasper等[29]研究发现DM能降低PCa的发病率,在老年人中比在年轻人中更明显,尤其在30岁前就诊断为DM(1型DM)的老年人。
有些研究者为了探讨甘精胰岛素对患前列腺的影响,设计了不同的研究方案。Fagot等[30]在不同浓度的甘精胰岛素对患癌风险的研究中发现,不同浓度的甘精胰岛素对PCa的发生并没有影响;而一个小样本的病例对照研究发现,当高浓度的甘精胰岛素用量使患癌风险增高5倍,而在其他胰岛素及其类似物的患者中并没有观察到[31]。Bordeleau等[32]研究了甘精胰岛素与n-3脂肪酸对患癌风险的影响,发现甘精胰岛素不会增加癌症(包括PCa)发生率及其特异性死亡率。Chen等[33]在研究胰岛素治疗与患PCa风险的荟萃分析中,分析了混杂因素的多少(≤5、>6)对使用甘精胰岛素的糖尿病患者患PCa风险的影响,说明了前列腺癌的发生是个多因素的过程,相对于其他降糖药物而言,胰岛素的使用与患PCa风险增加并没有显著的相关性。
本文Meta分析的不足:(1)我们没有搜索未发表的研究,只分析了已发表的研究,同时还有2个研究未找到全文,这导致一定的偏倚;(2)我们纳入的研究中来源亚洲或中国的较少,导致这部分数据缺失,因种族和饮食的不同,患PCa的风险也不一样,降低了结论的可靠性;(3)我们没有亚组分析肥胖对患PCa的影响,肥胖对PCa和DM的发生都有一定影响,这会对结论产生一定的影响;最后,纳入研究的DM患者的严重程度是不一样的,由于原始文献这方面数据缺失,没进行亚组分析。
甘精胰岛素是临床上常用的降糖药,它的安全性受到临床和公共健康的关注。 甘精胰岛素与非甘精胰岛素在引起PCa发生上无显著差异,这在一定程度上减轻DM患者及卫生保健人士的焦虑和担心。但是PCa的发生,受DM的严重程度、种族、肥胖和随访时间的影响,因此仍需要多中心、大样本的研究,以更好的评估甘精胰岛素与非甘精胰岛素对PCa发病率的影响。
PCa的发生受多个因素影响,根据我们分析的结果表明,甘精胰岛素与非甘精胰岛素相比,2型DM患者患PCa的风险没有差异,但是对于糖尿病患者,尤其是年老的糖尿病患者而言,有规律的随访并检测PSA值、睾酮水平是必要的,有经济条件的患者可行前列腺MRI检查,对于怀疑患有PCa的DM患者,可行前列腺穿刺,尽早确诊和治疗。
1 Smith MR, Lee H, Nathan DM. Insulin sensitivity during combined androgen blockade for prostate cancer. J Clin Endocrinol Metab 2006; 91(4): 1305-1308
2 Wang M, Hu RY, Wu HB, et al. Cancer risk among patients with type 2 diabetes mellitus: a population-based prospective study in China. Sci Rep 2015; 5: 11503
3 Onitilo AA , Engel JM, Glurich I. et al. Diabetes and cancer I: risk, survival, and implications for screening. Cancer Causes Control 2012; 23(6): 967-981
4 DeFronzo RA, Bonadonna RC, Ferrannini E. Pathogenesis of NIDDM. A balanced overview. Diabetes Care 1992; 15(3): 318-368
5 Onitilo AA , Stankowski RV, Berg, RL, et al. Type 2 diabetes mellitus, glycemic control, and cancer risk. Eur J Cancer Prev 2014; 23(2): 134-140
6 Jonasson JM, Ljung R, Talback M, et al. Insulin glargine use and short-term incidence of malignancies-a population-based follow-up study in Sweden. Diabetologia 2009; 52(9): 1745-1754
7 Currie CJ, Poole CD, Gale EA. The infuence of glucoselowering therapies on cancer risk in type 2 diabetes. Diabetologia 2009; 52(9): 1766-1777
8 Hemkens LG, Grouven U, Bender R. et al. Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues: a cohort study. Diabetologia 2009; 52(9): 1732-1744
9 Colhoun HM, SDRN Epidemiology Group. Use of insulin glargine and cancer incidence in Scotland: a study from the Scottish Diabetes Research Network Epidemiology Group. Diabetologia 2009; 52(9): 1755-1765
10 Chang CH, Toh S, Lin J W. et al. Cancer risk associated with insulin glargine among adult type 2 diabetes patients--a nationwide cohort study. PloS One 2011; 6(6): e21368
11 Blin P, Lassalle R, Dureau-Pournin C, et al. Insulin glargine and risk of cancer: a cohort study in the French National Healthcare Insurance Database. Diabetologia 2012; 55(3): 644-653
12 Ljung R, Talback M, HaglundB, et al. Insulin glargine use and short-term incidence of malignancies - a three-year population-based observation. Acta Oncol 2011; 50(5):685-693
13 Ruiter R, Visser LE, van Herk-Sukel MP, et al. Risk of cancer in patients on insulin glargine and other insulin analogues in comparison with those on human insulin: results from a large population-based follow-up study. Diabetologia 2012; 55(1): 51-62
14 Morden NE, Liu SK, Mavkezie TA, et al. Futher exploration of the relationship between insulin glargine incident cancer. Diabetes Care 2011; 34(9): 1971
15 Karlstad O, Starup-Linde J, Vestergaard P, et al. Use of isulin and Insulin Analogs and Risk of Cancer- Systematic eview and Meta-Analysis of Observational Studies. Curr Drug Saf 2013; 8(5): 33-348
16 Du X, Zhang R, Xue Y, et al. Insulin glargine and risk of cancer: a meta-analysis. Int J Biol Markers 2012; 27(3): e241-e246
17 Andersson C, Vaag A, Selmer C, et al. Risk of cancer in patients using glucose-lowering agents: a nationwide cohort study of 3.6 million people. BMJ Open 2012; 2(3). pii: e000433
18 Habel LA, Danforth KN, Quesenberry CP, et al. Cohort study of insulin glargine and risk of breast, prostate,and colorectal cancer among patients with diabetes. Diabetes Care 2013; 36(12): 3953-3960
19 Home PD, Lagarenne P. Combined randomised controlled trial experience of malignancies in studies using insulin glargine. Diabetologia 2009; 52(12): 2499-2506
20 Lind M, Fahlen M, Eliasson B, et al. The relationship between the exposure time of insulin glargine and risk of breast and prostate cancer: an observational study of the time-dependent effects of antidiabetic treatments in patients with diabetes. Prim care Dabetes 2012; 6(1): 53-59
21 Rosenstock J, Fonseca V, McGill JB, et al. Similar risk of malignancy with insulin glargine and neutral protamine Hagedorn (NPH) insulin in patients with type 2 diabetes: findings from a 5 year randomised, open-label study. Diabetologia 2009; 52(9): 1971-1973
22 SimÓ R. Puente D. Morros R, et al. Impact of glucoselowering agents on the risk of cancer in type 2 diabetic patients. The Barcelona case-control study. PloS One 2013; 2(3).pii: e79968
23 Stürmer T, Marquis MA, Zhou H, et al. Cancer incident among those initiating insulin therapy with glargine versus Human NPH insulin. Diabetes Care 2013; 36(11): 3517-3525
24 Shukla A, Grisouard J, Ehemann V, et al. Analysis of signaling pathways related to cell proliferation stimulated by insulin analogs in human mammary epithelial cell lines. Endocr Relat Cancer 2009; 16(2): 429-441
25 Weinstein D, Simon M, Yehezkel E, et al. Insulin analogues display IGF-1-like mitogenic and anti-apoptotic activities in cultured cancer cells. Diabetes Metab Res Rev 2009; 25(1): 41-49
26 Lutz SZ, Staiger H, Fritsche A, et al. Antihyperglycaemic therapies and cancer risk. Diab Vasc Dis Res 2014; 11(6): 371-389
27 Sommerfled MR, MÜnter G, Tschank G, et al. In vitro metabolic and mitogenic signaling of insulin glargine and its metabolic. PLoS ONE 2010; 5(3): e9540
28 Siegel RL, Miller KD, Jemal A, et al. Cancer statistics, 2016. CA Cancer J Clin 2016; 66(1): 7-30
29 Kasper JS, Liu Y, Pollak MN, et al. Hormonal profle of diabetic men and the potential link to prostate cancer. Cancer Causes Control 2008; 19(7): 703-710
30 Fagot JP, Blotiere PO, Ricordeau P, et al. Dose insulin glargine increase the risk of cancer compared with other basal insulin? : A French nationwide cohort study based on national administrative databases. Diabetes Care 2012; 36(2): 294-301
31 Mannucci E, Monami M, Balzi D, et al. Doses of insulin and its analogues and cancer occurrence in insulin-treated type 2 diabetic patients. Diabetes Care 2010; 33(9): 1997-2003
32 Bordeleau L, Yakubovich N, Dagenais GR, et al. The association of basal insulin glargine and/or n-3 fatty acids with incident cancers in patients with dysglycemia. Diabetes Care 2014; 37(5): 1360-1366
33 Chen YB, Chen Q, Wang Z, et al. Insulin therapy and risk of prostate cancer: a systematic review and meta-analysis of observational studies. PloS One 2013; 8(11): e81594
(2017-03-06收稿)
Meta analysis of the incidence of prostate cancer in diabetes patients treated with glargine insulin or non- glargine insulin
Zeng Sheng, Shen Huiqing, Li Wei, Ma Zhifang*Department of Urology, the First Hospital of Shanxi Medical University, Taiyuan 030001, Shanxi, China Corresponding author: Ma Zhifang, E-mail: zhifangma@163.com
ObjectiveThere has been some debate on whether insulin glargine increases the incidence of prostate cancer in patients with diabetes. Here we performed a meta-analysis to determine effects of glargine insulin on the incidence of prostate cancer in patients with diabetes.MethodsUsing Pubmed, Cochrane library and EMbase, we retrieved the published English literatures from 2000 to 2016 related to prostate cancer risk in diabetes patients treated with insulin glargine. According to the inclusion and exclusion criteria, we evaluate the quality of literatures. Using the RevMan 5 software and the fxed effect model or random effects model, we calculated the relative risk (RR) and the corresponding 95% confdence interval (CI) .ResultsFifty articles were included in the meta analysis. The study subjects were 647517 people, including 6049 patients with prostate cancer. There was no signifcant difference in the incidence of prostate cancer (RR=0.96, 95%CI=0.89-1.01, P=0.2) between glargine insulin group and non-glargine insulin group.ConclusionThe results indicate that glargine insulin does not signifcantly increase the incidence of prostate cancer in patients with diabetes compared with non-glargine insulin. However, the incidence of prostate cancer in patients with diabetes may be also associated with the severity of diabetes, race and other factors, which merits to be further investigated.
insulin; diabetes mellitus; prostatic neoplasms; Meta-analysis
10.3969/j.issn.1008-0848.2017.03.004
R 737.25; R 587.1
*通讯作者,E-mail: zhifangma@163.com
