Wnt经典通路β-catenin过表达对人牙周膜干细胞增殖能力及成骨能力的影响
2017-08-27李影刘娜张维顾斌
李影刘娜张维顾斌
Wnt经典通路β-catenin过表达对人牙周膜干细胞增殖能力及成骨能力的影响
李影刘娜张维顾斌
目的:探讨Wnt经典通路β-连环蛋白(β-catenin)过表达对人牙周膜干细胞(periodontal ligament stem cells,PDLSCs)增殖能力及成骨能力的影响。方法:收集因治疗需要拔除的健康前磨牙和第三磨牙8颗,分离、培养PDLSCs。通过构建慢病毒过表达载体,转染β-catenin基因使实验组过表达β-catenin。转染后显微镜下观察常规培养及成骨诱导7d后细胞形态;MTT测定转染前后PDLSCs的增殖情况;实时定量PCR技术检测淋巴增强因子-1(LEF1)、T淋巴细胞因子-4(TCF4)、Runt相关转移因子-2(Runt-related transcription factor 2,Runx2)、碱性磷酸酶(alkaline phosphatase,ALP)、人I型胶原蛋白-1(Colossians 1,COL-1)及P38丝裂原活化蛋白激酶(P38mitogen activated protein kinases,P38 MAPK)mRNA表达。成骨诱导7d后,提取RNA,检测成骨相关基因Runx2、ALP、COL-1、P38 MAPK mRNA表达。结果:转染后细胞表达绿色荧光(green fluorescent protein,GFP)。MTT结果示:β-catenin过表达组PDLSCs增殖能力较空转染组增强。β-catenin过表达组LEF1表达水平显著上升(P<0.05),TCF4表达水平无显著性差异(P>0.05);与空转染组相比β-catenin过表达组成骨诱导7d后Runx2、ALP、COL-1及P38表达水平显著降低(P<0.05)。结论:经典Wnt/β-catenin通路在PDLSCs增殖及成骨分化过程中发挥重要作用,核心蛋白β-catenin过表达可上调LEF1的表达促进PDLSCs的增殖能力,并可通过下调RUNX2、ALP、COL-1、P38的表达抑制其成骨能力。
PDLSCs;经典Wnt通路;β-catenin;增殖能力;成骨能力
干细胞是维持组织器官正常再生能力的重要基础。2004年,Seo首次从牙周膜中分离出人牙周膜干细胞(periodontal ligament stem cells,PDLSCs),其具有成体干细胞共有的特性,具有多向分化及自我更新能力,体内可形成牙周膜-牙骨质样结构,是牙周组织再生修复的理想种子细胞[1]。最新的动物模型和小规模试点可行性研究表明,PDLSCs可以作为修复牙周组织缺损的种子细胞[2]。PDLSCs在牙周组织生理功能维持与病理损伤修复中的重要作用及其牙周再生方面潜在的巨大应用前景,为PDLSCs生物学及其相关研究提供了新的契机[3]。
大量研究表明经典Wnt/β-catenin信号通路在干细胞成骨分化过程中发挥重要作用[4-5]。本课题组前期针对PDLSCs进行了抑制β-catenin的相关研究,发现β-catenin siRNA可特异性抑制PDLSCs中β-catenin基因表达,并明显抑制细胞增殖[7]。此外,本课题组前期研究发现,炎症微环境作用下经典/非经典Wnt通路在PDLSCs成骨分化过程中均发挥重要作用,抑制β-catenin可在一定程度上激活非经典Wnt/Ca2+通路,从而促进干细胞的成骨分化。但是,β-catenin发挥在PDLSCs成骨分化过程中的具体作用机制尚未被阐明。
本研究构建经典Wnt信号通路核心蛋白β-catenin过表达载体,进一步深入研究Wnt经典通路β-catenin过表达对PDLSCs增殖能力及成骨能力的影响,以期通过对β-catenin的调控来增强PDLSCs的成骨能力,为牙周组织再生提供新思路,为PDLSCs的临床应用奠定实验基础。
1.材料和方法
1.1 主要试剂和材料胎牛血清、α-minimum essential medium(α-MEM)培养基(Gibco,美国);0.25%胰蛋白酶(Sigma,美国);青链霉素(Gibco);链霉素(Gibco);慢病毒包装体系(含293T细胞、转染试剂)KLV3504、polybrene(北京英茂盛业公司);实时定量PCR仪(IQ5,美国);RNA抽提试剂盒及反转录试剂盒(Fermentas,美国);反转录聚合酶链反应试剂盒(RR037A,Takara,日本)、实时定量PCR试剂盒(AQ131,全式金)、MTT试剂盒(Takara,日本);β-catenin兔抗人单克隆抗体、羊抗兔IgG抗体(北京中杉金桥公司);荧光显微镜(奥林巴斯)。
1.2 实验方法本研究经中国人民解放军总医院伦理委员会批准(批准号:IACUC-2015048),所有受试者均签署了知情同意书。
1.2.1 离体牙样本收集实验所用离体牙均取自口腔颌面外科门诊。正常牙周膜组织来源于8名20-30岁因正畸需要拔除无龋前磨牙及第三磨牙的患者,男女各半。所有纳入个体均无系统性疾病及已知的可以影响牙周状况的疾病,无吸烟史,近6个月无特殊服药史。
1.2.2 牙周膜干细胞的体外培养PDLSCs的获取遵循本实验室前期的实验步骤[4]。在超净工作台内将拔除后2小时内的牙齿经0.01mol/L PBS冲洗3-5次后,自牙冠至牙根方向单向刮取牙根中下1/3部分的牙周膜,修剪组织块为1mm3大小,用0.25%EDTA-胰酶消化6min后,等量培养液终止消化,离心管内的组织离心800r/min,6min。弃上清后重悬并放置在6孔板中(含10% FBS、100单位/mL青霉素/链霉素的α-MEM培养基)。在37℃、5%CO2饱和湿度条件下培养5-8d,直至有细胞从组织块边缘爬出。细胞生长达约80%汇合时用胰酶消化传代,标记为第一代。采用有限稀释法克隆化培养分离人正常组织来源的PDLSCs,采用第3代细胞进行实验。
1.2.3 细胞分组及转染将牙周膜干细胞各分成3组:空白对照组-未经任何处理的PDLSCs;空转染组-转染空载质粒;β-catenin过表达组-转染过表达β-catenin载体。各组样本量为3。人β-catenin(NM_001098209)(Inovogen Tech公司)。将转染试剂稀释液(转染试剂20μl,DMEM无血清培养基480μl),加入质粒DNA溶液(慢病毒载体5μg Polyfect-V,pH1载体3.75μg DMEM,pH2载体1.25μg,DMEM无血清培养基490μl)中,立刻充分混匀;室温孵育转染混合液15min;消化HEK293T细胞,用293T培养基制备成0.6×106/ml细胞悬液,将细胞悬液放入15ml离心管备用;将每1ml转染混合液加入10ml细胞悬液(密度调整为2×105),轻轻吹吸细胞混匀;将细胞悬液加入10cm培养皿,放入37℃培养24h;去除含有转染试剂的培养基,用10ml病毒培养基换液;转染后48h收集细胞培养上清。500g离心10min去除细胞碎片,即为病毒液;将PDLSCs调整2×105密度接种于6孔板,待细胞贴壁后换无双抗的培养液(含10%FBS)至细胞密度达到60%左右进行转染;将适量病毒液和polybrene用细胞培养基稀释,加入细胞培养皿中;继续培养24h,用新的完全培养基替换病毒感染液;病毒感染后48h在荧光显微镜下观察,观察转染效果。
1.2.4 成骨诱导试验将第p3代空转染组及β-catenin过表达组的PDLSCs以2×106密度接种于6孔板,10%FBS的α-MEM 37℃、5%CO2饱和湿度条件下培养24h-48h,待细胞伸展至70%汇合后换矿化诱导液(含5mmol/L β-甘油磷酸钠,50mg/L维生素C,1×108mol/L地塞米松、10% FBS的α-MEM培养液)连续培养,隔4d换液,7d后收集细胞进行检测。
1.2.5 实时定量PCR检测分别提取常规培养条件及成骨诱导条件下转染前后的RNA,并测定RNA浓度,分别反转录为cDNA。反转录所得cDNA采用Syber Green荧光定量PCR检测试剂盒进行荧光定量PCR检测,反应体系均为20μl。引物序列:GAPDH,上游引物:5′-TCTGACGAC TCTGCTTCACG-3′,下游引物:5′-TTCAGGG CATGTGTGATGCT-3′;LEF-1,上游引物:5′-GG CCCCTCCTACTCCAGTTA-3′,下游引物:5-TA GACATGCCTTGCTTGGGG-3′;TCF-4,上游引物:5′-ATGCATGGGATCATCGGACC-3′;下游引物:5′-GGTCAGCCAACTCGTCACAGTC-3′;Runx2,上游引物:5′-CCCGTGGCCTTCAAG GT-3′,下游引物:5′-CGTTACCCGCCATGACA GTA-3′;ALP,上游引物:5′-ATGTCAACCGA AACGCCTCAG-3′,下游引物:5′-ATGGCGGA GTCGAACATGGCA-3′;COL-1,上游引物:5′-GCAAGGTGTTGTGCGATGA-3′,下游引物:5′-TGGTCGGTGGGTGACTCTG-3′;
P38 MAPK,上游引物:5′-GAACAAGACC GTCTGGGAGGTGC-3′,下游引物:5′-TTGGC GTGAATGATGGACTGAAA-3′。反应条件:95℃变性3min,95℃30s,60℃1min,40个循环。IQ5型实时荧光定量PCR仪监测记录数据,结果根据标准曲线由软件自动计算后得出。为验证该方法的重复性和扩增效率,本实验进行三次重复。
1.3 统计学分析SPSS22.0统计软件进行相关数据分析,计量资料采用均值±标准差表示。两组间比较采用独立样本t检验;以双侧P<0.05为差异有统计学意义。多组间比较采用卡方检验;以双侧P<0.05为差异有统计学意义,P值进行Bonferroni校正。
2.结果
2.1 β-catenin慢病病毒过表达载体成功转染至PDLSCs转染6h后观察空白对照组、空质粒转染组、β-catenin过表达组的PDLSCs,镜下观察可见6孔板内PDLSCs空质粒转染组及β-catenin过表达组均出现大量细胞凋亡,换为常规培养液后镜下可两组PDLSCs仍伸展贴壁,胞膜胞核清晰可见。转染24h后荧光显微镜下观察可见空质粒转染组(图1B)、β-catenin过表达组(图1C) PDLSCs均显示GFP绿色荧光,这表示已成功完成了β-catenin过表达转染。

图1 转染6h后镜下观察细胞形态(×200)及转染24h后荧光显微镜下观察细胞核GFP注:β-catenin为核表达
2.2 常规培养条件下过表达β-catenin促进PDLSCs增殖常规培养条件下,我们采用MTT法对空转染组及β-catenin过表达组进行连续8d的检测,我们的检测结果显示:β-catenin过表达组细胞吸光值自第3d起与空质粒转染组出现统计学差异,其显增殖活性显著高于空质粒转染组(图2A)。随后为了进一步验证过表达β-catenin对PDLSCs增殖能力的影响我们进一步进行基因水平的检测。我们的研究结果显示:β-catenin过表达组LEF1 mRNA表达水平较空转染组显著性升高(图2B),但两组的TCF4 mRNA表达水平无显著性差异(图2C)。

图2 PDLSCsMTT结果(OD值)及相关基因的表达水平检测A.β-catenin空转染组及β-连环蛋白过表达组的吸光度值。B.空转染组及β-catenin过表达组LEF1 mRNA表达水平。C.空转染组及β-catenin过表达组TCF4mRNA表达水平。与空转染组相比*P<0.05为具有统计学差异。
2.3 过表达β-catenin可抑制PDLSCs的成骨能力成骨诱导7d后采用实时定量PCR检测成骨关键基因ALP、COL-1、P38 MAPK、Runx2 mRNA的表达水平。常规培养条件下,空转染组ALP mRNA的表达量是β-catenin过表达组的1.15倍,成骨诱导后,空转染组ALP mRNA的表达量显著升高,而β-catenin过表达组有一定程度的降低,此时空转染组ALP mRNA的表达量是β-catenin过表达组的4.53倍(图3A)。COL-1是成骨相关标志蛋白,常规培养条件下,β-catenin过表达组COL-1 mRNA的表达量是空转染组的2.57倍,成骨诱导后,空转染组COL-1 mRNA表达量有一定程度的上升,而β-catenin过表达组表达量显著性降低,空转染组COL-1 mRNA的表达量是β-catenin过表达组的1.92倍(图3B)。P38 MAPK信号通路在间充质干细胞向成骨细胞分化过程中发挥重要作用。常规培养条件下,β-catenin过表达组P38mRNA的表达量是空转染组的1.58倍,成骨诱导后,空转染组P38mRNA表达量有一定程度的上升,而β-catenin过表达组表达量有一定程度的降低,空转染组P38 mRNA的表达量是β-catenin过表达组的1.51倍(图3 C)。Runx2是成骨相关的关键基因,常规培养条件下,β-catenin过表达组Runx2 mRNA的表达量是空转染组的2.73倍,成骨诱导后,空转染组Runx2 mRNA表达量显著性上升,而β-catenin过表达组表达量显著性降低,空转染组Runx2 mRNA的表达量是β-catenin过表达组的1.44倍(图3 D)。
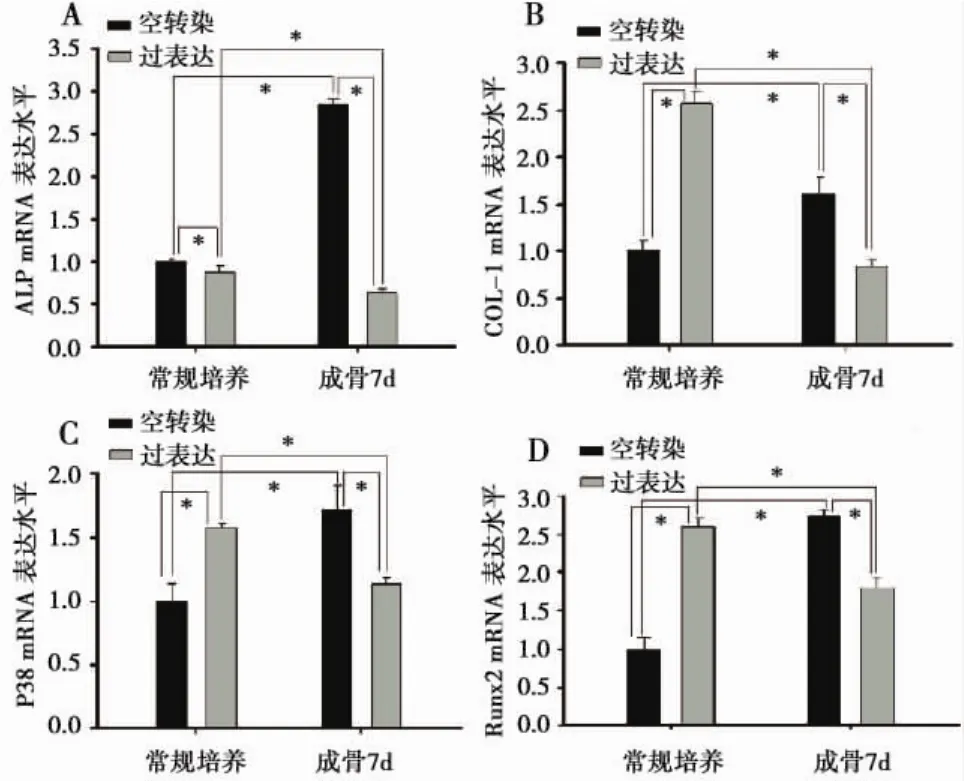
图3 常规培养及成骨诱导7d Real Time PCR检测结果常规培养及成骨诱导7d后ALP(A)、COL-1(B)、P38 MAPK(C)、Runx2(D)mRNA表达水平:空转组成骨诱导前后对比,*P<0.05;β-catenin过表达组成骨诱导前后相比,*P<0.05;常规培养条件下,空转染组与β-catenin过表达组相比,*P<0.05;成骨诱导条件下,空转染组与β-catenin过表达组相比,*P<0.05。
3.讨论
PDLSCs具有良好的增殖能力及多向分化潜能,可以分化为成牙骨质细胞、成纤维细胞、成骨细胞,是牙周组织再生的基础。在牙周组织再生的临床应用中具有广阔的前景。大量研究表明,无论是体内或者体外实验,成牙骨质细胞、成纤维细胞、成骨细胞都具备使牙周支持组织再生的能力[6-9]。传统牙周治疗方法并未取得理想的修复效果。现在很多研究都着眼于将PDLSCs与纳米支架材料相结合,运用于牙周支持组织损伤的治疗。
Wnt信号通路是在机体发育和干细胞分化中发挥重要作用的信号通路。根据是否依赖于β-catenin发挥作用,划分为Wnt经典以及非经典Wnt/Ca2+信号通路。经典Wnt/β-catenin信号通路是调控细胞分化的重要通路,在细胞的成骨分化中发挥重要的作用[10]。在慢性炎症微环境中非经典Wnt信号通路参与牙周膜干细胞的成骨分化[11]。本课题组前期研究结果表明:Wnt经典信号通路与PDLSCs的增殖能力密切相关,抑制Wnt经典信号通路核心蛋白β-catenin可显著抑制PDLSCs的增殖能力[12]。成骨诱导条件下抑制β-catenin可有效的抑制PDLSCs的β-catenin,并可增强Wnt非经典信号通路核心蛋白NLK的表达水平,提高PDLSCs的成骨分化能力。
为了更好的研究Wnt/β-catenin信号通路对PDLSCs成骨能力的影响我们构建了β-catenin过表达载体,经过转染条件的反复探索我们成功完成了细胞的转染。转染后细胞表达GFP,且转染效率稳定可靠,这为后续研究奠定了基础。常规培养条件下,PDLSCs MTT结果显示:与空转染组相比,β-catenin过表达组增殖能力增强,从第3天起出现统计学差异。TCF/LEF是一类有双向调节功能的转录因子,与Groucho结合后可抑制基因的转录,结合β-catenin后则可以促进基因的转录。有文献提示LEF1是Wnt信号通路中重要的核内转录因子属于LEF/TCF家族,其通过募集β-catenin,形成β-catenin-LEF/TCF复合物激活下游靶基因,从而介导Wnt信号通路[13]。TCF4是此家族的重要成员,作为核内转录因子可携带上游信号分子β-catenin入核,启动cyclin D1、c-myc等靶基因的表达,是核内基因调控的重要分子。qPCR结果显示:β-catenin过表达组LEF1 mRNA表达水平为空转染组的2.4倍,具有统计学差异。TCF4 mRNA表达水平较空转染组无显著性差异。我们推测β-catenin促进干细胞增殖可能与LEF1密切相关,可能与TCF4无直接联系。
成骨诱导后,β-catenin过表达组RUNX2 mRNA表达水平较常规培养条件下有一定程度的下降。可能是因为β-catenin过表达抑制了PDLSCs的成骨能力。有研究表明Smad可上调成骨细胞特异性转录因子Runx2、Osx等的表达,从而增强成骨细胞ALP和OCN的表达。以促进成骨细胞的分化和成熟[14]。常规培养条件下,β-catenin过表达组Runx2的表达水平较空转染组显著性增加,这可能与Smad蛋白家族的高表达有关。β-catenin过表达,牙周膜干细胞大量增殖,会导致Smad蛋白水平显著性增加,从而促进了与之协同作用的Runx2的表达水平显著性增加。具体机制有待进一步探究。COL-1是成骨的标志蛋白。成骨诱导培养条件下,β-catenin过表达组COL-1 mRNA的表达水平降低,证实了β-catenin过表达可抑制PDLSCs的成骨分化能力。常规培养条件下COL-1 mRNA的表达水平显著性增加,这可能是因为β-catenin过表达增强了PDLSCs的增殖能力,细胞大量增殖,分泌的细胞外基质中COL-1水平显著增加。ALP是成骨细胞的一种细胞表面标志性酶。对干细胞成骨诱导后,碱性磷酸酶表达有一定程度的增强。成骨诱导后,空转染组的ALP mRNA的表达水平显著性升高,β-catenin过表达组ALP mRNA表达水平显著降低。这可能是因为高表达的β-catenin抑制了干细胞的成骨分化。P38 MAPK信号通路在间充质干细胞向成骨细胞分化过程中发挥重要作用。成骨诱导培养条件下,空转染组的P38 mRNA的表达水平显著性升高,β-catenin过表达组P38 mRNA表达水平显著降低。大量研究结果表明,P38 MAPK可促进PDLSCs成骨能力,抑制P38 MAPK可降低其成骨能力[15-16]。P38 MAPK是干细胞成骨分化的重要标志,β-catenin过表达P38 mRNA表达水平显著降低,表明β-catenin过表达抑制了PDLSCs的成骨分化能力。通过上述结果我们发现β-catenin过表达可抑制PDLSCs的成骨分化能力。
综上,本研究结果表明在干细胞增殖及成骨分化过程中经典Wnt/β-catenin信号通路发挥关键作用,过表达β-catenin可增强PDLSCs的增殖能力,抑制PDLSCs的成骨分化能力。这为我们对PDLSCs的临床应用的研究提供了新的实验基础。
[1]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontalligament. Lancet.2004,364(9429):149-155
[2]Feng F,Akiyama K,Liu Y,et al.Utility of PDL progenitors for in vivo tissue regeneration:a report of 3 cases[J].Oral Dis, 2010,16:20-28
[3]贺慧霞,刘洪臣.牙周膜干细胞生物学研究新进展[J].中华老年口腔医学杂志,2010,8(3):176-179
[4]Liu N,Shi S,Deng M,et al.High levels of β-catenin signaling reduce osteogenic differentiation of stem cells in inflammatory microenvironments through inhibition of the noncanonical Wnt pathway[J].J Bone Miner Res,2011,26: 2082-2095
[5]Liu Y,Liu W,Hu C,et al.MiR-17modulates osteogenic differentiation through a coherent feed-forward loop in mesenchymal stem cells isolated from periodontal ligament of patients with periodontitis[J].Stem Cells,2011,29:1804-1816 [6]Dogˇan A,Ozdemir A,Kubar A,et al.Assessment of periodontal healing by seeding of fibroblast-like cells derived from regenerated periodontal ligament in artificial furcation defects in a dog:a pilot study[J].Tissue Eng,2002,8:273-282
[7]Dogˇan A,Ozdemir A,Kubar A,et al.Healing of artificial fenestration defects by seeding of fibroblast-like cells derived from regenerated periodontal ligament in a dog:a preliminary study[J].Tissue Eng,2003,9:1189-1196
[8]Nakahara T,Nakamura T,Kobayashi E,et al.In situ tissue engineering of periodontal tissues by seeding with periodontal ligament-derived cells[J].Tissue Eng,2004,10:537-544
[9]Bruckmann C,Walboomers XF,Matsuzaka K,et al.Periodontal ligament and gingival fibroblast adhesion to dentinlike textured surfaces[J].Biomaterials,2005,26:339-346
[10]Yu B,Chang J,Liu Y,et al.Wnt4 signaling prevents skeletal aging and inflammation by inhibiting nuclear factor-κB [J].Nature Medicine,2014,20(9):1009-1017
[11]刘娜,李华,张洋,等.炎症微环境作用下非经典Wnt/Ca2+信号通路对牙周膜干细胞成骨分化的影响[J].中华老年口腔医学杂志,2015,13(5):257-262
[12]刘娜,李华,李晓光,等.siRNA沉默β-连环蛋白对人牙周膜干细胞增殖能力的影响[J].口腔颌面修复学杂志,2015,(5):257-262
[13]Ling L,Nurcombe V,Cool SM.Wnt signaling controls the fate of mesenchymal stem cells[J].Gene,2009,433:1-7
[14]Lee KS1,Kim HJ,Li QL,et al.Runx2 is a common target of transforming growth factor beta1 and bone morphogenetic protein 2,and cooperation between Runx2 and Smad5 induces osteoblast-specific gene expression in the pluripotent mesenchymal precursor cell line C2C12[J].Mol Cell Biol, 2000,20(23):8783-8792
[15]Kook SH,Lim SS,Cho ES etl.COMP-angiopoietin 1 increases proliferation,differentiation,and migration of stemlike cells through Tie-2-mediated activation of p38 MAPK and PI3K/Akt signal transduction pathways[J].Biochem Biophys Res Commun,2014,455(3-4):371-377
[16]Wu Y1,Yang Y,Yang P,et al.The osteogenic differentiation of PDLSCs is mediated through MEK/ERK and p38 MAPK signalling under hypoxia[J].Arch Oral Biol,2013,58 (10):1357-1368
Effects of canonical Wnt/β-catenin over expression on proliferation and osteogenic differentiation of human periodontal ligament stem cells
LI Ying,LIU Na,ZHANG Wei,GU Bin(Department of Stomatology,Chinese PLA General Hospital,Beijing 100853, China)
Objective:To construct Wnt/β-catenin gene overexpressed vector and to investigate the effects of its over expression on proliferation and osteogenic ability of human periodontal ligament stem cells.Methods:8 healthy premolars and third molars extracted for treatment were isolated and cultured for human healthy individuals(PDLSCs).Amplify the Wnt/β-catenin gene from PDLSCs,and cloned it into pLV-EGFP-Nvector,to construct Wnt/β-catenin overexpressed vector, then to transfect it into PDLSCs by lipofection method.Cell morphology was observed under fluorescent microscope after transfection of PDLSCs in conventional and osteogenic culture condition on the seventh day.We tested MTT results of PDLSCs.lymphoid enhancer factor-1(LEF1),T cell factor-4(LEF4),Runt-related transfer factor-2(Runx2),alkaline phosphatase(ALP),human type I collagen(COL-1)and P38 mitogen activated protein kinase(P38 MAPK)were detectedby real-time quantitative PCR.Results:GFP was expressed efficiently in PDLSCs after transfection.MTT results showed proliferation of PDLSCs after transfection was boosted specifically and efficiently than before.Real-time PCR results showed the expression of LEF1 mRNA was significantly increased than before,while there is no difference in TCF4. Simultaneously,Runx2,ALP,COL-1 and p38 were significantly decreased of PDLSCs transfected with Wnt/β-catenin overexpressed vector cultured in osteogenic differentiation condition.Conclusion:Classic Wnt/β-catenin pathway plays an important role in PDLSCs proliferation and osteogenic differentiation.OverexpressionofthecoreproteinWnt/β-catenin can upregulate the expression of LEF1,promote the proliferation of PDLSCs,and inhibit the osteogenic ability of PDLSCs by down regulating the expression of RUNX2,ALP,COL-1 and P38.
periodontal ligament stem cells(PDLSCs);canonical Wnt pathway;β-catennin;Proliferation;Osteogenic
R783
A
1672-2973(2017)04-0198-06
2017-03-20)
国家自然科学基金(项目编号:31670998;51473175)北京市科技新星计划(项目编号:Z141107001814101)军事口腔医学国家重点实验室开放课题(2014KA03)
李影解放军总医院口腔医学研究所硕士生北京100853
刘娜解放军总医院口腔医学研究所博士后北京100853
张维中国科学院理化技术研究所抗菌检测中心北京100190
顾斌通讯作者解放军总医院口腔科副主任医师北京100853
