高龄老年人牙髓干细胞分离培养与生物学特性分析实例报告
2017-08-27乔朋艳刘洪臣
乔朋艳刘洪臣
·论著·
高龄老年人牙髓干细胞分离培养与生物学特性分析实例报告
乔朋艳刘洪臣
目的:对高龄老年人牙髓干细胞进行分离培养,探讨其生物学特性。方法:应用联合酶消化法,分离培养一例88岁老年男性患者右上第三磨牙的牙髓细胞,进行原代培养并传代,流式分析鉴定,体外培养观察细胞的形态、增殖、分化能力。结果:首次成功分离培养高龄老年人牙髓干细胞;倒置相差显微镜下可见细胞透亮,呈长梭形;流式细胞学分析显示,体外培养的老年人牙髓干细胞阳性表达间充质干细胞标记CD73、CD90、CD105,不表达造血干细胞和内皮细胞标记CD14、CD19、CD34、CD45及HLA-DR;细胞活力良好,可成骨向分化。结论:高龄老年人牙髓组织中存在牙髓干细胞,活力良好,具有一定的分化潜能。
牙髓干细胞;再生医学;组织工程;高龄老年人;高龄老年人牙髓干细胞
老年人因牙周病、外伤、肿瘤以及系统性疾病所致牙颌面缺损的人群患病率高[1,2],剩余骨量不足、骨质不佳,严重影响其种植修复与功能重建[3],干细胞介导的种植区骨增量与骨结合为重点探讨的问题,获得生物学性能良好的自体种子干细胞一直为国内外研究的热点[4]。
美国学者Gronthos等,于2000年首次发现和命名人牙髓干细胞(Dental pulp stem cells,DPSCs)[5],这是一类存在于人体牙髓组织中具有较强自我更新和多向分化潜能的未分化细胞或前体细胞,属间充质干细胞,在合适的体内或体外环境下可分化为多种人体细胞,为组织、器官修复和自体、异体移植的细胞治疗等提供细胞来源[6-9]。
研究发现,牙髓干细胞取材方便、易于获得和保存,其增殖和分化能力优于自体骨髓间充质干细胞(Bone marrow stem cells,BMSCs)[8,10-12]。但也有研究显示:不同年龄、来源及代数的干细胞生物学活性或有差异[13,14];对干细胞基因组、端粒、细胞周期抑制因子、线粒体等相关分子机制的研究表明,干细胞亦存在增龄性功能下降,表现为干细胞数量的减少和分化方向的改变[15]。本课题组前期研究亦证实,人骨髓间充质干细胞的增殖和成骨分化能力随年龄的增加而显著下降,成脂分化能力增强,但因胚层起源不同其活性及受年龄影响的程度存在差异:老年人颌骨来源的骨髓间充质干细胞,来自外胚层神经嵴,其增殖和成骨分化特性优于四肢骨来源的骨髓间充质干细胞[14],可修复下颌骨临界骨缺损。因此,保持干细胞的活力、延缓干细胞衰老及延长干细胞的寿命具有重要意义。牙髓干细胞的数量和生物学特性随年龄变化的规律是什么,高龄老年人牙髓干细胞可否作为组织再生修复的种子细胞,国内外尚未见研究报道。因此,本研究拟分离培养高龄老年人牙髓干细胞(Geriatric dental pulp stem cells,GDPSCs),观察细胞的形态、增殖、分化等生物学特性,探索其未来在临床应用的可能性。
1.材料与方法
1.1 离体牙收集经中国人民解放军总医院医学伦理委员会审核批准,临床搜集1例88岁老年男性患者右上第三磨牙,牙齿拔出后,立即放入预冷含2倍培养浓度双抗(100U/ml青霉素和100mg/ml链霉素)的α-MEM培养基中(Invitogen,美国)。
1.2 原代细胞培养无菌条件下劈开牙齿,取出牙髓,切除根尖部约2 mm牙髓组织,0.01M的灭菌磷酸盐缓冲液(PBS)冲洗后剪成大小约1mm×1mm×1mm的组织块,0.3%的I型胶原酶(Worthington Biochemical Corp.,美国)和0.4%的中性蛋白酶Dispase II(Sigma,美国)(1∶1)37℃消化1h,轻轻吹打离散单细胞团块,将形成的单细胞悬液通过孔径为70μm的细胞筛网,800r/min离心5min,将细胞沉淀用含20%胎牛血清(FBS,Invitogen,美国)+100U/ml青霉素+100mg/ml链霉素的α-MEM培养液重悬,以1×104-1×105/mL密度接种于5mL培养瓶(Corning,美国)中,置于37℃、5%CO2条件下常规培养,24h首次换液,以后每3天换液。光镜观察分离培养的该例高龄老年人牙髓干细胞的细胞形态和生长情况,细胞生长达80%融合时,2.5g/L的胰酶(Invitogen,美国)消化传代。
1.3 流式分析鉴定选取生长状态良好的P4代DPSCs,制备细胞浓度为1×106个/mL的细胞悬液,使用人间充质干细胞表面标记检测试剂盒(BD,美国),按说明书要求,在标号为①-⑧的1.5 mL的EP管中,依次加样如下:
①5μL CD90 FITC+100μL细胞悬液
②5μL CD44 PE+100μL细胞悬液
③5μLCD105PerCP-Cy5.5+100μL细胞悬液
④5μL CD73 APC+100μL细胞悬液
⑤100μL细胞悬液
⑥20μL Neg+20μL Pos isotype control cocktails+100μL细胞悬液
⑦20μL Neg+20μL Pos marker cocktails+ 100μL细胞悬液
⑧20μLPosmarker cocktail+5μLPEdrop in+ 100μL细胞悬液
室温避光孵育30分钟,用流式细胞仪检测鉴定。
1.4 细胞活性分析取生长良好的P4代细胞,在96孔板中接种100μL浓度为2×104cells/ml细胞悬液,即2000个细胞/孔,每板设10个复孔(n=10),共接种10块96孔板,置于培养箱预培养,分别在第1、2、3、4、5、6、7、8、9、10天观察细胞增殖情况。使用CCK-8(Dojindo,日本)试剂盒检测细胞的增殖特性,向每孔加入10μL CCK-8溶液,放回培养箱内孵育2小时,每孔取上清100μL放入一块新的96孔板中,用酶标仪检测450nm的吸光度值,绘制生长曲线,测定细胞增殖情况。
1.5 多向分化潜能①成骨向分化,选取生长状态良好的P4代DPSCs,以2×105个/孔接种于六孔培养板里(n=4),常规换液。待细胞达到约80%融合时,加入成骨诱导液(Cyagen Biosciences,Guangzhou China),每3天换液,2周后终止诱导,茜素红染色;②成脂向分化:选取生长状态良好的P4代DPSCs,以2×105个/孔接种于六孔培养板里(n=4),常规换液。待细胞达到约100%融合时,加入成脂诱导液(Cyagen Biosciences,Guangzhou China),首先使用A液诱导3天,换B液诱导1天,如此A液和B液交替作用,3周后终止诱导,油红-O染色。
2.结果
2.1 细胞原代培养及传代联合酶消化法获取的该例高龄老年人牙髓干细胞,在转移至培养瓶培养24小时后首次换液,即可见细胞贴壁,但数量较少,呈现克隆式贴壁生长。培养的原代细胞(P0)生长达80%融合的时间约为10天,1瓶传3瓶培养,至P1细胞生长再次达80%融合的时间则为3-4天,细胞透亮、形态为长梭形,图1为传代培养的P1、P4代DPSCs。

图1 分离培养的DPSCs,A:P1代,B:P4代
2.2 流式分析鉴定流式细胞学分析显示,体外培养的该例高龄老年人牙髓干细胞阳性表达间充质干细胞标记CD73、CD90、CD105,不表达造血干细胞和内皮细胞标记CD14、CD19、CD34、CD45及HLA-DR(图2)。

图2 DPSCs流式分析鉴定结果
2.3 细胞活性分析使用CCK-8检测结果显示,在接种后的1-2天为生长迟滞期,3-7天进入对数生长期,7天达到平台期,9天之后开始进入衰退期(图3)。

图3 CCK-8检测细胞活力结果
2.4 分化能力观察
2.4.1 成骨向分化经过2周的体外成骨诱导培养后,使用茜素红染色,肉眼可见钙化,光镜观察可见钙结节形成(图4、5)。

图4 成骨诱导培养2周后,茜素红染色,肉眼观察
2.4.2 成脂向分化经过3周的体外成脂诱导培养后,使用油红-O染色,光镜下观察,见少量脂滴样物质形成(图6)。

图5 成骨诱导培养2周后,茜素红染色,光镜下观察,可见钙化结节形成(箭头)
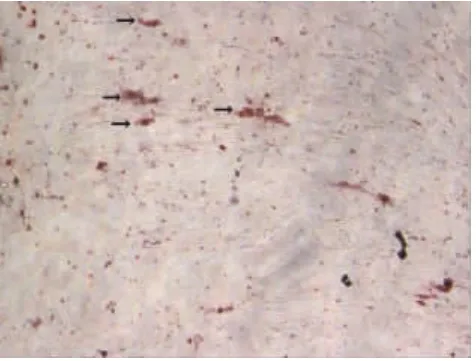
图6 诱成脂导培养3周后,油红-O染色,见少量脂滴样物质形成
3.讨论
3.1 分离、培养及鉴定研究者一般从临床拔除的智齿、正畸减数牙、无治疗价值的牙周炎患牙、多生牙以及牙髓炎患牙拔除的牙髓组织中获取人牙髓干细胞[6,7]。牙髓干细胞的分离培养主要有两种方法:外植体法(the explant method,DPSC-OG)和牙髓组织酶消化法(the enzymatic digestion of pulp tissue method,DPSC-ED)[16],本研究采用后者获得研究所需牙髓干细胞,进行贴壁培养和扩增。使用细胞流式分析仪对CD73+、CD90+、CD105+、CD34-、CD45-、CD14-、CD19-和HLA-DR-等针对间充质干细胞的特异性表面标志物进行鉴定[17],结果显示,分离培养的该例高龄老年人的牙髓细胞为间充质干细胞(图2),间充质干细胞主要表面标记物均在该牙髓干细胞上阳性表达,提示其拥有良好的增殖分化能力。
3.2 不同年龄来源牙髓干细胞的一般特性与对比分析研究表明,牙齿的年龄不同,所分离的牙髓干细胞展现的沿特定细胞系分化的特点和倾向或不同[13];但最近有学者比较了年轻恒牙牙髓干细胞和乳牙牙髓干细胞(Stem cells from human exfoliated deciduous teeth,SHEDs),提示不同来源、不同年龄的牙齿来源干细胞(Dental stem cells,DSCs)在细胞形态、增值速度、细胞表面标志物的表达、分化潜能方面表现相似。恒牙牙髓干细胞和乳牙牙髓干细胞,从临床应用的角度来说,应该是同等的机会[18]。许多使用恒牙牙髓干细胞与乳牙牙髓干细胞进行对比的体内移植实验研究,结果均显示二者的效果相似;甚至有研究显示,恒牙牙髓干细胞的体外可传代次数更多,而其成骨能力等生物学特性不受影响[18]。Laino等研究了45岁人牙髓干细胞,其生物学性能仍良好[17]。Wu等比较了4-8岁、12-20岁、32-49岁及55-67等几个年龄组的人牙髓干细胞的生物学特性,结果为,较其他组,55-67岁年龄组牙髓干细胞活性及分化能力部分减弱[19],但并未见体内实验的进一步比较研究。本研究首次成功分离的该例高龄老年人牙髓干细胞活性检测结果显示,在接种后的1-2天为生长迟滞期,3-7天细胞进入对数生长期,7天达到高峰,之后处于平台期,随着细胞的继续增殖出现接触抑制,第9天进入衰退期(图3),符合一般细胞学的生长规律;体外诱导培养结果显示出其一定的多向分化能力(图4-6)。
3.3 牙髓干细胞的应用研究牙髓干细胞目前被广泛应用于组织工程和再生医学研究。有学者预测,牙髓组织将成为整形外科、口腔及口腔颌面外科组织重建、器官修复和临床疾病治疗的重要干细胞来源[18,20],拔除的第三磨牙、正畸减数牙、多生牙等将不再被视作医疗废弃物[21-23]。目前,牙髓干细胞主要用于牙齿及颌骨组织、肌肉、骨骼系统组织的修复及再生研究,已有牙髓干细胞用于糖尿病所致严重肢体缺血坏死、骨坏死所致骨缺损、烧伤所致皮肤损伤的再生以及肝脏、神经、骨骼肌肉、血管及皮肤再生的报道[24-27],显示出良好的应用前景。
此外,牙髓干细胞或可用于一些系统性疾病的免疫调节治疗。研究显示,干细胞具有较强的免疫调节作用,能够通过诱导免疫耐受以及高表达调节性T细胞,降低炎症反应导致的组织损伤,有利于损伤组织的恢复和预后改善[28],牙髓干细胞现已被应用于多种疾病的免疫调节治疗,例如系统性红斑狼疮、结肠炎、多发性硬化症[29,30]等,受试对象在接受干细胞或其分泌物治疗后,相关症状得以缓解。未来,2型糖尿病、类风湿性关节炎等亦有望通过牙髓干细胞进行治疗[31,32]。研究发现,干细胞治疗的免疫调节机制更宏观和多元化,干细胞进入血液循环后会较快发生凋亡,凋亡过程中的干细胞与机体免疫系统相互作用,引发系列链状反应,细胞活性越好,与机体相互作用越强[29-32]。因此,活性更好的牙髓干细胞在上述疾病的治疗中可发挥更大的作用。
综上所述,分离培养的该例高龄老年人牙髓干细胞具备一定的增殖、分化潜能,尚需要进一步的体内、外系统对照研究,并对老年人牙髓干细胞的活力、干细胞状态相关分子(端粒酶活性、细胞周期抑制因子等)、多向分化能力及调控进行深入研究,为临床获取、存储及调控老年人牙髓干细胞用于组织再生修复提供实验依据。
[1]齐小秋.第三次全国口腔健康流行病学调查报告[M].人民卫生出版社,2008
[2]刘洪臣,储冰峰.口腔健康是老年人健康的基础[J].中华老年口腔医学杂志,2013,11(3):129-131
[3]刘洪臣.老年患者特定情况的人工种植牙修复[J].中华老年口腔医学杂志,2012,10(2):65-67
[4]Munsie M,Hyun I.A question of ethics:Selling autologous stem cell therapies flaunts professional standards[J].Stem Cell Res,2014,13(3):647-653
[5]Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625-13630
[6]Alongi DJ,Yamaza T,Song Y,et al.Stem/progenitor cells from inflamed human dental pulp retain tissue regenerationpotential[J].Regen Med,2010,5(4):617-631
[7]Chen FM,Sun HH,Lu H,et al.Stem cell-delivery therapeutics for periodontal tissue regeneration[J].Biomaterials, 2012,33(27):6320-6344
[8]Miura M,Gronthos S,Zhao M,et al.SHED:stem cells from human exfoliated deciduous teeth[J].Proc Natl Acad Sci USA,2003,100(10):5807-5812
[9]Liu J,Yu F,Sun Y,et al.Concise reviews:Characteristics and potential applications of human dental tissue-derived mesenchymal stem cells[J].Stem Cells,2015,33(3):627-638
[10]Rosa V,Dubey N,Islam I,et al.Pluripotency of Stem Cells from Human Exfoliated Deciduous Teeth for Tissue Engineering[J].Stem Cells Int,2016,2016:5957806
[11]Martinez Saez D,Sasaki RT,Neves AD,et al.Stem Cells from Human Exfoliated Deciduous Teeth:A Growing Literature[J].Cells Tissues Organs,2016,202(5-6):269-280
[12]Aghajani F,Hooshmand T,Khanmohammadi M,et al. Comparative Immunophenotypic Characteristics,Proliferative Features,and Osteogenic Differentiation of Stem Cells Isolated from Human Permanent and Deciduous Teeth with Bone Marrow[J].Mol Biotechnol,2016,58(6):415-427
[13]Nekanti U,Rao VB,Bahirvani AG,et al.Long-term expansion and pluripotent marker array analysis of Wharton's jelly-derived mesenchymal stem cells[J].Stem Cells Dev, 2010,19(1):117-130
[14]Wang X,Zou X,Zhao J,et al.Site-Specific Characteristics of Bone Marrow Mesenchymal Stromal Cells Modify the Effect of Aging on the Skeleton[J].Rejuvenation Res,2016,19 (5):351-361
[15]黄黎亚,陈书艳.端粒、线粒体和干细胞衰老[J].上海交通大学学报(医学版),2012,32(5):679-683
[16]Hilkens P,Gervois P,Fanton Y,et al.Effect of isolation methodology on stem cell properties and multilineage differentiation potential of human dental pulp stem cells[J].Cell Tissue Res,2013,353(1):65-78
[17]Laino G,d'Aquino R,Graziano A,et al.A new population of human adult dental pulp stem cells:a useful source of living autologous fibrous bone tissue(LAB)[J].J Bone Miner Res,2005,20(8):1394-1402
[18]Ledesma-Martinez E,Mendoza-Nunez VM,Santiago-Osorio E,Mesenchymal Stem Cells Derived from Dental Pulp:A Review[J].Stem Cells Int,2016,2016:4709572
[19]Wu W,Zhou J,Xu CT,et al.Derivation and growth characteristics of dental pulp stem cells from patients of different ages[J].Mol Med Rep,2015,12(4):5127-5134
[20]Abou Neel EA,Chrzanowski W,Salih VM,et al.Tissue engineering in dentistry[J].J Dent,2014,42(8):915-928
[21]Tirino V,Paino F,De Rosa A,et al.Identification,isolation, characterization,and banking of human dental pulp stem cells[J].Methods Mol Biol,2012,879:443-463
[22]d'Aquino R,De Rosa A,Lanza V,et al.Human mandible bone defect repair by the grafting of dental pulp stem/progenitor cells and collagen sponge biocomplexes[J].Eur Cell Mater,2009,12(18):75-83
[23]Huang AH,Chen YK,Lin LM,et al.Isolation and characterization of dental pulp stem cells from a supernumerary tooth[J].J Oral Pathol Med,2008,37(9):571-574
[24]Lu D,Chen B,Liang Z,et al.Comparison of bone marrow mesenchymal stem cells with bone marrow-derived mononuclear cells for treatment of diabetic critical limb ischemia and foot ulcer:a double-blind,randomized,controlled trial[J]. Diabetes Res Clin Pract,2011,92(1):26-36
[25]Rasulov MF,Vasilchenkov AV,Onishchenko NA,et al.First experience of the use bone marrow mesenchymal stem cells for the treatment of a patient with deep skin burns[J].Bull Exp Biol Med,2005,139(1):141-144
[26]Kadar K,Kiraly M,Porcsalmy B,et al.Differentiation potential of stem cells from human dental origin-promise for tissue engineering[J].J Physiol Pharmacol,2009,60(Suppl 7):167-175
[27]Mead B,Logan A,Berry M,et al.Dental Pulp Stem Cells:A Novel Cell Therapy for Retinal and Central Nervous System Repair[J].Stem Cells,2017,35(1):61-67
[28]刘洪涛,苏颖.牙髓干细胞治疗中枢神经系统损伤机制的研究进展[J].医学综述,2016,22(2):220-223
[29]Makino Y,Yamaza H,Akiyama K,et al.Immune therapeutic potential of stem cells from human supernumerary teeth[J].J Dent Res,2013,92(7):609-615
[30]Shimojima C,Takeuchi H,Jin S,et al.Conditioned Medium from the Stem Cells of Human Exfoliated Deciduous Teeth Ameliorates Experimental Autoimmune Encephalomyelitis[J]. J Immunol,2016,196(10):4164-4171
[31]Izumoto-Akita T,Tsunekawa S,Yamamoto A,et al.Secreted factors from dental pulp stem cells improve glucose intolerance in streptozotocin-induced diabetic mice by increasing pancreatic beta-cell function[J].BMJ Open Diabetes Res Care,2015,3(1):e000128
[32]Ishikawa J,Takahashi N,Matsumoto T,et al.Factors secreted from dental pulp stem cells show multifaceted benefits for treating experimentalrheumatoid arthritis[J].Bone,2016, 83:210-219
The preliminary research on geriatric dental pulp stem cells from an 88-year-old man
QIAO Peng-yan,LIU Hong-chen(Instituteof Stomatology,Chinese PLA General Hospital,Beijing 100853,China)
Objective:To isolate and obtain dental pulp stem cells(DPSCs)from the oldest-old and explore their biological functions.Methods:The dental pulp cells from an 88-year-old male patient’s upper third molar were isolated using the enzymatic digestion ofpulp tissue method,cultured,passaged and analyzed byflow cytometry.Cell morphology,proliferation and differentiation ability were observed in vitro.Results:It is the first to successfully isolated,cultured and passaged the geriatric dental pulp stem cells(GDPSCs).The morphology of the cells were spindle or exhibited several pseudopods under inverted phase contrast microscope and were positive for human multipotent mesenchymal stromal cells(MSCs)surface markersCD73,CD90,and CD105,butnegative forCD14,CD19,CD34,CD45 and HLA-DR.These cellsalso exhibited good self-renewal abilityand multilineage differentiation potential.Conclusion:DPSCs can be isolated from the pulp tissues of the oldest-old and present well proliferation and differentiation potentials.
dental pulp stem cells;regenerative medicine;tissue engineering;oldest-old;geriatric dental pulp stem cells
R787
A
1672-2973(2017)04-0193-05
2017-04-10)
国家高技术研究发展计划(863计划) (项目编号:2015AA033502)
乔朋艳解放军总医院口腔医学研究所博士后北京100853
刘洪臣通讯作者解放军总医院口腔医学研究所所长主任医师教授北京100853
