促兔眼蓝莓生长菌根真菌的分离与鉴定
2017-08-16单晓笛张书祥蒋光月
赵 磊, 刘 伟, 傅 翔, 单晓笛, 张书祥, 蒋光月, 黄 蓓
(1. 安徽大学 生命科学学院, 合肥 230601; 2. 安徽省农业科学院, 合肥 230031)
促兔眼蓝莓生长菌根真菌的分离与鉴定
赵 磊1, 刘 伟1, 傅 翔1, 单晓笛1, 张书祥1, 蒋光月2, 黄 蓓1
(1. 安徽大学 生命科学学院, 合肥 230601; 2. 安徽省农业科学院, 合肥 230031)
利用优势菌根真菌提高弱根系兔眼蓝莓对营养元素的吸收,促进兔眼蓝莓植株的生长。从皖南地区兔眼蓝莓菌根分离得到的9种真菌进行了功能试验:通过兔眼蓝莓幼苗接种试验,观察菌根真菌对兔眼蓝莓幼苗存活率及株高的影响;盆栽兔眼蓝莓植株接种试验观察菌根真菌侵染情况,检测其对兔眼蓝莓植株叶片N、P、K及叶绿素含量变化的影响。筛选得到4种对兔眼蓝莓生长有显著促进作用的菌株。利用形态学观察、DNA测序及构建系统发育树,分析发现其中3种属于毛霉属卷枝毛霉种(Mucorcircinelloides),其亚种水平有差异,另外1种属于毛霉属总状枝毛霉(Mucorracemosus),其相似率均大于99%。毛霉属卷枝毛霉种及总状枝毛霉种对兔眼蓝莓营养元素的吸收和植株的生长具有明显的促进作用。
兔眼蓝莓; 菌根真菌; 接种试验;ITS序列;分子鉴定
蓝莓即越橘(Vacciniumuliginosum) 又名笃斯,野生蓝莓被称为都柿(大小兴安岭、伊春)属于杜鹃花科(Ericaceae)越桔属[1],原产于北美,约有450种。蓝莓可分为矮丛、半高丛、高丛和兔眼蓝莓四大类。蓝莓果实中富含有丰富的熊庶果甙、花青素、黄酮等多种具有抗氧化性能的多酚类生理活性成分,被誉为“浆果之王”[2]。兔眼蓝莓的栽培土壤是酸性土壤(pH 4.0~5.0),根细缺少根毛,接触面积小,分布浅,吸收能力较弱[3]。自然条件下,菌根真菌能与植物形成互利共生的关系[4],因而筛选出有益的菌根真菌能够促进兔眼蓝莓对营养元素的吸收,有助于兔眼蓝莓生长和提高果实营养价值,改良兔眼蓝莓根系微生物环境以及增强兔眼蓝莓的生长势和对病虫害的抵抗能力。
袁继鑫等对大兴安岭野生蓝莓菌根进行研究,观察到3种类型菌丝体:有隔外生菌丝体、穿梭于细胞间和形成菌丝团的内生菌丝[5]。肇莹等通过形态观察结合18S rRNA测序比对筛选出对蓝莓的生长起到明显促进作用的晶粒鬼伞菌种(Coprinusmicaceus)[6]。蓝莓菌根真菌的侵染受到地域环境的综合影响,不同地域存在差异性。兔眼蓝莓为皖南地区的主栽品种,该品种生态适应性、长势和抗病虫性较强,比较抗旱耐湿热,但抗寒性较差,而人工改良后的土壤也影响根系对营养成分的吸收,因此筛选出促进兔眼蓝莓生长的菌根真菌尤为重要。同时,菌根真菌制剂的使用还能够降低栽培管理的费用和减少由于农药化肥等导致的环境污染,实现快速可持续性发展。
促兔眼蓝莓生长的菌根真菌的分离与鉴定是本课题组拟解决的关键技术问题。为此,从皖南地区兔眼蓝莓种植密集区域随机选点采样进行根系真菌菌落的培养,通过观察选出长势较好的,形态上存在一定差异的菌落分离培养,得到候选菌株后进行兔眼蓝莓苗接种试验,挑选对生长有效的菌株再进行盆栽兔眼蓝莓植株的接种试验,通过对受试兔眼蓝莓植株叶片营养元素、叶绿体含量的测定,筛选出优势菌株,结合形态学进行初步分类鉴定。再利用分子生物学手段,将提取得到的真菌基因组用ITS通用引物进行PCR扩增,得到的ITS序列进行测序,分析其 rDNA 的ITS序列进行分子鉴定[7-9]。
1 材料与方法
1.1 供试材料
蓝莓植株由安徽省芜湖市无为县玉泰农业有限公司和安徽省芜湖市南陵县泓源农业戴工山蓝莓基地提供,蓝莓组培苗由合肥师范学院蓝莓种苗培育基地提供。
量子共振检测仪为深圳同康公司生产。
1.2 菌根真菌的分离及观察
将根剪成3~4 cm。采用75%酒精、75%酒精和0.1%升汞结合的表面灭菌。选取幼根为分离材料,在无菌条件下再剪成0.5 cm根段,选用PDA培养基[10],每个培养皿中放置5个根段。待菌丝从根横切面发出,挑取真菌菌丝,转接于新的PDA培养基上,继续培养,转接几次直至获得纯化菌株。纯化后的菌株接种于PDA斜面,4℃保藏。
将菌株接种于PDA培养基,25℃下培养。观察菌落特征,挑取菌丝在光学显微镜观察真菌的分生孢子、孢子囊、菌丝体等形态结构。
1.3 蓝莓幼苗接种试验
将已分离纯化的菌种转接到新的PDA培养基上, 将其置于生化培养箱中28℃培养15 d,备用。将培养土放入121℃高压蒸汽灭菌20 min,分成80 g等量的小份,倒入无菌10 cm×8 cm×7 cm培养盆中,挖一个深5 cm的3 cm×3 cm的坑,加入25 mL土豆培养液,1 cm×1 cm菌饼2个,将蓝莓苗移入。将蓝莓幼苗置于通风恒温(25℃)光照环境培养,浇无菌水。移栽后第30天,统计成活率及幼苗株高。
1.4 蓝莓盆栽植株侵染试验
将候选菌根真菌接种于温室大棚蓝莓植株,3周后采集蓝莓植株毛根,先在10%KOH溶液中(60 ℃)浸泡20 h,然后取出根样用蒸馏水冲洗10 min,再用1%HCl溶液浸泡10 min。将菌根剪成0.5 cm大小的根段,用0.05%台盘蓝溶液(0.15%台盼蓝∶85%乳酸∶甘油1∶1∶1)染色1 h,在甘油中脱色30 min,最后将根样放在载玻片上进行显微观察。
1.5 蓝莓植株营养元素相对含量检测
采集受试植株第3~5片叶子5 g,用量子共振仪进行蓝莓叶片N、P、K相对含量检测。量子共振检测仪(Quantum resonance spectrometer,QRS)是一种类似核磁共振和红外光谱分析原理波谱分析仪器,通过测定生物体及物质中微高斯至毫高斯级的磁场,能直接从生物体或物质收集电磁波进入仪器,通过与仪器内置的标准量子共振谱相比较,输出由负到正的量价值输出由负到正的量价值[11-13]。检测单位为安徽省微量元素研究会。
1.6 叶绿素含量检测
采用多光谱成像系统技术检测。采集每张蓝莓叶片的图片,然后提取19个波段的光谱数据,再与叶片的实际叶绿素含量联合,用偏最小二乘法建立叶绿素校正模型,再提取每张叶片各个像素点的光谱数据带入校正模型,就可以得到各个像素点的叶绿素实际含量值,然后把实际含量返回到叶片上面,在这个可视化过程中只产生叶绿素各个像素点的实际含量[14]。
1.7 菌根真菌的分子鉴定
根据王旭丽等为真菌rRNA基因的ITS设计了3对通用引物,即ITS1、ITS4和ITS5。通用引物: ITS1:5′-TCCGTAGGTGAACCTGCG-3′;ITS4: 5′-TCCTCCGCTTATTGATATGC-3′,用于PCR对ITS 序列扩增。PCR 反应体系为: 95℃预变性 10 min;95℃变性45 s,55℃退火45 s,72℃延伸2 min,30个循环;72℃延伸 5 min。将PCR扩增产物纯化后送至滁州通用生物公司进行测序,所得产物序列提交到 NCBI 核酸数据库[15]。菌根真菌rDNA ITS序列输入GenBank 数据库中,获得GenBank登录号[16],并进行 BLAST 比对,获得相似性最高的序列进行分析[17],运用 Clustal W软件进行多重序列匹配排列( Multiple Alignments) 分析,使用 MEGA 6.06软件中的Neighbor-joining 法构建系统发育树[18],以确定该菌株分类学地位。
2 结果与分析
我们分别从安徽省芜湖市南陵县戴工山和无为县开城蓝莓园基地的兔眼蓝莓根部采集根样,土壤pH 4.5~5.5。将土壤样品中的兔眼蓝莓根样进行培养,选取长势良好的菌落进行分离纯化培养。
将分离纯化得到的9种菌根真菌(A~I)接种于PDA培养基,25℃培养7 d,观察菌落生长状态,然后对其菌落形态特征进行分类比较。
2.1 菌根真菌对兔眼蓝莓苗生长的影响
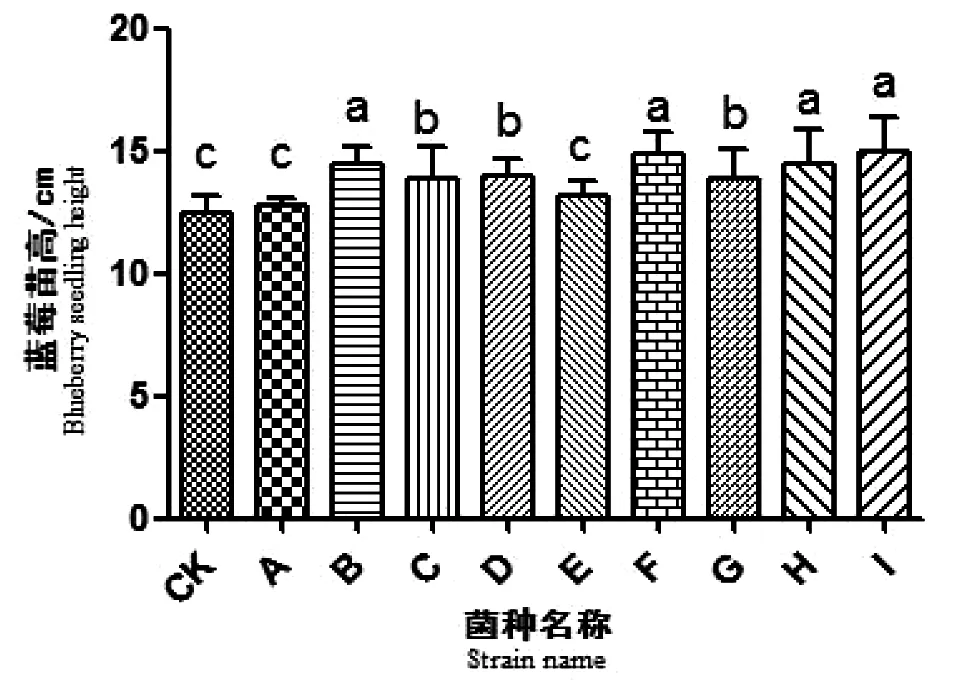
图1菌根真菌对兔眼蓝莓苗高的影响Fig 1 Effects of mycorrhizal fungi on the height of blueberry of shoots
图中不同字母表示有显著性差异(P<0.05);a表示与CK相比差异极显著(P<0.01);b表示与CK相比差异显著;c表示与CK相比差异不显著
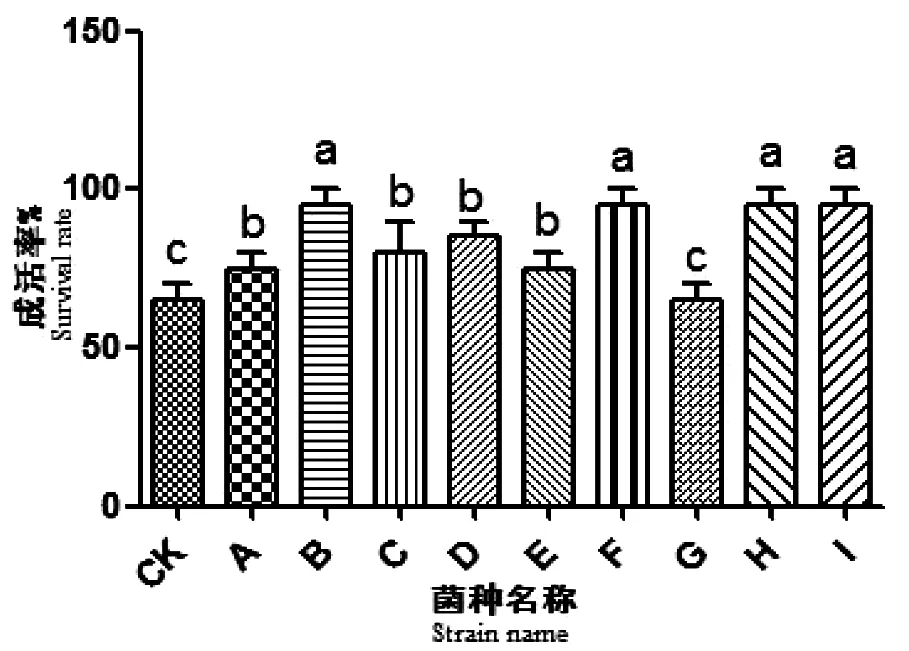
图2 菌根真菌对兔眼蓝莓幼苗成活率影响Fig 2 Effects of mycorrhizal fungi on the survival rate blueberry shoots
将分离纯化的9种菌根真菌接种到兔眼蓝莓幼苗根部,接种后30 d,统计兔眼蓝莓苗高和成活率。试验设置3次重复,应用方差分析(ANOVA)对试验数据进行差异显著性分析(SPSS 19.0),当P<0.05 时,表示差异显著[19]。
从图1可看出,B、D、F、H和I组影响效果显著(P<0.05),平均增长率均明显高于对照组。从图2中发现,B、F、H 和I菌根真菌对兔眼蓝莓幼苗存活率影响与CK组比较差异极显著(P<0.01)。
结果显示,B、F、H和I这4种菌根真菌能够显著提高兔眼蓝莓幼苗存活率,促进其幼苗生长。
2.2 菌根真菌对兔眼蓝莓植株叶片氮磷钾含量的影响
在菌根真菌对兔眼蓝莓幼苗生长试验的基础上,进行菌根真菌对1年生大棚兔眼蓝莓植株氮磷钾含量的影响试验。菌根真菌接种3周后,采集兔眼蓝莓叶片,用量子共振仪对兔眼蓝莓叶片N、P、K相对含量进行检测。量子共振检测仪能够识别待测物质所需要的成分,与仪器内置的标准量子共振谱相比较,通过计算机处理后,输出由负到正的量价值。量价值的大小标志营养水平的高低等,正值越高表示含量或功能性越好。
从表2可以看出,B、F、G、H和I组的氮磷钾相对含量高于CK组,说明这5种菌根真菌对兔眼蓝莓植株氮磷钾的吸收具有促进作用。
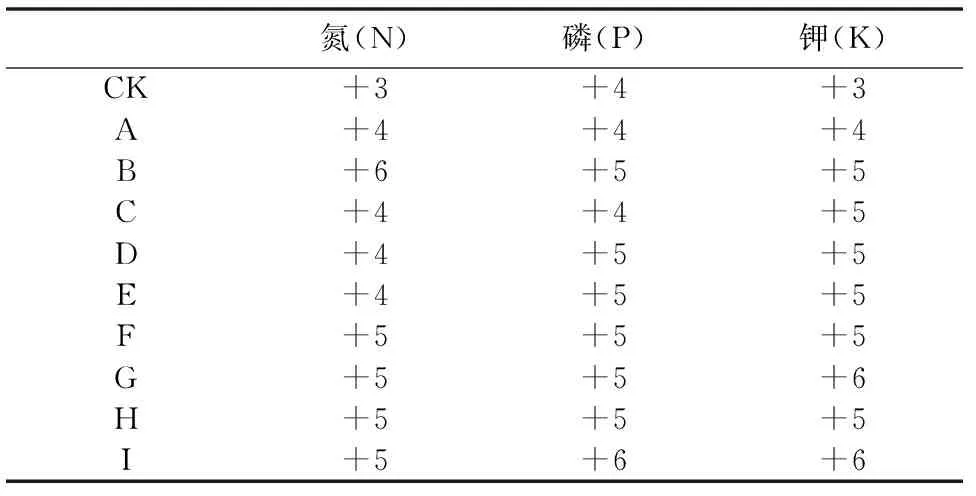
表2 蓝莓叶片N、P、K相对含量的检测
参考值:-1~+6
2.3 菌根真菌对兔眼蓝莓植株叶片叶绿素含量的影响

图3 菌根真菌对兔眼蓝莓植株叶片叶绿素含量的影响Fig 3 Effects of mycorrhizal fungi on the chlorophyll content of blueberry plants
垂直色条代表图像的叶绿素含量
利用多光谱成像系统对侵染菌根真菌的兔眼蓝莓植株叶片叶绿素含量进行检测。多光谱成像系统技术可以从光谱维和空间维获取被测目标的信息,可应用于作物生长状态监测和农产品品质检测等[20]。通过叶片各个像素点的光谱数据与内置标准含量的校正模型相比较,可以得到各个像素点的叶绿素实际含量。
图3检测结果显示,与对照组CK相比较,B、F、H及I 4种菌株对兔眼蓝莓植株叶片叶绿素含量提高更显著。
2.4 菌根真菌对兔眼蓝莓植株根侵染的形态学观察
综合以上功能筛选试验发现,B、F、H和I 4种菌根真菌对兔眼蓝莓植株生长和叶片营养元素含量提高都有明显的促进作用。因此,我们选择这4种菌根真菌进行兔眼蓝莓植株根侵染实验。侵染3周后,利用台盼蓝染色对各个处理组中兔眼蓝莓根系进行染色观察。
从图4中看出,4种菌株处理组中均观察到菌根真菌的浸染。其中在B菌浸染的表皮细胞中观察到胞内菌丝团,在外皮层中有平行菌丝,表皮外有根外菌丝;在F菌浸染的表皮细胞中也见到了胞内菌丝团、平行菌丝及胞外多根菌丝;在F菌浸染的表皮细胞中发现了颗粒状物质及根外菌丝,根部浸染的部分整体着色均匀;而在I菌浸染内外皮层细胞中见到了较多的胞内游走菌丝及平行菌丝。值得注意的是,在B、F和I感染的菌根中均观察到平行排列的菌丝体,而在H菌中,菌丝体缠绕紧密,螺旋状排列居多。

图4 兔眼蓝莓菌根真菌回接试验显微观察Fig 4 Microscopic observation of mycorrhizal fungi on the roots of the tested blueberry
2.5 兔眼蓝莓菌根真菌的鉴定及系统发育树的构建
筛选出的促兔眼蓝莓生长的B、F、H和I优势菌株,通过菌落外观形态、菌丝光学显微观察,结合台盼蓝染色进行菌丝形态差异性比较,对4种优势菌株进行初步分类鉴定。形态学观察结果如图5所示,其结构特征总结如见表3。

表3 菌根菌株的形态学特征

图5 菌根真菌菌落和菌丝体结构观察
Fig 5 Colony and mycelium observation of mycorrhizal fungi
B、F、H、I菌角标:1表示菌落形态;2表示菌丝形态;3表示台盼蓝染色后的菌丝形态
根据魏景超的真菌鉴定手册,对4种真菌进行形态学分类,初步鉴定为毛霉科真菌。
2.6 菌根真菌的分子鉴定
为了对4种真菌进行种属的分类,本试验利用 18S rDNA 测序技术,从核酸水平对菌株进行分类鉴定,以真菌 rDNA 的 ITS 序列通用引物对供试菌株ITS序列进行扩增。将测序获得的ITS序列在 GenBank 数据库中进行 BLAST 比对分析,其ITS序列与毛霉属真菌的部分序列同源性较高,同时对搜索结果得到的同源性大于 97% 的序列运用 Clustal W 软件进行序列匹配分析,运用 MEGA6.06软件中的 Neighbor-joining 法构建系统发育树,确定供试菌株的系统发育地位。
在系统发育树分析过程中,我们选出与菌株亲缘关系较近的4株菌株进行序列的相似率分析,其中B菌与Mucorcircinelloidesf.lusitanicus的序列覆盖度(Query coverage) 达到 100%,最大序列相似度(Max Ident) 达到 100%;F菌与Mucorcircinelloides的序列覆盖度(Query coverage) 达到 99%,最大序列相似度( Max Ident) 达到 99.5%;H菌与Mucorracemosus的序列覆盖度(Query coverage) 达到 99%,最大序列相似度(Max Ident) 达到 99.8%;I菌与Mucorcircinelloides的序列覆盖度(Query coverage) 达到 99%,最大序列相似度(Max Ident) 达到 99.8% 。综合发育树与相似率及形态学观察分析,判断B菌属于毛霉属卷枝毛霉种(Mucorcircinelloidesf.lusitanicus),F和I菌也归属于毛霉属卷枝毛霉种(Mucorcircinelloides);H菌属于毛霉属总状枝毛霉种(Mucorracemosus)。由此可以看出菌根真菌B、F、H和I与毛霉属真菌的亲缘关系较近。
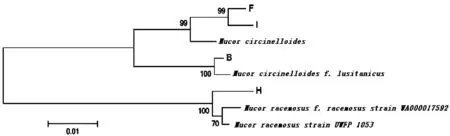
图6 菌株系统发育树Fig 6 Phylogenetic tree of mycorrhizal fungi strains
3 讨论
蓝莓属于菌根植物,其根系常含有多种类型菌根真菌[21],国外研究证明菌根真菌既可以促进蓝莓对多种营养元素的吸收,也可以在重金属元素过量时起到拮抗作用[22-23]。本文对安徽省皖南地区蓝莓基地栽培的兔眼蓝莓菌根进行采集,分离得到了促进兔眼蓝莓植株生长的菌根真菌并鉴定出其在分类学上的地位。通过对兔眼蓝莓植株叶片的N、P、K的相对含量及叶绿色含量的检测,表明分离得到的菌根真菌能够促进蓝莓植株营养元素的吸收。
兔眼蓝莓菌根结构属于典型的杜鹃类菌根,形成特殊毛根。最外层的表皮层是菌根真菌的侵染场所。在浸染的过程中,首先是菌丝进入表皮细胞进行分支,形成分枝状或圈状的胞内菌丝团,菌丝在通过这个结构时变细,侵入表皮内部。被杜鹃类菌根真菌侵染的细胞每个菌丝群结构都与胞外菌丝直接相连,在根的表面可以观察到根外菌丝。
通过试验选出的4个菌株在兔眼蓝莓毛根试验中均观察到了菌丝体侵染现象,呈现出典型的杜鹃花类菌根特征,其中在B菌、F菌侵染毛根表皮细胞中观察到胞内菌丝团,B、F、I菌侵染毛根表皮细胞中都观察到了平行排列的菌丝体,而在H菌中,菌丝体缠绕紧密,螺旋状排列居多。
本试验首次使用量子共振技术和多光谱成像系统技术对兔眼蓝莓叶片营养元素和叶绿素含量进行检测,分析菌根真菌对兔眼蓝莓生长的影响,试验方法更加简便可信。由于真菌的菌落形态受环境因素和培养条件的影响,其形态学和培养特征不稳定,在培养条件下很难产孢,为真菌的形态学鉴定带来困难[24-25],且菌根真菌的分布具有地理区域差异性。因此,通过形态学观察鉴定,结合分子鉴定手段,可以提高兔眼蓝莓菌根真菌鉴定结果的可靠性。
形态学分类结果显示,这4种菌属于毛霉科真菌;分子生物学鉴定得知B菌归属于毛霉属卷枝毛霉种f.lusitanicus(Mucorcircinelloidesf.lusitanicus),F和I菌也归属为毛霉属卷枝毛霉种(Mucorcircinelloides),其亚种分类待定,H菌归属于毛霉属总状枝毛霉种(Mucorracemosus)。本试验鉴定得到的兔眼蓝莓菌根真菌与其它地区蓝莓的菌根真菌不同,属于毛霉属菌根真菌。
4 结论
课题组首次从皖南兔眼蓝莓根系筛选出4株促进兔眼蓝莓生长的内生菌根真菌。通过对兔眼蓝莓幼苗及兔眼蓝莓植株的菌根真菌接种试验及N、P、K元素相对含量的检测,证明4种优势菌株对兔眼蓝莓植株的生长具有促进作用。通过分子生物学鉴定得知菌根真菌B菌归属于毛霉属卷枝毛霉f.lusitanicus种(Mucorcircinelloidesf.lusitanicus),F和I菌也归属为毛霉属卷枝毛霉种(Mucorcircinelloides),H菌归属于毛霉属总状枝毛霉种(Mucorracemosus)。该项研究成果为后期兔眼蓝莓菌根真菌商业化的制备提供可能和基础。
致谢:感谢安徽农业大学林学院黄勃教授真菌分子鉴定上给予的技术支持;感谢合肥师范学院蓝莓苗组培中心的徐德聪博士提供的帮助;感谢安徽大学生命科学学院潘文娟博士在多光谱成像系统技术方面提供的指导!
[1]李亚东. 越橘栽培与加工利用[M]. 长春:吉林科学技术出版社, 2001: 101-102.
[2]史海芝, 刘惠民. 国内外蓝莓研究现状[J]. 江苏林业科技, 2009, 36(4): 48-51.
[3]谭 钺, 王茂生, 吕 勐,等. 土壤环境对蓝莓生长的影响及改善措施[J]. 山东农业科学, 2015, 47( 3): 80-84.
[4]盛江梅, 吴小芹. 菌根真菌与植物根际微生物互作关系研究[J]. 西北林学院学报, 2007, 22(5): 104-108.
[5]袁继鑫. 野生蓝莓菌根真菌的分离、鉴定及接种效应 [D]. 北京:北京林业大学, 2013.
[6]肇 莹, 杨 涛, 孙进杰, 等. 一株蓝莓菌根真菌的鉴定及对蓝莓生长的影响[J]. 浙江农业学报, 2015, 27(3): 400-405.
[7]LIU X, LI X, LIU H, et al. Phylogenetic analysis of different ploidy saccharum spontaneum based on rDNA-ITS sequences[J]. PLoS One, 2016, 11(3): e0151524.
[8]陈剑山, 郑服丛. ITS序列分析在真菌分类鉴定中的应用[J]. 安徽农业科学, 2007, 35(13): 3785-3786.
[9]李依韦, 银 玲. rDNA-ITS序列分析在植物病原真菌分类鉴定中的应用[J]. 内蒙古民族大学学报(自然科学版), 2012, 27(1): 66-67.
[10]刘小燕, 屈 艾, 闫晶晶. 不同菌根真菌对蓝莓组培苗移栽成活率和生长的影响[J]. 山东农业科学, 2012,44( 5): 40-44.
[11]褚翠翠, 陆 宁, 宛晓春. 米邦塔仙人掌粗多糖的提取及量子共振分析[J]. 食品工业科技, 2007,28( 8): 185-187.
[12]李 茜, 黄 伟, 黄 蓓. 富硒螺旋藻对急性高脂血症小鼠血脂水平的影响[J]. 食品科学, 2016, 37(1): 194-197.
[13]岳晓斌, 师建国, 颜 虹. 量子共振检测(QRS)国内应用状况[J]. 国际精神病学杂志, 2010, 37(2): 115-118.
[14]PAN W J, WANG X, DENG Y R, et al. Nondestructive and intuitive determination of circadian chlorophyll rhythms in soybean leaves using multispectral imaging[J]. Sci Rep, 2015, 5:11108.
[15]王旭丽, 康振生, 黄丽丽, 等. ITS序列结合培养特征鉴定梨树腐烂病菌[J]. 菌物学报, 2007, 26(4): 517-527.
[16]王芝娜, 李 杰, 张银杰. 中国兰属植物菌根真菌的rDNA ITS分析[J]. 西北农林科技大学学报(自然科学版), 2013, 41(4): 191-196.
[17]ALTSCHUL S F, GISH W, MILLER W, et al. Basic local alignment search tool[J]. J Mol Biol, 1990, 215(3): 403-410.
[18]THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The clustal_x windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res, 1997, 25(24): 4876-4882.
[19]郭晓倩,房子舒,刘凤娇,等. 东北野生蓝莓花色苷组分分析及其抗氧化性比较[J]. 现代食品科技, 2016, 32(3): 313-320.
[20]冯 洁, 廖宁放, 梁敏勇, 等. 用于植物病虫害诊断的多光谱成像系统[J]. 光谱学与光谱分析, 2009,29( 4): 1008-1012.
[21]郑 钰, 高 博, 孙立夫, 等. 银叶杜鹃和繁花杜鹃根部真菌的多样性[J]. 生物多样性, 2010, 18(1): 76-82.
[22]STRIBLEY D P, READ D J. The biology of mycorrhiza in the ericaceae.The relationship between mycorrhizal infection and the capacity to utilize simple and complex organic nitrogen source[J]. New phytol, 1980, 86(4):365-371.
[23]SUT M, BOLDT-BURISCH K, RAAB T. Possible evidence for contribution of arbuscular mycorrhizal fungi (AMF) in phytoremediation of iron-cyanide (Fe-CN) complexes[J]. Ecotoxicology, 2016, 25(6):1260-1269.
[24]胡克兴.石斛属药用植物内生真菌多样性研究[D]. 北京:中国协和医科大学, 2008.
[25]龙良鲲, 姚 青, 羊宋贞, 等.一株丛枝菌根真菌的形态与分子鉴定[J]. 华南农业大学学报, 2006, 27(4): 40-42.
Isolation and identification of mycorrhizal fungi for the promoting growth ofVacciniumAshei
ZHAO Lei1, LIU Wei1, FU Xiang1, SHAN Xiao-di1, ZHANG Shu-xiang1, JIANG Guang-yue2, HUANG Bei1
(1. School of Life Science, Anhui University, Hefei 230601; 2. Anhui Academy of Agricultural Sciences, Hefei 230031, China)
Nine mycorrhizal fungi were isolated from the roots ofVacciniumAsheiinsouthern Anhui Province. The inoculation experiments for the mycorrhizal fungi were performed to detect the survival rate and the height in the shoots and to test the nutrient elements and chlorophyll content in plants of blueberry. four Fungi strains were found as dominant strains in promoting growth ofVacciniumAshei. Through morphological observation and molecular identification method, we found that three strains belong to familiesMucorspeciesMucorcircinelloides, and the different among them may be in subspecies level. Another species belongs to familiesMucorspeciesMucorracemosus, and the similarity between them was greater than 99%. The mycorrhizal fungi from familiesMucorspeciesMucorcircinelloidesandMucorracemosuscan significant promote the nutrient absorption and growth ofVacciniumAshei.
VacciniumAshei; mycorrhizal fungi; inoculation experiment; ITS sequence; molecular identification
2016-09-14;
2016-09-26
安徽省科技厅科技攻关项目(No. 1301032140)
赵 磊,硕士研究生,研究方向为生物化学与分子生物学,E-mail:1012941160@qq.com
黄 蓓,博士,教授,研究方向为细胞生物学,E-mail:beihuang@163.com
Q93-331
B
2095-1736(2017)04-0016-05
doi∶10.3969/j.issn.2095-1736.2017.04.116
