铅暴露对大弹涂鱼(Boleophthalmuspectinirostris)组织形态的影响
2017-08-16景丹丹龚一富王日昕
景丹丹, 龚一富, 张 燕, 俞 凯, 黎 明, 王日昕
(宁波大学 海洋学院, 宁波 315211)
铅暴露对大弹涂鱼(Boleophthalmuspectinirostris)组织形态的影响
景丹丹, 龚一富, 张 燕, 俞 凯, 黎 明, 王日昕
(宁波大学 海洋学院, 宁波 315211)
为了研究环境中铅离子(Pb2+)对大弹涂鱼肝、肠和脾组织结构的损伤,实验挑选体质量(21.80±2.70)g的健康大弹涂鱼96尾,分为4组,高剂量Pb2+处理组(2 mg/L)、中剂量Pb2+处理组(1 mg/L)、低剂量Pb2+处理组(0.5 mg/L)和空白组,进行毒性试验,分别于第12 h、48 h和96 h取样,对各组织器官进行组织切片分析。结果表明:随着Pb2+浓度的升高及处理时间的延长,肝组织出现组织水肿,部分细胞质空泡化、细胞核固缩;肠组织上皮细胞受损,杯状细胞明显增多;脾中淋巴细胞增多。研究表明,Pb2+暴露对大弹涂鱼肝、肠及脾组织结构均会造成伤害。
铅;大弹涂鱼;毒性机制;生物富集;组织结构
近年来,随着工业废水的排放、化肥农药的施用,水体重金属污染现象日益严重。铅(Pb)是一种广泛存在于自然界中的重金属元素。在水域生态系统中,铅可通过生物富集作用逐级放大,尤其对处于食物链顶部的鱼类来说危害较大。哺乳动物铅中毒机制研究已较为深入:Pb能够与Ca2+竞争受体,影响细胞内第二信使的活性,导致细胞损伤[1];干扰即刻早期基因(IEG)表达,影响神经系统发育[2];诱导视杆细胞凋亡,影响线粒体功能[3];过度激活自由基(ROS),造成氧化损伤[4]。吴晨等[5]发现在醋酸铅灌胃诱导下小鼠肝细胞结构损伤严重,细胞核体积缩小,染色质浓缩,线粒体肿胀,并出现空泡及线粒体的崩解。Pb在水生生物体内具有很强的蓄积性,在污染后不易被监测且难降解,不仅对水生生物系统构成危害,还可通过食物链对人类健康造成威胁[6]。
大弹涂鱼(Boleophthalmuspectinirostris)在分类上属于鲈形目、虾虎鱼亚目、弹涂鱼科、大弹涂鱼属,为暖水广温广盐性两栖经济鱼类,主要分布于近海及滩涂上[7]。大弹涂鱼对多种环境污染物敏感,是良好的环境污染指示者,在近岸养殖水体监测方面能够起到重要作用[8]。目前,鱼类消化道组织学研究较多[9-13],但重金属胁迫对鱼类组织学的研究较少。随着铅污染日益严重,越来越多的学者开始关注铅对鱼类的组织结构损伤。戴伟等[14]研究发现,饲料铅暴露诱导罗非鱼,致使肝细胞发生颗粒性样变、水样变和脂肪样变,同时胰腺细胞内酶原颗粒减少,发生炎细胞浸润。
本文对不同铅浓度不同暴露时间下大弹涂鱼的肝、肠和脾的形态组织结构进行研究,旨在通过组织学的研究探讨铅对鱼类组织器官造成的损害程度,为有效评价铅对生物的危险性和对机体可能产生的损伤作用提供形态学依据。
1 材料与方法
1.1 材料
实验所用大弹涂鱼购自浙江宁波,体重(21.80±2.70)g。大弹涂鱼在宁波大学校内养殖系统中暂养72 h后,选取大小均匀、性别为雄性、表皮无损伤、健康的大弹涂鱼进行毒性实验。所用海水为购买的清洁海水。
1.2 方法
1.2.1 铅处理
将醋酸铅配置成一定质量浓度的母液,实验前将母液用清洁海水稀释至指定质量浓度。将大弹涂鱼随机分配到12个10 L塑料养殖桶中,每桶8尾。实验分别设置0(对照)、0.5、1和2 mg/L Pb2+处理组(每个浓度设置3个重复),胁迫周期为96 h。养殖过程中,每天更换相同Pb2+浓度的海水,水温20℃~25℃,盐度12‰,保持自然光照。
1.2.2 取样
在实验开始后的12、48和96 h,从各处理组随机取鱼,每次每桶取3尾,冰浴麻醉后解剖获得肝、肠和脾,用生理盐水洗净,放入10%福尔马林中固定48 h。
1.2.3 组织石蜡包埋与切片
取固定了48 h的大弹涂鱼各组织,分别配置70%、80%、90%、95%和100%的梯度酒精进行脱水处理,二甲苯透明。
在组织包埋机中,石蜡温度为65℃,二甲苯∶石蜡(1∶1)浸透组织,再用石蜡浸蜡2次。包埋,切片厚度为6 μm。用毛笔将蜡片放到载玻片上,蛋白甘油黏附。55℃蒸馏水中展片,60℃烘箱1 h进行干片。
1.2.4 染色
将烘干后的蜡片用苏木精和伊红等试剂进行染色,树脂封片,在Olympus BX-51显微镜下观察并拍照。
2 结果
2.1 不同浓度铅暴露对大弹涂鱼肝结构的影响
铅暴露对大弹涂鱼肝脏组织结构的影响如图1所示,对照组(A-1、A-2、A-3)中肝细胞分布均匀,细胞核位于细胞中央,清晰可见,细胞呈多边形,相邻细胞分界明显,肝细胞单层排列形成肝板。可见管腔较大、管壁薄的小叶间静脉(A-2);0.5 mg/L Pb2+处理96 h后,肝组织开始出现细胞空质化,即细胞膜受损,细胞核裸露现象明显(B-3);在高浓度铅(1和2 mg/L)处理后,开始出现细胞核缩小,甚至消失的现象(C-3、D-1、D-2、D-3)。

图1 铅暴露对大弹涂鱼肝脏结构的影响(H-E,×200)
A-1、A-2、A-3为对照组; B-1、B-2、B-3为0.5 mg/L; C-1、C-2、C-3为1 mg/L; D-1、D-2、D-3为2 mg/L。其中,HC:肝细胞;HP:肝板;IV:小叶间静脉;CV:细胞质空泡化;PN:核固缩;V:空泡化
2.2 不同浓度铅暴露对大弹涂鱼肠结构的影响
如图2所示,对照组(a-1、a-2、a-3)的肠壁结构完整,细胞核清晰且分布规律;Pb2+暴露12 h时,对照组的肠壁结构与正常组并无大的区别;Pb2+暴露48 h和96 h时,随着铅浓度的升高,肠壁结构被破坏,细胞核分布不规律,杯状细胞开始明显增多,且固有膜开始缩小(c-3、d-2、d-3)。
2.3 不同浓度铅暴露对大弹涂鱼脾组织的影响
对照组(1-1、1-2、1-3)的脾红髓区与白髓区相混合,分界不明显,白髓区颜色较深并且范围较大;随着Pb2+浓度的升高和暴露时间的延长,白髓区的范围逐渐缩小,并且出现大量的蓝色淋巴细胞,并且在铅暴露第96 h,高浓度铅组(3-3、4-3)脾组织间开始出现空白,脾结构变疏松,见图3。
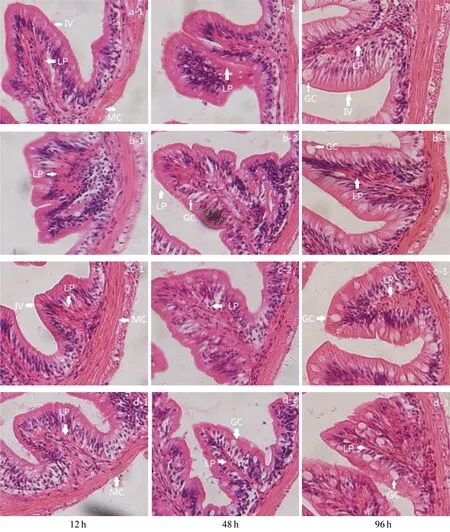
图2 铅暴露对大弹涂鱼肝脏结构的影响(H-E,×200)
a-1、a-2、a-3为对照组; b-1、b-2、b-3为0.5 mg/L; c-1、c-2、c-3为1 mg/L; d-1、d-2、d-3为2 mg/L。其中,MC:肌层;IV:肠绒毛;LP:固有膜;GC:杯状细胞
3 讨论
铅能够通过皮肤、鳃等组织进入鱼体内,引起鱼体的一系列生理变化,当环境中铅浓度过高时会对鱼体组织造成损伤,引起组织结构异常和组织病变,严重影响鱼类的生命代谢活动。另外重金属离子能使核酸解聚,结合在磷酸酯基上的重金属离子可从 RNA 和核酸的磷酸二酯键上夺取电子,从而使得成键不稳定、易水解,这样生物大分子可降解成小的碎片, 甚至消失[15]。
肝脏是鱼类重要的解毒器官,能够有效地清除环境污染物,将有毒物质代谢分解成无毒或低毒物质,并排出体外,因此鱼类肝脏组织的结构变化可以作为环境中有毒物质的生物指标[16-17]。本研究发现,大弹涂鱼肝组织在铅的暴露作用下,随着暴露时间的延长和浓度的增加,肝细胞排列紊乱,部分肝细胞空泡化,表明肝脏组织是铅及其代谢物的靶器官,由于铅进入肝脏组织中,诱导肝组织产生过多的氧自由基攻击细胞膜,使细胞膜破损,细胞核裸露,从而导致细胞质空泡化。本研究还发现,肝细胞在铅暴露作用下表现出组织肿胀,以及核固缩甚至消失的现象,推测可能是由于肝细胞凋亡导致。这与前人的研究结果是一致的:陈其晨等[18]研究发现暴露在污染物中的白鲢和草鱼,其肝实质部的大部分呈现出细胞空泡化,仅能见到染色较深的核和核仁;此外肝细胞还出现核固缩现象,核仁消失不见;细胞间隙及窦状隙腔都相应扩大。在污染物的胁迫下,鱼类肝组织会通过增大肝窦间隙,增强肝组织进行物质交换的能力,从而减轻机体损伤,但由于窦间隙的增大导致肝细胞与血液间物质交换发生变化,造成大量液体滞留从而使肝组织发生水肿[19-22]。

图3 铅暴露对大弹涂鱼脾脏结构的影响(H-E,×200)
1-1、1-2、1-3为对照组; 2-1、2-2、2-3为0.5 mg/L; 3-1、3-2、3-3为1 mg/L; 4-1、4-2、4-3为2 mg/L。 其中,M:黑色素巨噬细胞;MC:黑色素巨噬细胞中心;L:淋巴细胞;LC:淋巴细胞聚集区
消化系统功能的完整性对于鱼类来说,是整个生命活动得以维持的关键。鱼类肠道对食物的消化和吸收直接影响鱼类生长、发育和繁殖[23]。鱼类的肠道分为黏膜层、黏膜下层、肌肉层和浆膜层。黏膜层的上皮由单层柱状上皮细胞构成,其中散布不少杯状细胞。杯状细胞能分泌消化酶,且分泌黏液,借以保护上皮细胞[24]。吴昊[25]研究发现,河南华溪蟹在急性29.00 mg/L镉暴露4 d后,光镜下观察到急性镉处理对消化系统的损伤作用较大,可见后肠组织的肌纤维出现水肿、玻璃样变性,中肠组织甚至出现大面积细胞从基膜脱落、破裂及坏死的现象。本实验通过对大弹涂鱼的肠道结构进行形态学的观察,发现随着铅浓度的升高和铅暴露时间的延长,肠壁结构被破坏,上皮细胞受损,杯状细胞不断增多,推测可能是铅导致了肠道抗氧化系统的损伤,产生过多的脂质过氧化产物,从而导致杯状细胞的增多。另外推测铅通过破坏肠道结构使肠道无法发挥正常功能从而使机体产生中毒现象。
脾脏是硬骨鱼类重要的免疫造血器官,由红髓、白髓以及血管网组成[26]。白髓由淋巴细胞组成,是特异性免疫发生的主要场所。当抗原入侵脾脏引起体液免疫应答时,白髓中的淋巴细胞会大量增加[27]。红髓中存在着大量的血细胞,是免疫吞噬发生的主要场所[28]。王少博等[29]研究发现在镉暴露后,草鱼脾脏出现明显的细胞破裂,组织内出现较多的空隙,细胞分布变松散。鲍红丹等[30]发现,低水平铅暴露,能够使小鼠脾脏红髓与白髓分界不清楚,且白髓发育不良。另外有研究表明,铅对免疫功能的影响与铅对抑制培养脾细胞的增生反应有关[31]。本实验研究发现,随着Pb2+浓度的升高和暴露时间的延长,大弹涂鱼脾脏白髓区的范围逐渐缩小,脾组织间开始出现空隙,脾结构变疏松,并且出现数量较多的黑色素巨噬细胞,这种细胞能够吞噬脂褐素,因此细胞的体积相对较大,聚在一起就成了脂褐素细胞团。研究提示铅暴露引起脾组织形态结构的改变,可能是铅中毒影响免疫系统的一个重要机制。
综上所述,不同浓度铅暴露会对大弹涂鱼的组织结构产生一定的损伤,而延长暴露时间亦会有同样的作用,说明无论是高浓度的铅暴露还是低浓度铅的持续暴露都会使大弹涂鱼的组织结构遭受损伤,因此,本研究为铅对大弹涂鱼损伤提供了基本理论基础。
[1]SUSZKIW J B. Presynaptic disruption of transmitter release by lead[J]. Neurotoxicology, 2004, 25(4): 599-604.
[2]安兰敏, 牛玉杰, 徐 兵, 等. 铅对大鼠脑细胞凋亡的诱发作用及对fos、jun、p53基因和一氧化氮合酶表达的影响[J]. 癌变·畸变·突变, 2006, 18(5): 359-362.
[3]SHARIFI A M, BANIASADI S, JORJANI M, et al. Investigation of acute lead poisoning on apoptosis in rat hippocampus in vivo[J]. Neuroscience Letters, 2002, 329(1): 45-48.
[4]CHEN L, YANG X, JIAO H, et al. Tea catechins protect against lead-induced ROS formation, mitochondrial dysfunction and calcium dysregulation in PC12 cells[J]. Chemical Research in Toxicology, 2003, 16(9): 1155-1161.
[5]吴 晨, 连灵君, 徐 进, 等. 铅对小鼠肝脏超微结构及凋亡相关蛋白p53、Bax、Bcl-2表达的影响[J]. 环境科学学报, 2006, 26(9): 1510-1514.
[6]衡银亮. 水体铅污染致病风险与处理技术[J]. 河南水利与南水北调, 2014(10): 72-73.
[7]ROGERS J T, RICHARDS J G, WOOD C M. Ionoregulatory disruption as the acute toxic mechanism for lead in the rainbow trout (Omorhynchusmykiss)[J]. Aquatic Toxicology, 2003, 64(2): 215-234.
[8]张春丹, 黄福勇, 李明云, 等. 铬胁迫条件下大弹涂鱼(Boleophthalmuspectinirostris)外周血微核标记及肝脏过氧化物酶标记的变化[J]. 海洋与湖沼, 2006, 37(1): 7-12.
[9]苏友禄, 孙秀秀, 冯 娟, 等. 军曹鱼消化系统的形态及组织学研究[J]. 南方水产, 2008, 4(6): 88-94.
[10]王永波, 陈国华, 王 珺, 等. 波纹唇鱼消化系统的组织学[J]. 水生生物学报, 2010, 34(4): 685-693.
[11]赵 峰, 张龙珍, 庄 平, 等. 长鳍篮子鱼的外形特征与消化系统结构[J]. 海洋渔业, 2008, 30(3): 202-206.
[12]勾效伟, 区又君, 廖 锐, 等. 平鲷消化系统形态学、组织学及组织学研究[J]. 南方水产, 2008, 4(5): 28-36.
[13]王健鑫, 石 戈, 李 鹏, 等. 条石鲷消化道的形态学及组织学[J]. 水产学报, 2006, 30(5): 618-626.
[14]戴 伟, 金成官, 傅玲琳, 等. 饲料铅暴露对罗非鱼肝胰脏抗氧化防御系统及显微结构的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(3): 350-354.
[15]徐永江, 柳学周, 马爱军. 重金属对鱼类毒性效应及其分子机理的研究概况[J]. 海洋科学, 2004, 28(10): 67-70.
[16]MENARD A, DROBNE D, JEMEC A. Ecotoxicity of nanosized TiO2review of in vivo data[J]. Environmental Pollution, 2011, 159(3): 677-684.
[17]ALVES L C, GLOVER C N, WOOD C M. Dietary Pb accumulation in juvenile freshwater rainbow trout (Oncothynchusmykiss)[J]. Archives of Environment Contamination & Toxicology, 2006, 51(4): 615-625.
[18]陈其晨, 张克检, 徐关文. 重金属对鱼类毒性的综合研究[J]. 水产学报, 1988(1): 21-33.
[19]DEVI G P, AHMED K B A, VARSHA M K N S, et al. Sulfidation of silver nanoparticle reduces its toxicity in zebrafish[J]. Aquatic Toxicology, 2014, 158: 149-156.
[20]Al-BARIRUTY G A, SHAW B J, HANDY R D, et al. Histopathological effects of waterborne copper nanoparticles and copper sulphate on the organs of rainbow trout (Oncorhynchusmykiss)[J]. Aquatic Toxicology, 2013, 126: 104-115.
[21]AHMED M K, HABIBULLAH-AL-MAMUN M, PARVIN E, et al. Arsenic induced toxicity and histopathological changes in gill and liver tissue of freshwater fish, tilapia (Oreochromismossambicus)[J]. Experimental and Toxicologic Pathology, 2013, 65(6): 903-909.
[22]AMEUR W B, LAPUENTE J D, MEGDICHE Y E, et al. Oxidative stress, genotoxicity and histopathology biomarker responses in mullet (Mugilcephalus) and sea bass (Dicentrarchuslabrax) liver from Bizerte Lagoon (Tunisia)[J]. Marine Pollution Bulletin, 2012, 64(2): 241-251.
[23]徐革锋, 陈侠君, 杜 佳, 等. 鱼类消化系统的结构、功能及消化酶的分布与特性[J]. 水产学杂志, 2009, 22(4): 49-55.
[24]徐永锋, 宋代军. 鱼类肠道组织结构及其功能适应性[J]. 江西饲料, 2004(4): 16-19.
[25]吴 昊. 镉对河南华溪蟹消化系统的损伤作用和毒性机制的研究[D]. 太原: 山西大学, 2014.
[26]曹守花. 鲻鱼呼吸代谢及免疫、嗅觉器官组织形态结构初步研究[D]. 上海: 上海海洋大学, 2013.
[27]李宗芳, 张 澍. 脾脏的基础研究进展与展望[J]. 西安交通大学学报(医学版), 2008, 29(1): 1-6.
[28]CHADBURN A. The spleen: anatomy and anatomical function[J]. Seminars in Hematology, 2000, 37(1): 13-21.
[29]王少博, 王维民, 郭亚楠, 等. 重金属镉和铬对草鱼苗的急性和慢性毒性效应[J]. 兰州大学学报(自然科学版), 2007, 43(4): 60-64.
[30]鲍红丹, 孙 鹂. 低水平铅染毒对小鼠脾脏显微结构的影响[J]. 杭州师范学院学报(自然科学版), 2005, 4(6): 431-432.
[31]MCMURRY S T, LOCHMILLER R L, CHANDRA S A, et al. Sensitivity of selected immunological, hematological and reproductive parameters in the cotton rat to subchronic lead exprosure[J]. Journal of Wildlife Diseases, 1995, 31(2): 193-204.
Effects of Pb2+on tissue structure of liver, intestines and spleen in mudskipperBoleophthalmuspectinirostris
JING Dan-dan, GONG Yi-fu, ZHANG Yan, YU Kai, LI Ming, WANG Ri-xin
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
In order to study the effects of Pb2+on tissue structure of liver, intestines and spleen of fish, Mudskippers (21.80±2.70)g were randomly stocked into 16 tanks with 8 fish each in triplicate. The fish were exposed to 0, 0.5, 1 and 2 mg/L Pb2+, and sampled on the 12th, 48thand 96thh. The results showed that Pb2+exposure results in tissue edema, cytoplasm vacuolization and in liver, epithelial cell damage, gobiet cells increased in intestinal, and lymphocytes increased in spleen. The results indicated that Pb2+exposure can cause damage to the structure of liver, intestines and spleen of mudskipper.
Pb2+;Boleophthalmuspectinirostris; toxic mechanism; bio-concentration; structure
2016-08-02;
2016-08-19
国家自然科学基金(31272661);宁波市自然科学基金(2016A610083)
景丹丹,硕士研究生,主要从事海洋生物学研究,E-mail:1149859493@qq.com
龚一富,副教授, 主要从事植物分子生物学, E-mail: gongyifu@163.com
Q495;X174
A
2095-1736(2017)04-0029-04
doi∶10.3969/j.issn.2095-1736.2017.04.029
