木瓜榕食果榕小蜂雌蜂触角感器的扫描电镜观察
2017-08-16李宗波杨大荣彭艳琼
杨 培, 李宗波, 杨大荣, 彭艳琼
(1. 中国科学院西双版纳热带植物园 热带森林生态学重点实验室, 勐腊 666303; 2. 西南林业大学林学院 云南省森林灾害预警与控制重点实验室, 昆明 650224)
木瓜榕食果榕小蜂雌蜂触角感器的扫描电镜观察
杨 培1, 李宗波2, 杨大荣1, 彭艳琼1
(1. 中国科学院西双版纳热带植物园 热带森林生态学重点实验室, 勐腊 666303; 2. 西南林业大学林学院 云南省森林灾害预警与控制重点实验室, 昆明 650224)

请扫二维码,关注本文及作者更多信息
木瓜榕食果榕小蜂是一种专性寄生于木瓜榕雌花前期榕果的一类造瘿寄生蜂,对其雌蜂触角进行了扫描电镜观察。结果表明,木瓜榕食果榕小蜂雌蜂触角呈膝状,长(1342.5±96.5)μm,由转节、柄节、梗节和11个鞭小节组成。触角感器共有5类6种,分别为毛形感器、刺形感器、锥形感器(单孔形和多孔形)、栓锥型乳突状感器、多孔板形感器,且多数感器位于触角的外侧面和腹面。其中,毛形感器和多孔板形感器是其主要感器,前者除转节外的触角各节均有分布,后者数量均匀分布于触角第3~10鞭小节。结合木瓜榕食果榕小蜂产卵行与触角感器类型和分布,对触角感器的功能进行了探讨。这些结果将为下一步开展电生理学研究,揭示木瓜榕食果榕小蜂寄主搜寻和信息利用模式奠定基础。
木瓜榕;雌花前期;非传粉榕小峰;食果榕小蜂;触角感器
昆虫与植物形成的生态系统是陆地生态系统中最重要的组成部分。自石炭纪开始,两者经历了3亿多年的演化,形成了互利共生、协作、寄生、竞争、捕食等各种种间互作关系,这种互作实质上是以营养为基础形成的食物链;而在食物链之外,还存在一个以信息为基础将物种无形联系起来的信息链[1-2],这是物种互作和协同进化的基础,而榕树与传粉榕小蜂形成的互利共生则是种间互作的一个极好例子[3-5]。
榕蜂互利共生系统指榕树(Ficusspp.)与其传粉榕小蜂(Chalcidoidea: Agaoninae)形成的传粉育幼繁殖系统(Nursery pollination mutualisms)[6],榕树依赖专一性传粉榕小蜂为其传粉,传粉榕小蜂也须依赖榕树提供的唯一场所才能实现自身的繁殖,两者相得益彰,缺一不可。但是,在榕蜂互利共生系统之内,还存在一类寄生于榕树雌花资源或传粉榕小蜂的非传粉榕小蜂,包括造瘿类、寄居类、寄生类等,对榕蜂互利共生有负向影响[7-8]。榕果具有雌花前期、雌花期、间花期、雄花期和成熟期5个发育阶段,雌花期榕果顶端苞片会主动开放,允许传粉榕小蜂进入榕果产卵或传粉,但多数非传粉榕小蜂并不进入榕果,主要在果壁外通过产卵器将卵产于榕果内部,产卵时期包括雌花前期、雌花期和间花期3个发育阶段[8]。待榕果发育至雄花期,无论传粉榕小蜂或是非传粉榕小蜂,所有后代均发育成熟,然后依赖传粉榕小蜂雄蜂后代挖掘的出蜂口从榕果果腔内出来,开始新的生命循环[4]。已有研究表明,传粉榕小蜂和非传粉榕小蜂均依赖于阶段性榕果释放的特异性信息化学物质进行寄主定位[9-12],这意味着不同种类、不同产卵阶段的榕小蜂所利用的信息物质存在着差别。
木瓜榕(FicusauriculataLour.)广泛分布于西双版纳低山沟谷潮湿雨林中,是该地区一类关键物种[5],其榕果主要寄生着传粉者Ceratosolenemarginatus,造瘿者Sycophagasp.,寄生者Philotrypesislongicaudata和Sycoscapterroxburghi4种榕小蜂,分别于榕果发育至雌花期,雌花前期和间花期产卵。其中,造瘿者木瓜榕食果榕小蜂最为特殊,其产卵不仅仅局限于雄性榕果,还可在雌性榕果内产卵,且后代也可在雌果内正常羽化、交配(图1)。因此,对于这样一个榕蜂繁殖群落,木瓜榕食果榕小蜂识别寄主所利用的信息化学物质是什么?雌雄榕果信息物质构成有何异同?什么因素使其无法分辨雌雄榕果?为解答这些问题,并为后续开展榕小蜂电生理学研究(GC-EAD)提供支持信息,有必要对其触角及其着生的感器类型、分布、数量等进行扫描电镜观察。
1 材料与方法
1.1 木瓜榕食果榕小蜂
木瓜榕食果榕小蜂隶属于膜翅目(Hymenoptera)金小蜂科(Pteromalidae)延腹榕小蜂亚科(Sycoryctinae),雌雄二型(图1-A、B、C)。雌蜂体黑色,体长(2.25±0.21)mm,产卵器长(12.92±0.78)mm,果外产卵,专性寄生于木瓜榕; 雄蜂体黄色,无翅,终生生活于榕果内部,主要任务是与雌蜂交配(图1-C)。

图1 木瓜榕食果榕小蜂形态及其在雌花前期榕果果外产卵的行为特征
A. 雄果;B.雌果;C.雌果内繁殖的雄蜂,实线示雄蜂瘿花,虚线示雌蜂瘿花
1.2 扫描电镜观察雌蜂
将新羽化的雌蜂固定于2.5%戊二醛中,于4℃保存2 h,然后放入PBS缓冲液(pH 7)中超声波清洗50 s,之后逐级脱水(30%、50%、70%、80%、95%乙醇,无水乙醇,醋酸异戊酯),每次10 min。脱水完成后,样品经临界点干燥(Quorum K850),于体视镜下摘取触角,按背面、腹面和侧面黏附在样品台上,每个面5根触角。镀金后,样品用环境扫描电子显微镜(EVO LS10)观察,加速电压10 kV。
1.3 触角感器的分类与统计
触角感器的命名主要参照传统分类方法[13-14],特别是膜翅目寄生蜂[15-20],并基于外部形态、表面特征、孔的位置和开口方式等加以确定。利用Photoshop移除背景色,用WonderWebware Screen Ruler测量各感器长度、宽度和基部直径;触角各部感器数量按照Renthal[21]的方法进行估算,长度和数量分布差异性用Kruskal-Wallis进行检验。
2 结果与分析
2.1 雌蜂触角形态
木瓜榕食果榕小蜂雌蜂触角呈膝状,由柄节、梗节和鞭节组成(图2),全长(1342.5±96.5)μm。柄节呈圆柱形,长(235.97±6.49)μm。梗节倒梨形,长(96.35±7.35)μm。鞭节由11个鞭小节组成,分为环节2节,长(77.39±5.47)μm;索节6节,长(534.37±43.09)μm;棒节3节,长(170.71±20.37)μm。其中,转节最为特殊,其末端与柄节相连,但已与柄节完全分离,应被视为独立一节(图2);长(43.11±7.13)μm,基部着生于触角窝内,可为触角转动提供支点。
2.2 雌蜂触角感器的类型
2.2.1 毛形感器(Sensilla trichodea, ST) 是木瓜榕食果榕小蜂雌蜂触角上分布最广、数量最多的感受器,除转节外触角各节均有分布,鞭节的数量明显多于柄节和梗节(表1)。毛形感器外形细长,呈弧形弯曲,表面具有8条纵向沟槽,基部位于一臼形凹槽内(图3-A~D;图4-C、D);感器长(32.81±3.82)μm,基部直径(1.86±0.34)μm,触角各节毛形感器长度没有显著的差异(χ2=2.608,P=0.627)。
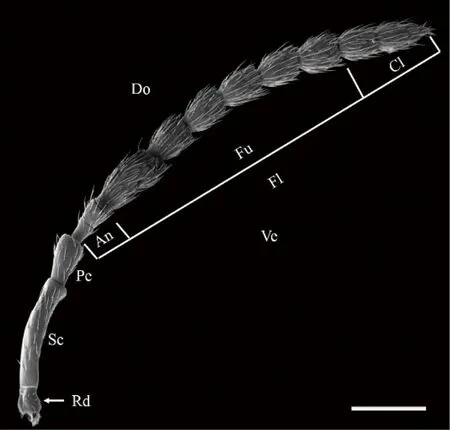
图2 木瓜榕食果榕小蜂雌蜂触角及其构成
Rd: 转节;Sc:柄节;Pe:梗节;An:环节;Fn:索节;Cl棒节;Fl:鞭节;Do:背面观;Ve:腹面观;比例尺 20 μm
2.2.2 刺形感器(Chaetica sensilla, ChS)外形如刺,呈刚毛状,直立于触角表面,较毛形感器粗壮;顶部钝圆,基部着生一大型凹窝内(图4-F、G)。感器长(4.01±0.24)μm,基部直径(1.11±0.26)μm,主要分布于转节外侧面和腹面、柄节与梗节交界处的节间膜,数量仅3~6个(表1)。
2.2.3 锥形感器(Basiconic sensilla, BS)分为单孔锥形感器(图3-A,图4-A)和多孔锥形感器(图3-A、B,图4-B)2种:(I)单孔锥形感器(Uniporous basiconic sensilla, UBS)仅分布触角第3棒节端部,数量较少(表1),直立呈锥形,表面具8~11个纵向沟槽,顶部具孔;长(24.75±5.93)μm,基部直径(2.33±0.39)μm,明显突出于触角主轴(图3-A,图4-B)。(II)多孔锥形感器(Multiporous basiconic sensilla, MBS)外形似感觉锥,但感器基部1/5处略微弯曲,与触角主轴近平行(图3-A、B,图4-B);感器长(24.41±4.08)μm,基部直径(2.02±0.25)μm,较为粗壮,分布于触角第2~6索节和第1~2棒节,数量2~6个不等,尤以腹侧面最为明显,近似于对称排列(图3-A,表1)。
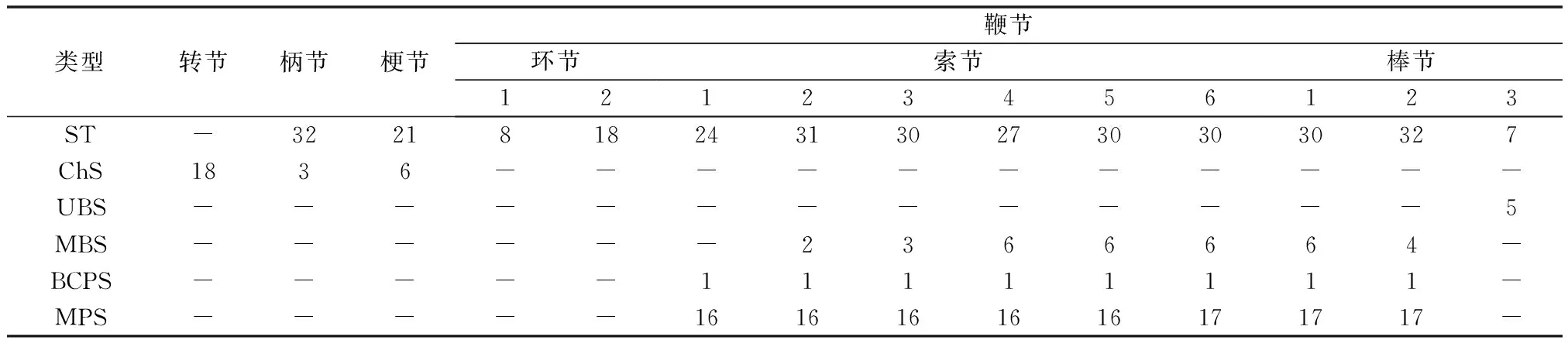
表1 木瓜榕食果榕小蜂雌蜂触角各节触角感器分布与数量
2.2.4 栓锥型乳突状感器(Basiconic capitate peg sensilla, BCPS)由乳突状的头部和一短柄组成,头部钝圆,有10~11纵向沟槽;短柄着生于一圆形凹陷内(图3-B,图4-E)。该感器数量均匀分布于触角索节和第1~2棒节腹面,每节1个(图3-B,表1)。
2.2.5 多孔板形感器(Multiporous placoid sensilla, MPS)外形似平板,表面分布着大量的微孔,几乎与触角主轴表面完全愈合,仅端部小部分与触角主轴分离(图3-A、B,图4-B)。MPS是仅次于毛形感器的第二大感器,长(36.55±3.76)μm,宽(5.19±0.81)μm,分布于第3~10鞭小节,且各鞭小节MPS的数量、长度、宽度均无显著差异(P>0.05,表1)。
3 讨论
触角感器是昆虫感知环境信息和调控自身行为的桥梁与纽带,其形态、数量、分布等与昆虫的生活习性联系密切[22]。扫描电镜观察发现,木瓜榕食果榕小蜂雌蜂触角上共存在6种感器,他们也同样存在于其他种类寄生蜂的触角上[15, 17-20, 23-29],只是被给予了不同的名称,如毛形感器分为端部弯曲无孔形(ST1-AP)和直立无孔形(ST2-AP)[28],刺形感器被称为蒲姆氏鬃毛[30],栓锥型乳突状感器被称为坛形感器[31]或腔锥形感器[18]。
3.1 触角感器的形态与功能
毛形感器外形纤弱,端部向触角主轴弯曲,类似于茧蜂科、树蜂科、赤眼蜂科、传粉榕小蜂科等寄生蜂触角表面的无孔毛形感器[15, 17-20, 25-29]。Amornsak等[15]认为触角感器表面的沟槽是由无数的微孔构成,但对叶榕传粉榕小蜂,木瓜榕传粉榕小蜂、钝叶榕传粉榕小蜂等透射电镜观察显示其为厚壁无孔型结构[17-18],加之木瓜榕食果榕小蜂触角上的毛形感器与传粉榕小蜂毛形感器在形态、分布、着生位置等方面高度类似[17-18, 20, 29],推断其为一种机械感器。
刺形感器被认为是机械感器,对触角位置具有感知功能[13-14, 17]。木瓜榕食果榕小蜂刺形感器位于转节腹侧面以及柄节与梗节交界处的节间膜(图4-G),推测其能够感受触角位置和运动所产生的机械刺激,是一种本体感受器。
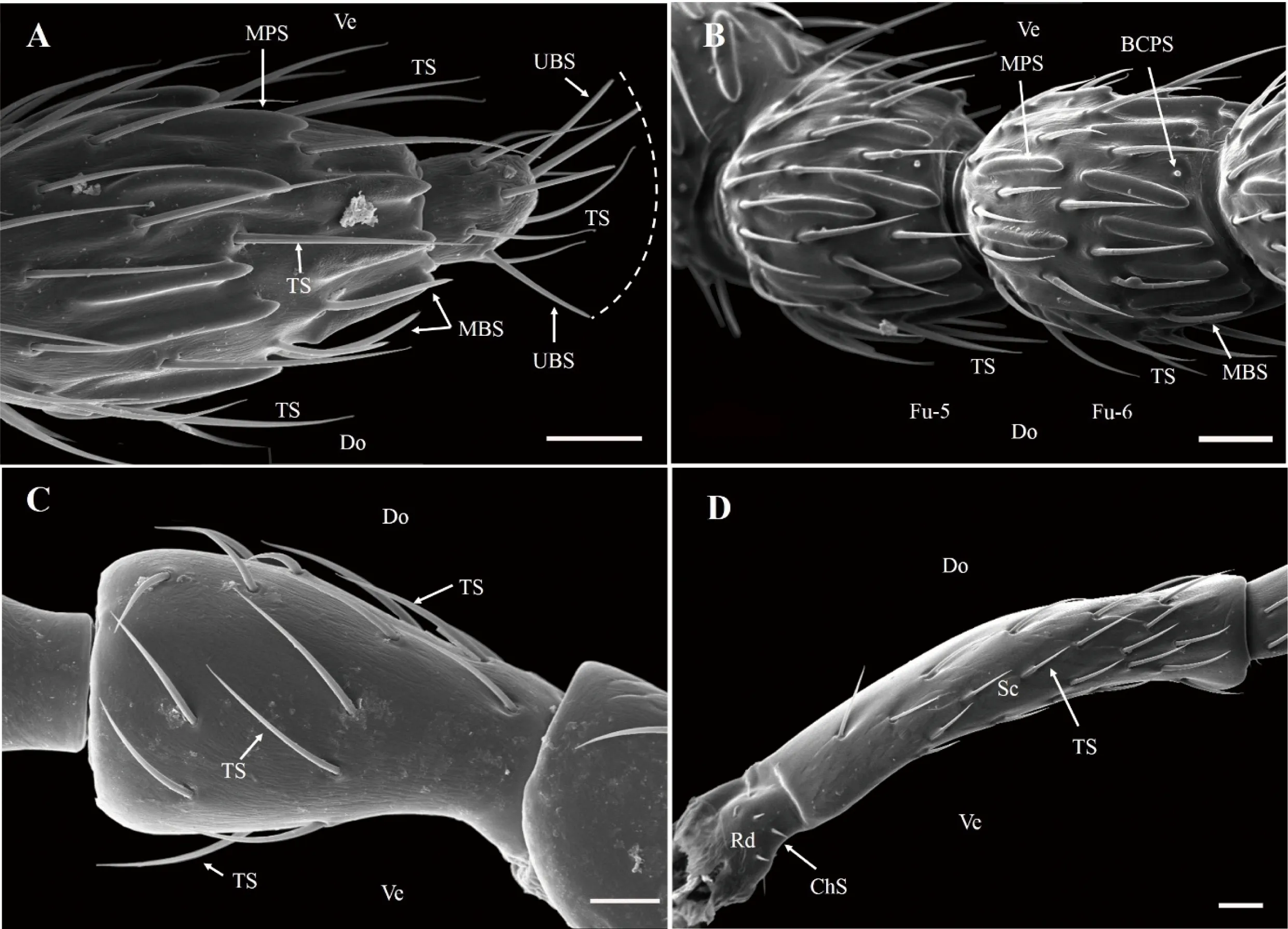
图3 木瓜榕食果榕小蜂雌蜂触角感器的类型、形态和分布
A:棒节及其感器与分布; B:索节第5亚节和第6亚节及其感器; C:梗节及其感器; D:柄节和转节及其感器。比例尺 20 μm
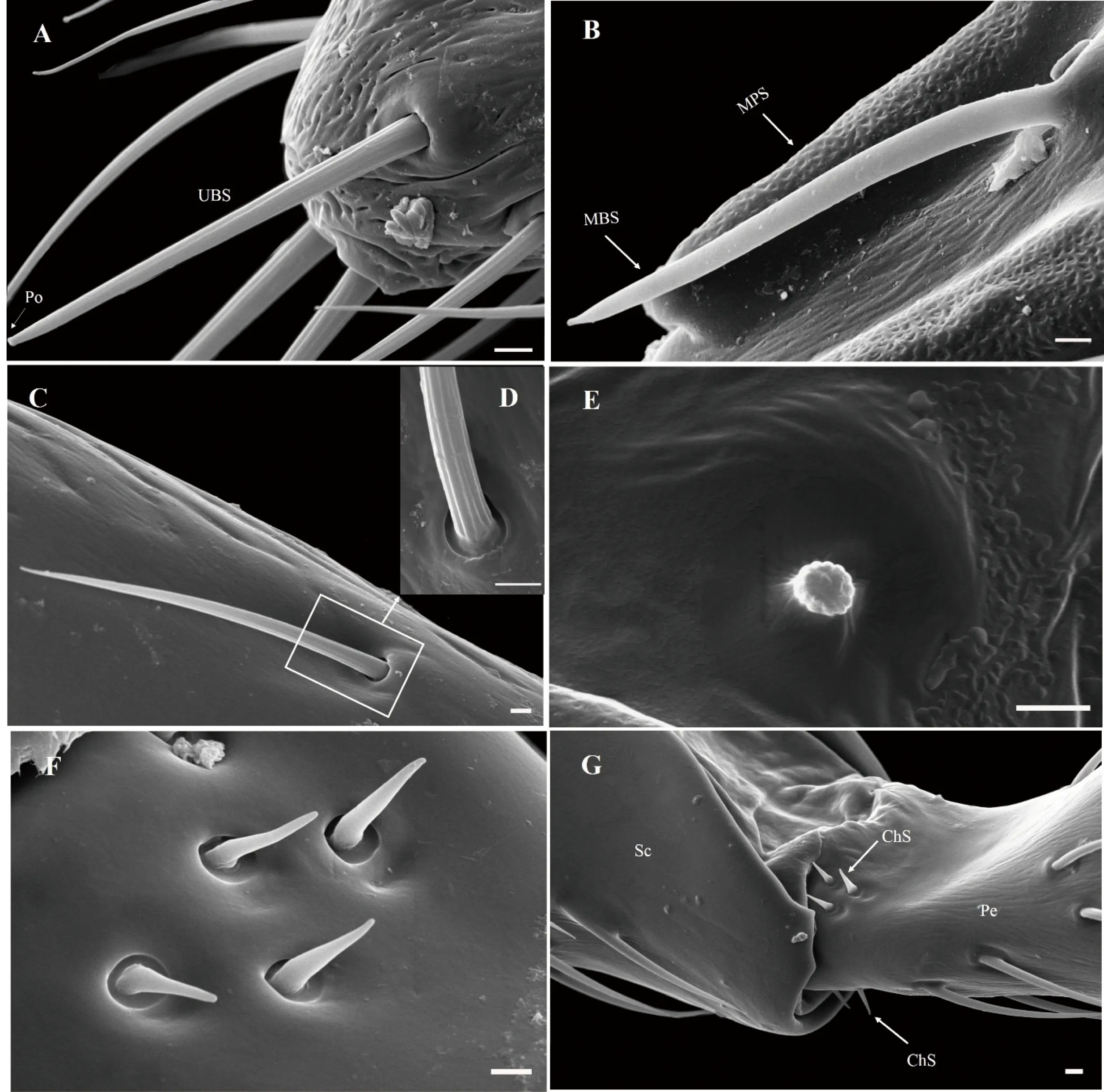
图4 木瓜榕食果榕小蜂雌蜂触角感器的微观形态
A:单孔锥形感器; B:多孔锥形感器; C:毛形感器; D:毛形感器表面及其基部特征; E:栓锥型乳突状感器; F:刺形感器; G:位于柄节与梗节交界处的刺形感器。比例尺2 μm
依据锥形感器形态、表面特征、孔的位置和数量,2种锥形感受器应被视作化学感器[32],与木瓜榕食果榕小蜂的寄主搜寻行为是相关的。单孔锥形感器顶端具孔,也被称为单孔味觉感器[24]、凹形锥形感器[23],是公认的味觉感器。由于单孔锥形感器仅分布于棒节端部,明显突出触角主轴(图3-A),加之木瓜榕食果榕小蜂着陆在榕果表面时会主动弯曲触角,用端部触碰榕果表面(图1),这使得单孔锥形感器能够首先与榕果表面接触,感知榕果腺体释放的非挥发性信息化学物质[33],有益于进一步判断榕果是否适合产卵。对于多孔锥形感器来说,其又被称为多孔毛形感器,锥形感器2,锥形感器B,与木瓜榕传粉榕小蜂、对叶榕传粉榕小蜂和钝叶榕传粉榕小蜂触角上的多孔锥形感器极为类似,只是由于扫描电镜放大倍数限制,使我们无法直接观察到它的微孔结构,但这3种传粉榕小蜂超微切片证实其表面多孔,壁薄[17-18],为典型的嗅觉器官。
栓锥型乳突状感器与其他类型的感受器形态上截然不同,拥有一个球形的突起,其上分布着纵形的沟槽,Gao等[27]和Li等[18]已经证实这些沟槽是由大量的微孔组成;另一方面,栓锥形乳突状感器一般分布鞭节的腹面,这与木瓜榕食果榕小蜂寄主识别阶段相一致。当着陆在榕果果面的木瓜榕食果榕小蜂一旦感应到合适的信息线索,触角立刻平放,横扫榕果表面,尽管这种扫动不会使其直接触碰榕果表面,但可增加挥发性信息化学物质的俘获,其嗅觉功能应该被肯定[16, 32]。
多孔板形感器是膜翅目昆虫触角上最典型的感器类型,也可作为榕小蜂种类鉴定依据[19]。一般认为,多孔型的感器为嗅觉器官[32],其多孔的表面可允许气味分子进入感受器淋巴腔,通过与触角结合蛋白的耦合而产生信号信息[34]。Ochieng等[26]利用单感器记录技术证明了多孔板型感受器对植物挥发性化合物极为敏感。根据木瓜榕食果榕小蜂触角上多孔板型的外部形态、着生方式、表皮特征等(图3-A、B,图4-B),推测其为嗅觉器官,对其榕树榕果阶段性挥发物具备感知能力。
3.2 与传粉榕小蜂化感器的比较
化感器是昆虫周缘神经系统进行信息编码与解译的核心,其类型、数量、分布及排列方式等反映了昆虫寄主识别、交配、繁殖、交配等诸多行为与化学信息间的共适应性[22, 34]。非传粉榕小蜂与传粉榕小蜂在同一榕果共同发育,同步羽化,但与传粉榕小蜂不同,非传粉榕小蜂为卵育型寄生蜂(Synovigenic),产卵时期跨度更大,寿命更长[35-36],意味非传粉榕小蜂有更多时间来搜寻和识别寄主,这使得化学信息接收器官,即化感器承受的进化压力降低,形态延伸、数量增多、端部分离等与感器接受能力相关的特征减少[19]。而另一方面,榕果雌花前期和间花期释放化学信息的种类、量均显著低于雌花期[11],加之榕树种群内部榕果发育高度异步,株内发育高度同步,意味羽化的非传粉榕小蜂必须离开母树(Natal fig)[5, 35],重新在背景复杂雨林中搜寻特定榕树及其处在寄生阶段的榕果,从而使非传粉榕小蜂主动识别寄主榕树的压力明显增加,而这种作用力可能明显超过寿命所带来的正向压力。根据信息的可靠性和识别度(Reliability-detectability problem)理论[37],非传粉榕小蜂与寄主榕树间的专性依赖,协同进化[8],双方共同促使非传粉榕小蜂提高化感器的接受能力。木瓜榕食果榕小蜂具有单孔锥形感器、多孔锥形感器、栓锥型乳突状感器和多孔板形感器4种化感器,前3种与榕小蜂产卵行为相关,是一种近距离识别,其形态、数量和排列形式与传粉榕小蜂[17-18]没有本质的差别;而多孔板形感器是一种长距离化学信息感受器官,从木瓜榕食果榕小蜂与传粉榕小蜂多孔板形感器的数量和表面积对比发现(图5),木瓜榕食果榕小蜂触角上的多孔板形感器数量和表面积要大于多数传粉榕小蜂,且与鞭节长度正相关,这从反面证实了多孔板形感器接受能力提高的事实。但一些研究认为多孔板形感器的信息接受能力与感器形态和排列方式无关,而取决于感器内部神经元的空间排列方式或专性神经元[38],意味着感受器数量和表面积的增加提高了感器与气味分子的结合概率,从而提升木瓜榕食果榕小蜂寄主识别能力。因此,未来结合木瓜榕雌花前期榕果挥发物成分分析和气相色谱-触角电位技术,将有利于探索木瓜榕食果榕小蜂寄主搜寻和信息利用模式。
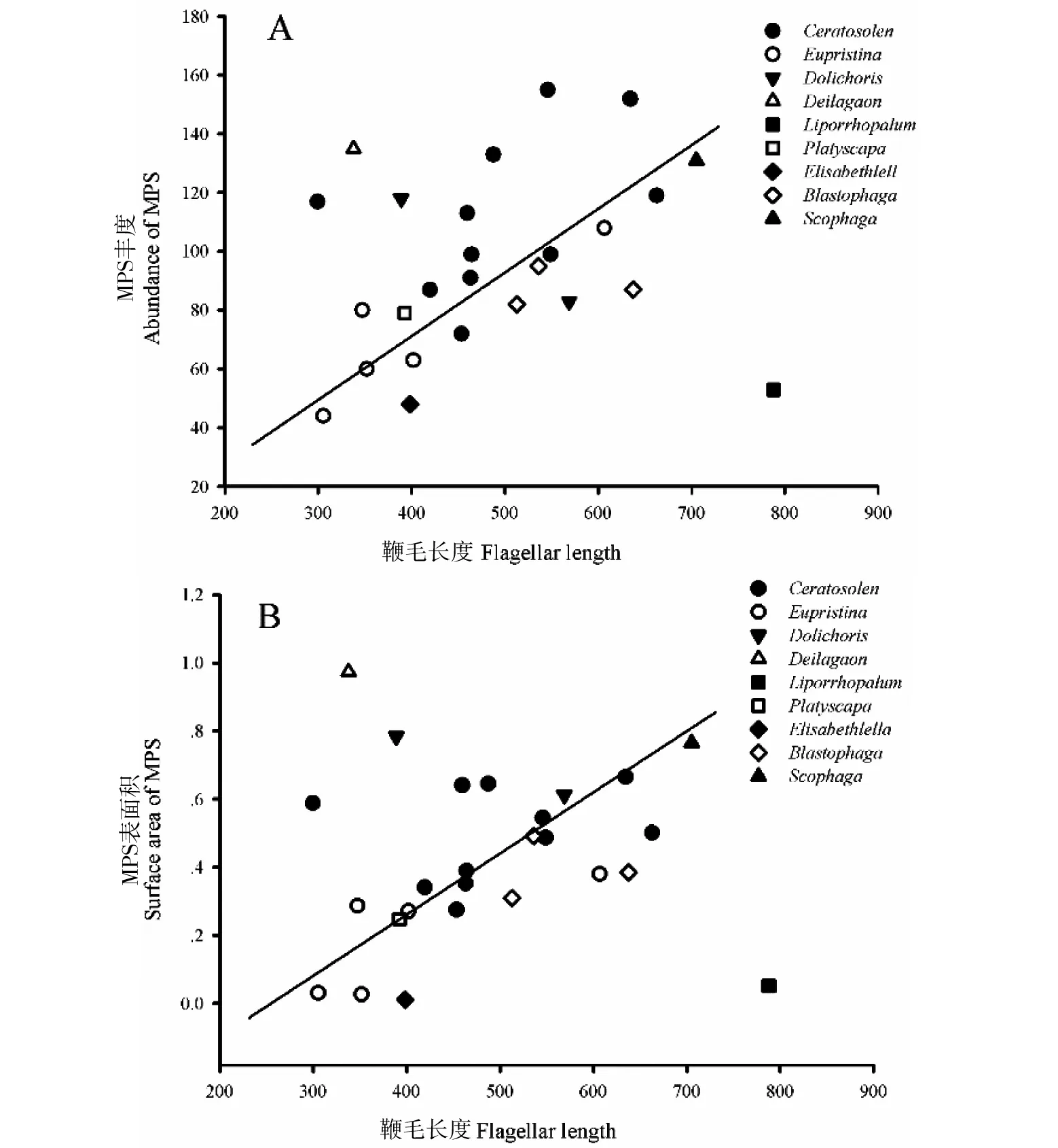
图5 木瓜榕食果榕小蜂与其他榕小蜂多孔板形感器的数量和表面积比较
[1]钦俊德,王琛柱. 论昆虫与植物的相互作用和进化的关系[J]. 昆虫学报, 2001, 44(3): 360-365.
[2]闫凤鸣. 化学生态学[M].北京: 科学出版社, 2011: 14-26.
[3]JANZEN D H. How to be a fig[J]. Annu Rev Eco Syst, 1979, 10: 13-51.
[4]WEIBLEN G D. How to be a fig wasp[J]. Annu Rev Entomol, 2002, 47: 299-330.
[5]杨大荣,徐 磊,彭艳琼,等. 云南省榕小蜂和榕树的物种组成及多样性[J]. 生物多样性, 2004, 12(6): 611-617.
[7]RASPLUS J Y, KERDELHUÉ C, LE CLAINCHE I, et al. Molecular phylogeny of fig wasps Agaonidae are not monophyletic[J]. C R Acad Sci III, 1998, 321(6): 517-527.
[8]COOK J M, RASPLUS J Y. Mutualists with attitude: coevolving fig wasps and figs[J]. Trends Ecol Evol, 2003, 18(5): 241-248.
[9]GRISON-PIGÉ L, BESSIRE J-M, HOSSAERT-MCKEY M. Specific attraction of fig-pollinating wasps: role of volatile compounds released by tropical figs[J]. J Chem Ecol, 2002, 28(2): 283-295.
[10]PROFFIT M, SCHATZ B, BORGES R M, et al. Chemical mediation and niche partitioning in non-pollinating fig-wasp communities[J]. J Anim Ecol, 2007, 76(2): 296-303.
[11]PROFFIT M,SCHATZ B,BESSIERE J,et al. Signalling receptivity: comparison of the emission of volatile compounds by figs ofFicushispidabefore, during and after the phase of receptivity to pollinators[J]. Symbiosis, 2008, 45(1): 15-24.
[12]HOSSAERT-MCKEY M,SOLER C,SCHATZ B,et al. Floral scents: their roles in nursery pollination mutualisms[J]. Chemoecology, 2010, 20(2): 75-88.
[13]SCHNEIDER D. Insect antennae[J]. Annu Rev Entomol, 1964, 9(1): 103-122.
[14]KEIL T A. Functional morphology of insect mechanoreceptors[J]. Microsc Res Tech, 1997, 39(6): 506-531.
[15]AMORNSAK W, CRIBB B, GORDH G. External morphology of antennal sensilla ofTrichogrammaaustralicumGirault (Hymenoptera: Trichogrammatidae)[J]. Int J Insect Morphol Embryol, 1998, 27(2): 67-82.
[16]VAN BAAREN J, BOIVIN G, BOURDAIS D, et al. Antennal sensilla of hymenopteran parasitic wasps: variations linked to host exploitation behavior. Modern research and educational topics in microscopy[M]. Badajoz: Formatex, 2007, 1: 345-352.
[17]LI Z B, YANG P, PENG Y Q, et al. Ultrastructure of antennal sensilla of femaleCeratosolensolmsiMarchali (Hymenoptera: Chalcidoidea: Agaonidae: Agaoninae)[J]. Can Entomol, 2009, 141(5): 463-477.
[18]LI Z B, YANG P, PENG Y Q, et al. Ultrastructure and distribution of sensilla on the antennae of female fig waspEupristinasp. (Hymenoptera: Agaonidae)[J]. Acta Zool, 2014, 95(1): 73-83.
[19]李宗波,杨 培,赵 健,等. 传粉榕小蜂雌蜂多孔板形感器的形态与适应进化[J]. 应用昆虫学报, 2014, 51(4): 1086-1097.
[20]李宗波,杨 培,彭艳琼,等. 木瓜榕传粉榕小蜂雌蜂触角感器的分布和超微形态[J]. 昆虫学报, 2012, 55(11): 1272-1281.
[21]RENTHAL R, VELASQUEZ D, OLMOS D, et al. Structure and distribution of antennal sensilla of the red imported fire ant[J]. Micron, 2003, 34(8): 405-413.
[22]CARBAJAL F A, CATALS. Relationship between antennal sensilla pattern and habitat in six species of Triatominae[J]. Mem Inst Oswaldo Cruz, 2002, 97(8): 1121-1125.
[23]NORTON W N, Vinson S B. Antennal sensilla of three parasitic Hymenoptera[J]. Int J Insect Morphol Embryol, 1974, 3(3-4): 305-316.
[24]ISIDORO N, BIN F, COLAZZA S, et al. Morphology of antennal gustatory sensilla and glands in some parasitoids Hymenoptera with hypothesis on their role in sex and host recognition[J]. J Hymenoptera Res, 1996, 5: 206-239.
[25]VAN BAAREN J, BOIVIN G, LE LANNIC J, et al. Comparison of antennal sensilla ofAnaphesvictusandA.listronoti(Hymenoptera, Mymaridae), egg parasitoids of Curculionidae[J]. Zoomorphology, 1999, 119(1): 1-8.
[26]OCHIENG S A, PARK K C, ZHU J W, et al. Functional morphology of antennal chemoreceptors of the parasitoidMicroplitiscroceipes(Hymenoptera: Braconidae)[J]. Arthropod Struct Dev, 2000, 29(3): 231-240.
[27]GAO Y, LUO L Z, HAMMOND A. Antennal morphology, structure and sensilla distribution inMicroplitispallidipes(Hymenoptera: Braconidae)[J]. Micron, 2007, 38(6): 684-693.
[28]ONAGBOLA E O, FADAMIRO H Y. Scanning electron microscopy studies of antennal sensilla ofPteromaluscerealellae(Hymenoptera: Pteromalidae)[J]. Micron, 2008, 39(5): 526-535.
[29]李宗波,杨 培,彭艳琼,等. 苹果榕传粉小蜂雌性触角感器及其生态学意义[J]. 昆虫知识, 2009(6): 941-950.
[30]REN L, SHI J, ZHANG Y, et al. Antennal morphology and sensillar ultrastructure ofDastarcushelophoroides(Fairmaire)(Coleoptera: Bothrideridae)[J]. Micron, 2012, 43(9): 921-928.
[31]CROOK D, KERR L, MASTRO V. Sensilla on the antennal flagellum ofSirexnoctilio(Hymenoptera: Siricidae)[J]. Ann Entomol Soc Am, 2008, 101(6): 1094-1102.
[32]STEINBRECHT R A. Pore structures in insect olfactory sensilla: a review of data and concepts[J]. Int J Insect Morphol Embryol, 1997, 26(3-4): 229-245.
[33]SOUZA C D, PEREIRA R A S, MARINHO C R, et al. Diversity of fig glands is associated with nursery mutualism in fig trees[J]. Am J Bot, 2015, 102(10):1-14.
[34]WALKER W B, JACQUIN-JOLY E, HILL S R. Editoral: functional characterization of insect chemoreceptors: receptivity range, expression and evolution[J]. Front Ecol Evol, 2016, 4: 37.
[35]COMPTON S G, RASPLUS J-Y, WARE A. African fig wasp parasitoid communities. Parasitoid community ecology[M]. UK: Oxford University Press, 1994, 34: 343-368.
[36]RORY J C N, COMPTON S G. Regulation of seed and pollinator production in the fig-fig wasp mutualism[J]. J Anim Ecol, 1996, 65(2): 170-182.
[37]CONSOLI L F, PARRA P J R, ZUCCHI A R. Egg parasitoids in agroecosystems with emphasis on Trichogramma[M]. Dordrecht: Springer Publisher, 2010, 9: 97-147.
[38]ALDWORTH Z N, STOPFER M. Olfactory coding: tagging and tuning odor-activated synapses for memory[J]. Curr Biol, 2012, 22(7): R227-R229.
Morphological characteristics of antennal sensilla of femaleSycophagasp.observed with scanning electron miscroscopy
YANG Pei1, LI Zong-bo2, YANG Da-rong1, PENG Yan-qiong1
(1. Key Laboratory of Tropical Forest Ecology, Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Mengla 666303; 2. Key Laboratory of Forest Disaster Warning and Control in Yunnan Province, College of Forestry, Southwest Forestry University, Kunming 650224, China)
Sycophagasp. is a species-specific and galling parasite at the pre-female floral stage ofFicusauriculata. To provide a prerequisite for future electrophysiological studies on the fig wasp chemoreception, the antenna of femaleSycophagasp. was excised and examined by the sanning electron microscopy. The results showed that the antennae ofSycophagasp. is geniculate in shape and consist of the basic segments: scape with radicula, pedicel and a long threadlike flagellum subdivided into 11 flagellomeres. The total antenal length is (1342.5±96.5)μm. Six sensillar types were recorded and described on the antennae of femaleSycophagasp.. The identified sensillar types included trichoid sensilla, chaetica sensilla, uniporous and multiporous basiconic sensilla, basiconic capitate peg sensilla, and multiporous placoid sensilla. Most sensilla were located on the outside laternal side and ventral side of the antennae. According to the abundance, trichoid sensilla and multiporous placoid sensilla were regarded as the main sensillar type on the antennae of the female wasps. The former was distributed over the whole area of antennal segments, except for the radicula, but the latter presented the equal number of sensilla on the 3rd-11thflagellomeres. Their probal functions were discussed in view of sensillar type, distribution and oviposition behavior ofSycophagasp..
Ficusauriculata; pre-female floral stage; non-pollinating fig wasp;Sycophagasp.; antennal sensilla
2016-05-27;
2016-06-03
国家自然科学基金(31200292, 31100279); 中国科学院西部之光项目; 云南省应用基础研究项目(2014FB183); 云南省高校科技创新团队项目
杨 培,博士,助理研究员,主要从事进化生态学研究,E-mail: yangpei@xtbg.org.cn
彭艳琼,博士,研究员,主要从事进化生态学研究,E-mail: pengyq@xtbg.ac.cn
Q964
A
2095-1736(2017)04-0011-06
doi∶10.3969/j.issn.2095-1736.2017.04.011
