基于RSM模型对纤维素酶预处理制备MFC的参数优化
2017-08-07张启莲张正健陈蕴智李志红
张启莲 张正健 陈蕴智 李志红
(天津科技大学包装与印刷工程学院,中国轻工业食品包装材料与技术重点实验室,天津,300222)
·MFC制备·
基于RSM模型对纤维素酶预处理制备MFC的参数优化
张启莲 张正健*陈蕴智 李志红
(天津科技大学包装与印刷工程学院,中国轻工业食品包装材料与技术重点实验室,天津,300222)
研究了响应曲面法(RSM)应用于纤维素酶预处理制备微纤化纤维素(MFC)的工艺条件优化,首先通过马尔文粒度仪、刚果红染色法等手段对MFC性能进行单因素分析,然后以MFC的粒径、比表面积为响应值,采用RSM对工艺条件进行优化和分析。结果表明,纸浆浓度、酶用量、酶处理时间的变化对于制备的MFC性能都具有一定的影响,依据单因素分析,利用RSM进行参数优化,预测得出酶预处理制备MFC的优化条件为:纸浆浓度为10%,酶用量为10.53 U/g,处理时间为24 h。
微纤化纤维素;响应曲面法;粒径;比表面积;参数优化
微纤化纤维素(microfibrillated cellulose,简称MFC)是一种新型纤维素产品,其最初是在20世纪80年代由Herrick等人[1]和Turback等人[2]首先开发出的。MFC是一种通过机械力对纤维素进行反复并且高强度的均质化处理后得到的纤维产品,呈高润胀胶体状,一般情况MFC的直径为20~60 nm,长度大约为几微米到十几微米,长径比在100~150范围内[3]。制备出的MFC具有许多优异的性能,如较强的化学反应活性、高强度、较大比表面积和低热膨胀系数等,被广泛用于聚合物、生物材料、涂料、食品、化妆品、医疗、包装和印刷等领域[4-7]。特别是,与普通纤维素相比,MFC的抗张强度和杨氏模量很大,因此其可以形成网状结构,也能与其他材料很好地共混成型,为新型材料的制备及其应用提供了更加广泛的选择。
在MFC的制备过程中,若不采用任何预处理,单纯通过机械处理,存在能耗高(20~40 kWh/kg)、效率低、性能不稳定、难以工业化生产等缺点[8],所以需要结合预处理技术来制备MFC。在国内外现有的预处理技术中,相对于酸处理、碱处理、羧甲基化处理和TEMPO催化氧化预处理等处理方法[9-13],酶预处理法[14-15]制备MFC具有很多其他方法都不具有的优势,如反应条件温和、能耗低、经济环保等,并且预处理所使用的酶本身也是一种可再生资源,因此酶预处理将会越来越多地应用于MFC的制备中。
响应曲面法(RSM)优化是一种实验条件优化的方法,将实验得出的数据结果进行响应面分析,通过多项式模型拟合得到预测模型,在各因素水平响应值的基础上,找出预测的响应最优值以及相应的实验条件。作为一种普遍适用的实验设计、分析工具,RSM应用于MFC的制备体现了突出的优势和作用,适用于一些因所用酶的品质、加工设备的特性、MFC应用的方向、成本要求等因素的变化而有所影响的情况。目前该方法已经广泛应用于科研领域的建模分析优化,但在酶预处理制备MFC的最优化研究方面鲜有报道。本研究以MFC的粒径、比表面积作为评价指标,考察纸浆浓度、酶用量和酶处理时间对MFC性能的影响,通过以响应曲面优化法(RSM)为依据的Box-Behnken实验,建立多项式预测模型并分析其有效性,进而得到最优工艺参数,为MFC的制备及条件优化提供参考和依据。
1 实 验
1.1 实验材料
漂白硫酸盐桉木浆,芬欧汇川纸业有限公司;苏柯汉纤维素酶,山东潍坊苏柯汉生物公司;刚果红,北京诺博莱德科技有限公司。
1.2 实验仪器
瓦利打浆机(T2505,上海首力贸易有限公司);打浆度测定仪(ZDJ-100,四川宜宾造纸厂);PFI磨(P40110.E00,上海久久贸易有限公司);高压均质机(GJJ,上海台驰轻工装备有限公司);马尔文粒度仪(Mastersizer3000E,德国马尔文公司);紫外分光光度计(UV-2700,上海天河环境技术有限公司)。

图1 MFC的制备路线
1.3 实验方法
纤维素酶预处理制备MFC:经蒸馏水清洗干净的漂白硫酸盐桉木浆先经过瓦利打浆机处理、纤维素酶预处理、PFI磨的机械处理,最后将处理后的浆料进行连续高压均质处理最终制得所需产品,制备过程如图1所示。在整个生产过程中,纤维素酶预处理起着关键作用[16-17]。
单因素实验:通过控制纸浆浓度、酶用量和酶处理时间在预处理制备MFC过程中的改变量,考察单一因素对MFC性能的影响。
RSM条件优化:以MFC的粒径、比表面积为响应值,采用RSM分析法进行工艺条件及交互作用的数据优化和分析,得出最适的工艺条件。本研究根据Box-Behnken实验设计原理,在单因素实验的基础上,采用三因素三水平的RSM,以酶用量、酶处理时间和纸浆浓度为自变量因素,分别以A、B、C来表示,并以+1、0、-1分别代表自变量的高、中、低水平,进行编码,如表1所示。

表1 实验自变量因素水平及编码
2 结果与分析
2.1 MFC性能的单因素分析
在纤维素酶预处理实验中,纸浆浓度和酶用量以及酶处理时间是决定酶处理效果的关键因素。纸浆浓度影响酶与纤维素反应体系的反应速率,反应速率会随纸浆浓度的增加而增加,但过高的纸浆浓度也会抑制反应速率[18];酶用量可以直接反映体系中酶的浓度,酶用量过低不能有效水解纤维素纤维,酶用量过高又会导致纤维素纤维水解过度,因此酶用量也直接与生产成本相关;酶处理时间的长短对纤维素纤维的水解作用影响也很大,如果酶处理时间过长,一方面酶的活性会有所下降,另一方面也影响制备的MFC的性能。因此,有必要探讨纸浆浓度和酶用量以及酶处理时间对酶预处理制备的MFC性能的影响。
2.1.1 预处理纸浆浓度对MFC性能的影响

图2 不同纸浆浓度制备MFC的粒径和比表面积的变化
图2为不同纸浆浓度制备MFC的粒径和比表面积的变化。从图2中可以看出,随着纸浆浓度从2%增加到10%,MFC的粒径从52.4 μm减小到40.8 μm,比表面积从30.08 m2/g增至35.05 m2/g。这表明纸浆浓度对MFC粒度具有相当大的影响,主要是由于预处理浆浓增加,提高了单位体积的纤维素酶含量,从而提升了纤维素酶的预处理效率,有利于纤维细胞壁的润胀和细纤维化以及后续高压均质,使得MFC的粒径减小、比表面积增大。
2.1.2 预处理纤维素酶用量对MFC性能的影响
图3表示的是不同用量纤维素酶制备MFC的粒径和比表面积的变化。从图3中可以看出,随着酶用量的增加,MFC的粒径先减小后增加,并且在酶用量为10 U/g时粒径达到最小;而MFC的比表面积先增加后减小,并且在酶用量为10 U/g时所制备的MFC比表面积最大。这主要是由于酶用量增加时会增加酶蛋白与纤维的结合位点,相应的增加纤维素酶水解纤维素纤维的反应速率;当酶用量增加到一定程度时,纤维与酶的结合位点就会达到饱和,纤维素酶水解纤维素纤维的反应速率达到最大,如果继续增加酶用量,这时反应速率可能会因为产物抑制而不能得到增加,从而导致制备的MFC的粒径增大,比表面积有所下降。

图3 不同用量纤维素酶制备MFC的粒径和比表面积的变化
2.1.3 纤维素酶处理时间对MFC性能的影响

图4 纤维素酶不同处理时间制备MFC的粒径和比表面积的变化
图4表示的是纤维素酶不同处理时间制备MFC的粒径和比表面积的变化。由图4可以看出,随着酶处理时间的增加,MFC的粒径呈先减小后增大的趋势,在酶处理时间为16 h时MFC的粒径最小。这是由于酶处理时间过长导致纤维素纤维过度水解,从而使MFC的粒径反而越来越大。从图4中还可以看出,在纤维素酶不同处理时间下,制备的MFC的比表面积随着酶处理时间的增加呈现先增大后减小的趋势,在酶处理时间为16 h时MFC的比表面积最大。这是由于酶对纤维素纤维的水解速度会随着时间的增加而增加,从而达到平衡,但是随着酶处理时间继续增加,产物不断增多则会对反应产生抑制作用,使反应速率越来越慢,并且导致纤维素纤维过度水解,从而使MFC的比表面积反而越来越小。
2.2 RSM优化纤维素酶处理制备MFC
2.2.1 RSM实验结果及模型确定
依据单因素实验所得数据,设计纸浆浓度、酶用量、酶处理时间三因素三水平实验(见表1),基于响应曲面软件设计17组实验,各组实验条件及结果见表2。
利用Design-Expert软件对制备的MFC粒径和比表面积与不同操作变量之间关系进行多种拟合,对拟合模型的方差分析比较。对表3、表4、表5、表6关于粒径和比表面积的数据进行方差分析,其中,表5和表6是MFC粒径和比表面积的4种回归模型的方差分析。首先,由表3、表4的F值和P值可以看出,两组实验数据的线性拟合和三次模型拟合都不显著,而二次模型拟合比较显著,所以二次多项式模型在本实验中可信度比较强。然后,对于4种模型的R2和R2校正值进行分析,通过表5和表6可以发现,无论对于比表面积或者粒径来说,它们的二次、三次模型的R2和R2校正值基本相同,并且都明显比线性模型和双因素模型好,同时可以看出二次模型R2预测值是最大的,且预测残差平方是最小的,一般系统趋向于选择拥有最大预测值和最小预测残差平方的模型,即二次多项式模型。综上所述,采用二次多项式模型更加符合实验的要求。

表2 各组实验条件和结果
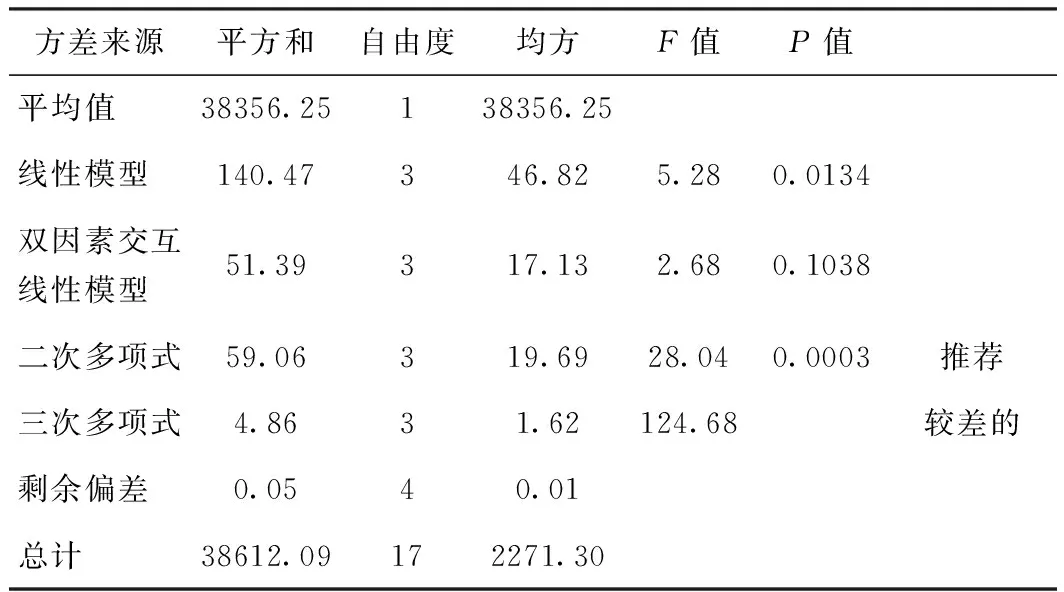
表3 粒径的多种模型方差分析比较
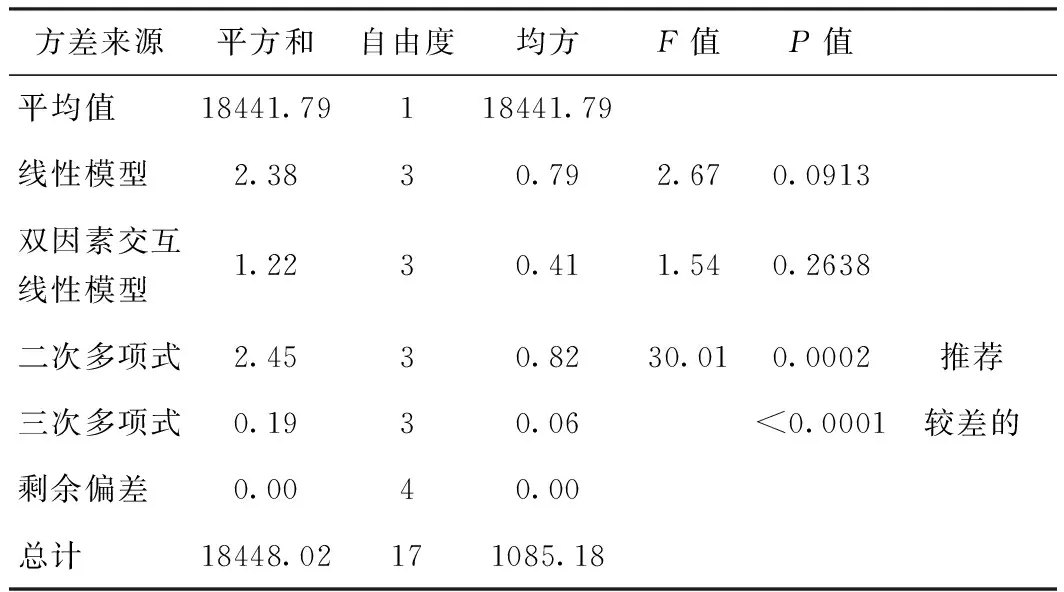
表4 比表面积的多种模型方差分析比较

表5 粒径的R2综合分析
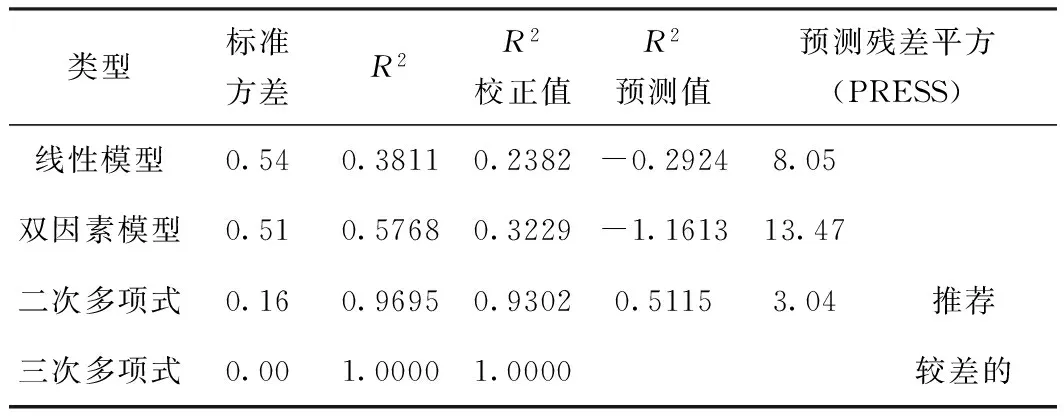
表6 比表面积的R2综合分析
图5为粒径和比表面积的预测值与实际值的对比图。从图5可以看出,实际值比较均匀地分布在预测曲线旁边,说明本实验的回归模型的可信性良好。表7和表8分别为粒径和比表面积的回归模型方差分析表。由表7和表8可以看出,粒径模型和比表面积模型的F值为分别为39.71和24.70,P值为<0.0001,远远小于检验规定的一般显著性(0.05和0.01),失拟项P值分别为0.0520与0.0600,均大于0.05,二次多项式模型具有很好的显著性而且失拟项不显著,因此这两个模型的拟合程度比较好,实验误差也比较小,因此可以用这两个模型分别对MFC粒径和比表面积进行预测。从表5和表6中可以看出,粒径模型的预测值与实际值之间的相关性达为98.08%,R2校正值为0.9561,表明MFC制备工艺中,此模型能够解释95.61%响应值的变化;比表面积模型的预测值与实际值之间的相关性达为96.95%,R2校正值为0.9302,表明MFC制备工艺中,此模型能够解释93.02%响应值的变化,因此说明这两个模型的拟合程度良好。

图5 预测值与实际值的对比
从表7的P值来分析,其中A、AB、A2、C2达到极显著水平(P<0.01),B2达到显著水平(P<0.05),表明酶用量独自或两两交互都在MFC粒径大小中起到比较显著的作用效果,而纸浆浓度以及酶处理时间作用却不明显。从表8的P值分析,其中A、AB、BC、A2、B2达到极显著水平(P<0.01),C达到显著水平(P<0.05),表明酶用量独自或两两交互都在MFC比表面积大小中起到比较显著的作用效果,而纸浆浓度以及处理时间作用一般。

表7 粒径的回归模型方差分析表

表8 比表面积的回归模型方差分析表
综合考虑3个因素的二次及交互作用的影响,在实验考察范围内,3个因素对MFC粒径和比表面积影响的主次顺序为:酶用量>酶处理时间>纸浆浓度。
2.2.2 模型的响应面交互作用分析
(1)酶用量与酶处理时间的交互影响分析
图6为酶用量与酶处理时间的等高图和响应曲面。图6(a)和图6(b)的左图分别表示在纸浆浓度为8%(0水平)时,酶用量和酶处理时间的等高线,该图反映酶用量和酶处理时间因素以及两者的交互作用对MFC粒径和比表面积的影响。由图6(a)和图6(b)的右图可以看出,酶用量是MFC粒径的显著影响因素,而酶处理时间在此区间内对MFC粒径与比表面积的影响并不明显。而从表7可以看出AB交叉作用的P值<0.0001,所以酶用量和酶处理时间的交互作用较强。纸浆浓度一定,随着酶用量的增加,MFC的粒径显著增大,比表面积变小。当酶用量为10 U/g左右时,MFC粒径最小,比表面积最大。
(2)酶用量与纸浆浓度的交互影响分析
图7为酶用量与纸浆浓度的等高图和响应曲面。图7(a)和图7(b)的左图表示在酶处理时间为20 h(0水平)时,酶用量和纸浆浓度的等高线,该图反映酶用量和纸浆浓度因素以及两者的交互作用对MFC粒径和比表面积的影响。从图7(a)和图7(b)的右图可以看出,酶用量是MFC粒径和比表面积的显著影响因素,而纸浆浓度在此区间内对MFC粒径和比表面积的影响并不明显,而从表8可以看出AC交叉作用的P值比较大,所以酶用量和纸浆浓度的交互作用较弱。酶处理时间一定,随着浆浓的增加,MFC的粒径变化比较小,比表面积较大。当浆浓为10%左右时,MFC粒径相对较小,而比表面积相对较大。
(3)酶处理时间与纸浆浓度的交互影响分析
图8为酶处理时间与纸浆浓度的等高图和响应曲面。图8(a)和图8(b)的左图表示在酶用量为20 U/g(0水平)时,酶处理时间和纸浆浓度的等高线,该图反映酶处理时间和纸浆浓度因素以及两者的交互作用对MFC粒径和比表面积的影响。由图8(a)和图8(b)的右图可以看出,无论是酶处理时间还是纸浆浓度对MFC粒径和比表面积的影响都不显著,而从表8可以看出,BC交叉作用的P值也较大,所以酶处理时间和纸浆浓度的交互作用很弱。

图6 酶用量与酶处理时间的等高图和响应曲面
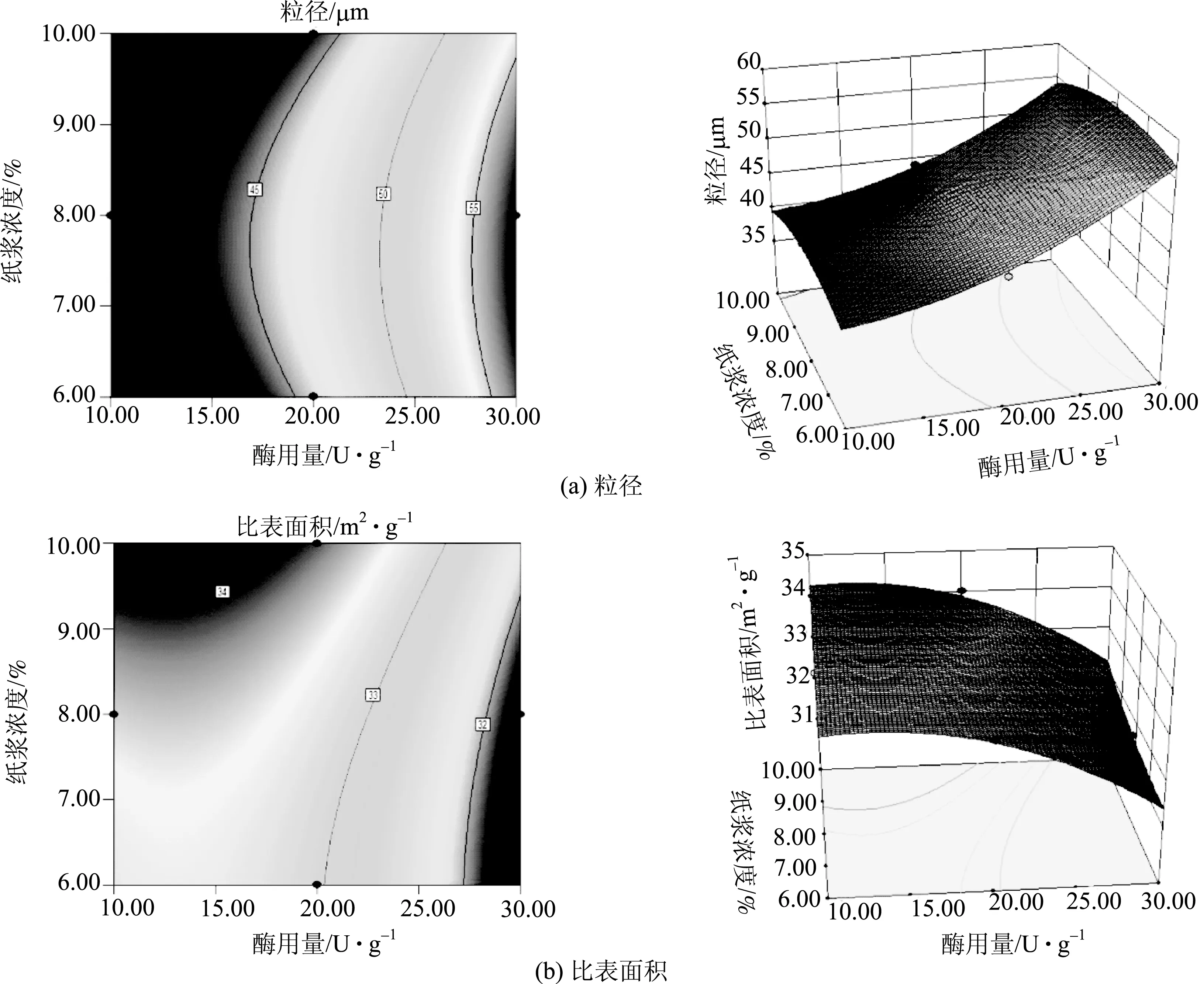
图7 酶用量与纸浆浓度的等高图和响应曲面
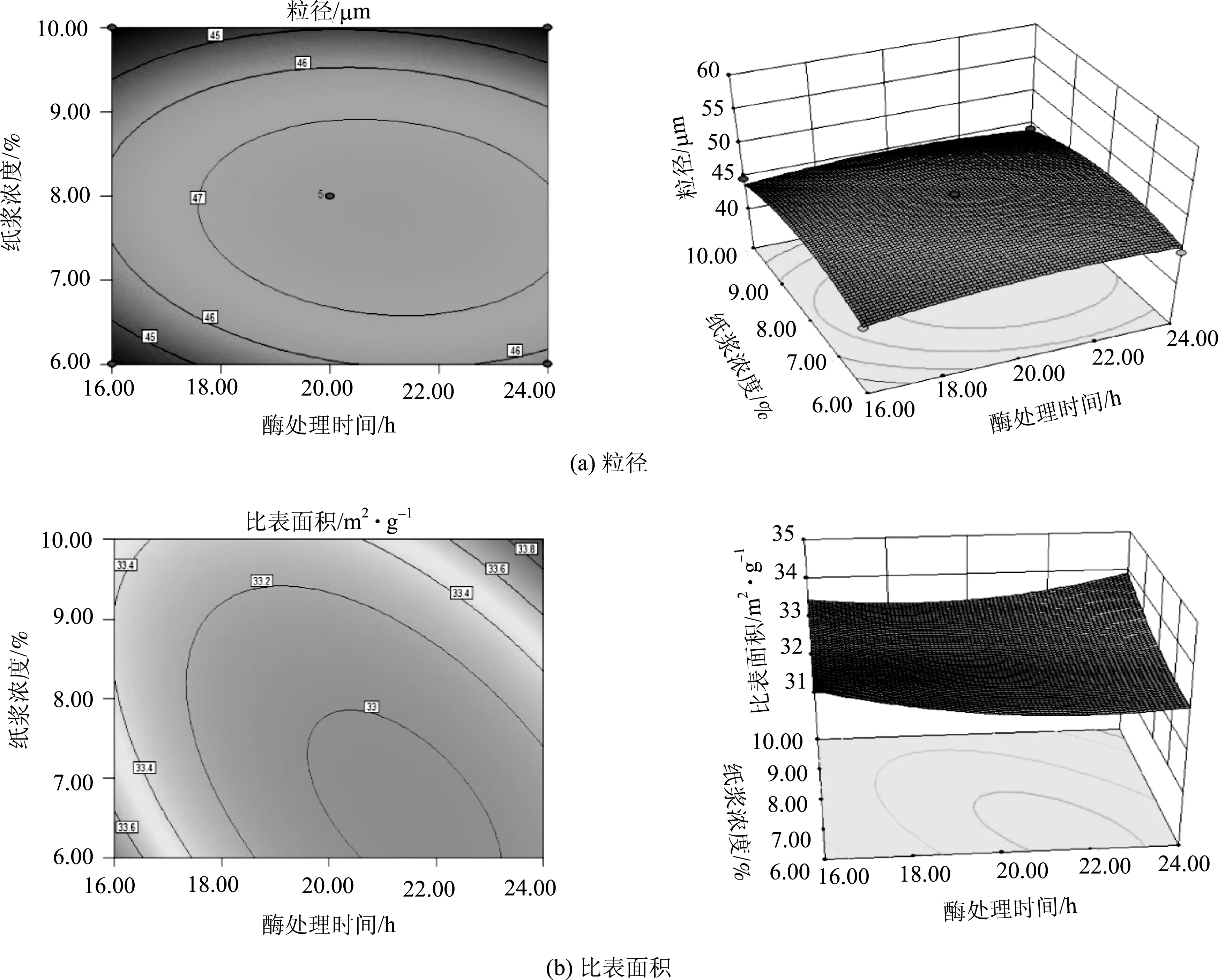
图8 酶处理时间与纸浆浓度的等高图和响应曲面

序号酶用量/U·g-1酶处理时间/h纸浆浓度/%粒径/μm比表面积/m2·g-1110.5324.0010.0039.6634.29推荐210.3224.0010.0039.6234.28310.1024.0010.0039.5934.28411.5624.0010.0039.8734.31510.2023.9810.0039.6334.27611.7524.0010.0039.9234.31710.5423.9510.0039.7234.27810.0024.0010.0039.6834.25912.8524.0010.0040.2334.311010.2724.009.8340.0234.21
2.2.3 工艺优化
进一步通过Design-Expert软件分析计算,综合考虑酶用量、酶处理时间、纸浆浓度等因素,得出MFC粒径较小、比表面积较大时,确定最佳优化条件为:酶用量10.53 U/g,酶处理时间24 h,纸浆浓度10%。
3 结 论
响应曲面法(RSM)和纤维素酶预处理制备微纤化纤维素(MFC)工艺,都是目前较为常见的研究主题,本研究将两者结合起来,利用RSM优化酶解法制备MFC工艺,根据RSM进行实验设计和模型建立,得出MFC粒径及其比表面积与纸浆浓度、酶用量和酶预处理时间的二次回归模型,回归模型对MFC粒径和比表面积的响应显著。通过RSM的优化预测功能得出酶预处理制备MFC的优化条件为:酶用量为10.53 U/g,酶处理时间为24 h,纸浆浓度为10%。这对于MFC的酶预处理制备具有一定的指导意义。
[1] Herrick F W, Casebier R L, Hamilton J K, et al. Microfibrillated cellulose: Morphology and accessibility[J]. Journal of Applied Polymer Science. Applied polymer symposium, 1983, 37: 797.
[2] Turbak A F, Snyder F W, Sandberg K R. Microfibrillated cellulose, a new cellulose product: properties, uses, and commercial potential[J]. Journal of Applied Polymer Science. Applied polymer symposium, 1983, 37: 815.
[3] Svagan A J, Samir M A, Berglund L A. Biomimetic polysaccharide nanocomposites of high cellulose content and high toughness[J]. Biomacromolecules, 2007, 8(8): 2556.
[4] Siro' I, Plackett D. Microfibrillated cellulose and new nanocomposite materials: a review [J]. Cellulose, 2010, 17: 459.
[5] XIANG Xiu-dong, WAN Xiao-fang, LI You-ming, et al. Research Progress on the Preparation and Application of Microfibrillated Cellulose [J]. China Pulp & Paper, 2013, 32 (10): 59. 项秀东, 万小芳, 李友明, 等. 微纤化纤维的制备及其应用的研究进展[J].中国造纸, 2013, 32(10): 59.
[6] Zhou Sukun, Mao Jianzhen, Xu Feng. Preparation and Applications of Microfibrillated Cellulose[J]. Progress in Chemistry, 2014, 26 (10): 1752. 周素坤, 毛健贞, 许 凤. 微纤化纤维素的制备及应用[J]. 化学进展, 2014, 26(10): 1752.
[7] Cozzolino C A, Nilsson F, Iotti M, et al. Exploiting the nano-sized features of microfibrillated cellulose(MFC) for the development of controlled-release packaging[J]. Colloids and Surfaces B: Biointerfaces, 2013, 110: 20.
[8] Spence K L, Venditti R A, Rojas O J, et al. A comparative study of energy consumption and physical properties of microfibrillated cellulose produced by different processing methods[J]. Cellulose, 2011, 18(4): 1097.
[9] Jiang Zehui, Wang Hankun, Yu Yan, et al. A Review of Preparation and Properties of Microfibrillated Cellulose Originated from Plants [J]. World Forestry Research, 2012, 25 (2): 46. 江泽慧, 王汉坤, 余 雁, 等. 植物源微纤化纤维素的制备及性能研究进展[J]. 世界林业研究, 2012, 25(2): 46.
[10] Sabrine A, Iskander B, Manuel R V, et al. Non-woody plants as raw materials for production of microfibrillated cellulose (MFC): A comparative study[J]. Industrial Crops and Products, 2013, 41: 250.
[11] Taipale T, Österberg M, Nykänen A, et al. Effect of microfibrillated cellulose and fines on the drainage of kraft pulp suspension and paper strength[J]. Cellulose, 2010, 17(5): 1005.
[12] Isogai T, Saito T, Isogai A. Wood cellulose nanofibrils prepared by TEMPO electro-mediated oxidation[J]. Cellulose, 2011, 18(2): 421.
[13] ZHANG Si-hang, FU Run-fang, DONG Li-qin, et al. Research Progress on Preparation of Nano Cellulose and Its Application in Composites[J]. China Pulp & Paper, 2017, 36(1): 67. 张思航, 付润芳, 董立琴, 等. 纳米纤维素的制备及其复合材料的应用研究进展[J]. 中国造纸, 2017, 36(1): 67.
[14] WANG Zhuan, LI Xin-ping, DU Min, et al. Study on Fiber Modification of Bleached Masson Pine by Endo-cellulase and Its Mechanism[J]. China Pulp & Paper, 2015, 34(1): 11. 王 转, 李新平, 杜 敏, 等. 内切纤维素酶预处理对漂白马尾松纤维形态和结构的影响[J]. 中国造纸, 2015, 34(3): 11.
[15] TIAN Ye, CHEN Jia-chuan, YANG Gui-hua. Effects of Cellulase Treatment on Wheat Straw APMP[J]. China Pulp & Paper, 2011, 30(5): 16. 田 野, 陈嘉川, 杨桂花. 纤维素酶处理对麦草APMP浆性能的影响[J]. 中国造纸, 2011, 30(5): 16.
[16] press release: Nanocellulose for the first time on a large scale-Innventia. [OL]. 2011, http://www.innventia.com/en/About-us/News1/Press-Release-Nanocellulose-for-the-first-time-on-a-large-scale/.
[17] Lavoine N, Desloges I, Dufresne A, et al. Microfibrillated cellulose-Its barrier properties and applications in cellulosic materials: A review[J]. Carbohydrate Polymers, 2012, 90: 735.

(责任编辑:常 青)
Parameter Optimization of Cellulase Pretreatment for MFC Preparation Based on RSM Model
ZHANG Qi-lian ZHANG Zheng-jian*CHEN Yun-zhi LI Zhi-hong
(College of Packaging and Printing Engineering, Tianjin University of Science and Technology, China Light Industry Key Lab of Food Packaging Materials and Technology, Tianjin, 300222)(*E-mail: zhangzj@tust.edu.cn)
The response surface method (RSM) was used to optimize the process conditions of cellulase pretreatment for MFC preparation in this study. At first, the single factor analysis of the properties of MFC were conducted by Malvern particle size analyzer and Congo red staining method; then, RSM analysis method was used to optimize the process conditions using the particle size and specific surface area of MFC as the response values. The results showed that the changes of pulp concentration, cellulase dosage and cellulase pretreatment time had a certain influence on the performance of MFC. It was concluded that the optimized conditions of cellulase pretreatment for MFC preparation were as follows: the pulp concentration was 10%, the cellulase dosage was 10.53 U/g, and the cellulase pretreatment time was 24 h.
microfibrillated cellulose; response surface method; particle size; specific surface area; parameter optimization
张启莲女士,在读硕士研究生;主要研究方向:微纤化纤维素的制备及薄膜应用。
2017- 04- 09(修改稿)
TS72
A
10.11980/j.issn.0254- 508X.2017.07.001
*通信作者:张正健,副教授;主要研究方向为微纳米纤维素的制备及应用。
