公路运输对新西兰兔血液及生化指标的影响
2017-08-04余传辛高秀秀万梓成
余传辛,高秀秀,万梓成,梁 旺,3,王 萧
(1.广州中医药大学,广州 510405; 2.广州中医药大学实验动物中心,广州 510405;3.梅州市第二中医医院针灸科,广东 梅州 514011)
公路运输对新西兰兔血液及生化指标的影响
余传辛1,高秀秀1,万梓成1,梁 旺1,3,王 萧2*
(1.广州中医药大学,广州 510405; 2.广州中医药大学实验动物中心,广州 510405;3.梅州市第二中医医院针灸科,广东 梅州 514011)
目的 观察公路运输对新西兰兔血液常规和生化指标的影响。方法 选用12只健康普通级新西兰兔进行2 h公路运输,分别在运输前,运输后0、24、48、72、96 h采集血液获得检测样本。通过血液分析仪检测血常规指标:白细胞(WBC)、红细胞(RBC)、血红蛋白量(HGB)、红细胞压积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、血小板(PLT)。通过全自动生化分析仪检测:肝功能指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、白蛋白(ALB)、总蛋白(TP);肾功能指标:尿素氮(UREA)、肌酐(CREA)、尿酸(UA);脂代谢指标:甘油三酯(TG)、总胆固醇(COHL);糖代谢指标:葡萄糖(GLU);炎性指标:超敏感C-反应蛋白(CRP);血清酶:α-淀粉酶(AMYL)、肌酸激酶(CK)。结果 与运输前比较,运输结束后:血常规指标中,WBC先升高(P< 0.05或P< 0.01)后降低,RBC、HGB、HCT、PLT均先降低(P< 0.05或P< 0.01)后升高,MCV在运输结束96 h时显著高于运输前(P< 0.05);肝功能指标中,ALT、AST先升高(P< 0.05或P< 0.01)后降低,TP、ALB先降低(P< 0.05或P< 0.01)后升高;肾功能指标中,BUN先升高(P< 0.05或P< 0.01)后降低,CREA先降低(P< 0.01)后升高;脂代谢指标中,TG先降低(P< 0.01)后升高;糖代谢指标GLU在运输结束24 h时显著低于运输前(P< 0.01);除MCV外,各项指标均在运输结束96 h时与运输前无明显差异。结论 公路运输会引起新西兰兔血液常规、肝肾功能指标、脂代谢指标、糖代谢指标及肌酸激酶指标的变化,且各指标在96 h内基本恢复至运输前水平。
公路运输;新西兰兔;血常规;生化指标
运输在实验动物行业必不可少,运输应激是动物机体在运输过程中禁食、环境变化、颠簸、心理压力等应激源的综合作用后所产生的适应性和防御性反应[1],是在普通级实验兔生产与实验过程中最常见的一种应激[2]。且运输过程中环境温湿度、装载密度、运输时间、装卸过程、禁食饮水等对实验兔产生的各种不利影响都会影响实验动物的福利,影响实验动物的生理生化指标。
新西兰兔作为常用实验动物应用越来越广泛[3],在实验过程中保持其生理和生化客观指标的稳定对保证科研实验结果的确定性与稳定性意义重大。因在广州周边市区运输新西兰兔至本校车程约1.5 ~ 2 h,故本实验通过对新西兰兔在运输前及经过2 h公路运输后的适应性饲养期间的血液常规和部分生理生化指标的检测,探讨新西兰兔在运输前后血液指标的影响及变化规律,以期为选用新西兰兔作为实验动物进行科学实验提供适应性饲养时间的理论依据。
1 材料和方法
1.1 试验动物
健康的普通级新西兰兔12只,雌雄各半,体重3.0 ~ 3.5 kg,由广州中医药大学实验动物中心提供【SCXK(粤)2013-0020】,【SYXK(粤)2013-0001】。在动物饲养和实验过程中,严格遵循实验动物伦理条例,并经广州中医药大学实验动物伦理委员会伦理审查通过后进行,申请表编号:S2015060。
1.2 实验方法
选用12只健康的普通级新西兰兔,进行2 h公路运输,运输时间:2016年1月13日上午9:00 ~ 11:00。运输前一天对新西兰兔进行耳中动脉采集血液标本供检测,运输过程禁食禁水,运输密度约为4只/m2,运输过程中采用自动温湿度记录仪记录在行车过程中车内的温湿度变化。在运输结束后0、24、48、72、96 h分别进行血液标本采集以供检测。
1.3 试剂
生化试剂:甘油三酯(TG)试剂盒,批号:20150112;总胆固醇(COHL)试剂盒,批号:20150622;葡萄糖(GLU)试剂盒,批号:20150512;白蛋白(ALB)试剂盒,批号:20150322;总蛋白(TP)试剂盒,批号:20150622;丙氨酸氨基转移酶(ALT)试剂盒,批号:20150722;天门冬氨酸氨基转移酶(AST)试剂盒,批号:20150512;肌酸激酶(CK)试剂盒,批号:20150722;尿素氮(UREA)试剂盒,批号:20150622;肌酐(CREA)试剂盒,批号:20150622;尿酸(UA)试剂盒,批号:20150422;α-淀粉酶(AMYL)测定试剂盒,批号:20150412;超敏感C-反应蛋白(CRP)定量测定试剂盒,批号:20150612,均购自广州瑞宇生物科技有限公司。
血常规试剂:稀释液,批号:D15042301;溶血剂,批号:L14102301;清洗液,批号:C15050401;浓缩清洗液,批号:C15020301,均购自广州市贝立医学科技有限公司。
1.4 主要仪器设备
7060全自动生化分析仪(日本Hitachi公司生产);VetABC全自动血液分析仪(法国ABX公司生产);LGR-WSD20自动温湿度记录仪(杭州路格科技有限公司生产)。
1.5 血液标本的采集和检测
将新西兰兔固定后用一次性使用静脉采血针(规格0.7 × 18 TW)从耳中动脉采血5 mL,其中4 mL注入普通真空采血管,静置30 min,4 000 r/min离心10 min,收集血清检测血液生化指标:ALT、AST、ALB、TP、UREA、CREA、UA、TG、COHL、GLU、CRP、AMYL、CK。另1 mL注入EDTA-K2抗凝管中检测血液常规指标:WBC、RBC、HGB、HCT、MCV、MCH、MCHC、PLT。
1.6 统计学方法
用SPSS 17.0软件进行统计处理,统计结果以平均数±标准差表示。
2 结果
2.1 运输过程中车内环境温度及湿度变化
在运输过程中利用温湿度仪记录车内温湿度变化,并以曲线图记录下来。由图1和图2可见,在行车过程中车内温度保持在27℃左右,湿度保持在60%左右。
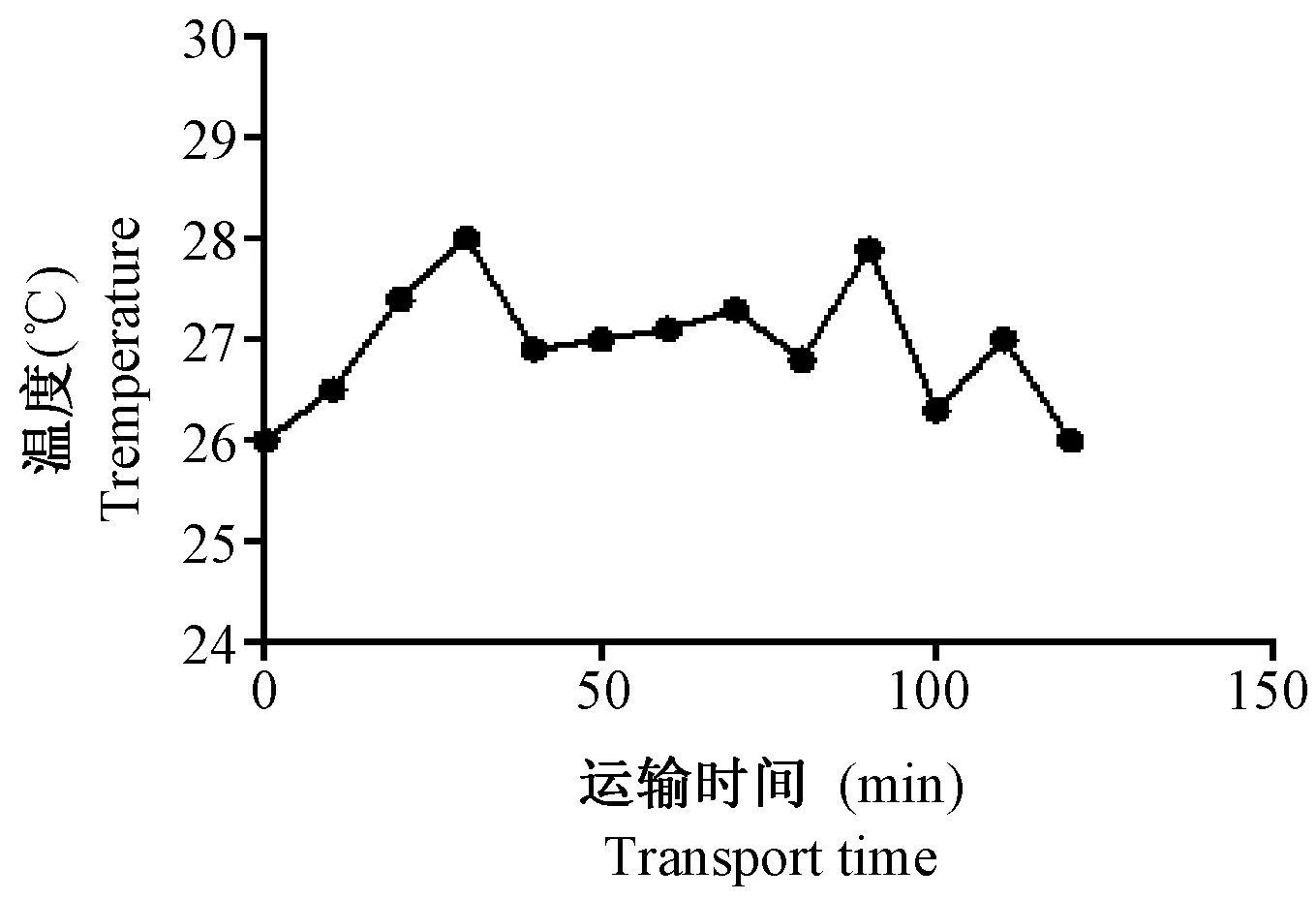
图1 运输过程中车内温度变化Fig.1 Temperature changes in the car during transport
2.2 公路运输对新西兰兔血液常规的影响
从表1可知,与运输前比较,WBC在运输结束0 h时极显著升高(P< 0.01),24 h显著升高(P< 0.05),在运输结束48 h至96 h无显著差异;RBC在运输结束0、24 h有所降低,但差异不显著,在运输结束48、72 h时则显著降低(P< 0.05),运输结束96 h基本回到运输前水平;HGB在运输结束0 h时差异不显著,运输结束24 h显著降低(P< 0.05),运输结束48 h极显著降低(P< 0.01),运输结束72、96 h时基本又回到运输前水平;HCT、PLT均在运输结束后呈降低趋势,在48 h时有显著性差异(P< 0.01),在运输结束96 h则基本回到运输前水平;MCV仅在运输后96 h时升高(P< 0.05),其余时间点与运输前基本持平;MCH、MCHC在运输结束后各时间点差异均不显著。
2.3 公路运输对新西兰兔肝功能指标的影响
由表2可知,与运输前比较:TP在运输结束0 h有降低趋势,但差异不明显,运输结束24、48 h时明显降低(P< 0.05),至运输结束72、96 h时基本恢复至运输前水平;ALB在运输结束0 h至72 h时显著降低(P< 0.05或P< 0.01),在运输结束96 h时则无显著差异;ALT在运输结束0 h时显著性升高(P< 0.01),之后降低,至96 h时基本降至运输前水平;AST在运输结束0、24 h时均显著性升高(P< 0.01),至运输结束48、72、96 h均回到运输前水平。
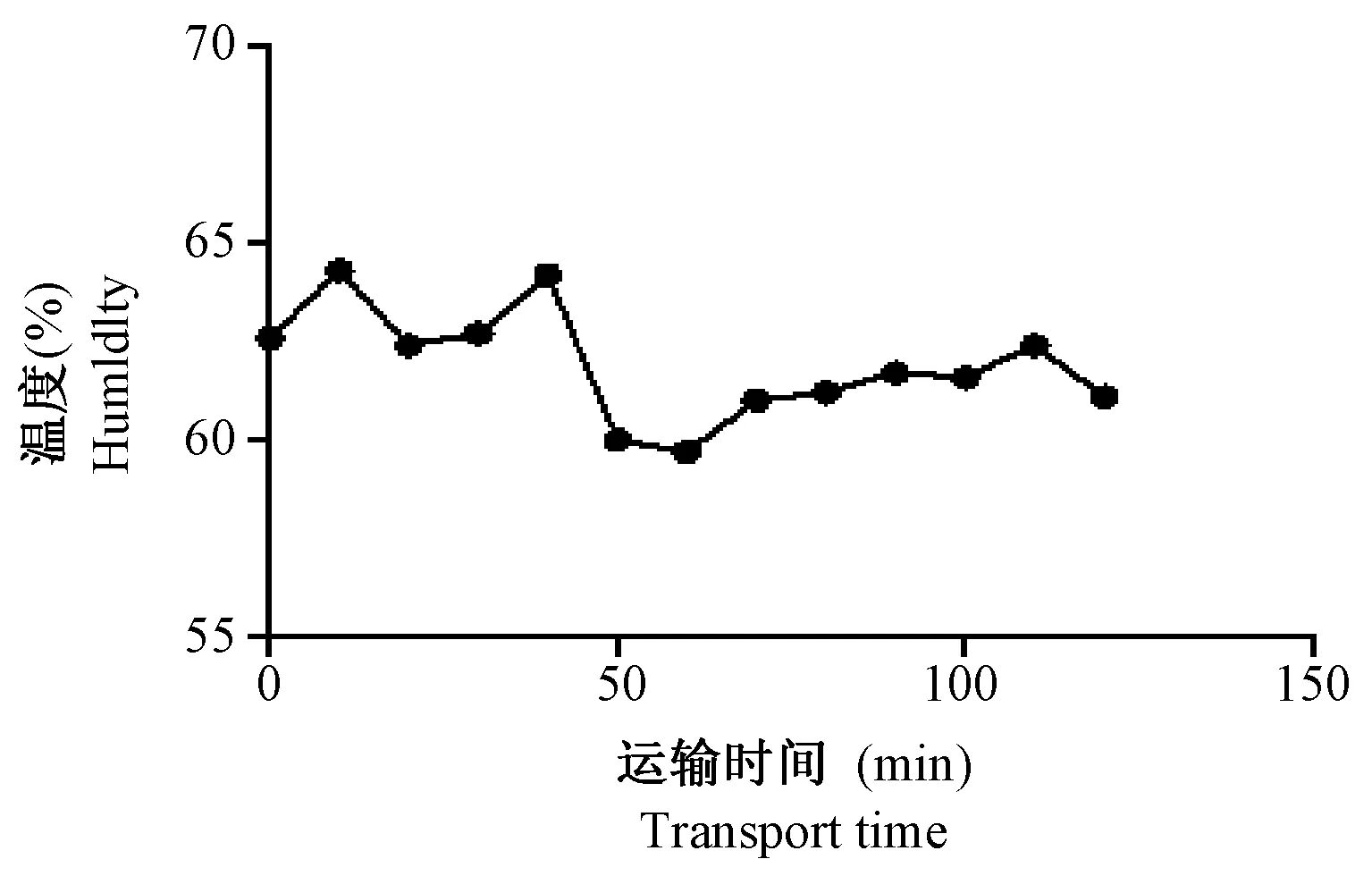
图2 运输过程中车内湿度变化Fig.2 Humidity changes in the car during transport
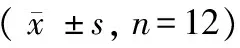
表1 血常规检测结果Tab.1 Changes in hematological parameters during the transport
注:与运输前比较,*P< 0.05,**P< 0.01。
Note.*P< 0.05,**P< 0.01, compared with that before transport.
2.4 公路运输对新西兰兔肾功能指标的影响
由表3可知,与运输前比较,BUN在运输结束0 h时显著升高(P< 0.05),而在运输结束24 h时则显著性降低(P< 0.01),之后回升,至运输结束48、72、96 h时无明显差异;CREA在运输结束0、24 h时显著性降低(P< 0.01),至运输结束48、72、96 h时基本恢复至运输前水平。UA则在运输前后无显著差异。
2.5 公路运输对新西兰兔糖代谢和脂代谢指标的影响
由表4可知,与运输前比较,GLU在运输结束0 h有降低趋势,差异不显著,在运输结束24 h时极显著降低(P< 0.01),在运输结束48 h时则升高,之后运输结束48、96 h时均略高于运输前,但均无显著差异;TG在运输结束0、24、48 h时极显著降低(P< 0.01),至运输结束72、96 h时基本恢复至运输前水平。CHOL在运输前后无显著差异。
2.6 公路运输对血清酶和CRP的影响
由表5可见,与运输前比较,CK、CRP及AMYL在运输前后差异无显著性。
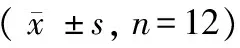
表2 肝功能检测结果Tab.2 Results of liver function test
注:与运输前比较,*P< 0.05,**P< 0.01。
Note.*P< 0.05,**P< 0.01, compared with that before transport.
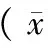
表3 肾功能检测结果±s)Tab.3 Results of renal function test
注:与运输前比较,*P< 0.05,**P< 0.01。
Note.*P< 0.05,**P< 0.01, compared with that before transport.
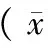
表4 糖代谢、脂代谢检测结果±s)Tab.4 Results of glycometabolism and lipid metabolism test
注:与运输前比较,*P< 0.05,**P< 0.01。
Note.*P< 0.05,**P< 0.01, compared with that before transport.
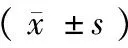
表5 血清酶、CRP检测结果Tab.5 Results of serum enzyme and CRP test
注:与运输前比较,*P< 0.05,**P< 0.01。
Note.*P< 0.05,**P< 0.01, compared with that before transport.
3 讨论
动物在运输应激状态下,体内生理及生化代谢会发生一系列变化,反应在血液常规及生化指标上,如造成皮质醇、皮质酮、加压素、甲状腺激素、若干转氨酶、脱氢酶、肌酸磷酸激酶各种酶和激素的异常[4],而运输过程中的各种不利的环境因素会导致实验动物血糖、尿素以及血液指标的变化。但是从前人研究结果来看有不一致,此次实验一月份在广州进行,彼时广州地区气候比同时期国内多数省份舒适,这可能也是影响实验结果的重要因素。
动物的生理指标是判断健康动物状态和选择合格动物的标准,也是病理学、毒理学研究的重要参考值[5],本实验通过检测运输前后血液常规、转氨酶、血清总蛋白、白蛋白、肌酐、尿素氮、尿酸等肝肾功能指标和血糖、胆固醇、甘油三酯等代谢指标以及肌酸激酶、α-淀粉酶,C-反应蛋白等最常用最有意义的指标[6],以期初步反应动物应激之后的机体状态和受损情况。
3.1 公路运输对新西兰兔血液常规的影响
血液是维持生命的重要组成部分,血液中白细胞系具有保护机体的重要作用[7],白细胞数量的变化与机体的免疫功能有关,其数量多少决定其免疫能力的高低[8],红细胞参与氧气和二氧化碳的运输,血小板则具有止血功能,可见其组成成分改变往往提示机体处于非健康状态。但关于实验动物在运输应激前后血常规的变化有较大争议,邓红雨[9]研究报道在运输前后牛血液WBC、RBC、HGB、HCT均无明显差异,王鑫蕾等[10]报道比格犬WBC、RBC、HGB、HCT在运输后适应性饲养前极显著高于适应性后,汤继顺等[11]报道运输后WBC、RBC、HGB、HCT和MCH的数值比运输前显著增加。韩瑾瑾等[12]报道,与运输前比较,运输后WBC升高但差异不显著,RBC、HGB降低但差异也不显著。
本实验研究结果表明,新西兰兔在运输结束后WBC显著升高,与汤继顺[11]报道一致,说明在运输应激后,新西兰兔机体启动了免疫机制以抵抗不利的外界环境。而RBC、HGB、HCT、PLT则显著降低,至运输结束96 h时基本恢复至运输前水平,与邓红雨[9]、汤继顺[11]的报道不一致,与王鑫蕾[10]的报道一致。这可能是在运输过程造成了动物短暂的营养不良、水分不足等,或者在运输条件下动物过度烦躁或兴奋等影响新西兰兔的消化吸收功能,这些使得新西兰兔运输过程中丢失水分过多、贫血而致。在运输结束适应性饲养后,消化功能恢复,营养得到补充,上述指标均基本恢复到运输前。本实验结果中MCV在运输结束96 h时显著升高,运输结束0 h至72 h均无显著变化,邓红雨[9]报道禁食长途运输可致动物脱水,引起MCV升高,MCV是HCT与RBC的比值结果,在96 h时其余指标均正常,单独MCV升高没有确切的临床意义[13]。
3.2 公路运输对新西兰兔生化指标的影响
肝脏是体内合成蛋白的重要器官,其功能指标有总蛋白、白蛋白、转氨酶等[14]。据报道,运输应激会使血清中ALT、AST升高[9,12,15],TP、ALB变化差异不显著[15]。本实验结果表明,运输结束后,ALT、AST均显著升高,TP、ALB显著降低,与邓红雨[9]报道一致。实验结果中肝功能各项指标均在运输结束96 h时与运输前无显著差异,说明运输引起的剧烈运动、过于劳累导致肝脏有一定程度受损而使其合成蛋白功能下降以及血清中ALT、AST 浓度升高[16],而不是由于肝脏感染炎症而引起[9]。同时白蛋白与总蛋白含量降低可能是因为在运输过程中营养摄入不足,机体蛋白质分解代谢加强。AST升高也可能是由于肌肉疲劳、肌细胞受损引起[9],但本实验结果中CK在运输前后无显著差异,因此不能证明新西兰兔在2 h短途运输过程中有肌细胞损伤。
肾脏是重要的排泄器官,能调节机体内水电平衡、酸碱平衡[17]。肌酐、尿素氮和尿酸是临床常见的肾功能检测指标,在一定程度上反应肾小球滤过功能[18]。本实验结果表明,BUN在运输结束后0 h时显著高于运输前,在运输结束24 h时则显著低于运输前,运输结束48 h及以后则与运输前无显著差异,CREA在运输结束后显著降低,UA在运输结束后无明显变化。关于运输前后BUN变化的报道颇有争议,王鑫蕾[10]报道比格犬BUN在运输后适应性饲养前低于适应性饲养后,CREA则高于适应性饲养后,韩瑾瑾[12]报道BUN在运输后极显著降低,卢春莲[15]报道,运输后BUN有一定程度升高,但差异不显著,汤继顺[11]报道运输后BUN显著升高,本实验中BUN先升高后降低但CREA降低,不能证明新西兰兔在本实验运输过程中肾功能受损,可能是运输过程中蛋白质分解增加导致运输结束0 h时BUN升高,运输结束后蛋白质又补充不足则致运输结束24 h时BUN下降,而CREA短暂降低可能是由于运输过程中营养摄入不足、肌肉营养不良所致。
血糖和甘油三酯是反应机体能量代谢的生化指标,糖类是机体能量的重要来源或直接来源[19],脂类是体内的供能和储能物质[20],已有文献中对GLU和TG在运输前后变化报道不一[9,10,21,22],可能与动物的种类和对能量的需求与消耗基础不同有关,本实验结果中GLU和TG均在运输后显著降低,提示新西兰兔在运输应激时能量消耗增加,对能量的需求也增加。
CK主要存在于骨骼肌、心肌等组织细胞中,其活性变化可以判断组织在应激使是否受损[23]。CRP是肝脏合成的急性期蛋白,主要与炎症和损伤有关[24]。AMYL是唾液与胰腺分泌的消化淀粉及多糖的消化酶,临床多用于辅助诊断消化性疾病。本实验结果中CK、CRP、AMYL在运输前后均无显著变化,不能说明新西兰兔在此实验运输过程中有组织损伤。
综上所述,运输应激对新西兰兔血液常规及生化指标均有一定影响,本次实验结果表明在运输过程中各种不利因素导致的指标变化除MCV以外,均在96 h时恢复至与运输前无显著差异。
[1] 袁芳,谭波. 运输应激对潼南猪肝脏生化指标及腹泻的影响[J]. 中国畜牧兽医文摘, 2016, 32(6): 61.
[2] 胡艳,钟敏,苏州,等. 缓解普通级实验兔运输应激的措施探讨[J]. 江西畜牧兽医杂志, 2015, (6): 28-29.
[3] 卞伟. 新西兰白兔的生产性能及推广利用情况[J]. 特种经济动植物, 2015, (10): 2-3.
[4] 李彩云,潘学营,张超,等. 实验动物运输福利的研究进展[J]. 中国比较医学杂志, 2015, 25(11): 86-89.
[5] 董浩然,王萧,桑传兰,等. 温度、湿度对实验动物福利的影响[J]. 广州中医药大学学报, 2012, 29(1): 59-65
[6] 饶子亮,赵士海,黄小琼,等. 垫料对小鼠血常规值和血清生化指标的影响[J]. 实验动物与比较医学, 2009, 29(1): 51-54.
[7] 吴荣华,施云刚,姚红艳,等. 运输应激对西门塔尔杂交牛生理指标的影响[J]. 动物医学进展, 2014, 35(1): 54-57.
[8] 刘恭植. 现代医学免疫学[M]. 江苏南京: 江苏科学技术出版社, 2000: 319-323.
[9] 邓红雨. 公路运输条件下牛的运输应激反应研究[D]. 河南农业大学, 2013.
[10] 王鑫蕾,吴小彦,王新维,等. 运输应激对比格犬血常规及生化指标的影响[J]. 动物医学进展, 2014, 35(12): 175-178.
[11] 汤继顺,李立冰,陈胜,等. 运输应激对大别山黄牛的影响[J]. 动物医学进展, 2013, 34(12): 236-240.
[12] 韩瑾瑾,杨高丰,张凯韩,等. 夏南牛运输前后生理指标和血液指标的对比研究[J]. 动物医学进展, 2011, 32(3):121-124
[13] 程敏,冯梅. 血液检验各参数在贫血鉴别诊断中的临床意义[J]. 临床医药实践, 2015, 24(11): 867-869.
[14] 邹慧. 对肝脏疾病患者进行生化检验的临床价值分析[J]. 世界最新医学信息文摘, 2016, 16(22): 135-136
[15] 芦春莲,李妍,曹玉凤,等. 肉牛宰前运输应激对其血液理化指标及免疫机能的影响[J]. 中国兽医学报, 2016, 36(7): 1173-1177.
[16] 张全江,李秋霞,熊正英. 耐力训练后再力竭运动对小鼠血液部分生化指标的影响[J]. 陕西师范大学学报(自然科学版), 2004, 32(1): 98-101.
[17] 高胜利. 生化及免疫学检查对肾脏疾病临床诊治的意义[J]. 河南职工医学院学报, 2014, 26(6): 683-684.
[18] 曲万云. 常见病检验手册[M]. 合肥:安徽科技出版社, 2003: 66
[19] 樊福好. 猪的血糖与健康的关系[J]. 猪业科学, 2016, 06: 102-103.
[20] 赵水平. 血脂代谢基础及临床相关问题(上)[J]. 中华医学信息导报, 2005, 20(5): 19.
[21] 饶开晴,夏东,刘锐,等. 大鼠模拟运输应激的效果分析[J]. 西南民族大学学报(自然科学版), 2007, 33(6): 1321-1323.
[22] 魏光河,张培晏. 运输对荣昌猪生理生化指标的影响[J]. 动物医学进展, 2011, 32(10): 123-127.
[23] 汪翼. 肌酸激酶升高的临床意义与特发性高肌酸激酶血症[J]. 中国实用儿科杂志, 2009, 24(6): 494-496.
[24] 朱骏. C-反应蛋白的测定及临床意义[J]. 安徽卫生职业技术学院学报, 2003, 2(4): 45-47.
Effects of road transport on hematological and biochemical parameters innew zealand rabbits
YU Chuan-xin1, GAO Xiu-xiu1, WAN Zi-cheng1, LIANG Wang1, 3, WANG Xiao2*
(1.Guangzhou University of Traditional Chinese Medicine, Guangzhou 510405, China; 2.Laboratory Animal Center,Guangzhou University of Traditional Chinese Medicine, Guangzhou 510405; 3.Acupuncture Division, MeizhouSecond Chinese Medicine Hospital, Meizhou 514011)
Objective To observe the effects of road transport on hematological and biochemical parameters in New Zealand rabbits. Methods A total of 12 healthy New Zealand rabbits were selected for 2 h road transport. Blood samples were collected at 0, 24, 48, 72 and 96 h after transport, respectively. White blood cells (WBC), red blood cells (RBC), hemoglobin (HGB), hematocrit (MCV), mean erythrocyte hemoglobin content (MCH), mean erythrocyte hemoglobin concentration (MCHC) and platelets (PLT) were measured using a blood analyzer. Blood alanine aminotransferase (ALT), aspartate aminotransferase (AST), albumin (ALB), total protein (TP), urea nitrogen (UREA), creatinine, uric acid (UA), triglycerides (TG), total cholesterol (COHL), glucose (GLU), hypersensitive C-reactive protein (CRP), α-amylase (AMYL), and creatine kinase (CK) were detected by an automatic biochemical analyzer. Results Compared the parameters before and after transport, The WBC count was increased first (P< 0.05 orP< 0.01) and then decreased after transport, the levels of RBC, HGB, HCT and PLT were decreased first (P< 0.05 orP< 0.01) and then increased after transport, and MCV was significantly high at 96 h after transport (P< 0.05). Among the clinical biochemical parameters, ALT, AST and BUN were firstly elevated (P< 0.05 orP< 0.01) and then decreased. TP, ALB as well as CREA and TG were firstly decreased (P< 0.05 orP< 0.01) and then increased. GLU was significantly low at 24 h after transport (P< 0.05). All parameters except MCV at 96 h after transport were not significantly different from those before transport. Conclusions Changes of blood routine, liver and kidney function indexes, lipid metabolism indexes, glucose metabolism index and creatine kinase index are observed in the New Zealand rabbits after 2-hour road transportation, and all the indicators except MCV return to pre-transport levels within 96 h.
Road transport; New zealand rabbits; Blood routine parameters; Clinical biochemical parameters
广东省科技厅科技计划项目(2015A030302073);广东省科技厅科技计划项目(2013B040200033)。
余传辛(1991-),女,硕士研究生在读。Email: 1149102050@qq.com
王萧(1972-),男,博士,研究员。Email: xwang72@gzucm.edu.cn
研究报告
R-33
A
1671-7856(2017) 07-0053-06
10.3969.j.issn.1671-7856. 2017.07.010
2017-01-13
