长链非编码 RNA CCAT1对人乳头状甲状腺癌侵袭和迁移能力的影响
2017-08-04刘丽云徐晋珩张志勇崔永兴
刘丽云,龚 健,徐晋珩,张志勇*,崔永兴
(1.唐山市工人医院病理科,河北 唐山 063000; 2.唐山市工人医院外科,河北 唐山 063000)
长链非编码 RNA CCAT1对人乳头状甲状腺癌侵袭和迁移能力的影响
刘丽云1,龚 健2,徐晋珩1,张志勇1*,崔永兴1
(1.唐山市工人医院病理科,河北 唐山 063000; 2.唐山市工人医院外科,河北 唐山 063000)
目的 检测长链非编码RNA CCAT1在人乳头状甲状腺癌中的表达,并观察下调表达CCAT1对人乳头状甲状腺癌细胞侵袭和迁移能力的影响。方法 检测人正常甲状腺细胞Nthy-ori 3-1及人乳头状甲状腺癌细胞TPC-1中CCAT1的水平,在TPC-1细胞中转染CCAT1 siRNA质粒,利用Transwell小室及划痕实验观察下调表达CCAT1对细胞侵袭和迁移能力的影响,通过Western blot检测BRAF、MUC15、RKIP蛋白的变化。结果 人乳头状甲状腺癌细胞TPC-1中CCAT1的水平明显高于人正常甲状腺细胞Nthy-ori 3-1;在TPC-1细胞中下调表达CCAT1后能够明显抑制细胞的侵袭和迁移能力;Transwell 侵袭实验和迁移实验显示下调表达CCAT1组TPC-1细胞的穿膜数与对照组比较明显减少。划痕实验中下调表达CCAT1后细胞间距较对照组明显增大,提示细胞运动能力减弱。同时下调表达CCAT1可明显降低细胞中BRAF、MUC15的表达,增高RKIP蛋白的表达。结论 人乳头状甲状腺癌中长链非编码RNA CCAT1较正常甲状腺细胞明显升高;在乳头状甲状腺癌中下调表达CCAT1可抑制细胞的侵袭、迁移运动能力,并且可能通过影响BRAF、MUC15、RKIP蛋白的表达发挥上述功能。
长链非编码;siRNA CCAT1;人乳头状甲状腺癌;TPC-1;Nthy-ori 3-1;细胞侵袭;细胞迁移
人乳头状甲状腺癌(papillary thyroid cancer,PTC)是临床上最为常见的甲状腺恶性肿瘤,PTC约占甲状腺癌的85% ~ 90%[1-3]。PTC临床上多以手术治疗为主[4],其早期诊断较为困难。研究显示,约有50% ~ 80%的PTC患者在确诊时往往已经发生了转移[5,6]。故而对PTC细胞的迁移侵袭能力调控研究就颇显重要。
长链非编码RNA(long non-coding RNA,lncRNA)是近年来发现的一类调控型大分子RNA。尽管其并不能转录蛋白质,但其在诸多生理活性和生命活动中发挥着重要作用,如参与细胞发育、基因印记、X染色体沉默以及调控转录和转录后水平等[7,8]。令人颇为兴奋的是,近来研究表明长链非编码RNA与人乳头状甲状腺癌进展的关系极其密切[9]。结肠癌相关转录因子1(colon cancer associated transcript 1,CCAT1)基因是2012年被发现的一种长链非编码RNA,研究已经显示CCAT1在结肠癌组织中异常表达[10];该基因相对表达水平高低还与结肠癌细胞增殖与转移活性关系密切[11-13]。诸多研究显示,CCAT1还可以促进肝癌细胞的增殖活化、肺癌、胆囊癌、胃癌、肝癌组织的发展,并被认为是乳腺癌诊断的经典生物标志分子[14-17]。然而,就CCAT1在人乳头状甲状腺癌方面的研究还较为缺乏。Nissan等[18]研究表明,癌细胞中过表达的CCAT1可有效促进癌细胞的转移。据此推断,CCAT1的过表达可能也会促进人乳头状甲状腺癌细胞的侵袭和转移。
因而,本试验拟首先检测人乳头状甲状腺癌TPC-1中CCAT1的表达水平,研究CCAT1在TPC-1细胞与正常甲状腺细胞中的表达水平差异;之后通过检验CCAT1 siRNA基因转染后TPC-1细胞侵袭迁移能力,研究CCAT1的表达水平与TPC-1细胞侵袭转移能力的关系,并探讨其分子机制,以期为人乳头状甲状腺癌的防治提供依据和借鉴。
1 材料和方法
1.1 材料
胰蛋白酶由美国Sigma公司购进;PBS磷酸缓冲液由美国Hyclone提供;细胞培养箱购买自德国Heraeus Sepatech 公司。DMEM培养基、胎牛血清和PBS均购自美国Hyclone,Trizol试剂盒购自美国Invitrogen;BCA蛋白浓度测试试剂盒(增强型)、5× SDS蛋白上样缓冲液、20× TBS缓冲液等购自南京建成生物有限公司。本试验细胞处理等过程中使用的超净工作台提供自上海艺斯高上海贸易有限公司。BRAF、MUC15、RKIP一抗为兔抗人多克隆抗体,二抗为辣根过氧化物酶(HRP)标记的山羊抗兔多克隆抗体购于北京百迈客生物科技有限公司,GAPDH为单克隆小鼠抗人GAPDH抗体,二抗为HRP标记的山羊抗小鼠多克隆抗体,均购于杭州艾康生物技术有限公司。
1.2 方法
1.2.1 检测人正常甲状腺细胞Nthy-ori 3-1及人乳头状甲状腺癌细胞TPC-1中CCAT1的水平
将人正常甲状腺细胞Nthy-ori 3-1和人乳头状甲状腺癌细胞TPC-1加入DMEM培养基,重复小心吹打细胞使其均匀分布,随后离心弃上清液。培养箱中培养细胞48 h,胰蛋白酶溶液消化2~3 min后终止消化;离心弃上清重悬细胞。调整细胞密度至2×107/mL,采用RT-PCR测定两组细胞的CCAT1 lncRNA基因相对表达水平。
据国家和地方节能标准和能效标准的实施,对应的软件也同步更新。节能软件和能效测评软件在全国使用率均在70%以上,为我国绿色建筑设计创造了条件。软件除销售给用户外,在我们的绿色建筑的设计咨询中项目中,也广泛使用,既检验了软件功能,也增加了用户体验,有利于软件的改进和完善。开发了绿色建筑设计领域系列软件产品,实现了绿色建筑设计软件的产业化。
通过Oligo 6软件设计引物,CCAT1引物序列上游:5’-CCAATTGAACCGAGCCTTGT-3’;下游:5’-TCGTGAGCGTTTTCGCAATG-3’,目的片段长度298 bp。参照物GAPDH引物序列上游:5’-TCCTCTGACTTCAACAGCGACAC-3’;下游5’-TCTCTCTTCCTCTTGTGCTCTTGC-3’,片段长度为176 bp。反应后琼脂糖凝胶电泳并成像仪摄片,用Image Proplus 6.0图像分析软件测算电泳条带的OD值,进而计算其相对表达量。每个检测重复三次。
1.2.2 基因转染
CCAT1 siRNA载体质粒及其空载质粒分别由上海生工生物有限公司合成并提供。将处于对数生长期的TPC-1细胞分为CCAT1 siRNA基因转染组(进行CCAT1 siRNA基因载体转染)和阴性对照组(进行空载质粒转染)两组,采用电穿孔法进行基因转染。
用HeBS液(140 mmol/L NaCl,5 mmol/L KCl,0.75 mmol/L Na2HPO4,6 mmol/L glucose,25 mmol/L Hepes)重悬、计数,调整各组细胞密度至5×106/mL;每次取200 μL细胞悬液加入电击杯,分别向转染组和阴性对照组加入4 μg CCAT1 siRNA和空载质粒;电击后25℃静置2 min,然后分别将两组细胞加入DMEM培养液进行培养48 h,备用。
1.2.3 Transwell小室检测下调表达CCAT1对细胞侵袭能力的影响
培养后48 h,Transwell小室侵袭实验检测CCAT1 siRNA转染后人乳头状甲状腺癌细胞侵袭能力。将基质胶均匀铺至Transwell小室上室,并加入100 μL细胞悬液(106/mL),下室加入500 μL完全培养基,37℃孵育24 h,取出Transwell,多聚甲醛固定,风干后加入0.1%结晶紫染色20 min。擦除上室细胞,显微镜下随机选择视野拍照,计算迁移到下腔表面的细胞数。
1.2.4 划痕实验观察下调表达CCAT1对细胞迁移能力的影响
1.2.5 Western blot检测BRAF、MUC15、RKIP蛋白的变化
培养48 h后,采用蛋白免疫印迹法测定人乳头状甲状腺癌细胞TPC-1中BRAF、MUC15、RKIP蛋白表达水平。取两组细胞,提取细胞蛋白质,BCA法测定细胞蛋白浓度。用细胞裂解液将各组蛋白稀释至等浓度,与2×上样缓冲液1∶1混合,100℃煮沸5 min蛋白变性。每组取蛋白40 μg,10%SDS-PAGE凝胶电泳(70 V,30 min;100 V,90 min);转膜(200 mA,3 h)至PVDF膜;5%脱脂牛奶室温封闭2 h(或4℃过夜);一抗1∶500,室温孵育2 h(或4℃过夜);TPBS洗涤3次,PBS洗涤1次;将Western印迹试剂均匀涂于PVDF膜上,凝胶成像系统曝光1 ~ 2 min。用Image Proplus 6.0图像分析软件测算电泳条带的OD值,计算相对表达量。
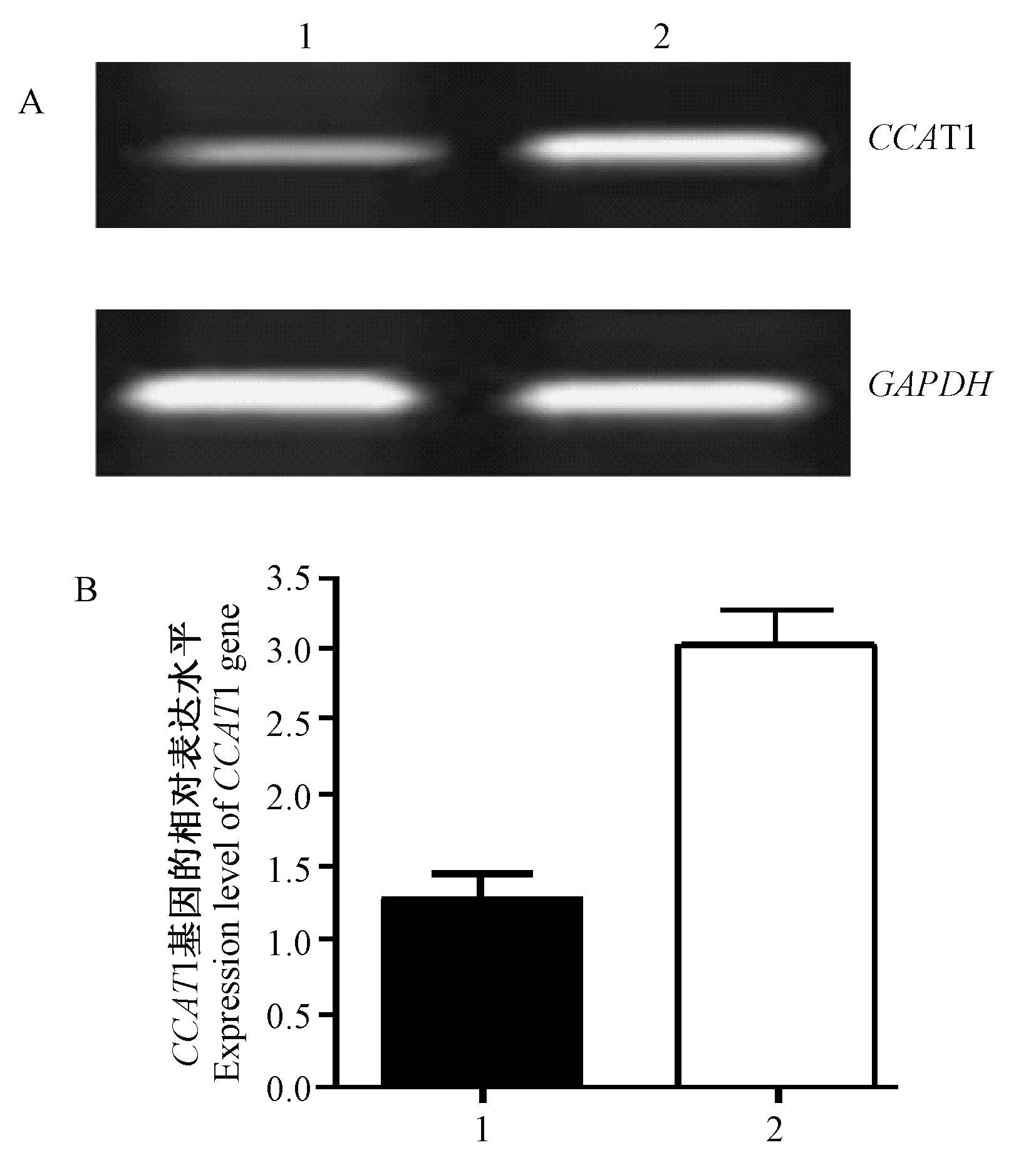
注:A:CCAT1基因的相对表达水平电泳结 果。1:正常甲状腺细胞Nthy-ori 3-1;2:人乳头 状甲状腺癌细胞TPC-1。B:CCAT1基因的相对表达水平。图1 CCAT1基因表达水平Note. A: Electrophoresis results of relative expression level of CCAT1 gene. 1: Normal thyroid Nthy-ori 3-1 cells; 2: Papillary thyroid cancer TPC-1 cells; B: Relative expression level of CCAT1 gene.Fig.1 Expression level of CCAT1 gene
1.3 统计学处理
2 结果
2.1 人乳头状甲状腺癌细胞TPC-1中CCAT1基因表达水平
通过RT-PCR进行测定CCAT1基因相对表达水平。图1为RT-PCR的电泳图,可见目的基因CCAT1相对表达量,人正常甲状腺细胞(1.282 ± 0.164)和人乳头状甲状腺癌TPC-1细胞(3.026 ± 0.243),基因CCAT1在人乳头状甲状腺癌细胞中的相对表达水平显著高于其在正常甲状腺细胞中的表达水平(P< 0.05)。
2.2 下调表达CCAT1后细胞的侵袭能力
如图2所示,基因沉默CCAT1对人乳头状甲状腺癌细胞的侵袭能力变化的影响。阴性对照组(52.93 ± 4.56)和基因转染组(23.06 ± 2.79)细胞的侵袭率差异有显著性(P< 0.05),与阴性对照组相比,基因转染组癌细胞的侵袭率降低。
2.3 下调表达CCAT1后细胞的迁移能力
采用划痕愈合实验检测人乳头状甲状腺癌TPC-1细胞迁移能力,结果如图3。阴性对照组和基因转染组细胞的迁移率分别是(46.25 ± 3.98)%和(19.20 ± 2.23)%,阴性对照组与基因转染组细胞的迁移能力差异有显著性(P<0.05)。CCAT1 siRNA基因转染显著降低了TPC-1细胞的迁移能力,与阴性对照组相比,转染组细胞降低。
2.4 BRAF、MUC15、RKIP蛋白表达
如表1、图4所示,Western blot结果显示CCAT1 siRNA基因转染显著降低了人乳头状甲状腺癌细胞TPC-1中的BRAF、MUC15的表达水平,并提高了RKIP的蛋白表达水平。与阴性对照组相比,下调CCAT1表达组BRAF和MUC15的蛋白表达水平分别降低,RKIP表达水平升高,且二者差异有显著性(P< 0.05)。
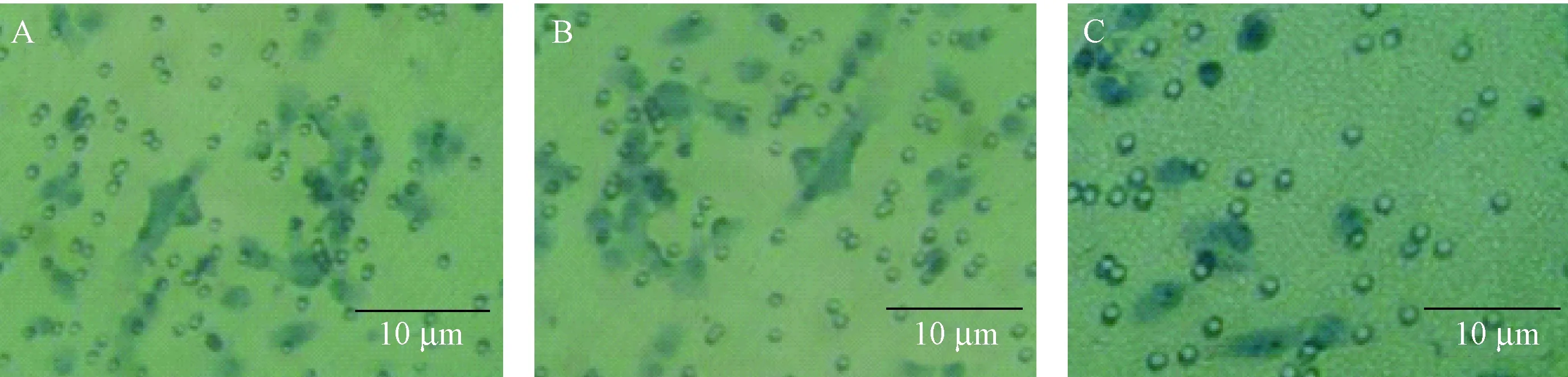
注: A:正常细胞组;B:阴性对照组;C:基因转染组。(× 200)图2 CCAT1下调表达后细胞的侵袭能力Note. A: Normal cell group; B: Negative control group; C: Gene transfection group.Fig.2 inhibition of cell invasion after down-regulation of CCAT1

注: A:正常细胞组; B:阴性对照组; C:基因转染组。(×200)图3 下调表达CCAT1后细胞的迁移能力Note. A: Normal cell group; B: Negative control group; C: Gene transfection group.Fig.3 Inhibition of cell migration after down-regulation of CCAT1

组别GroupsBRAFMUC15RKIP正常细胞组Normalcellgroup0198±00300213±00380234±0078阴性对照组Negativecontrolgroup0185±00280207±00350259±0102基因转染组Genetransfectiongroup0067±00100082±00080436±0117
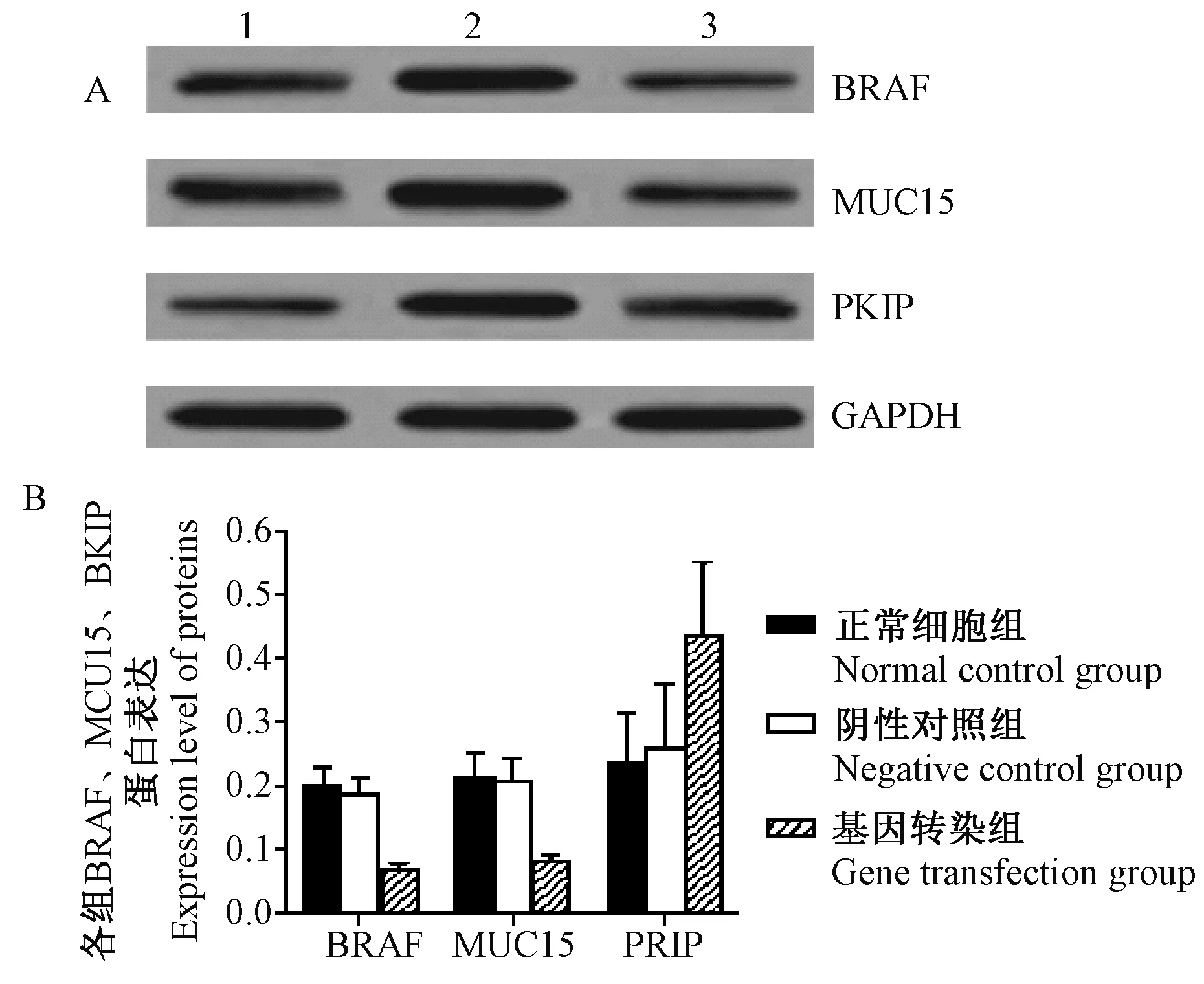
注:A:正常细胞组; B:阴性对照组; C:基因转染组。图4 各组BRAF、MUC15、RKIP蛋白表达水平Note. A: Normal cell group; B: Negative control group; C: Gene transfection group.Fig.4 Expression levels of BRAF, MUC15 and RKIP proteins in each group
3 讨论
尽管长链非编码RNA无法编码蛋白质,但是由于其具有特定的空间结构,并可定位于细胞核或者细胞质内;故而其具有复杂的生物学功能,如参与染色质重构、翻译和翻译后调控、RNA剪接等生理过程[19-21]。
在正常细胞中只能检测到微量或检测不到的CCAT1表达。在机体发生癌变时,肿瘤组织中的CCAT1基因表达水平会显著升高[22-24]。但就CCAT1在TPC-1细胞中的表达水平的研究尚为缺乏。本研究结果表明,TPC-1细胞TPC-1中的CCAT1基因相对表达水平显著高于正常甲状腺细胞。这提示高表达水平的CCAT1可能在TPC-1细胞的进程中发挥着重要作用。本试验通过CCAT1 siRNA基因转染以探讨CCAT1基因对TPC-1细胞侵袭迁移能力的影响。本试验提示,下调CCAT1的基因表达水平显著降低了TPC-1细胞的侵袭和迁移能力。研究显示CCAT1在结直肠癌转移、胆囊癌细胞进展中均具有积极的促进作用[25-27]。
BRAF是MAPK信号途径最为有效的激活剂[28-30]。彭思丹等[31]研究显示,人乳头状甲状腺癌组织中的BRAF蛋白表达水平显著高于癌旁组织。BRAF可与Ras相互激活而磷酸化MEK和ERK蛋白,并将信号传导至胞内,调控细胞侵袭和转移等方面的功能。MUC15是黏蛋白家族成员之一,癌细胞中过表达的MUC15可以激活ERK-MAPK信号通路,进而提高癌细胞的侵袭转移能力[32]。RKIP在癌细胞中低表达,其可以依赖Raf和不依赖Raf两种方式抑制MAPK信号传导通路,调控癌细胞的侵袭和迁移能力[33]。本试验通过沉默CCAT1基因表达,显著降低了TPC-1细胞中BRAF和MUC15的蛋白表达水平,提高了RKIP蛋白表达水平。CCAT1 siRNA基因转染可能通过调控BRAF、MUC15和RKIP的蛋白表达影响癌细胞的侵袭和转移能力。癌细胞中BRAF、MUC15和RKIP蛋白分子表达均与MAPK信号转导通路有关。而MAPK信号转导途径与c-myc蛋白表达的调控关系密切[29]。He等[30]研究表明,c-myc可通过结合CCAT1的启动子区域活化CCAT1基因表达,上调的CCAT1进而提高癌细胞侵袭能力。因此CCAT1基因沉默导致的癌细胞侵袭和迁移能力下降可能通过c-myc和MAPK信号转导通路有关。
本文通过CCAT1 siRNA基因转染,显著抑制了人乳头状甲状腺癌TPC-1细胞的侵袭和迁移活性,其可能是通过MAPK信号转导通路调控的BRAF、MUC15和RKIP蛋白表达实现的。因此,CCAT1可能是人乳头状甲状腺癌防治的新靶点,但其具体机制有待进一步研究探讨。
[1] 丁金旺, 周荣璟, 罗中尧, 等. 34βE12、Galectin-3及HBME-1在甲状腺良、恶性结节中的表达差异及临床诊断价值[J]. 中国耳鼻咽喉头颈外科, 2016, 23(2): 88-92.
[2] Hou P, Liu D, Xing M. Functional characterization of the T1799-1801 del and G1799-1816ins BRAF mutations in papillary thyroid cancer[J]. Cell Cycle, 2014, 6(3): 377-379.
[3] Grant CS. Papillary thyroid cancer: strategies for optimal individualized surgical management[J]. Clin Ther, 2014, 36(7): 1117-1126.
[4] 姚庆春, 姜涛, 窦京涛. 甲状腺乳头状微小癌的研究进展[J]. 中华老年多器官疾病杂志, 2014, 13(10): 792-795.
[5] Hafez MT, Refky B, Elwahab KA, et al. Axillary lymph nodes metastasis in a patient with recurrent papillary thyroid cancer: a case report[J]. J Med Case Rep, 2015, 9(1): 890-894.
[6] Xu D, Lv X, Wang S, et al. Risk factors for predicting central lymph node metastasis in papillary thyroid microcarcinoma[J]. Int J Clin Exp Patholo, 2014, 7(9): 6199-6205.
[7] Pan YF, Feng L, Zhang XQ, et al. Role of long non-coding RNAs in gene regulation and oncogenesis[J]. Chin Med J (Engl), 2011, 124(15): 2378-2383.
[8] Maass PG, Luft FC, Bähring S. Long non-coding RNA in health and disease[J]. J Mol Med, 2014, 92(4): 337-346.
[9] 丁金旺, 张煜, 王克义, 等. 长链非编码RNA在甲状腺乳头状癌中的表达谱分析[J]. 中国耳鼻咽喉头颈外科, 2016, 23(5): 293-294.
[10] 赵志洋. 长链非编码RNA CCAT1通过调控线粒体凋亡通路影响结肠癌细胞增殖的机制研究[J]. 医药前沿.2015, 35(5): 371-374.
[11] Alaiyan B, Ilyayev N, Stojadinovic A, et al. Differential expression of colon cancer associated transcript1(CCAT1) along the colonic adenoma-carcinoma sequence[J]. BMC Cancer, 2013, 13: 196.
[12] Zhu H, Zhou X, Chang H, et al. CCAT1 promotes hepatocellular carcinoma cell proliferation and invasion[J]. Int J Clin Exp Pathol, 2015, 8(5): 5427-5434.
[13] Li Z, Yu X, Shen J. Long non-coding RNAs: emerging players in osteosarcoma[J]. Tumor Biol, 2016, 37(3): 2811-2816.
[14] Ma MZ, Chu BF, Zhang Y, et al. Long non-coding RNA CCAT1 promotes gallbladder cancer development via negative modulation of miRNA-218-5p[J]. Cell Death Dis, 2015, 6: e1583.
[15] Yang F, Xue X, Bi J, et al. Long noncoding RNA CCAT1, which could be activated by c-Myc, promotes the progression of gastric carcinoma[J]. J Cancer Res Clin Oncol, 2013, 139(3): 437-445.
[16] Deng L, Yang SB, Xu FF, et al. Long non-coding RNA CCAT1 promotes hepatocellular carcinoma progression by functioning as let-7 sponge[J]. J Exp Clin Cancer Res, 2015, 34(1): 18.
[17] Zhang XF, Liu T, Li Y, et al. Overexpression of long non-coding RNA CCAT1 is a novel biomarker of poor prognosis in patients with breast cancer[J]. Int J Clin Exp Pathol, 2015, 8(8): 9440-9445.
[18] Nissan A, Stojadinovic A, Mitrani-Rosenbaum S, et al. Colon cancer associated transcript-1: a novel RNA expressed in malignant and pre-malignant human tissues[J]. Int J Cancer, 2012, 130(7): 1598-1606.
[19] 孙伟鹏, 聂常富, 韩风, 等. 长链非编码RNA CCAT1在肝细胞癌组织及细胞株中的表达及临床意义[J]. 临床肿瘤学杂志, 2016, 21(4): 325-328.
[20] 崔戈, 张婷, 崔杰. 结肠癌相关转录因子1表达在结直肠癌早期筛查及预后评估中的作用[J]. 南京医科大学学报(自然科学版), 2015, 35(7): 1008-1012.
[21] Haling JR, Sudhamsu J, Yen I, et al. Structure of the BRAF-MEK complex reveals a kinase activity independent role for BRAF in MAPK signaling[J]. Cancer Cell, 2014, 26(3): 402-413.
[22] Szabo A, Fekete T, Koncz G, et al. RIG-I inhibits the MAPK-dependent proliferation of BRAF mutant melanoma cells via MKP-1[J]. Cell Signal, 2016, 28(5): 335-347.
[23] Ahronian LG, Corcoran RB. Effective MAPK inhibition is critical for therapeutic responses in colorectal cancer with BRAF mutations[J]. Mol Cell Oncol, 2015, 3(1): e1048405.
[25] Tsai MC, Manor O, Wan Y, et al. Long noncoding RNA as modular scaffold of histone modification complexes[J]. Science, 2010, 329(5992): 689-693.
[26] Tripathi V, Ellis JD, Shen Z, et al. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation[J]. Mol Cell, 2010, 39(6): 925-938.
[27] Kotake Y, Nakagawa T, Kitagawa K, et al. Long non-coding RNA ANRIL is required for the PRC2 recruitment to and silencing of p15 INK4B tumor suppressor gene[J]. Oncogene, 2011, 30(16): 1956-1962.
[28] Gao Y, Meng H, Liu S, et al. LncRNA-HOST2 regulates cell biological behaviors in epithelial ovarian cancer through a mechanism involving microRNA let-7b[J]. Hum Mol Genet, 2015, 24(3): 841-852.
[29] 郑人源, 张琴, 卓强, 等. 阻断p38MAPK信号通路对大鼠肝星状细胞活性及c-myc蛋白表达的影响[J]. 重庆医学, 2014, 43(25): 3307-3310.
[30] He X, Tan X, Wang X, et al. C-Myc-activated long noncoding RNA CCAT1 promotes colon cancer cell proliferation and invasion[J]. Tumour Biol, 2014, 35(12): 12181-12188.
[31] 彭思丹, 邹琼燕, 易文君. BRAF 及其信号通路相关蛋白在甲状腺乳头状癌中表达及意义[J]. 实用预防医学, 2011, 18(8): 1397-1399.
[32] Nam KH, Noh TW, Chung SH, et al. Expression of the membrane mucins MUC4 and MUC15, potential markers of malignancy and prognosis, in papillary thyroid carcinoma[J]. Thyroid, 2011, 21(7): 745-750.
[33] Zhang M, Zhang D, Fan D. RKIP suppresses the proliferation and invasion of choriocarcinoma cells through inhibiting the MAPK signaling pathway[J]. Int J Clin Exp Med, 2015, 8(12): 22183-22190.
Effect of long non-coding RNA CCAT1 on invasion andmigration of papillary thyroid cancer cells
LIU Li-Yun1, GONG Jian2, XU Jin-Heng1, ZHANG Zhi-yong1*, CUI Yong-xing1
(1.Department of Pathology, Tangshan Gongren Hospital, Tangshan 063000, China; 2.Department of Surgery,Tangshan Gongren Hospital, Tangshan 063000)
Objective To detect the expression of long non-coding RNA (lncRNA) CCAT1 in human papillary thyroid cancer, and to observe the effect of CCAT1 down-regulation on the invasion and migration of human papillary thyroid cancer. Methods The expression of CCAT1 was detected in human normal thyroid Nthy-ori 3-1 cells and human papillary thyroid cancer TPC-1 cells. CCAT1 siRNA plasmid was transfected into TPC-1 cells. The effect of CCAT1 down-regulation on cell invasion and migration was observed by Transwell chamber assay and scratch test, and the expressions of BRAF, MUC15 and RKIP proteins were detected by Western blot. Results The level of CCAT1 in human papillary thyroid cancer TPC-1 cells was significantly higher than that in human normal thyroid Nthy-ori 3-1 cells. CCAT1 down-regulation significantly inhibited the invasion and migration of TPC-1 cells. The Transwell invasion assay revealed that the number of migrated TPC-1 cells in the CCAT1 down-regulation group was significantly lower than that in the control group. The scratch test showed an increased distance between cells in the CCAT1 down-regulation group compared to the control group, suggesting a reduced cell motility. The expressions of BRAF and MUC15 proteins were decreased in the CCAT1 down-regulation group, while that of RKIP protein was increased. Conclusions The expression of CCAT1 in papillary thyroid cancer cells is significantly higher than that in normal human thyroid cells. Down-regulation of CCAT1 in papillary thyroid cancer cells may inhibit the cell invasion and migration by regulating the expression of BRAF, MUC15 and RKIP proteins.
LncRNA; siRNA CCAT1; Human papillary thyroid cancer; TPC-1; Nthy-ori 3-1; Cell invasion; Cell migration
刘丽云,主治医师。研究方向:肿瘤病理。Email: sunguolei2580@163.com
张志勇,主治医师。研究方向:肿瘤病理。
研究报告
R-33
A
1671-7856(2017) 07-0081-06
10.3969.j.issn.1671-7856. 2017.07.015
2017-04-05
