1.8 mT不同频率正弦交变电磁场对青年大鼠骨密度及骨形态计量的影响比较
2017-08-01周延峰李雪雁李文苑秦荣
周延峰,李雪雁,李文苑,秦荣
1.8 mT不同频率正弦交变电磁场对青年大鼠骨密度及骨形态计量的影响比较
周延峰*,李雪雁*,李文苑,秦荣
兰州理工大学生命科学与工程学院,甘肃兰州 730050

周延峰, 李雪雁, 李文苑, 等. 1.8 mT不同频率正弦交变电磁场对青年大鼠骨密度及骨形态计量的影响比较. 生物工程学报, 2017, 33(7): 1158–1167.Zhou YF, Li XY, Li WY, et al. Effects of 1.8 mT sinusoidal electromagnetic fields of different frequencies on bone mineral density and bone histomorphometry of young rats. Chin J Biotech, 2017, 33(7): 1158–1167.
比较不同频率的正弦交变电磁场对SD青年大鼠骨密度及骨形态计量指标的影响,筛选可有效提升大鼠骨密度的频率参数。将32只8周龄SD雌性大鼠随机分为4组:对照组、15 Hz组、30 Hz组、45 Hz组;除对照组外,实验组大鼠每天都给予相应频率的1.8 mT正弦交变电磁场干预,干预时间为90 min。磁场干预8周后,双能X射线骨密度仪检测大鼠全身骨密度、右侧股骨骨密度和椎骨骨密度,ELISA分析血清中骨形成与骨吸收生化指标的含量,右侧胫骨进行荧光间距测量与骨形态计量分析。相比于对照组,15 Hz组、45 Hz组大鼠的全身骨密度、股骨骨密度、椎骨骨密度均明显升高 (0.05),血清中骨钙素与骨保护素含量也显著提升 (0.05);实验组大鼠的胫骨双荧光间距与骨组织静态参数均高于对照组(0.05)。结果表明,15 Hz、45 Hz正弦交变电磁场可有效提升青年大鼠的骨密度,从而可预防骨质疏松的发生。
骨密度,正弦交变电磁场,骨形态计量学
骨质疏松症 (Osteoporosis,OP) 是一种常见的危害现代人类健康的全身性骨骼疾病,骨微结构的劣化与骨折风险的增加,使其具有很高的病后致残和致死率[1–3]。当前对于OP的防治,主要包括服用双膦酸盐等药物并补充钙剂与维生素D[4–5],除药物、膳食与运动[6–7]等治疗方式外,有研究结果显示,电磁场干预青年大鼠可影响大鼠骨密度并改善骨功能[8],进而可降低或延缓OP的发生。
作为评价骨质量的重要标准,骨密度 (Bone mineral density,BMD) 能有效衡量骨含量的高 低[9],骨密度的升高直接导致峰值骨量 (Peak bone mass) 的提升,而峰值骨量的高低又是诱发OP的一个主要原因,峰值骨量越高,OP发生概率越低[10–12]。骨量的多少由骨密度直观反映,而骨组织结构的优劣状况以及骨的代谢情况可由骨形态计量学指标客观展现[13]。在众多新型的物理治疗方法中,电磁场干预因其具有无创伤、无感染、使用方便等优点,应用十分广 泛[14–15]。通过电磁场的干预,使生物个体在青春期达到峰值骨量的最大值,以此来延缓OP发生的研究具有重要的意义。此外,在本课题组前期的细胞实验中证实1.8 mT正弦交变电磁场能够促进成骨细胞成熟与矿化[16],相关动物实验也筛选并获得了有效的电磁场波形[17],基于以往实验的结论与预试验的结果[18],本文通过比较50 Hz以内的不同频率1.8 mT正弦交变电磁场对青年大鼠峰值骨量及骨形态计量指标的影响,在筛选最佳电磁场频率的同时也探究正弦电磁场增加骨量、优化骨组织结构的作用机制,研究结果将为电磁场预防和延缓骨质疏松症的发生提供参考。
1 材料与方法
1.1 实验仪器及材料
双能X线骨密度仪(GE公司,美国),Epoch型酶标仪(Bio Tek公司,美国),水合氯醛(天津大茂化学试剂公司,中国),盐酸四环素与钙黄绿素 (Enzo Life Sciences Ltd,瑞士),血清骨钙素 (Osteocalcin,OC) 试剂盒 (IDS Ltd,英国)、大鼠核因子κB受体活化因子配体 (Receptor activator for nuclear factor-κB ligand,RANKL)血清试剂盒和大鼠骨保护素 (Osteoprotegerin,OPG) 血清试剂盒 (上海研吉生物科技有限公司,中国),抗酒石酸酸性磷酸酶5b (Tartrate resistant acid phosphatase,TRAP-5b) 试剂盒 (IDS Ltd,英国),Technovit®9100树脂包埋试剂盒 (Heraeus Kulzer GmbH & Co. KG,德国),SP1600硬组织切片机 (LEICA公司,德国),BX53型正置显微镜 (Olympus公司,日本)。
1.2 电磁场发生仪
由中国科学院兰州近代物理研究所研制,磁场发生仪线圈内径为120 cm,频率范围为0−100 Hz,磁场强度为0–5.5 mT,可选波形有正弦、脉冲、三角等,仪器输出的电磁场波形、强度及频率均可自由设定,经高斯计检测,仪器运行期间,线圈中轴区域内(d=70 cm) 产生的电磁场均匀稳定(误差率<4%),实验期间,鼠笼每日均放置在线圈正中的固定位置。
1.3 实验动物分组及磁场处理
32只8周龄SPF级雌性SD大鼠,由甘肃中医药大学动物实验中心提供,许可证号:SCXK (甘) 2015-0001,体重(80±5) g。随机分成对照组与实验组,实验组包括:15 Hz组、30 Hz组和45 Hz组。实验组大鼠每天给予相应频率的1.8 mT正弦交变电磁场干预,干预时间90 min。对照组除不进行磁场处理外,其他条件均与实验组相同。每日观察大鼠身体与精神状态,每周进行1次体重测量。
1.4 骨密度检测
磁场干预4周后,所有大鼠腹腔麻醉 (10%水合氯醛) 后,经双能X线骨密度仪(GE公司,美国) 检测大鼠全身BMD。磁场处理8周后,麻醉大鼠并检测全身BMD,然后经腹腔动脉采血,处死动物。剥离大鼠两侧股骨和整个腰椎后,检测股骨与腰椎骨 (L1-L6) 的骨密度。
1.5 血清生化指标检测
动脉血样经1 500 r/min离心5 min,分离出血清,–80 ℃冻存备用。ELISA试剂盒测定大鼠血清中的骨钙素OC、RANKL及OPG,于酶标仪450 nm处测定吸光度值,并通过各自的标准曲线计算出OC含量与RANKL/OPG的值。ELISA试剂盒测定大鼠血清中TRACP-5b,于酶标仪405 nm处测定值,并通过标准曲线计算出TRACP-5b的含量。
1.6 脏器固定及病理切片
剥离干净大鼠的肝、肾、心、脾、子宫等脏器后,称重并计算器官系数,然后脏器经4%甲醛固定,常规切片,HE染色,由资深病理医师进行病理学观察及诊断。
1.7 骨形态计量分析
大鼠处死前15 d和前5 d,分别于皮下注射双荧光标记物:盐酸四环素(5 mg/mL) 和钙黄绿素(2 mg/mL)。大鼠处死后,剥离的胫骨保存于70%酒精中用于骨形态分析,将胫骨经酒精脱水、二甲苯透明后,采用不脱钙塑料包埋法包埋。包埋体置于SP1600硬组织切片机中切片,切片厚度为400 μm,切片用强力胶封固在载玻片后经1 000−2 000目的砂纸打磨。取两张完整的切片,一张用于双荧光标记的观察及荧光间距的量化分析,另一张经苦味酸-品红 (Van gieson,VG) 染色后,显微镜下观察染色结果,采用IPP6.0图片分析软件进行骨形态计量分析。
1.8 统计学分析
采用SPSS17.0统计软件进行数据分析,检测数据以均数±标准差(±) 表示,不同组间差异采用单因素方差分析,组间两两比较采用LSD检验法。<0.05为差异具有显著性,<0.01为差异具有极显著性。
2 结果与分析
2.1 大鼠体重及精神状况
电磁场干预实验大鼠的场景见图1,整个实验过程中,实验大鼠与对照组大鼠在体重差异上无统计学意义,见表1,所有大鼠精神状况也无明显差异。

图1 不同频率电磁场对实验大鼠进行每日1.5 h的干预
表1 不同频率电磁场处理后大鼠的体重变化情况(±s,g)
Table 1 Weight changes of rats treated with different frequency electromagnetic fields (±s,g)

表1 不同频率电磁场处理后大鼠的体重变化情况(±s,g)
GroupsNumber4 week8 week Control group8151.3±6.264 8184.4±9.157 3 15 Hzgroup8154.5±5.573 1183.0±6.603 2 30 Hz group8151.7±5.316 0182.9±8.243 4 45 Hzgroup8154.2±6.897 4185.2±8.458 1
The weight of the rats in 1.8 mT different frequency sinusoidal electromagnetic field’s interference after one month and two months.
2.2 骨密度检测结果
磁场干预4周后,与对照组大鼠相比,实验组大鼠全身BMD无统计学意义 (>0.05),磁场处理8周后,15 Hz组、45 Hz组全身BMD均显著高于对照组 (<0.05)。见表2。大鼠离体骨密度的结果显示,15 Hz、45 Hz组大鼠在股骨骨密度上相比对照组,有统计学意义 (<0.05),实验组大鼠与对照组大鼠在腰椎骨 (L1–L6) 骨密度上无显著差异 (>0.05)。见表3。
2.3 血清生化指标检测结果
15 Hz、45 Hz组的骨形成指标OC含量显著高于对照组 (<0.05),OPG/RANKL的值有极显著性差异 (<0.01);30 Hz组在OC含量上无明显差异 (>0.05),在OPG/RANKL的比值上有显著差异 (<0.05);在骨吸收指标TRACP-5b的含量上,实验组与对照组比较,无统计学意义(见表4)。
2.4 脏器病理结果
实验组与对照组的大鼠器官系数上无统计学差异,所有大鼠脏器病理切片经资深病理科医师检查后未发现异常病理性改变,对照组大鼠脏器的病理切片与骨密度提升最显著的45 Hz组大鼠脏器的病理切片见图2。
2.5 双荧光间距结果
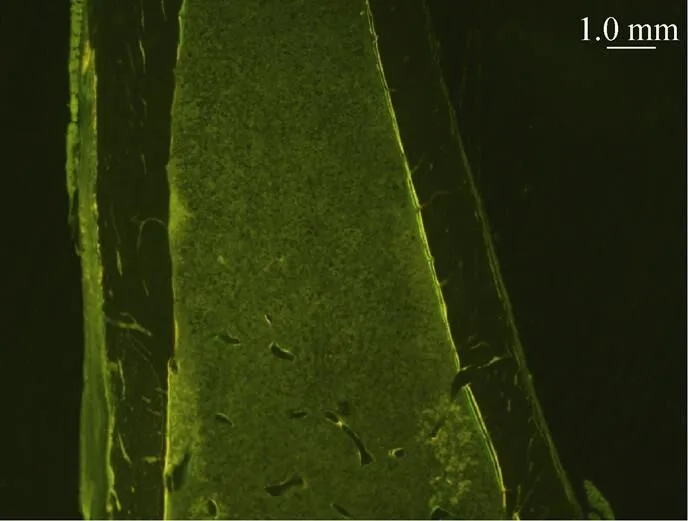
树脂包埋的胫骨切片中,量取胫骨同一部位的30处荧光间距值,数据统计后得出:15 Hz组大鼠胫骨的双荧光间距值显著高于对照组大鼠的荧光间距值 (0.05);45 Hz组大鼠胫骨的双荧光间距值极高于对照组荧光间距 (0.01);30 Hz组大鼠胫骨双荧光间距与对照组无统计学差异 (>0.05)。不同组别大鼠胫骨的双荧光间距值,见表5。
不同组别大鼠的胫骨双荧光标记情况见图3。
表2 不同频率电磁场干预后大鼠全身BMD变化情况(±s,g/cm2)
Table 2 Changes of rats’ BMD after the intervention with different frequency electromagnetic fields (±s, g/cm2)

表2 不同频率电磁场干预后大鼠全身BMD变化情况(±s,g/cm2)
GroupsNumber4 week8 week Control group80.119 7±0.005 6250.127 2±0.007 260 15 Hz group80.122 3±0.005 0840.134 2±0.007 503* 30 Hz group80.121 4±0.006 4470.131 7±0.006 334 45 Hz group80.123 3±0.006 5210.134 6±0.008 095*
Compared with the control group,*<0.05.
表3 不同频率电磁场干预后大鼠离体骨密度值(±s,g/cm2)
Table 3 Bone mineral density of rats after intervention with different frequency electromagnetic fields (±s, g/cm2)
表3 不同频率电磁场干预后大鼠离体骨密度值(±s,g/cm2)
GroupsNumberFemur (R)Lumbar vertebra (L1-L6) Control group80.131 44±0.007 2660.129 47±0.007 262 15 Hz group80.137 25±0.007 563*0.135 01±0.009 356 30 Hz group80.134 06±0.006 6270.129 45±0.008 637 45 Hz group80.139 42±0.008 099*0.135 16±0.006 913
Compared with the control group,*<0.05.
表4 大鼠血清中骨相关生化指标的检测结果(±s)
Table 4 Detection results of serum biochemical parameters in rats (±s)

表4 大鼠血清中骨相关生化指标的检测结果(±s)
GroupsNumberOC (ng/mL)OPG/RANKL (%)TRACP-5b (U/L) Control group817.471 0±3.022 710.241 8±1.036 50.382 1±0.038 1 15 Hz group818.443 9±2.178 7*15.687 2±1.436 4**0.377 6±0.028 4 30 Hz group818.067 2±3.462 413.343 1±0.957 1*0.378 3±0.023 3 45 Hz group818.961 3±2.560 8*16.272 4±1.608 1**0.380 2±0.034 2
OC: osteocalcin; OPG: osteoprotegerin; RANKL: receptor activator for nuclear factor-κB ligand; TRACP-5b: tartrate resistant acid phosphatase 5b. Compared with the control group, *<0.05,**<0.01.
表5 大鼠胫骨双荧光间距值(±s)
Table 5 The interval values of double fluorescence in rats tibia (±s)

表5 大鼠胫骨双荧光间距值(±s)
GroupsNumberInterval values of fluorescence (μm) Control group82.862 0±0.237 1 15 Hz group84.187 5±0.417 3* 30 Hz group83.493 7±0.440 8 45 Hz group84.929 1±0.521 6**
Compared with the control group,*<0.05,**<0.01.
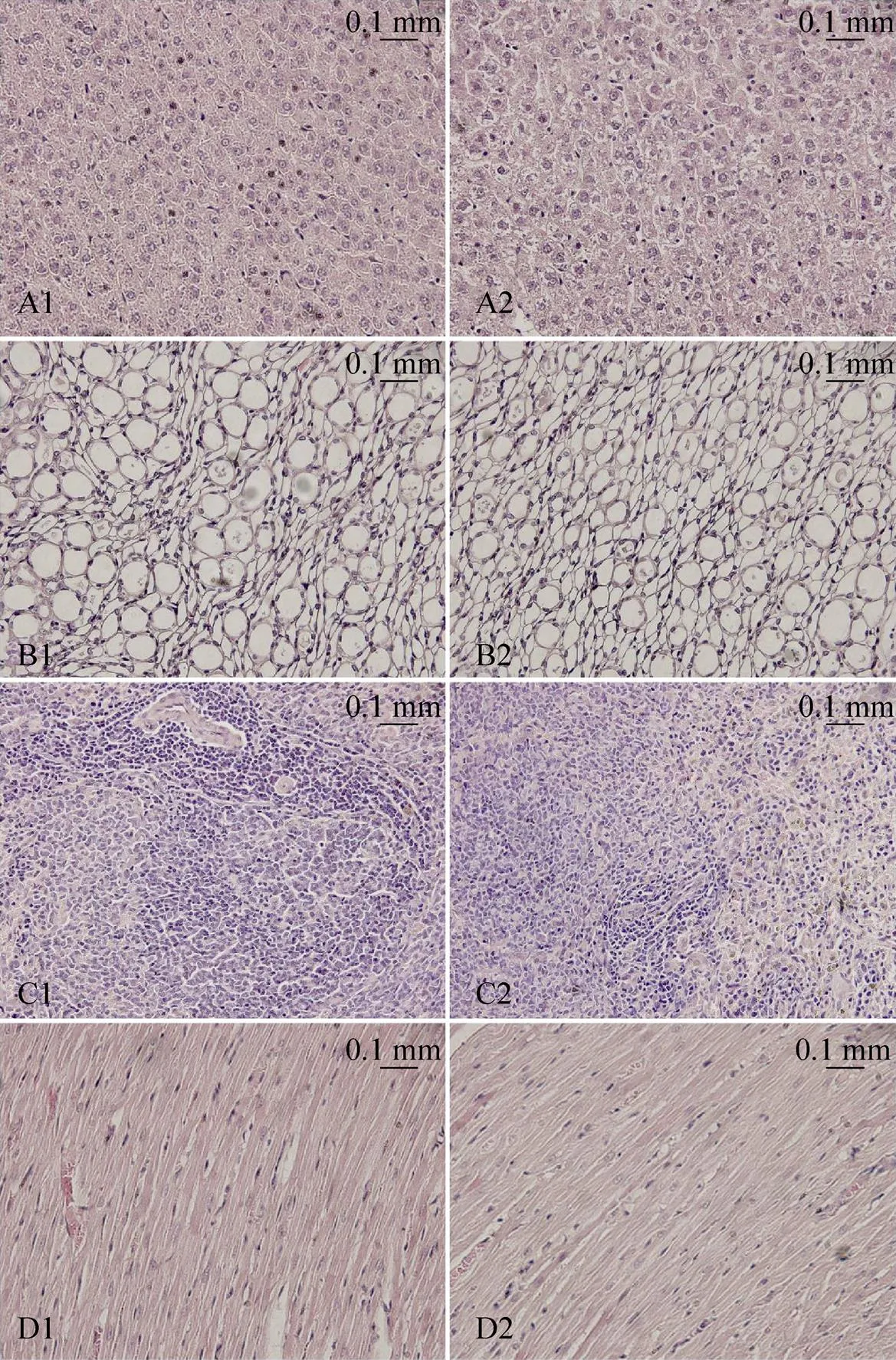
图2 对照组大鼠与45 Hz组大鼠的不同脏器病理图片
2.6 胫骨骨形态计量分析结果
大鼠胫骨的近骺端骨组织染色结果显示:15 Hz组、30 Hz组、45 Hz组的红色骨小梁数量明显多于对照组,而骨小梁的分离度则明显降低,见图4。软件量化的骨小梁数量、厚度、分离度、面积百分比值见表6,其中15 Hz组、40 Hz组大鼠胫骨的骨小梁数量、分离度、面积百分比相比于对照组,均有极显著的差异 (<0.01);30 Hz组的骨小梁数量、分离度、面积百分比与对照组相比,有显著性差异 (<0.05);实验组大鼠与对照组大鼠在骨小梁厚度上无显著差异 (>0.05)。

A
B
C
D
图3 不同组别大鼠胫骨的双荧光标记图(×40)
Fig. 3 Double fluorescent markers of tibia in different groups (×40). (A) Control group. (B) 15 Hz group. (C) 30 Hz group. (D) 45 Hz group. Yellow fluorescence is tetracycline hydrochloride, green fluorescence is calcein fluorescence, and the spacing is the growth in ten days of rat tibia.

A
B

C
D
图4 大鼠胫骨骨形态(×40)
Fig. 4 Bone morphology of tibia in rats (×40). (A) Control group. (B) 15 Hz group. (C) 30 Hz group. (D) 45 Hz group. In pictures, the red is the cortical bone and the trabecular bone, the brown yellow is the bone marrow cavity.
表6 大鼠胫骨近骺端组织计量学静态参数比较(±s,n=8)
Table 6 Comparison of static parameter histomorphometry in tibial metaphysic of rats (±s, n=8)

表6 大鼠胫骨近骺端组织计量学静态参数比较(±s,n=8)
GroupsTb.NTb.Th (mm)Tb.Sp (mm)TB/AR(%) Control group2.308 2±0.333 30.144 6±0.004 90.288 4±0.014 038.263 1±4.341 5 15 Hz group3.350 8±0.364 9**0.159 2±0.010 90.194 9±0.004 1**54.746 4±4.192 7** 30 Hz group3.114 3±0.238 2*0.150 3±0.011 60.226 8±0.013 2*47.520 6±4.308 1* 45 Hz group3.528 9±0.385 3**0.158 0±0.024 20.168 3±0.014 7**67.342 2±3.925 4**
Tb.N: number of trabecular bone; Tb.Th: thickness of trabecular bone; Tb.Sp: separation degree of trabecular bone; TB/AR: Area percentage of bone, Compared with the control group, *0.05, **0.01.
3 讨论与结论
电磁场在临床上对缓解骨质疏松引起的疼痛具有显著的效果,因其副作用小、成本低廉的特点,在物理治疗的方法中日益凸显。有报道表明,电磁场运用于去势大鼠的动物模型,可降低中年大鼠骨量的丢失[19],但通过提高青春期时生物个体的峰值骨量,以此来延缓生物体OP发生的实验尚未报道。此外,不同参数的电磁场干预去势大鼠后,大鼠骨量的变化情况也不尽相同[20]。本文以青年大鼠为对象,结合本课题组前期细胞实验与动物实验筛选的有效电磁场强度与磁场干预最佳时间[21],来比较不同频率SEMFs对青年大鼠骨密度及骨形态计量指标的影响。
骨密度是衡量骨质量的黄金指标,骨密度的提升直观地反映了骨强度的状况,因此许多与骨相关的药物研究和治疗方法都以骨密度的提升为评价标准[22-23]。本实验结果显示SEMFs干预青年大鼠两个月后,15 Hz组、45 Hz组的青年大鼠全身骨密度与离体骨密度都有显著性的增加,而不同组别大鼠的体重、器官系数、脏器病理切片均无明显差异,说明15 Hz、45 Hz可作为有效的电磁场频率来安全可靠地提高青年大鼠的峰值骨量。
OC作为骨形成的相关酶,其高低反映成骨状况的活跃与否,OPG/RANKL的比值可描述骨形成的快慢,是骨形成的一个重要指标;TRACP-5b是反映骨吸收情况的重要指标。血清中骨相关生化指标含量的高低可显示在成骨与吸收骨的动态过程中,骨量的增加是以骨生成的正向增加为主导,还是以骨吸收的负向降低为主导。本实验血清生化结果显示,15 Hz、45 Hz的1.8 mT正弦交变电磁场能够显著提升骨形成相关因子OC的表达,且OPG/RANKL的比值也有明显的增高,而骨吸收的相关因子在实验组和对照组之间却无明显差异。结果预示电磁场提升青年大鼠峰值骨量主要是以促进大鼠成骨活动相关因子的表达,进而使成骨与吸收骨的动态平衡倾向于成骨一侧。周建等研究发现,正弦电磁场能促进成骨细胞增殖分化以及骨形成相关基因的表达[24],表明动物实验结果与细胞实验结论存在一定相关性。
骨的双荧光标记可直接反映某一时段内骨量增加的情况,骨形态计量的指标能客观展现骨微结构与骨代谢的变化状况,因而它们在研究骨质疏松相关药物的作用机理中应用十分广泛[25]。本实验通过荧光间距的量化比较,从骨量累计的角度上表明,15 Hz、45 Hz的1.8 mT正弦交变电磁场可显著增加骨的生成。大鼠胫骨的VG染色结果既直观展示了骨微结构的差异,又以Tb.N、Tb.Th、Tb.Sp、Tb/AR%等指标来量化反映骨代谢的差异。结果显示,电磁场组在胫骨骨小梁数量、骨小梁分离度、骨小梁面积百分比上,都有不同程度的提升,其中15 Hz组、45 Hz组有极显著的提升,30 Hz组有显著提升。然而,实验组大鼠与对照组大鼠在胫骨的骨小梁厚度上却没有明显差异,这与Milena等发现的电磁场干预对天竺鼠胫骨骨小梁的影响结果近似[26], 预示SEMFs在增加青年大鼠骨量的过程中,主要是通过增加骨小梁的密度来实现的。在骨代谢过程中,成骨细胞与破骨细胞交替扮演重要的角色,本实验中,磁场组大鼠骨小梁数量与面积百分比的增加以及骨小梁厚度的无变化,预示 1.8 mT正弦交变电磁场可能在骨代谢的过程中主要促进成骨活动,少影响或无影响骨吸收的活动,这与周建等发现的1.8 mT正弦交变电磁场可明显促进成骨细胞成熟和矿化的结论相关联。此外,Hong等发现7.5 Hz的1.0 mT SEMF能促进破骨细胞生成、提升骨吸收的能力[27]。尽管不同参数的电磁场作用的主要对象也不同,但它们的总体效果都是骨的生成量大于骨的吸收量,骨量的有效增加也使得大鼠骨微结构得到进一步改善。
综上,15 Hz、45 Hz的1.8 mT正弦交变电磁场能够有效提升青年大鼠骨密度,改善大鼠的骨微结构,但电磁场频率不同,改善效果也不同。成骨生化指标的提升和骨代谢状况的变化不仅为电磁场作用机理的研究提供更为广阔的思路,也为电磁场预防和治疗骨质疏松提供更有价值的参考,引导我们进行更深一步的探究。
REFERENCES
[1] Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future. Lancet, 2011, 377(9773): 1276–1287.
[2] Henríquez MS, Gómez MJ de Tdjada Romero. Osteoporosis. Medicine, 2016, 12(16): 900–908.
[3] Raquel S, Sabina H, Xavier N, et al. Current and future treatments of secondary osteoporosis. Best Pract Res Clin Endocrinol Metab, 2014, 28(6): 885–894.
[4] Atsushi H, Sadayuki I, Yasumoto M, et al. Effect of alendronate on muscle mass: investigation in patients with osteoporosis. Osteoporosis and Sarcopenia, 2015, 1(1): 53–58.
[5] Sadaoki S, Satoshi T, Masanori S, et al. Treatment with the combination of ibandronate plus eldecalcitol has a synergistic effect on inhibition of bone resorption without suppressing bone formation in ovariectomized rats. Bone, 2015, 81: 449–458.
[6] María J, José L, Santos C, et al. Therapeutic holidays in osteoporosis: long-term strategy of treatment with bisphonates. Med Clín, 2016, 146(1): 24–29.
[7] Ahmet I, Umut C, Sema H, et al. Idiopathic juvenile osteoporosis: a case report and review of the literature. Inter J Surg Case Rep, 2015, 9: 127–129.
[8] Jing D, Shen G, Huang J, et al. Circadian rhythm affects the preventive role of pulsed electromagnetic fields on ovariectomy-induced osteoporosis in rats. Bone, 2010, 46(2): 487–495.
[9] Lorentzon M, Norjavaara E, Kindblom JM. Pubertal timing predicts leg length and childhood body mass index predicts sitting height in young adult men. J Pediatr, 2011, 158(3): 452–457.
[10] Bonjour JP, Chevalley T, Ferrari S, et al. The importance and relevance of peak bone mass in the prevalence of osteoporosis. Salud Pública Méx, 2009, 51(S1): 5–17.
[11] Jing D, Cai J, Wu Y, et al. Pulsed electromagnetic fields partially preserve bone mass, microarchitecture, and strength by promoting bone formation in hindlimb-suspended rats. J Bone Miner Res, 2014, 29(10): 2250–2261.
[12] Anna Daroszewska. Prevention and treatment of osteoporosis in women: an update. Obst Reproduc Med, 2015, 25(7):181–187.
[13] Xing L, Jiao YH, Geng LH, et al. Xianlinggubao for treatment of osteoporotic rats: serological and bone histomorphometric evaluation. J Clin Rehabil Tissue Eng Res, 2011, 15(15): 2786–2789 (in Chinese). 邢磊, 焦颖华, 耿丽华, 等. 仙灵骨葆治疗骨质疏松大鼠: 血清学及骨组织形态计量学评价. 中国组织工程研究与临床康复, 2011, 15(15): 2786–2789.
[14] Cao ZS, Chen YJ, Chen YX, et al. Electromagnetic irradiation may be a new approach to therapy for peri-implantitis. Med Hypotheses, 2012, 78(3): 370–372.
[15] Alan AS, Abimael FD, Antonio AN, et al. A new method for topology design of electromagnetic antennas in hyperthermia therapy. App Math Model, 2017, 42: 209–222.
[16] Zhou J, Ming LG, Ge BF, et al. Effects of 50 Hz sinusoidal electromagnetic fields of different intensities on proliferation, differentiation and mineralization potentials of rat osteoblasts. Bone, 2011, 49(4): 753–761.
[17] Gao YH, Cheng K, Ge BF, et al. Effect of different-intensity SEMFs on bone mineral density and histomorphometry in SD rats. China J Orthop Traumatol, 2014, 27(11): 933–937 (in Chinese). 高玉海, 成魁, 葛宝丰, 等. 不同强度正弦交变电磁场对大鼠骨密度及骨形态计量学的影响. 中国骨伤, 2014, 27(11): 933–937.
[18] Zhou YF, Ye S, Li SF, et al. Effect of 1.8 mT sinusoidal electromagnetic field with different frequency on peak bone mass of young rats. Med Pharm J Chin PLA, 2016, 28(10): 8–11 (in Chinese). 周延峰, 叶铄, 李少锋, 等. 1.8 mT不同频率正弦交变电磁场对青年大鼠峰值骨量的影响. 解放军医药杂志, 2016, 28(10): 8–11.
[19] Cheng GZ, Zhai YK, Chen KM, et al. Sinusoidal electromagnetic field stimulates rat osteoblast differentiation and maturation via activation of NO-cGMP-PKG pathway. Nitric Oxide, 2011, 25(3): 316–325.
[20] Zhou J, Wang JQ, Ge BF, et al. Different electromagnetic field waveforms have different effects on proliferation, differentiation and mineralization of osteoblasts. Bioelectromagnetics, 2014, 35(1): 30–38.
[21] Gao YH, Li SF, Zhou J, et al. Effect of sinusoidal electromagnetic field on bone mineral density and histomorphometry of rats at different time points. Acta Acad Med Sin, 2014, 36(6): 660–667 (in Chinese). 高玉海, 李少锋, 周建, 等. 不同时间正弦交变电磁场对大鼠骨密度及骨形态计量指标的影响. 中国医学科学院学报, 2014, 36(6): 660–667.
[22] Shen WW, Zhao JH. Pulsed electromagnetic fields stimulation affects BMD and local factor production of rats with disuse osteoporosis. Bioelectromagnetics, 2010, 31(2): 113–119.
[23] Cadossi R, Setti S. Low-frequency pulsed electromagnetic fields in orthopedic practice: bone and cartilage repair//Proceedings of 2011 the 30th URSI General Assembly and Scientific Symposium. Istanbul: IEEE, 2011: 1–4.
[24] Ferroni L, Tocco I, De Pieri A, et al. Pulsed magnetic therapy increases osteogenic differentiation of mesenchymal stem cells only if they are pre-committed. Life Sci, 2016, 152: 44–51.
[25] Liang M, Zhang J, Liang XH, et al. Effects of combining estrogen and progesterone on bone mineral density and histomorphometry in ovariectomized rats. J Clin Rehabil Tissue Eng Res, 2010, 14(24): 4380–4384 (in Chinese). 梁敏, 张劼, 梁杏欢, 等. 雌孕激素联合对去卵巢大鼠骨密度和骨形态计量学的影响. 中国组织工程研究与临床康复, 2010, 14(24): 4380–4384.
[26] Fini M, Torricelli P, Giavaresi G, et al. Effect of pulsed electromagnetic field stimulation on knee cartilage, subchondral and epyphiseal trabecular bone of aged Dunkin Hartley guinea pigs. Biomed Pharmacother, 2008, 62(10): 709–715.
[27] Hong JM, Kang KS, Yi HG, et al. Electromagnetically controllable osteoclast activity. Bone, 2014, 62: 99–107.
(本文责编 陈宏宇)
Effects of 1.8 mT sinusoidal electromagnetic fields of different frequencies on bone mineral density and bone histomorphometry of young rats
Yanfeng Zhou*, Xueyan Li*, Wenyuan Li, and Rong Qin
School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, Gansu, China
To study the effects of different frequency sinusoidal electromagnetic fields on the bone mineral density and bone histomorphometry of SD young rats, and to screen suitable electromagnetic field frequency. In total 32 female SD rats of 8 weeks old were randomly divided into 4 groups: control group, 15 Hz group, 30 Hz group and 45 Hz group. Except for the control group, rats in experimental groups were treated with corresponding frequency of 1.8 mT sinusoidal electromagnetic field 90 minutes every day. Rats were measured for bone mineral density after 8 weeks by dual energy X-ray absorptiometry. Rats’ femur and vertebral bones were measured by analyzing the static and dynamic forms on the right tibia bone for morphometrics. Rat serum was measured to estimate the index of bone formation and bone resorption. Bone mineral density of rats from 15 Hz group and 45 Hz group was higher than that of the control group (<0.05). Serum osteocalcin level of rats from 15 Hz group and 45 Hz group was higher than that of the control group (<0.05). Double fluorescence spacing and static parameters of bone tissue in experimental group rat tibia were higher than that of the control group (<0.05). Our findings imply that 15 Hz and 45 Hz sinusoidal electromagnetic fields can effectively increase bone mineral density in young rats for preventing osteoporosis.
bone mineral density, sinusoidal electromagnetic field, bone histomorphometry
January 12, 2017; Accepted: April 11, 2017
Xueyan Li. Tel: +86-931-8316037; E-mail: lxy@lut.cn
*These authors contributed equally to this study.
Supported by: National Natural Science Foundation of China (Nos. 81270963, 81471090).
国家自然科学基金 (Nos. 81270963, 81471090) 资助。
网络出版时间:2017-05-03
http://kns.cnki.net/kcms/detail/11.1998.Q.20170503.1449.001.html
