细菌性脑膜炎大鼠模型的尿液蛋白质组学变化
2017-08-01倪艳颖张繁霜安满霞高友鹤
倪艳颖,张繁霜,安满霞,高友鹤
细菌性脑膜炎大鼠模型的尿液蛋白质组学变化
倪艳颖1,张繁霜1,安满霞1,高友鹤2
1 中国医学科学院基础医学研究所北京协和医学院基础学院病理生理学系,北京 100005 2 北京师范大学生物化学与分子生物学系北京基因工程与生物技术重点实验室,北京 100875

倪艳颖, 张繁霜, 安满霞, 等. 细菌性脑膜炎大鼠模型的尿液蛋白质组学变化. 生物工程学报, 2017, 33(7): 1145–1157.Ni YY, Zhang FS, An MX, et al. Changes of urinary proteins in a bacterial meningitis rat model. Chin J Biotech, 2017, 33(7): 1145–1157.
与脑脊液和血液不同,尿液不受到稳态机制的调节,更倾向于积累和反应机体生理和病理状态下的变化。生物标志物的本质特征是变化,因此尿液是寻找疾病早期标志物的更好来源。在世界范围内,细菌性脑膜炎依然是引起新生儿和儿童疾病的主要原因。为了降低死亡率和致残率,需要用无创的方法寻找细菌性脑膜炎的相关线索。本研究中,使用大鼠脑室内注射大肠杆菌模型模拟细菌性脑膜炎,在第1天和第3天的大鼠尿液中寻找尿液蛋白谱的差异变化,为进一步寻找大肠杆菌性脑膜炎的早期生物标记物研究进行初步的探索。通过膜上酶切和胶内酶切将尿蛋白切成肽段并通过液相色谱串联质谱技术 (LC-MS/MS) 分析肽段信息。第1天的尿液通过胶内酶切方法鉴定到17个差异蛋白,通过膜上酶切鉴定到20个差异蛋白;第3天的尿液通过膜上酶切方法鉴定到5个差异蛋白。这些差异蛋白为寻找细菌性脑膜炎早期生物标志物的初步探索奠定了基础。
细菌性脑膜炎,早期诊断,液相色谱与串联质谱偶联技术,尿液蛋白质组学,动物模型
与生理及病理生理过程相关的变化是生物标志物最重要的特征。血液或脑脊液都受到稳态机制的调节,趋向于将代谢变化排出,保持相对稳态。尿液不受稳态机制的调节,可以容纳体内代谢变化。因此,尿液是寻找疾病标志物的良好场所[1]。
在世界范围内,细菌性脑膜炎依然是引起新生儿和儿童疾病的重要原因[2]。细菌性脑膜炎的死亡率非常高,在幸存者中的神经系统后遗症非常普遍[3-4]。在细菌性脑膜炎初期临床症状,例如头痛、颈强直、发热、恶心和抽搐,不具有特异性[5]。细菌性脑膜炎诊断的金标准是微生物培养,然而这种方法灵敏度低[6-7]。并且,这种方法对于没有明显脑膜炎症状的儿童而言,在早期很难被广泛应用。为了降低死亡率和致残率,使用无创和简单的方法寻找细菌性脑膜炎早期诊断相关线索是必不可少的。
尿液容纳各种变化,因此会受到很多生理及病理因素的影响,例如性别、饮食、药物和运动等[8]。运用临床样品去寻找早期生物标志物,需要大量样品去平衡种群和个体差异;而运用简单动物模型去模拟疾病,可以降低样品的复杂程度,还可以在疾病早期观察相关的病理生理变化,有利于寻找和疾病早期诊断相关的信息[9]。
大肠杆菌是引起儿童细菌性脑膜炎的一种常见革兰氏阴性杆菌[10]。在本研究中,用感染大肠杆菌的大鼠去模拟儿童细菌性脑膜炎。该细菌性脑膜炎模型病情进展相对缓慢,有利于在早期寻找疾病标志物。我们在疾病早期 (即手术后的第1天) 和大鼠临床症状明显时 (即手术后第3天),收取尿液进行分析 (图1)。
本研究的目的是通过蛋白质组学的方法在尿液中寻找蛋白质表达的差异,为后续在尿液中寻找细菌性脑膜炎的早期特异性生物标志物进行初步探索。不但有利于进一步研究细菌性脑膜炎的病理生理机制,而且可为寻找细菌性脑膜炎的尿液生物标志物研究奠定基础。

图1 细菌性脑膜炎大鼠模型尿液蛋白质鉴定的过程
1 材料与方法
1.1 细菌性脑膜炎模型的建立
SPF级的雄性Sprague-Dawley大鼠 (170−190 g) 由北京维通利华实验动物技术有限公司提供,动物许可证为SCXK (京) 2008-0001。动物实验遵循中国医学科学院基础医学研究所伦理委员会的审查和批准。所有动物在室内温度为 (22±1) ℃和湿度为65%−70%条件下使用标准实验动物饮食进行饲养。
Sprague-Dawley大鼠用2%苯巴比妥钠 (40 mg/kg) 进行腹腔注射麻醉。细菌性脑膜炎模型制作如下[11]:大鼠脑池内注射20 µL(DH5α 1×107CFU/mL),对照组注射同等体积的生理盐水。在造模后的第1天和第3天进行临床表现评分[12]:1) 昏迷;2) 不能直立;3) 30 s内不能直立;4) 自发活动减少,5 s内不能直立;5) 正常。不能自发行走并且昏迷的大鼠评分为1,有神经系统表现缺陷的评分低于4。
1.2 细菌性脑膜炎大鼠病理检查及生化检查
用4%多聚甲醛灌注大鼠。将灌注好的鼠脑组织取出,并于甲醛中固定。将鼠脑组织做成石蜡切片并进行苏木精-伊红染色 (HE) 和Nissl’s染色 (N) 以显示组织病理损伤。
分别采集细菌性脑膜炎组和对照组大鼠的脑脊液和血液。白细胞计数在北京协和医学院医院检验科完成。
1.3 尿蛋白样品制备和LC-MS/MS分析
在注射大肠杆菌后使用大鼠代谢笼收集对照组大鼠和细菌性脑膜炎模型大鼠的尿液进行分析,并于–80 ℃冰箱保存。提取尿液样品蛋白的过程如下:取4 mL未进行任何处理的大鼠冻存尿液 (可根据尿蛋白浓度,更改尿液的体积),4 ℃、2 000 ×的条件下离心30 min,并取上清于4 ℃、12 000 ×的条件下再次离心30 min,目的是去除大的细胞碎片;使用3倍体积的预冷乙醇于–20 ℃过夜沉淀蛋白;裂解液 (8 mol/L尿素,2 mol/L硫脲,25 mmol/L二硫苏糖醇和50 mmol/L Tris) 重新溶解尿蛋白[13];Bradford方法测定蛋白浓度。
对照组和细菌性脑膜炎模型组大鼠各3只通过胶内酶切方法进行质谱分析。胶内酶切尿蛋白过程如下:1D-SDS-PAGE (Invitrogen,Carlsbad,CA) 分离尿蛋白;将差异表达的凝胶带切成小块,用25 mmol/L 碳酸氢铵/乙腈 (1∶1) 洗涤,直至带色褪色并消失;使用20 mmol/L二硫苏糖醇 (Dithiothreitol,DTT) 使尿蛋白变性,并使用55 mmol/L碘乙酰胺 (IAA) 烷基化尿蛋白;将trypsin (Trypsin Gold,Promega,Fitchburg,WI,USA) 加入到干燥的凝胶小粒中,并孵育过夜,收集肽段。将提取的多肽通过zip tip (PipetteTips;Waters,Inc,Milford,Massachusetts,USA) 脱盐。
对照组和细菌性脑膜炎模型组大鼠各6只通过膜上酶切方法进行质谱分析。膜上酶切尿蛋白过程如下:将蛋白质装载到10 kDa滤膜 (Pall,Port Washington,NY,USA) 上;用UA(8 mol/L尿素加入0.1 mol/L Tris-HCl,pH 8.5) 和50 mmol/L NH4HCO3依次洗涤尿蛋白;向滤膜体系内再依次加入5 mmol/L DTT和50 mmol/L IAA;加入胰蛋白酶 (1∶50) 孵育过夜,收集肽段;酶切的肽段肽通过HLB柱 (Waters,Milford,MA) 脱盐,然后通过真空泵 (Thermo Fisher Scientific,Bremen,Germany) 抽干。
酶切后的肽段用0.1% 甲酸酸化,然后使用Thermal EASY-nLC1200色谱系统加载到反相微毛细管柱上。通过Thermo Orbitrap Fusion Lumos mass spectrometer (Thermo Fisher Scientific,Bremen,Germany) 进行质谱分析获取数据。
1.4 蛋白质鉴定和非标记定量
所有的质谱数据均使用PD软件进行处理 (Version 2.4.1,Matrix Science,London,UK),并于Swiss-prot数据库中搜索匹配。其搜索参数设置如下:多肽母离子和子离子的质量偏差为0.05 Da;固定修饰为半胱氨酸的脲基甲基化,可变修饰为蛋白质N-末端乙酰化和甲硫氨酸氧化;允许两个缺失的胰蛋白酶裂解位点。
通过Scaffold软件(Version 4.4.6,Proteome Software Inc.,Portland,Oregon,USA) 进行定性分析。设置条件如下:可信分数≥95.0%;包含两个以上特异肽段[14]。谱图数用于筛选差异蛋白[15]。
1.5 Gene ontology分析
在大鼠尿液样品中鉴定的所有蛋白质通过PANTHER数据库 (http://www.pantherdb.org/) 进行分析。蛋白质分类是基于分子功能、参与的生物过程和细胞定位3个方面。
1.6 统计学分析
2 结果与分析
2.1 细菌性脑膜炎大鼠脑的组织病理学变化
与对照组相比,细菌性脑膜炎大鼠的脑组织HE染色可见明显炎症浸润 (图2)。在蛛网膜下腔可见毛细血管扩张充血和大量炎症细胞。尼氏染色可见,神经细胞肿胀变形,大量尼氏小体溶解消失。对照组蛛网膜下腔未见炎症,海马神经元也未见损伤。说明已成功地建立了细菌性脑膜炎模型。

图2 细菌性脑膜炎大鼠脑组织的组织病理改变
2.2 细菌性脑膜炎大鼠的行为表现、体重变化及白细胞检查
细菌性脑膜炎大鼠感染大肠杆菌后第3天出现神经系统症状,例如呼吸急促,活动减少,并显示较低的症状评分。注射细菌后的第4天,细菌性脑膜炎组的大鼠出现死亡。而对照组的大鼠未见神经系统症状,症状评分较高 (图3A,=6,<0.001)。细菌性脑膜炎大鼠体重在第3天出现明显下降,而对照组大鼠体重呈稳步上升趋势 (图3B,=6,<0.05)。这些指标的变化也与细菌性脑膜炎一致。
造模后的第1天和第3天,测量脑脊液和血液中的白细胞数量 (图4A,B,=6)。与对照组相比,实验组大鼠的脑脊液白细胞和血液白细胞数量都上升,然而并未达到统计学上的意义。这说明,造模后第1天和第3天的白细胞检查不能为早期诊断提供有价值的线索。
2.3 尿蛋白的SDS-PAGE分析
通过SDS-PAGE凝胶电泳技术分析造模后第1天和第3天的尿蛋白。造模后第1天,细菌性脑膜炎大鼠的尿蛋白出现如下变化:分子量位于170 kD和15 kDa的尿蛋白表达下降;位于55 kDa和35 kDa的尿蛋白表达上升 (图5)。造模后第3天的尿蛋白胶上没有显著的差异。根据SDS-PAGE结果,造模后第1天的尿蛋白通过传统膜上酶切和针对变化条带的胶上酶切两种酶切方法将蛋白切成肽段,进行质谱分析;造模后第3天的尿蛋白通过传统膜上酶切的方法进行酶切,进行质谱分析。
2.4 尿液的蛋白肌酐比分析
细菌性脑膜炎大鼠感染大肠杆菌后第1、 3天的尿蛋白肌酐比分析。与对照组大鼠相比,细菌性脑膜炎大鼠模型的尿蛋白肌酐比在注射大肠杆菌后的第1天发生下降,第3天出现上升。但尿蛋白肌酐比均未出现显著改变,可初步评估细菌性脑膜炎大鼠的肾功能与对照组大鼠的肾功能并无明显差异。细菌性脑膜炎大鼠尿液蛋白表达的差异,可能是同时发生的血浆蛋白成分改变而引起的,而不是由于感染应激等全身反应导致肾功能改变引起的。

图3 细菌性脑膜炎大鼠的症状评分和体重

图4 细菌性脑膜炎大鼠的脑脊液和血液中的白细胞计数
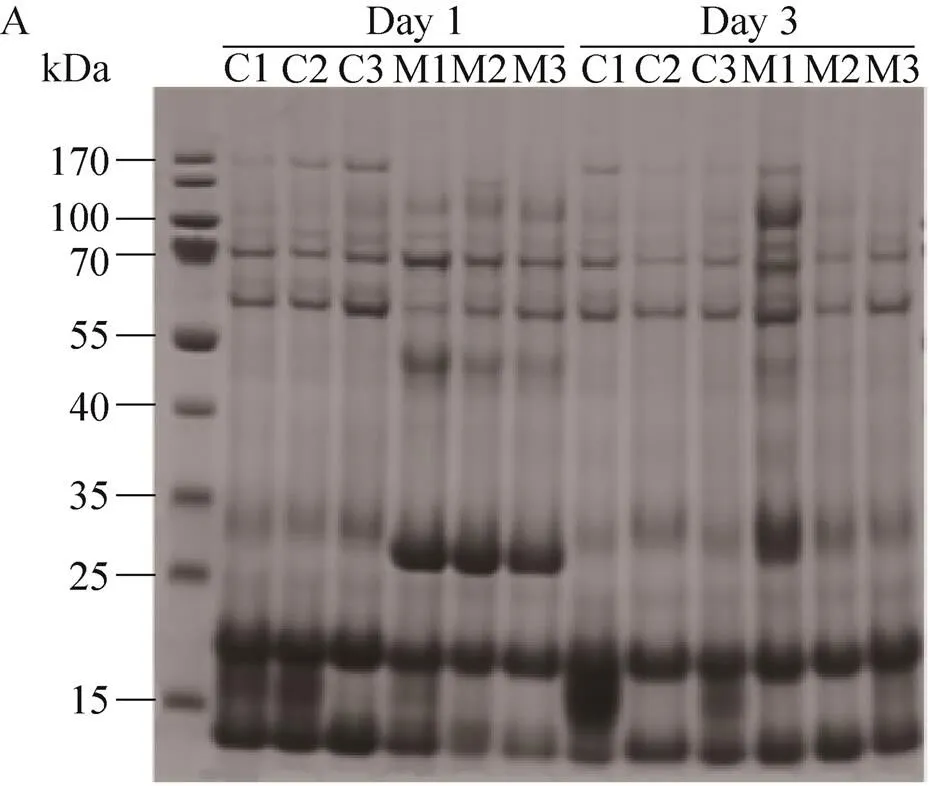
图5 尿液蛋白样品的SDS-PAGE分析
2.5 大肠杆菌性脑膜炎的尿蛋白质组学变化
通过LC-MS/MS鉴定和软件分析后,膜上酶切共鉴定到500个尿液蛋白。将质谱分析得到的尿液蛋白进行筛选。满足以下条件的尿蛋白可被筛选为差异蛋白:1) 含有两个特异性肽段;2) 变化倍数≥1.5或≤0.67,<0.05;3) 升高组中谱图数≥5。

图6 尿蛋白肌酐比分析
大肠杆菌性脑膜炎第1天的尿液通过胶内酶切方法鉴定到17个差异蛋白 (表1),其中11个蛋白表达上升,6个蛋白表达下降;通过膜上酶切方法鉴定到20个差异蛋白 (表2),其中11个蛋白表达上升,9个蛋白表达下降。其中α-1-酸性糖蛋白 (A1AG)、α-1-抗蛋白酶 (A1AT)、中性粒细胞明胶酶相关脂质运载蛋白 (NGAL)、T-激肽原1 (KNT1) 在两种方法中表达均上升,前表皮生长因子 (EGF) 表达均下降。大肠杆菌性脑膜炎第3天的尿液使用膜上酶切方法鉴定到5个差异蛋白 (表2),其中2个蛋白表达上升,3个蛋白表达下降。补体C4在大肠杆菌性脑膜炎大鼠第1天和第3天的尿液中均显著变化。将所有筛选到的差异蛋白在Ensembl homolog数据库中搜索,33个差异蛋白具有人的同源蛋白[16]。
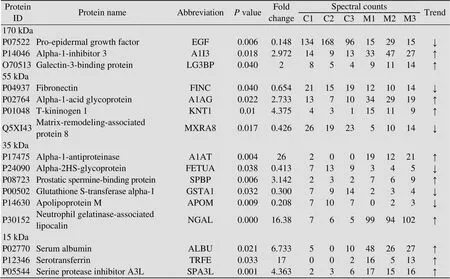
表1 胶内酶切方法鉴定到的差异蛋白
Note: C and M represent the control group and meningitis group, respectively with C1 and M1 representing No. 1 rat in each group.

表2 膜上酶切方法鉴定到的差异蛋白
Note: C represents the control group, and M represents the meningitis group, respectively with M1 and M3 representing day 1 and day 3.
2.6 Gene ontology 分析
大肠杆菌性脑膜炎大鼠的尿液差异蛋白通过PANTHER分类系统进行分析,并同时展示不同尿液差异蛋白在分子功能、不同生物学过程中的作用以及在细胞分区中的分布信息 (表3)。分析显示,同一尿液差异蛋白具有不同的分子功能,并可参与不同的生物学过程。例如,血浆铜蓝蛋白具有结合、催化、运输的活性,可参与定位、代谢、多细胞生物体等多种生物学过程。

表3 尿液差异在分子功能、不同生物学过程中的作用以及在细胞分区中的分布信息
3 讨论
我们用大肠杆菌脑池注射构造了细菌性脑膜炎的大鼠模型,该模型的主要病理生理过程是炎症以及免疫防御反应等一系列过程。我们的目的是想探究大肠杆菌性脑膜炎鼠的尿蛋白谱是否会发生变化,进而为寻找细菌性脑膜炎的生物标志物奠定基础。本研究尿液中鉴定到的一些差异蛋白,例如A1AG、补体C4和纤连蛋白,曾被其他研究报道过在细菌性脑膜炎患者的血液或脑脊液中显著变化。例如,A1AG和A1AT在调节免疫系统方面起作用,在细菌性脑膜炎患者的脑脊液和血液中表达上升,与本研究中尿液中变化趋势一致[17];血浆铜蓝蛋白可参与代谢反应以及机体对刺激的反应等生物学过程,其在细菌性脑膜炎患者的血液中表达上升[18];半乳凝素-3结合蛋白、β2-微球蛋白与中性粒细胞明胶酶相关脂质运载蛋白在细菌性脑膜炎患者的脑脊液中表达上升[19-21];丛生蛋白在细菌性脑膜炎患者的血液中表达下降[22],以上这些蛋白在其他文献中的变化与本文尿液中的变化一致。另外,还有一些差异蛋白在其他文献中的变化与本文尿液中的变化相反。例如,补体C4可参与机体对刺激的应激反应,其在细菌性脑膜炎患者脑脊液中表达下降[23],在本文尿液中表达上升;纤连蛋白在细菌性脑膜炎患者脑脊液中表达上升[24],在本文尿液中表达下降。这些差异蛋白居多是源自感染应激等全身反应,可以反映机体处于炎性、感染和免疫等应激状态。还有一些尿液中的差异蛋白,例如基质重塑相关蛋白8,在血脑屏障的成熟和维持中发挥作用,可能是源自脑部损伤的蛋白。本研究是针对细菌性脑膜炎诊断标志物的初步探索,特异性尿液差异蛋白还需要进一步的研究探索。
尿蛋白谱的改变可能来源于不同的途径。尿液内的差异蛋白有可能继发于脑脊液或血液内蛋白的改变,进而引起肾脏过滤的尿液蛋白发生改变;也可能是机体内产生的病理生理过程,例如感染、应激等,引起了肾脏功能的改变,进而导致尿液蛋白的改变。本研究中通过尿蛋白肌酐比初步分析,与对照组大鼠的肾功能相比,大肠杆菌细菌性脑膜炎大鼠模型的肾功能未发生明显的改变。本研究中的尿液差异蛋白可能来源于同时发生改变的脑脊液蛋白或者血浆蛋白。说明不仅泌尿系统疾病的尿蛋白谱会发生改变,大肠杆菌细菌性脑膜炎的尿蛋白谱也会发生改变,这为后续在尿液中寻找疾病生物标志物奠定了重要基础。并且尿液中差异蛋白的具体改变机制以及运输到尿液中所涉及到的各种通路都是我们今后的研究重点。
本研究中有一些差异蛋白已被其他研究报道过,例如EGE在Fanconi综合征者尿液中表达下降[25],A1AT在糖尿病患者尿液中表达上升[26];A1AG是急性阑尾炎[27]以及尿毒症[28]的尿液差异表达。以上研究说明多种蛋白有可能参与相同的病理生理过程,同一种蛋白也可能与很多疾病密切相关[29]。实验中寻找到的差异蛋白可以参与很多病理生理过程,包括机体的炎症反应,以及应激状态反应等。一组参与不同生理和病理生理过程的差异蛋白的组合更有可能反映机体的变化信息。
针对造模后第1天尿蛋白两种不同酶切方法,鉴定到了相同的差异蛋白,也鉴定到了不同的差异蛋白。传统的自上而下的蛋白质组学策略,即膜上酶切方法可以提供更为详细的信息。然而,很难区分完整的蛋白质与降解的碎片。相反,基于一维SDS-PAGE的胶内酶切方法解决了这一问题。例如血清转铁蛋白 (76 kDa) 在15 kDa条带中被鉴定到,鉴定片段可能是血清转铁蛋白的降解片段。低分子量蛋白A1AG (24 kDa) 在55 kDa条带中被鉴定到,鉴定的可能是带有修饰的A1AG蛋白。因此,在传统膜上酶切之前,首先应该分析一维SDS-PAGE是否有差异。如果有差异,应该针对不同的实验目的选择更加适合的酶切方法进行酶切,进而质谱鉴定。
随着时间的延长,在细菌性脑膜炎大鼠尿液中鉴定到的差异蛋白越来越少。尿液是人体代谢的废物,可以容纳身体的各种代谢变化,因此尿液中蛋白的变化情况可以反映身体的变化。在细菌性脑膜炎疾病初期,是大鼠体内各种反应变化产生最为集中、最为强烈的时期。因此体内的各种变化可以在尿液中较明显地反映出来,进而会鉴定到较多的差异蛋白。随着病情的进展,大鼠机能的下降,体内的反应有可能会减少,例如大鼠的免疫系统同病原的斗争会减少,因此各种反应变化也会逐渐减少,可能是导致鉴定到的差异蛋白越少的原因。具体的原因还需要更加深入的研究才能确定。
本研究通过注射大肠杆菌的大鼠模型模拟细菌性脑膜炎,用液相色谱串联质谱技术分析大肠杆菌性脑膜炎大鼠的尿蛋白谱改变。该研究在设计之初,并不知道能否见到任何的尿蛋白变化。实验中在大鼠大肠杆菌性脑膜炎尿液中寻找到一些差异表达的蛋白,说明大鼠在注射大肠杆菌后尿蛋白谱确实发生了改变,为后续寻找细菌性脑膜炎尿液标志物奠定了重要的基础。相信随着质谱鉴定水平的不断提高,在今后的研究中会有更多的低峰度尿液蛋白被挖掘,加之更加完善的实验设计,例如大肠杆菌性脑膜炎大鼠模型、其他类型大肠杆菌感染大鼠模型以及对照组3组平行实验的对比分析,可以为寻找细菌性脑膜炎标志物提供更多的线索。当然,如果针对尿液中所寻找到的差异蛋白在细菌性脑膜炎发病机制中所参与的具体通路及功能进行研究,能更加明确地将尿中蛋白的变化与细菌性脑膜炎的病理生理过程相联系。
REFERENCES
[1] Gao YH. Urine—an untapped goldmine for biomarker discovery? Sci China Life Sci, 2013, 56(12): 1145–1146.
[2] Wijetunge DSS, Karunathilake KHEM, Chaudhari A, et al. Complete nucleotide sequence of pRS218, a large virulence plasmid, that augments pathogenic potential of meningitis-associatedstrain RS218. BMC Microbiol, 2014, 14: 203.
[3] Kim KS. Acute bacterial meningitis in infants and children. Lancet Infect Dis, 2010, 10(1): 32–42.
[4] García-Hernández P, Prieto B, Martinez-Morillo E, et al. Interleukin-6 in cerebrospinal fluid as a biomarker of acute meningitis. Ann Clin Biochem, 2016, 53(1): 155–163.
[5] Baraff LJ, Lee SI, Schriger DL. Outcomes of bacterial meningitis in children: a meta-analysis. Pediatr Infect Dis J, 1993, 12(5): 389–394.
[6] Wu HM, Cordeiro SM, Harcourt BH, et al. Accuracy of real-time PCR, Gram stain and culture for,andmeningitis diagnosis. BMC Infect Dis, 2013, 13: 26.
[7] Taskın E, Turgut M, Kılıc M, et al. Serum procalcitonin and cerebrospinal fluid cytokines level in children with meningitis. Mediators Inflamm, 2004, 13(4): 269–273.
[8] Wu JQ, Gao YH. Physiological conditions can be reflected in human urine proteome and metabolome. Expert Rev Proteomics, 2015, 12(6): 623–636.
[9] Zhao MD, Li ML, Li XD, et al. Dynamic changes of urinary proteins in a focal segmental glomerulosclerosis rat model. Proteome Sci, 2014, 12: 42.
[10] Liu L, Johnson HL, Cousens S, et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000. Lancet, 2012, 379(9832): 2151–2161.
[11] Leib SL, Leppert D, Clements J, et al. Matrix metalloproteinases contribute to brain damage in experimental pneumococcal meningitis. Infect Immun, 2000, 68(2): 615–620.
[12] Leib SL, Clements JM, Lindberg RLP, et al. Inhibition of matrix metalloproteinases and tumour necrosis factorα converting enzyme as adjuvant therapy in pneumococcal meningitis. Brain, 2001, 124(9): 1734–1742.
[13] Sun W, Li FX, Wu SZ, et al. Human urine proteome analysis by three separation approaches. Proteomics, 2005, 5(18): 4994–5001.
[14] Nesvizhskii AI, Keller A, Kolker E, et al. A statistical model for identifying proteins by tandem mass spectrometry. Anal Chem, 2003, 75(17): 4646–4658.
[15] Schmidt C, Grønborg M, Deckert J, et al. Mass spectrometry-based relative quantification of proteins in precatalytic and catalytically active spliceosomes by metabolic labeling (SILAC), chemical labeling (iTRAQ), and label-free spectral count. RNA, 2014, 20(3): 406–420.
[16] Jia LL, Li XD, Shao C, et al. Using an isolated rat kidney model to identify kidney origin proteins in urine. PLoS ONE, 2013, 8(6): e66911.
[17] Paradowski M, Łobos M, Kuydowicz J, et al. Acute phase proteins in serum and cerebrospinal fluid in the course of bacterial meningitis. Clin Biochem, 1995, 28(4): 459–466.
[18] Çaksen H, Dede S, Cemek M, et al. Brief clinical report:evaluation of antioxidant status in children with acute bacterial meningitis and encephalitis. Int J Neurosci, 2003, 113(11): 1497–1504.
[19] Nasioudis D, Witkin SS. Neutrophil gelatinase-associated lipocalin and innate immune responses to bacterial infections. Med Microbiol Immunol, 2015, 204(4): 471–479.
[20] Bellac CL, Coimbra RS, Simon F, et al. Gene and protein expression of galectin-3 and galectin-9 in experimental pneumococcal meningitis. Neurobiol Dis, 2007, 28(2): 175–183.
[21] Hansen PB, Kjeldsen L, Dalhoff K, et al. Cerebrospinal fluid beta-2-microglobulin in adult patients with acute leukemia or lymphoma: a useful marker in early diagnosis and monitoring of CNS-involvement. Acta Neurol Scand, 1992, 85(3): 224–227.
[22] Høgåsen K, Mollnes TE, Brandtzaeg P. Low levels of vitronectin and clusterin in acute meningococcal disease are closely associated with formation of the terminal-complement complex and the vitronectin-thrombin-antithrombin complex. Infect Immun, 1994, 62(11): 4874–4880.
[23] Oren R, Laufer J, Goldberg I, et al. C3, C4, factor B and HLA-DR alpha mRNA expression in renal biopsy specimens from patients with IgA nephropathy. Immunology, 1995, 86(4): 575–583.
[24] Weller M, Sommer N, Stevens A, et al. Increased intrathecal synthesis of fibronectin in bacterial and carcinomatous meningitis. Acta Neurol Scand, 1990, 82(2): 138–142.
[25] Cutillas PR, Chalkley RJ, Hansen KC, et al. The urinary proteome in Fanconi syndrome implies specificity in the reabsorption of proteins by renal proximal tubule cells. Am J Physiol Renal Physiol, 2004, 287(3): F353–F364.
[26] Sharma K, Lee S, Han S, et al. Two-dimensional fluorescence difference gel electrophoresis analysis of the urine proteome in human diabetic nephropathy. Proteomics, 2005, 5(10): 2648–2655.
[27] Watson L, Midgley A, Pilkington C, et al. Urinary monocyte chemoattractant protein 1 and alpha 1 acid glycoprotein as biomarkers of renal disease activity in juvenile-onset systemic lupus erythematosus. Lupus, 2012, 21(5): 496–501.
[28] Vasson MP, Baguet JC, Arveiller MR, et al. Serum and urinary alpha-1 acid glycoprotein in chronic renal failure. Nephron, 1993, 65(2): 299–303.
[29] Zhao MD, Li ML, Li XD, et al. Dynamic changes of urinary proteins in a focal segmental glomerulosclerosis rat model. Proteome Sci, 2014, 12: 42.
(本文责编 陈宏宇)
Changes of urinary proteins in a bacterial meningitis rat model
Yanying Ni1, Fanshuang Zhang1, Manxia An1, and Youhe Gao2
1,,,,,100005,Gene Engineering and Biotechnology Beijing Key LaboratoryDepartment of Biochemistry and Molecular BiologyBeijing Normal UniversityBeijingChina
Unlike cerebrospinal fluid or blood, urine accumulates metabolic changes of the body and has the potential to be a promising source of early biomarkers discovery. Bacterial meningitis is a major cause of illness among neonates and children worldwide. In this study, we used-injected rat model to mimic meningitis and collected urine samples on day 1 and day 3. We used two different methods to digest proteins and analyzed peptides by liquid chromatography coupled with tandem mass spectrometry (LC-MS/MS). We identified 17 and 20 differential proteins by two methods respectively on day 1, and 5 differential proteins by filter-aided digestion method on day 3. Finding these differential proteins laid a foundation to further explore biomarkers of bacterial meningitis.
bacterial meningitis, early diagnose, LC-MS/MS, urine proteome, animal model
January 18, 2017; Accepted:April 11, 2017
Youhe Gao. Tel/Fax: +86-10-58804382; E-mail: gaoyouhe@bnu.edu.cn
Supported by:National Key Research and Development Program of China (No. 2016YFC1306300), National Basic Research Program of China (973 Program) (No. 2013CB530805), Beijing Natural Science Foundation (Nos. 7173264, 7172076), Fundamental Research Funds for the Central Universities (No. 2015KJJCB21), Beijing Cooperative Construction Project (No. 11065113), Beijing Normal University (No. 11100704).
国家重点研发计划课题 (No. 2016YFC1306300),国家重点基础研究发展计划(973计划) (No. 2013CB530805),北京自然科学基金 (Nos. 7173264, 7172076),中央高校基本科研业务费专项资金 (No. 2015KJJCB21),北京合作建设项目 (No. 11065113),北京师范大学 (No. 11100704) 资助。
网络出版时间:2017-04-18
http://kns.cnki.net/kcms/detail/11.1998.Q.20170418.1113.003.html
