藜麦醇提物提取工艺的正交优化及其抑菌性研究
2017-07-18徐澜,曹维
徐 澜,曹 维
(忻州师范学院 生物系,山西 忻州 034000)
藜麦醇提物提取工艺的正交优化及其抑菌性研究
徐 澜,曹 维
(忻州师范学院 生物系,山西 忻州 034000)
采用微波辅助法对藜麦醇提物的提取工艺进行正交优化,并探讨了藜麦醇提物的抑菌性。结果表明:在乙醇体积分数为100%,料液比为1∶50,微波功率为200 W,微波时间为80 s的条件下,藜麦醇提物的提取率达10.984 mg/g(平均提取率为10.993 mg/g),优化工艺稳定、可靠。抑菌性试验表明藜麦醇提物对金黄色葡萄球菌有明显抑制作用,且抑菌性随藜麦醇提物浓度增大而增强。
藜麦;醇提物;微波辅助;抑菌性
0 前言
藜麦Chenopodium quinoa Willd属藜科(藜科可食用的植物比较少见),双子叶植物,原产于南美洲安第斯山区,是印加土著居民的传统食物,有7 000多年的种植历史,联合国粮农组织认为藜麦是唯一可满足人体基本营养需求的单一植物,正式推荐藜麦为最适宜人类的完美全营养食品[1]。藜麦是一种高蛋白、低热量、活性物质丰富的食物,适合不同人群食用[2]。同时,藜麦含有在大多数水果和蔬菜中含量甚微的异黄酮,可作为人类和其他哺乳动物的外源性化合物,适合所有人群。黄酮类化合物具有多种生物活性,可用于抗菌、消炎、抗突变、降压等,在抗氧化、抗癌、防癌等方面也有显著效果[3]。前人多用醇水混合物提取不同材料中的黄酮类化合物,在刺芹[4]、牡荆[5]、甘薯[6]、银杏[7]、金银花[8]、橙皮[9]、大蒜[10]等中进行了黄酮的提取与含量测定,结果表明,各种物质中黄酮含量及提取率均不同,大蒜中黄酮提取率最低,为1.122 mg/g,甘薯中黄酮提取率最高,为87.15 mg/g。然而,有关藜麦黄酮类化合物的研究国内外报道甚少[11],为开发利用日益受到国际社会重视的藜麦资源,本试验对藜麦醇提物及其抑菌性进行了初步探讨,以期为藜麦黄酮类物质及醇提物等有效成分的开发利用提供参考。
1 材料与方法
1.1 试验材料与设备
藜麦(产地:山西静乐)种子:山西省忻州市粮油站购买。金黄色葡萄球菌:山西省忻州师范学院生物系实验室提供。WFZ UV-2102C紫外可见分光光度计:尤尼柯(上海)仪器有限公司;XH-MC-1实验室微波合成仪:上海祥鹄科技有限公司;G6R迅数菌落计数仪:杭州迅数科技有限公司;SW-CJ-1F净化工作台:上海博讯实业有限公司医疗设备厂;立式压力蒸汽灭菌锅:上海云泰仪器仪表有限公司。
1.2 试验方法
1.2.1 标准曲线的制作
本试验参照黄酮标准曲线的制作:精确称取芦丁标准试剂5 mg,用体积分数为60%的乙醇完全溶解后,再用此乙醇定容至50.0 mL,摇匀得到质量浓度为0.1 g/L芦丁标准液。分别吸取0.0、1.0、2.0、3.0、4.0、5.0 mL 于 6只 10 mL 比色管中,然后用60%的乙醇定容至5.0 mL,再分别从中吸取2.0 mL于6只10 mL比色管中,加入5%的亚硝酸钠溶液 0.6 mL,摇匀,静置 6 min后,加入 10%的硝酸铝溶液0.6 mL,摇匀,静置6 min后,再加入4%的氢氧化钠溶液4.0 mL,摇匀,静置10 min后于波长510 nm处测定吸光度,每次加入试剂后,都应充分振荡以利于反应完全。以芦丁质量浓度x(mg/mL)为横坐标、吸光度值y为纵坐标,所得数据经回归处理,得到标准曲线回归方程为y=4.217 1x-0.007 19,相关系数为R2=0.998 82。
1.2.2 藜麦醇提物提取率的计算
吸取样品液2.0 mL于比色管中,按照芦丁标准曲线制作方法测定吸光度,根据芦丁标准曲线回归方程计算质量浓度(C),然后计算每克藜麦醇提物的提取率,按下式计算:提取率=(C×V×稀释倍数)/原料质量,其中C为藜麦醇提物的质量浓度(mg/mL),V 为提取液体积(mL)。
1.2.3 藜麦醇提物提取方法
藜麦种子干燥至恒质量→粉碎过30目筛→加入提取剂后微波辅助提取→离心取上清液,并量取体积→测定醇提物含量。
1.2.4 单因素试验
1.2.4.1 乙醇体积分数对藜麦醇提物提取率的影响
称取干燥的藜麦粉末0.1 g,在料液比为1∶45,微波功率为200 W,微波时间为100 s的条件下,分别以体积分数为60%、70%、80%、90%、100%的乙醇微波辅助提取藜麦醇提物,提取液冷却后3 500 r/min离心10 min,用移液枪分别小心吸取上清液0.5 mL放入10 mL具塞试管中,并用相应体积分数的乙醇稀释至2 mL,加入5%亚硝酸钠溶液0.6 mL,混匀,静置6 min;再加入10%的硝酸铝溶液0.6 mL,混匀,静置6 min,再加入4%氢氧化钠溶液4 mL,摇匀,静置10 min,以 2 mL蒸馏水和所用的试剂混合做空白,在510 nm波长处测取吸光度。
1.2.4.2 料液比对藜麦醇提物提取率的影响
称取干燥的藜麦粉末0.1 g,在乙醇体积分数为100%,微波功率为200 W,微波时间为100 s的条件下,分别以料液比为 1∶35、1∶40、1∶45、1∶50、1∶55微波辅助提取藜麦醇提物,提取及测定方法同上。
1.2.4.3 微波功率对藜麦醇提物提取率的影响
称取干燥的藜麦粉末0.1 g,在乙醇体积分数为100%,料液比为1∶45,微波时间为100 s的条件下,分别以微波功率为 100、150、200、250、300 W微波辅助提取藜麦醇提物,提取及测定方法同上。
1.2.4.4 微波时间对藜麦醇提物提取率的影响
称取干燥的藜麦粉末0.1 g,在乙醇体积分数为100%,料液比为1∶45,微波功率为 200 W的条件下,分别以微波时间为 80、90、100、110、120 s微波辅助提取藜麦醇提物,提取及测定方法同上。
1.2.5 正交试验设计
根据单因素试验,为了进一步确定微波辅助提取藜麦醇提物的最佳工艺,以乙醇体积分数、料液比、微波功率、微波时间为考察因素,进行四因素三水平正交试验,因素与水平见表1。
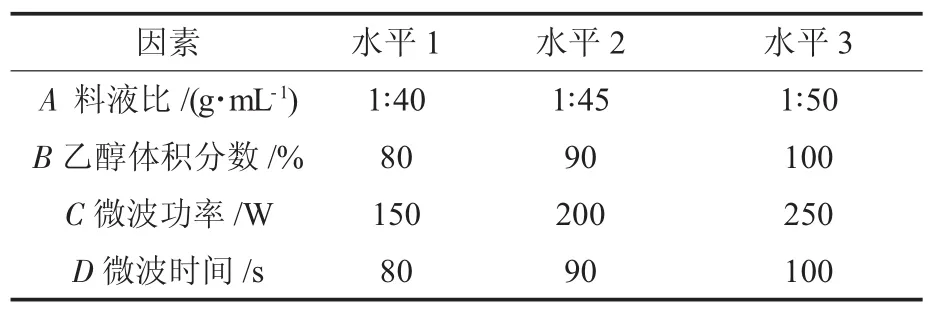
表1 因素与水平Table 1 Factors and levels of orthogonal experiments
1.2.6 藜麦醇提物抑菌性研究
1.2.6.1 培养基配制
牛肉膏蛋白胨培养基主要广泛用于细菌的培养,又称为普通培养基。其pH呈中性或微碱性,有利于细菌的生长。配方为:牛肉膏3 g、蛋白胨10 g、氯化钠 5 g、琼脂 15~20 g、水 1 000 mL、pH 7.4~7.6。事先按配方称好各个药品,在锅中加入1 000 mL自来水煮沸,再依次加入称好的药品,待除了琼脂以外的药品都融化后,一边加入琼脂一边搅拌,防止粘锅,然后将配制好的溶液定容到1 000 mL,最后用精密pH计测量培养基的pH值,若培养基偏酸,则逐滴加入1 mol/L NaOH,边加边搅拌,并随时测其pH值,直至达7.6。若培养基偏碱,则用1 mol/L HCl调节,注意避免回调,以防影响培养基内各离子浓度。最后将配好的培养基分装到事先备好的干净锥形瓶中,每个锥形瓶中的量不要超过容积的一半,然后在瓶口塞上棉塞,在棉塞外面包上报纸,以阻止细菌进入。
1.2.6.2 灭菌
将上述分装好的培养基、500 mL蒸馏水、6支编号的10 mL具塞试管、10个培养皿、1个涂布器,用121.3℃高压蒸汽灭菌20 min。
1.2.6.3 制作菌悬液
在超净台上,在6支试管中各倒入10 mL无菌水,然后将培养后的金黄色葡萄球菌的平皿取出观察挑选单菌落,用接种针挑取适量菌体放入编号为1的无菌水中,制成菌悬液,然后用移液枪吸取200 μL菌悬液放入2号试管摇匀,再从2号吸取200 μL放入3号,依次进行直至6号管,得充分稀释的菌悬液。
1.2.6.4 涂布
取出8个培养皿,设两次重复,分别标号0、1、2、3,待倒入的培养基凝固后,在标号为1的培养皿中加入100 μL提取液(按最佳提取工艺制作),2号加入 200 μL,3 号加入 300 μL,然后用涂布器涂布均匀。
用移液枪分别吸取100 μL 6号试管中的菌悬液加入上述8个培养皿中,并用涂布器涂布均匀,最后将涂布完成的培养皿放入恒温培养箱中37℃恒温培养12 h。
1.2.6.5 计数菌落
用菌落计数仪计数菌落数,并对数据进行统计分析。
1.2.7 数据处理方法
采用Excel 2003作图,DPS 7.05数据处理系统进行统计分析。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对提取率的影响(图1)
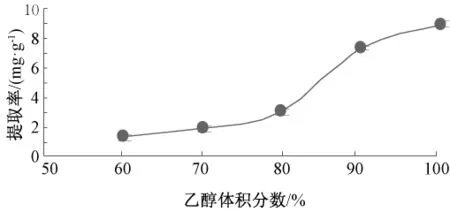
图1 乙醇体积分数对提取率的影响Fig.1 Effect of ethanol volume fraction on the extraction rate
由图1可知,随着乙醇体积分数的增大,藜麦醇提物提取率逐渐升高,在乙醇体积分数为90%时黄酮提取率增速最大,之后缓慢增长,在体积分数为100%时提取率达到最大值。因此,最佳乙醇体积分数为100%,此时的提取率为8.380 mg/g。
2.1.2 料液比对提取率的影响(图2)

图2 料液比对提取率的影响Fig.2 Effect of material-to-liquid ratio on the extraction rate
由图2可知,藜麦醇提物提取率随料液比增加呈先上升后下降的趋势。在料液比为1∶45时提取率达到最大值,之后随着料液比的增大提取率反而下降。提取剂量过少时,浓度差太小,藜麦醇提物成分未能充分浸出;提取剂过多时,可能溶解出更多其他成分,影响了藜麦醇提物的溶出。因此,最佳料液比为1∶45,此时提取率为8.278 mg/g。
2.1.3 微波功率对提取率的影响(图3)
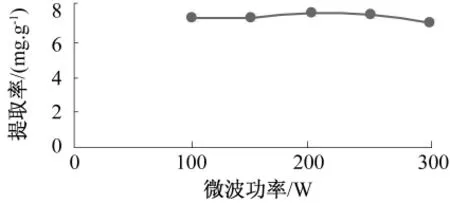
图3 微波功率对提取率的影响Fig.3 Effect of microwave power on the extraction rate
由图3可知,藜麦醇提物提取率随微波功率的增大略有提高,在微波功率200 W时达最大值,之后提取率呈下降趋势。当微波时间一定时,微波功率越大,系统升温越快,系统内分子运动越快,越有利于藜麦醇提物的浸出;而功率过大时,系统剧烈沸腾,提取剂迅速挥发,并且强热会破坏有效物质,故提取率下降。因此,最佳微波功率为200 W,此时提取率为8.425 mg/g。
2.1.4 微波时间对提取率的影响(图4)
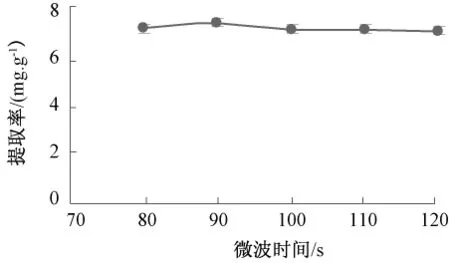
图4 微波时间对提取率的影响Fig.4 Effect of microwave time on the extraction rate
由图4可知,随着微波时间的延长提取率升高,当时间达到90 s时提取率最高,随后降低,达到100 s后趋于平缓。起始阶段随微波时间延长分子间碰撞加剧,利于藜麦醇提物浸出,而当时间延长到一定程度后,分子相对运动减小,黄酮浸出增量不明显,强热还会破坏已浸出的藜麦醇提物。因此最佳微波时间为90 s,此时提取率为8.260 mg/g。
2.2 正交设计试验结果
正交试验设计及结果见表2,方差分析见表3。
从表2和表3可以看出,4个因素对藜麦醇提物提取率影响极显著,大小顺序依次为B(乙醇体积分数)>A(料液比)>D(微波时间)>C(微波功率)。藜麦醇提物的最佳提取工艺为A3B3C2D1,即料液比1∶50、乙醇体积分数 100%、微波功率 200 W、微波时间80 s,提取率为10.984 mg/g。按最佳工艺提取藜麦醇提物,平均提取率为10.993 mg/g,优于正交试验及单因素试验的结果,因此可确认该工艺最优。
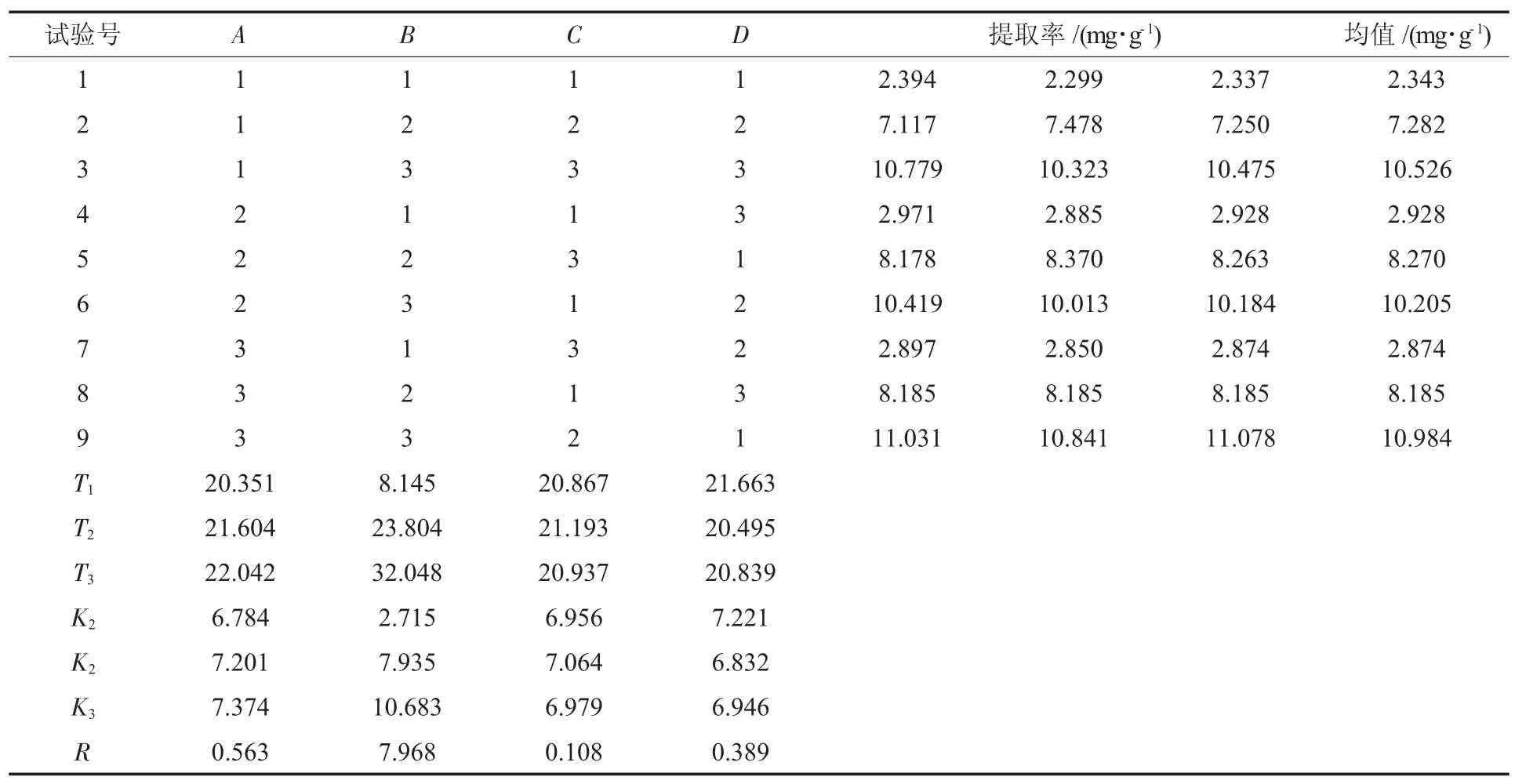
表2 正交试验设计及结果Table 2 Orthogonal experiment design and results

表3 正交试验方差分析Table 3 Variance analysis of orthogonal experiments
2.3 藜麦醇提物抑菌性测定结果
为研究藜麦醇提物的抑菌性,使用菌落计数仪测定,结果见图5—图8。
由图5至图8可知:藜麦醇提物对金黄色葡萄球菌有较强的抑菌性,且抑菌效果随提取液量的不同而不同。抑菌性整体随所加提取液量的增加而增强,金黄色葡萄球菌出现的范围和频率逐渐减少。
为进一步明确藜麦醇提物对金黄色葡萄球菌的抑菌性,对菌落计数仪获得的数据进行了统计分析(见表4、表5),结果表明藜麦醇提物对金黄色葡萄球菌的抑菌效果极显著,但试验组间的抑菌性差异随所加提取液量的增加而相对减小,对照组和试验组间抑菌性的差异总体随醇提液量的增加而越显著。

图5 未添加提取液的菌落数Fig.5 Colony count of suspension without extracts

图6 添加100 μL提取液的菌落数Fig.6 Colony count of suspension with 100 μL extract
图7 添加200 μL提取液的菌落数Fig.7 Colony count of suspension with 200 μL extract

图8 添加300 μL提取液的菌落数Fig.8 Colony count of suspension with 300 μL extract

表4 藜麦醇提物抑菌性测定结果Table 4 Antibacterial activity against Staphyloccocus aureus of the ethanol extracts

表5 藜麦醇提物抑菌性测定结果方差分析Table 5 Variance analysis of antibacterial activity against Staphyloccocus aureus of the ethanol extracts
3 讨论
藜麦是近乎完美的食物,有极大的食用和药用价值,本课题对藜麦醇提物的提取工艺进行了考察,结果表明藜麦醇提物的最佳提取工艺条件为乙醇体积分数100%,料液比1∶50,微波功率200 W,微波时间 80 s,提取率为10.984 mg/g。按此最佳提取工艺进行重复试验,得到藜麦醇提物平均提取率为10.993 mg/g。表明此提取工艺比较稳定、可靠,有较强可借鉴性。前人研究表明,超声波辅助提取藜麦总黄酮提取率可达3.737 mg/g[12],比较而言,本研究藜麦醇提物(主要成分为黄酮)的提取率更高,且提取时间更短,所需温度更低,自然降低了能耗,不仅环保而且降低了提取成本。原因是微波是电磁波,具有加热速度快(不需热传导过程,内外同时加热)、加热均匀、选择性加热的特点,能在对藜麦醇提物破坏力尽可能低的情况下,高效率辅助乙醇提取;而超声波是声波,能使液体微粒之间发生猛烈撞击,从而使液体温度骤然升高,加速化学反应,可能因为引起反应的过程比较缓慢和复杂,提取过程中一些黄酮类物质被破坏,所以造成提取时间长、提取率不高。本试验还对藜麦醇提物进行了抑菌性的测定,结果表明藜麦醇提物对金黄色葡萄球菌有显著的抑菌作用。不足之处是:本试验提取的为藜麦醇提物的粗提物,没有进一步分离纯化,未测定藜麦醇提物对供试菌的最低抑菌浓度(MIC)。需要进一步研究藜麦醇提物的具体有效成分及其抗氧化性,并探讨其抗氧化性最佳的环境条件,如温度、pH、光照(时间、强度、种类)等,为藜麦的开发利用提供参考。目前,作为一种营养价值极高的安全农产品,藜麦因含具有抗氧化性的黄酮类物质,其应用范围将越来越广泛,可以添加到护肤品、食品、保健品等中,既能保证效果,又绿色环保。
[1] 肖正春,张广伦.藜麦及其资源开发利用[J].中国野生植物资源,2014,33(2):62-66.
[2] 王黎明,马宁,李颂,等.藜麦的营养价值及其应用前景[J]. 食品工业科技,2014,35(1):381-384,389.
[3] 李凤霞,王青,张钟,等.薇菜黄酮类化合物的提取及抗氧化研究[J].包装与食品机械,2008(1):7-11.
[4] 李丽,李晓娇,黄金金,等.刺芹总黄酮的微波辅助提取及抑菌性研究[J].云南化工,2015(3):9-13.
[5] 黄琼,黎贵卿,陈海燕,等.微波法提取牡荆总黄酮的工艺及其抗氧化活性的研究[J].食品科技,2010(3):2544-2546.
[6] 陆国权,任韵,唐忠厚,等.甘薯黄酮类物质的提取及其基因型差异研究[J].浙江大学学报(农业与生命科学版),2005,31(5):541-544.
[7] 于文萃.微波法提取银杏叶中黄酮类化合物的工艺研究[J].吉林化工学院学报,2014(5):83-86.
[8] 贾霖,黄国清,肖军霞.金银花中黄酮类化合物的提取工艺[J].食品研究与开发,2013,34(9):41-43.
[9] 扶庆权,陈昌云,邵阳.响应面法优化橙皮总黄酮的微波辅助提取工艺研究[J].南京晓庄学院学报,2014(6):61-65.
[10]高淑云,徐婷婷.响应面法优选大蒜中黄酮提取工艺研究[J]. 中国调味品,2013,38(3):44-49.
[11]陆敏佳,蒋玉蓉,陈国林,等.藜麦叶片黄酮类物质的提取及基因型差异[J].浙江农林大学学报,2014(4):534-540.
[12]董晶,张焱,曹赵茹,等.藜麦总黄酮的超声波法提取及抗氧化活性[J].江苏农业科学,2015(4):267-269.
ORTHOGONAL OPTIMIZATION OF EXTRACTION PROCESS OF THE ETHANOL EXTRACTS OF CHENOPODIUM QUINOA WILLD AND ITS ANTIBACTERIAL ACTIVITY
XU Lan,CAO Wei
(Department of Biology, Xinzhou Teachers University, Xinzhou 034000, China)
In order to provide references for development and utilization of Chenopodium quinoa,we optimized the microwave-assisted extraction process of ethanol extracts of Chenopodium quinoa,and discussed the antibacterial activity of the extract.Results showed that the extraction rate of the ethanol extracts reached 10.984 mg·g-1(average extraction rate 10.993 mg·g-1)under the optimum conditions of ethanol volume fraction 100%,solid-to-liquid ratio 1 ∶50,microwave power 200 W,and microwave time 80 s.The process was stable and reliable.Antibacterial tests showed that the ethanol extracts of Chenopodium quinoa had significant effect in inhibiting Staphylococus aureus,and the antibacterial activity was enhanced with the concentration of the ethanol extract.
Chenopodium quinoa;ethanol extracts;microwave assisted;antibacterial activity
TS201.1
B
2016-11-25
公益性行业(农业)科研专项(201503124);山西省高等学校教学改革创新项目(J2016096);忻州师范学院博士科研启动项目(2016)
徐澜(1975—),女,山西偏关人,副教授,博士,主要从事植物生理生化教学与研究工作。
1673-2383(2017)03-0083-06
http://kns.cnki.net/kcms/detail/41.1378.N.20170621.1051.030.html
网络出版时间:2017-6-21 10:51:03
