4种方法提取花脸香蘑胞内多糖及其理化性质比较研究
2017-07-18王兰英徐盼菊杨海茹黄燕怡
王兰英,唐 萌,徐盼菊,杨海茹,黄燕怡,曾 俊
(吉林大学珠海学院,广东 珠海 519000)
4种方法提取花脸香蘑胞内多糖及其理化性质比较研究
王兰英,唐 萌,徐盼菊,杨海茹,黄燕怡,曾 俊
(吉林大学珠海学院,广东 珠海 519000)
以花脸香蘑为材料,采用热水浸提法、复合酶提法、碱液提取法、超声提取法提取花脸香蘑多糖,并对获得的粗多糖的多种理化性质进行测定分析,确定了花脸香蘑多糖的最佳提取方法。结果表明:不同的提取方法对多糖得率及成分均有重要影响,其中碱提多糖得率最高,为(21.10±0.13)%,超声提取多糖得率最低,为(8.15±0.17)%;4种方法提取的粗多糖溶液其红外图谱特征峰相似,但略有不同,结合在1 022~1 153 cm-1区域内的吸收峰,碱提多糖的糖环结构可能为呋喃型,其他3种粗多糖可能为吡喃型;热水浸提法、复合酶法、超声提取法提取的多糖溶液对DPPH均有较高的清除率,而碱提多糖溶液对DPPH自由基清除率较低,仅为6%~7%;4种方法提取的多糖溶液对羟基的清除率相差不大且均随糖浓度的上升而增大,达到最大值100%。结合提取效果及多糖的生物活性,复合酶法提取的粗多糖得率高、纯度高,具有极强的抗氧化活性,为最佳提取方法。
花脸香蘑;提取工艺;抗氧化;多糖;傅里叶红外光谱仪
0 前言
多糖是一种重要的生物活性化合物,广泛存在于自然界中。糖类分子不但担负着能源和结构支架的职能,而且还担负着携带细胞信息的职能[1]。对糖类的研究,从最初的糖的结构、化学合成、代谢途径等逐渐发展到糖蛋白、糖脂等糖复合物等方面。真菌多糖作为多糖类物质的重要来源,具有多种生理活性如抗肿瘤、免疫调节、抗突变、抗病毒、降血脂、降血糖、抗氧化、抗辐射和抗溃疡等功效[2]。自1988年起我国已成为食用菌生产第一大国,其产值仅次于粮、棉、油、果、菜,居第6位,成为我国重要的园艺产业及创汇产业[3]。随着人们生活水平的提高,食用菌在食品领域的价值获得极大提高,一系列多种多样的食用菌相关新型食品相继面市。
花脸香蘑营养丰富,具有多糖、二萜类等多种活性成分,据报道花脸香蘑多糖具有抗菌、保肝、抗肿瘤、抗氧化、调节植物生长、抑制水稻细条病的病原菌、提高免疫力等功效[4-12]。真菌多糖由于提取方法不同,其多糖的得率及理化性质会发生相应地变化,通过比较花脸香蘑4种不同提取方法的试验结果,根据获得的多糖的理化性质选取最佳提取方法。
1 材料与方法
1.1 菌株
菌株由吉林大学珠海学院微生物实验室保藏。
1.2 试剂与仪器
纤维素酶:江苏锐阳生物科技有限公司;果胶酶、木瓜蛋白酶:上海源叶生物有限公司;浓硫酸、乙醇、葡萄糖、邻苯三酚、水杨酸、盐酸等均为国产分析纯。
UV-2450紫外可见分光光度计、IRPrestige-21傅里叶红外光谱仪:日本岛津;TP-520H电子天平:湘仪天平仪器设备有限公司。
1.3 液体发酵
按蔗糖3%、磷酸二氢钾0.1%、硫酸镁0.1%、酵母粉1%的配方配制7 L培养基,于25℃、150 r/min发酵罐中培养7 d,收集菌丝体,洗净后冷冻干燥,过50目筛备用。
1.4 多糖提取方法
1.4.1 热水浸提法
称取1 g菌丝体粉末,按照料液比1∶60(g/mL)加水,90℃提取2 h,提取完毕后抽滤。收集清液,减压浓缩至1/10体积,用3倍体积95%乙醇进行醇沉,静置于4℃冰箱24 h,8 000 r/min离心15 min,收集沉淀用无水乙醇反复洗涤,于40℃烘箱烘干,记录其质量。
1.4.2 碱液提取法
配制0.5 mol/L NaOH溶液,称取1 g菌粉,按照料液比 1∶60(g/mL)加碱液,90 ℃提取 2 h,抽滤。收集清液,浓缩至1/10体积,用3倍体积95%乙醇进行醇沉,静置于4℃冰箱24 h,8 000 r/min离心15 min,收集沉淀用无水乙醇反复洗涤,于40℃烘箱烘干,记录其质量。
1.4.3 复合酶提取法
称取1 g菌粉,加入0.6%的复合酶(W纤维素酶∶W果胶酶∶W木瓜蛋白酶=6∶1∶8),按料液比 1∶60(g/mL)加水,用0.5 mol/L NaOH和HCl调pH至7,40℃、120 r/min恒温水浴酶解2 h后,沸水浴灭酶活性10 min,抽滤。收集清液,浓缩至1/10体积,用3倍体积95%乙醇进行醇沉,置于4℃冰箱24 h,8 000 r/min离心15 min,沉淀用无水乙醇洗涤,于40℃烘箱烘干,记录其质量。
1.4.4 超声辅助提取法
称取1 g菌粉,按料液比1∶60(g/mL)加水超声辅助提取120 min,功率300 W,频率40 kHz。抽滤,收集清液,浓缩至1/10体积,用3倍体积95%乙醇进行醇沉,静置于4℃冰箱24 h,8 000 r/min离心15 min,收集沉淀用无水乙醇反复洗涤,于40℃烘箱烘干,记录其质量。
1.5 花脸香蘑的多糖理化性质测定
采用蒽酮-硫酸法测定粗多糖中的多糖含量[13];用考马斯亮蓝-G250法测定粗多糖中的蛋白质含量[14]。将4种方法提取的粗多糖进行紫外图谱扫描,分别配制0.1 mg/mL的多糖溶液,在200~400 nm范围内进行紫外扫描,观察其在260、280 nm波长处有无吸收峰;取1 mg左右干燥多糖样品,加入适量KBr粉末研磨混匀后,压片,在4 000~400 cm-1范围内进行红外光谱扫描。
1.6 抗氧化活性测定
1.6.1 DPPH自由基清除率测定
[15]略加改动,配制多个浓度梯度样品溶液,在试管中依次加入1.5 mL样品液,1.5 mL 0.1 mmol DPPH的95%乙醇溶液,混匀后避光反应30 min,在 517 nm测吸光度值(A)。

式中:A0为对照组吸光度值,1.5 mL蒸馏水加1.5 mL DPPH溶液;Ai为样品组吸光度值,1.5 mL样品溶液加1.5 mL DPPH溶液;Aj为空白组吸光度值,1.5 mL样品溶液加上1.5 mL 95%乙醇。
1.6.2 羟基自由基清除率测定[16]
配制多个浓度梯度的样品溶液,加入9 mmol/L FeSO4溶液 1 mL、9 mmol/L水杨酸-乙醇溶液1 mL,最后加8.8 mmol/L H2O2溶液l mL启动反应,于37℃水浴反应0.5 h后,每组3个平行,在510 nm波长处测定吸光度(A)。

式中:A0为对照组吸光度值,1 mL蒸馏水加1 mL FeSO4、1 mL 水杨酸-乙醇溶液、1 mL H2O2溶液;Ai为样品组吸光度值,1 mL样品溶液加1 mL FeSO4、1 mL水杨酸-乙醇溶液、1 mL H2O2溶液;Aj为空白组吸光度值,1 mL样品溶液加上2 mL蒸馏水、1 mL 95%乙醇。
2 结果与分析
2.1 多糖得率、含量及蛋白质含量比较
如表1所示,4种提取方法中,碱液提取法的多糖得率最高,达到了(21.10±0.13)%,超声波辅助提取法的多糖得率最低,为(8.15±0.17)%,热水浸提法与复合酶法的多糖得率分别为(11.94±0.20)%和(19.61±0.60)%;热水浸提法及复合酶法提取的粗多糖中糖含量较高,分别达到了(91.03±1.20)%和(94.47±3.84)%,而超声辅助提取法获得的粗多糖中多糖含量最低,为(67.75±2.24)%;4种方法提取多糖蛋白质含量均较低。从上述分析可以看出,碱液提取法与复合酶提取法粗多糖得率要远高于其他两种方法,而复合酶法的多糖含量比碱液法高19.54个百分点,说明复合酶法获得的多糖产量大、纯度高,为4种方法中的最佳提取方法。碱液提取法的多糖得率是4种提取方法中最高的,同时蛋白质含量最低,但粗多糖中多糖纯度不高,且获得的粗多糖较黏稠,不易干燥。热水浸提法获得的多糖得率较低,但粗多糖的多糖含量较高,蛋白质含量为(3.12±0.30)%,说明热水浸提法获得的粗多糖产量少,但纯度较高,该方法需长时间在较高温度下进行,故能耗较高;超声辅助提取法的多糖得率最低,同时粗多糖中多糖含量也最低,蛋白质含量为(2.31±0.14)%,说明超声辅助提取法获得的多糖产量低、纯度低,提取效果不 甚理想。

表1 4种方法提取多糖得率、含量和蛋白含量比较Table 1 Comparison of polysaccharides yield and content and protein content with four extraction methods %
2.2 紫外分析
将热水浸提法(A)、碱液提取法(B)、复合酶法(C)、超声辅助法(D)提取的多糖水溶液在 200~400 nm范围内进行扫描,由图1可知A、C、D在200 nm均附近有糖的特征吸收,而A、B、C在260、280 nm附近有吸收,说明A、B、C中可能含有核酸以及蛋白质。
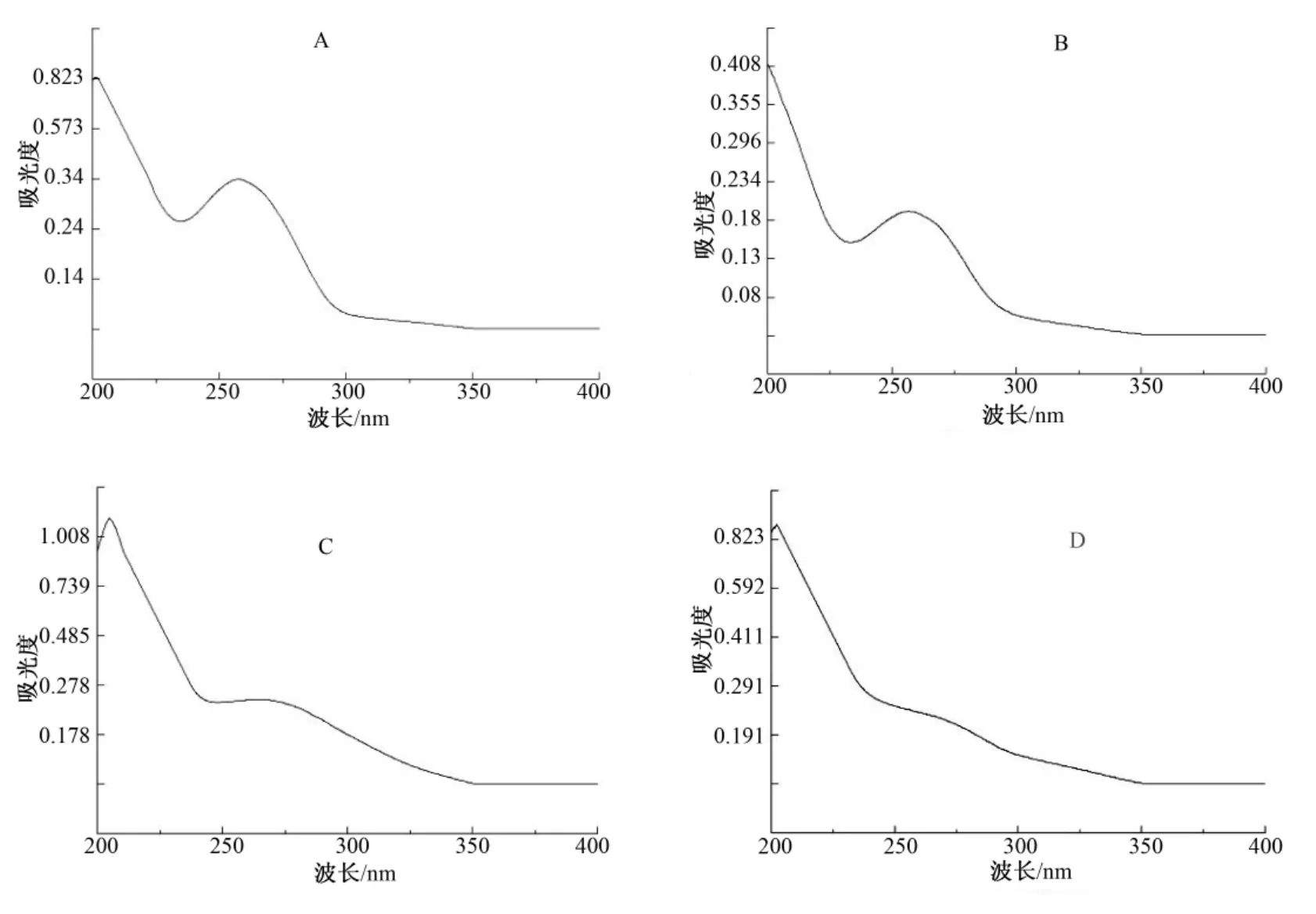
图1 4种方法提取的多糖的紫外光谱Fig.1 UV spectrum of polysaccharides extracted by four methods
2.3 红外图谱分析[17-18]
由图2可知,4种方法提取的多糖在3 400 cm-1处附近均有吸收峰,可能是由糖分子内或分子间的O—H伸缩振动引起的,2 900 cm-1处为饱和C—H伸缩振动的特征吸收峰,1 600 cm-1处为C=O伸缩振动吸收峰,1 400 cm-1处附近特征峰为C—H变角振动。A、C、D提取的多糖在1 022~1 153 cm-1区域内有吸收峰,表明此3种多糖中的糖环构型可能为吡喃型,而B提取的多糖的糖环结构可能为呋喃型。B、C、D 分别在 866 cm-1、925 cm-1、856 cm-1处有特征吸收,说明其糖苷键可能为β型糖苷键,而A在此区域无明显吸收峰,无法判断其糖苷键类型。
2.4 抗氧化活性比较
2.4.1 DPPH自由基清除
由图3可知,3种多糖溶液均有较高的清除率,其中,复合酶法提取的糖溶液在0.01~1 mg/mL区域内清除率上升速度很快,当质量浓度达到1mg/mL时,清除率为91.29%,其后清除率稳定在91%左右,说明复合酶法提取的多糖在低浓度区域即对DPPH自由基有较强的清除能力,且在4种方法中,复合酶法提取的多糖溶液清除率最高,达到了91.62%;超声提取的糖溶液在低质量浓度区域0.01~1 mg/mL清除率上升速度较快,在4种方法中仅次于复合酶法,当质量浓度为1 mg/mL时,清除率为76.93%,其后上升缓慢,趋于稳定,最终在8 mg/mL时,清除率为85.73%;热水提取的多糖溶液在质量浓度为1 mg/mL时,清除率为21.22%,在质量浓度1~6 mg/mL区域保持平稳上升的趋势,当质量浓度达到6 mg/mL时,清除率趋于稳定,最大清除率为80.56%。在试验过程中,发现由碱液提取的多糖溶液于0.25~0.5 mg/mL时反应出现了与其他3种多糖溶液不同颜色变化,在多糖质量浓度为0.5 mg/mL时,清除率为13.32%,随后基本在小范围内波动,清除率在6%~7%之间,猜测在反应过程中有新的物质产生。

图2 4种方法提取的多糖的红外光谱Fig.2 Infrared spectrogram of polysaccharides extracted by four methods

图3 4种方法提取的多糖溶液对DPPH自由基的清除率Fig.3 DPPH free radicals scavenging ability of polysaccharides extracted by four methods
2.4.2 羟基自由基清除
如图4所示,4种方法提取的多糖溶液对羟基自由基的清除率上升趋势基本一致,上升速度略有不同。在0.01~1 mg/mL的低质量浓度区域,碱液提取法获得的多糖溶液清除率上升速度最慢,说明低浓度的碱液提取的多糖溶液对羟基自由基的清除率最低,在1 mg/mL时为18.29%;热水浸提法与复合酶法提取的多糖溶液在0.01~1 mg/mL区间,清除率上升趋势相似,热提法多糖溶液清除率略高于复合酶法,在1 mg/mL时,热水浸提法和复合酶法提取的多糖溶液对羟基的清除率分别为40.79%和33.75%;超声提取的多糖溶液在0.01~1 mg/mL的区间,清除率上升最快,在1 mg/mL时为51.64%,说明低质量浓度的超提多糖溶液即对羟基自由基有较强的清除效果。在多糖溶液质量浓度达到4 mg/mL时,碱液提取法与超声辅助提取法所获得的多糖清除率均已达到稳定,约为100%;当多糖质量浓度达到6 mg/mL,热水浸提法与复合酶法所获得的多糖溶液清除率趋于稳定,约为100%。
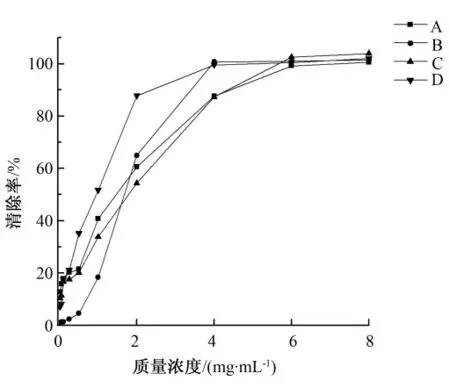
图4 4种方法提取的多糖溶液对羟基自由基的清除率Fig.4 Hydroxy free radicals scavenging ability of polysaccharides extracted by four methods
3 结论
根据此前的文献报道,花脸香蘑多糖的提取方法较为单一,多采用热水浸提的方法,而其他提取方法未见系统的报道。通过对热水浸提法、复合酶提取法、碱液提取法、超声辅助提取法所提取的花脸香蘑多糖的理化性质进行系统的评价比较,可以选取花脸香蘑多糖的最佳提取方法。
试验结果显示:热水浸提法提取多糖纯度高,操作简单,但得率较低,耗能高;碱液提取法拥有操作简便、多糖产量高等优点,但提取获得的多糖含量较低、纯度不高,且对设备的耐腐蚀性要求较高,能耗大;复合酶提取法提取多糖得率高、含量高、纯度高,能耗少,但需用酶酶解,提高了提取成本;超声辅助提取法得率为(8.15±0.17)%,相较于其他方法最低,多糖含量为(67.75±2.24)%,说明纯度不高,提取效果不佳,但其操作简单,可在室温条件下进行,能耗低。
上述4种方法提取花脸香蘑各有优点,研究者可根据目的、试验条件的不同选择相应的方法。但从多糖提取综合效果看,复合酶法提取的粗多糖得率为(19.61±0.60)%,多糖含量最高,为(94.47±3.84)%,蛋白质含量较低,对DPPH自由基以及羟基自由基均有较高的清除率,为最佳提取方法。
参考文献:
[1] 张惟杰.糖类研究漫谈[J].生命的化学,2005(5):432-433.
[2] 李小定,荣建华,吴谋成.真菌多糖生物活性研究进展[J].食用菌学报,2002(4):50-58.
[3] 农业部种植业管理司.我国食用菌产业的发展进程和展望[J].浙江食用菌,2009(5):1-4.
[4] MAZUR X,BECKER U,ANKE T,et al.Two new bioactive diterpenes from Lepista sordida[J].Phytochemistry,1996,43(2):405-407.
[5] 张京良,李蓉,江晓路.花脸香蘑Lepista sordida LS7的鉴定及其发酵液抗菌活性分析[J].食品与生物技术学报,2010(6):948-951.
[6] 吴晓琴,宋晓琳,彭瀛,等.花脸蘑多糖水提物对D-氨基半乳糖致小鼠急性肝损伤的保护作用[J]. 延边大学医学学报,2013,36(1):22-24.
[7] MIAO S S,MAO X H,PEI R,et al.Lepista sordida polysaccharide induces apoptosis of Hep-2 cancer cells via mitochondrial pathway[J].International Journal of Biological Macromolecules,2013,61:97-101.
[8] CHOI J H,ABE N,TANAKA H,et al.Plantgrowth regulator, imidazole-4-carboxamide,produced by the fairy ring forming fungus Lepista sordida [J].Journal of Agricultural and Food Chemistry,2010,58(18):9956-9959.
[9] 刘艳如,李小明,李军进,等.花脸香蘑对水稻细条病的抑制活性研究初报[J].中国农学通报,2012,28(12):202-205.
[10]秦丹,孔超,孙效乐,等.花脸香蘑粗多糖对雏鸡免疫调节作用的研究[J].食用菌学报,2013,20(2):37-41.
[11] LUO Q,SUN Q,WU LS,et al.Structural characterization of an immunoregulatory polysaccharide from the fruiting bodies of Lepista sordida[J].Carbohydrate Polymers,2012,88:820-824.
[12] ZHONG W Z,LIU N,XIE Y G,et al.Antioxidantand anti-aging activities ofmycelial polysaccharides from Lepista sordida[J].International Journal of Biological Macromolecules,2013,60:355-359.
[13]张惟杰.复合多糖生化研究技术[M].2版.上海:上海科学技术出版社,1987:12.
[14]何保山,王丹,左春艳,等.用分光光度法快速测定蛋白质含量的研究[J].河南工业大学学报(自然科学版),2011(4):27-29.
[15]WU H C,CHEN H M,SHIAU CY.Free amino acids and peptides as related to antioxidant aroperties in protein hydrolysates of mackerel(Scomberaustriasicus)[J].Food Research International,2003,36(9-10):949-957.
[16]张京良.花脸香蘑(Lepista sordida)液体发酵及代谢产物的研究[D].青岛:中国海洋大学,2010.
[17]明建.云南特有食药用菌活性多糖研究[D].重庆:西南大学,2008.
[18]潘莹,许经伟.冬枣多糖的分离纯化及抗氧化活性研究[J].食品科学,2016(13):89-94.
COMPARISON OF EXTRACTION METHODS AND PHYSICOCHEMICAL PROPERTIES OF POLYSACCHARIDES FROM LEPISTA SORDIDA
WANG Lanying,TANG Meng, XU Panju, YANG Hairu, HUANG Yanyi, ZENG Jun
(Zhuhai College of Jilin University, Zhuhai 519000,China)
Polysaccharide is one kind of the most important bioactive compounds,which are widely distributed in nature,and take on the function of energy and structure and cell information.In this study,four kinds of extraction methods such as hot water,alkaline solution,multiplex-enzyme and ultrasonic-assisted were used to extract polysaccharides from Lepista sordida.The effects of different extraction methods on the physicochemical properties of the polysaccharide were compared and analyzed by ultraviolet spectrometry,infrared spectroscopy and other methods.The optimum extraction method of polysaccharides from Lepista sordida was selected.The results showed that the extraction method had significant effect on the yield and composition of polysaccharides.The highest yield of polysaccharides(21.10±0.13)%was afforded by alkali extraction,while the lowest yield(8.15+0.17)%was afforded by ultrasonic extraction method.The infrared spectrum characteristic peaks of the four polysaccharides were similar.According to the peaks among 1 022~1 153 cm-1,the ring structure of polysaccharides extracted in alkaline solution probably was furanose ring,and the other three was pyranose ring.The polysaccharide solutions extracted by hot water,multiplex-enzyme and ultrasonic-assisted all had a high DPPH radicals scavenging ability,but poor effect was afforded using polysaccharide extracted in alkaline solution.The polysaccharides extracted by the four methods all had excellent scavenging ability on hydroxy radicals,and the scavenging rates were increased with the increasing of concentration until to the maximum of 100%.Little difference occurred in hydroxy radicals scavenging rate of polysaccharides extracted by the four methods.Combination of the extraction yield and bioactivity of the products,multiplex-enzyme was the optimum extraction method,and the afforded polysaccharides had better extraction efficiency and purity,lower protein content and the best anti-oxidant activity.
Lepista sordida;extraction process;anti-oxidation;polysaccharide;infrared spectroscopy
TS201.2
B
2016-09-29
广东省教育厅青年创新人才项目(2016KQNCX208)
王兰英(1982—),女,山东烟台人,博士,讲师,主要从事药食用真菌活性物质研究与开发。
1673-2383(2017)03-0061-06
http://kns.cnki.net/kcms/detail/41.1378.N.20170621.1050.022.html
网络出版时间:2017-6-21 10:50:49
