手性色谱柱测定维格列汀中间体对映异构体
2017-06-28栗伟娜翟梦宇高子彬
栗伟娜,胡 佳,翟梦宇,高子彬,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄 050018)
手性色谱柱测定维格列汀中间体对映异构体
栗伟娜1,胡 佳1,翟梦宇1,高子彬1,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄 050018)
为建立维格列汀中间体对映异构体含量的测定方法,采用正相高效液相色谱法,色谱柱为Chiralpak®AD-H型手性色谱柱(250 mm×4.6 mm,5 μm),流动相为正己烷-乙醇-甲醇(三者体积比为65∶25∶10),流速为0.8 mL/min,进样体积为10 μL,检测波长为210 nm,柱温为35 ℃。实验得知:维格列汀中间体与其对映异构体的分离度良好,空白溶剂不干扰对映异构体的含量测定;检测限为27 ng/mL,定量限为81 ng/mL;重复性试验中,供试品所含对映异构体含量的RSD值均小于2.0%;稳定性试验中,12 h内对映异构体峰面积及含量的RSD值均小于2.0%;耐用性试验中,维格列汀中间体与其对映异构体峰可实现完全分离,并且不同参数下对映异构体含量的RSD值小于2.0%。结果表明,此方法专属性强,灵敏度高,重复性、耐用性良好,可用于维格列汀中间体对映异构体含量的测定。
色谱分析;维格列汀中间体;高效液相色谱法;对映异构体;含量测定
糖尿病是由于胰岛素分泌及作用缺陷引起的以血糖升高为特征的慢性代谢疾病,口服的降糖药包括胰岛素增敏剂(噻唑烷二酮类和双胍类)、胰岛素分泌促进剂(非磺酰脲类[1]、磺酰脲类[2]胰岛素分泌促进剂)、α-葡萄糖苷酶抑制剂等。近年来,噻唑烷二酮类药物的几个主要品种包括曲格列酮、罗格列酮、吡格列酮等在临床应用过程中发现了肝损伤、心血管风险及诱发癌症风险等毒副作用[3-5],限制了这类药物的应用。新型降糖药二肽基肽酶-4抑制剂类药物具有较好的安全性和耐用性,总不良反应与安慰剂相似[6]。维格列汀是一种口服有效的二肽基肽酶-4抑制剂[7-9],可有效改善2型糖尿病患者的血糖控制[10-13],其药理活性、降糖机理以及临床疗效已通过相关试验得到了证实[14-17],为糖尿病患者提供了一种新的用药选择,显示了良好的应用前景。
(S)-1-(2-氯乙酰基)吡咯烷-2-甲腈是维格列汀合成的关键中间体,维格列汀结构中有一个手性中心,其对映异构体几乎全部由上述中间体合成过程[18-20]中的差向异构化衍生而得,因此维格列汀中间体中的对映异构体的控制对最终产品质量控制至关重要。目前尚无维格列汀中间体对映异构体含量测定方法的相关报道,正相手性色谱柱因其对对映异构体有良好的分离效果而广泛应用于对映异构体含量的测定中[21-25]。因此,本文采用正相高效液相色谱法,使用手性色谱柱对维格列汀中间体中对映异构体含量的测定方法进行研究。
1 主要仪器与试药
1.1 主要仪器
日立L-2000型高效液相色谱仪,日本日立公司提供;AL-205型电子分析天平,瑞士梅特勒-托利多公司提供。
1.2 试剂与药品
维格列汀中间体(自制,批号分别为131006,131015,131022,纯度分别为99.27%,99.45%,99.31%);维格列汀中间体对映异构体对照品(自制,批号为DZWD01,纯度为87.12%);正己烷(色谱纯,J.T.Baker);乙醇(色谱纯,J.T.Baker);甲醇(色谱纯,J.T.Baker)。
2 方法与结果
2.1 色谱条件
色谱柱:Chiralpak®AD-H(250 mm×4.6 mm,5 μm);流动相:正己烷-乙醇-甲醇(三者体积比为65∶25∶10);流速:0.8 mL/min;检测波长:210 nm;柱温:35 ℃;进样体积:10 μL。
2.2 溶液配制
1)供试品溶液
取维格列汀中间体(批号为131006)50 mg,精密称定,置于50 mL容量瓶中,加入乙醇溶解并稀释,制成1 mL约含维格列汀中间体1 mg的溶液,作为供试品溶液。
2)对照品溶液
取维格列汀中间体对映异构体对照品(批号为DZWD01)25 mg,精密称定,置于50 mL容量瓶中,用乙醇溶解,制成1 mL约含维格列汀中间体对映异构体0.5 mg的溶液,作为维格列汀中间体对映异构体的对照品溶液。
3)系统适用性溶液
取维格列汀中间体50 mg,精密称定,置于50 mL容量瓶中;再精密量取上述对照品溶液1 mL,置于同一50 mL容量瓶中,用乙醇溶解,制成1 mL中含有维格列汀中间体对映异构体约10 μg、含维格列汀中间体约1 mg的溶液,作为系统适用性溶液。
2.3 系统适用性及专属性试验
2.3.1 专属性试验
取乙醇、对照品溶液、供试品溶液和系统适用性溶液,分别采用高效液相色谱仪分析,记录色谱图,供试品溶液及系统适用性溶液的色谱图见图1和图2。
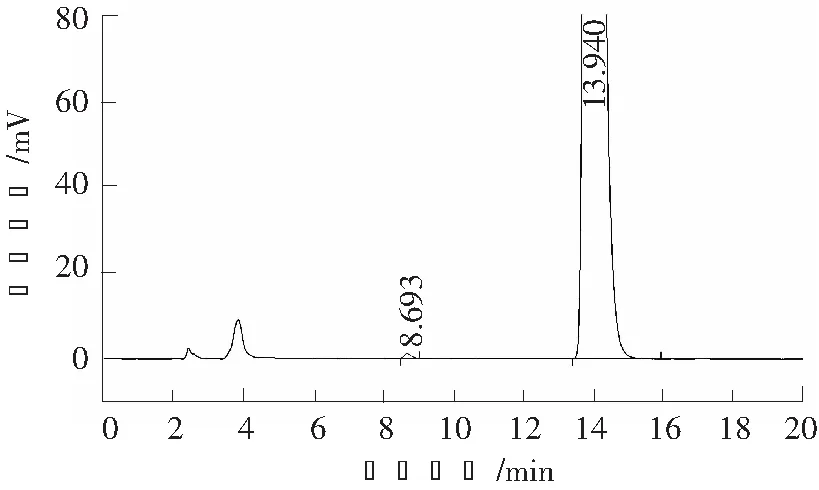
图1 供试品溶液高效液相色谱图Fig.1 HPLC chromatogram of sample solution
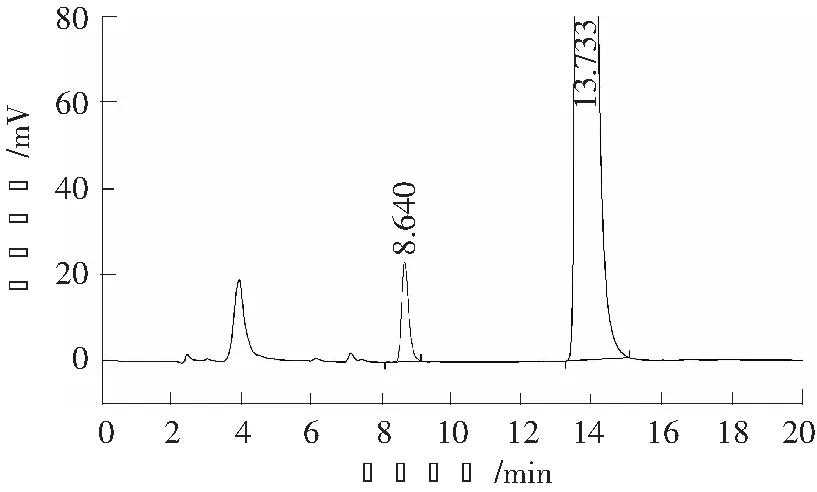
图2 系统适用性溶液高效液相色谱图Fig.2 HPLC chromatogram of system suitation
结果表明:溶剂(乙醇)不干扰对映异构体的测定,维格列汀中间体与其对映异构体完全分离。系统适用性结果详见表1。
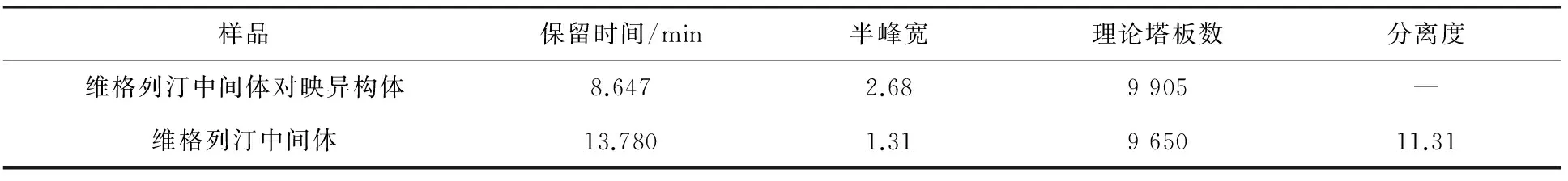
表1 系统适用性结果
2.3.2 检测限与定量限
1)检测限
取“2.2”项下维格列汀中间体对映异构体对照品溶液适量,进行逐级稀释后进样,当峰高约为基线噪音的3倍时测得检测限,结果见表2。

表2 检测限结果
2) 定量限
取“2.2”项下维格列汀中间体对映异构体对照品溶液适量,进行逐级稀释后进样,当峰高约为基线噪音的10倍时测得定量限,此时质量浓度为81 ng/mL,结果见表3。
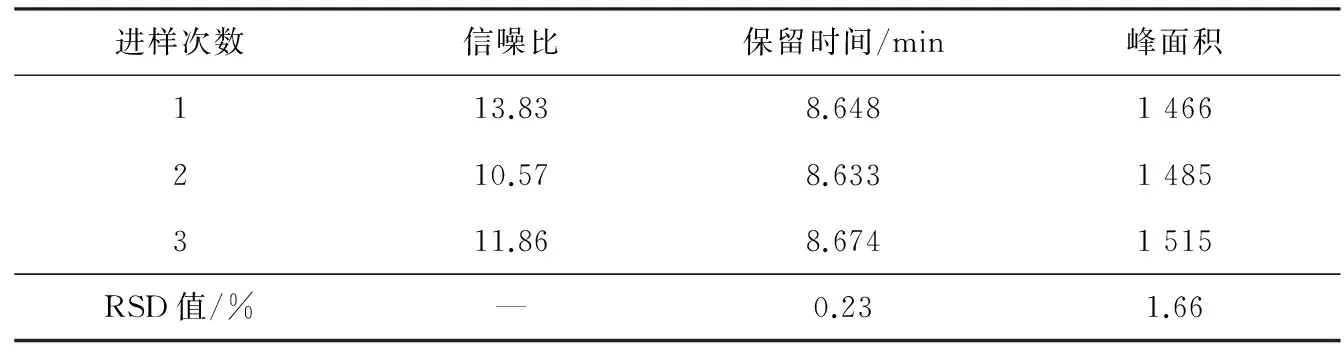
表3 定量限考察结果
由以上数据可知:3份定量限溶液的色谱图中,信噪比均大于10,对映异构体峰保留时间及峰面积重复性良好(RSD值小于2.0%)。
2.3.3 重复性试验
称取维格列汀中间体适量,精密称定,加入乙醇溶解并稀释制成1 mL中含有维格列汀中间体1 mg的溶液,平行配制6份样品溶液进行检测,采用面积归一化测定样品中对映异构体的含量,结果见表4。

表4 重复性考察结果
表4试验数据表明:样品中对映异构体含量的RSD值(n=6)在2.0%以内,说明该方法重复性好,能够满足对映异构体的测定要求。
2.3.4 稳定性试验
取“2.2”项下供试品溶液于室温放置,每隔2 h取样,按“2.1”项下色谱条件分别进行高效液相色谱仪分析,考察对映异构体峰面积及其含量的变化情况。结果得知,对映异构体峰面积及其含量的RSD值分别为0.51%和0.59%,将供试品溶液在室温下放置,对映异构体峰面积及含量在12 h内均无明显变化(RSD值小于2.0%),说明供试品溶液在12 h内稳定。
2.3.5 耐用性试验
通过改变流动相配比、流速、柱温、色谱柱批次,评估测定条件下参数微小变动时测定结果不受影响的承受程度。要求在色谱条件变动参数(见表5)下,维格列汀中间体与其对映异构体分离度大于1.5,对映异构体含量测定结果的RSD值不大于2.0%。耐用性考察结果见表6。

表5 色谱条件变动参数

表6 耐用性考察结果
结果表明:流动相配比、流速、柱温、色谱柱的微小变动不影响分离,维格列汀中间体与其对映异构体峰的分离度均大于1.5,并且不同参数下对映异构体含量的RSD值小于2.0%,说明该方法耐用性好。
2.4 样品测定
分别取批号为131006,131015,131022的维格列汀中间体适量,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,采用面积归一化法进行计算。试验得知,3批维格列汀中间体对映异构体的质量分数分别为0.06%,0.06%,0.05%。
3 讨 论
3.1 色谱条件的优化
前期方法建立的试验结果表明,流动相中甲醇的加入对分离有重要作用。当流动相为正己烷-乙醇(二者体积比为65∶35)时,维格列汀中间体与其对映异构体不能分离;当流动相为正己烷-乙醇-甲醇(三者体积比为65∶30∶5)时,维格列汀中间体与其对映异构体取得良好的分离效果。随着流动相中甲醇比例的增加,主峰保留时间缩短,灵敏度提高,但分离度减小。兼顾灵敏度与分离度,确定流动相为正己烷-乙醇-甲醇(三者体积比为65∶25∶10)。调整柱温分别为30,35,40 ℃,考察柱温对分离的影响。试验结果表明,随着柱温的提高,保留时间缩短,分离度略有增大,但考虑色谱柱的温度耐受范围,在满足分离的情况下选择较低柱温,因此最终确定柱温为35 ℃。
3.2 样品浓度的选择
通过对比不同浓度样品的分离图谱及数据,发现样品浓度对分离及峰形的影响较大。结果表明,维格列汀中间体浓度减小,分离度明显增大,半峰宽减小。在满足检测灵敏度的前提下,选择较低的样品浓度对分离有利,因此确定样品质量浓度为1.00 mg/mL。
4 结 语
本研究建立了采用手性色谱柱测定维格列汀中间体中对映异构体含量的方法,由于维格列汀中间体和其对映异构体具有相同的响应值且在检测浓度下主成分峰未出现超载现象,因此采用面积归一化法可以准确测定对映异构体的含量。此方法专属性强,灵敏度高,重复性、耐用性良好,可作为维格列汀中间体的对映异构体常规检测方法。
本方法使用的色谱柱为多糖涂敷型正相手性柱,即固定相表面涂敷了手性多聚物(直链淀粉-三-(1,5-二甲苯基氨基甲酸酯))的球形硅胶。由于是物理涂敷,因此必须注意流动相的选择。通常情况下用正己烷、乙醇、异丙醇为流动相,特殊情况下可使用甲醇和乙腈,但需严格控制流动相的混合比例,否则会影响分离甚至导致色谱柱的不可逆损伤,减少色谱柱使用寿命。此外,正相手性柱生产厂家很多,不同厂家的分离效果不同,使用时应注意甄别。
/References:
[1] BICKLE J F. Meglitinide analogues: A review of clinical data focused on recent trials[J].Diabetes Metab,2006, 32(2):113-120.
[2] 刘永贵, 田红, 解学星, 等. 治疗2型糖尿病的非胰岛素类药物的研究进展[J]. 现代药物与临床, 2013, 28(2): 108-113. LIU Yonggui, TIAN Hong, XIE Xuexing, et al. Research progress in non-insulin drugs used for treating type 2 diabetes[J]. Drugs & Clinic, 2013, 28(2): 108-113.
[3] 王堃. 曲格列酮肝细胞毒性作用及其机制研究[D]. 大连: 大连医科大学, 2003. WANG Kun. The Research for the Effect and Meanism of Troglitazone Hepatotoxicity[D]. Dalian:Dalian Medical University, 2003.
[4] POUWELS K B, van GROOTHEEST K. The rosiglitazone decision process at FDA and EMA. What should we learn[J].The International Journal of Risk and Safety in Medicine,2012, 24(2): 73-80.
[5] COLMERS I N, BOWKER S L, MAJUMDAR S R, et al. Use of thiazolidinediones and the risk of bladder cancer among people with type 2 diabetes: A meta-analysis[J]. Canadian Medical Association Journal, 2012, 184(12): E675-E683.
[6] 蔡乐,刘萍. 新型口服降糖药——二肽基肽酶-Ⅳ抑制剂[J]. 国际药学研究杂志,2010, 37(5):361-365. CAI Le, LIU Ping. Dipeptidyl peptidase Ⅳ inhibitors:A new class of oral agents for treatment of type 2 diabetes mellitus[J]. Journal of International Pharmaceutical Research,2010, 37(5):361-365.
[7] STROP P, BANKOVICH A J, HANSEN K C, et al. Structure of a human a-type potassium channel interacting protein DPPX, a member of the dipeptidyl aminopeptidase family[J]. Journal of Molecular Biology, 2004, 343(4): 1055-1065.
[8] 朱翊, 傅得兴. 二肽基肽酶Ⅳ抑制剂的研究进展[J]. 中国药学杂志, 2007, 28(17): 1284-1286.
[9] 谷艳玲. 维格列汀片剂的制备[D]. 石家庄:河北科技大学, 2015. GU Yanling. Preparation of Vildagliptin Tablets[D].Shijiazhuang: Hebei University of Science and Technology, 2015.
[10]孟艳秋, 张宇, 刘凤鑫, 等. 二肽基肽酶Ⅳ抑制剂的药理作用及其机制研究[J]. 现代药物与临床, 2013, 28(2): 101-107. MENG Yanqiu, ZHANG Yu, LIU Fengxin, et al. Research progress in pharmacologic actions of dipeptidyl peptidase Ⅳ inhibitors and its mechanism[J]. Drugs & Clinic, 2013,28 (2): 101-107.
[11]周映红, 黄文龙, 张惠斌, 等. GLP-1受体激动剂及DPP-Ⅳ抑制剂的研究进展[J]. 中国药科大学学报, 2008, 39(5): 385-391. ZHOU Yinghong, HUANG Wenlong, ZHANG Huibin, et al. Progress in the investigation of GLP-1 receptor agoniss and DPP-Ⅳ inhibitors[J]. Journal of China Pharmaceutical University, 2008, 39(5): 385-391.
[12]董静莲,卢丙艳. DPP-4抑制剂在2型糖尿病治疗中的作用[J]. 天津药学,2013,25(6):65-67. DONG Jinglian, LU Bingyan. The effect of DPP-4 inhibitor in treatment of 2 diabetes[J]. Tianjin Pharmacy,2013,25(6):65-67.
[13]MEIER J J, GALLWITZ B, SALMEN S, et al. Normalization of glucose concentrations and deceleration of gastric emptying after solid meals during intravenous glucagon-like peptide 1 in patients with type 2 diabetes[J]. Journal of Clinical Endocrinology and Metabolism, 2003, 88(6): 2719-2725.
[14]安富荣, 崔岚, 王勤. 治疗2型糖尿病新药——维格列汀[J]. 中国新药与临床杂志, 2012, 31(10): 574-578. AN Furong, CUI Lan, WANG Qin. Vildagliptin in treatment of 2 diabetes mellitus[J]. Chinese Journal of New Drugs and Clinical, 2012, 31(10): 574-578.
[15]韩英. 治疗2型糖尿病的新药维格列汀[J]. 天津药学,2012, 24(4):59-61. HAN Ying. The new drug for type 2 diabetes vildagliptin[J]. Tianjin Pharmacy,2012, 24(4):59-61.
[16]樊新星,徐珽,卢静. 抗糖尿病新药维格列汀[J]. 中国新药杂志,2008, 17(14):72-74. FAN Xinxing,XU Ting,LU Jing, et al. Vildagliptin:A new agent for diabetic treatment[J]. Chinese Journal of New Drugs,2008, 17(14):72-74.
[17]樊建领,焦伟杰. 抗糖尿病新药物维格列汀的研究进展[J]. 中国医药导报,2012, 9(12):9-10. FAN Jianling,JIAO Weijie. Research progress of the new drug vildagliptin for anti-diabetes[J]. China Medical Herald,2012, 9(12):9-10.
[18]陶铸,邓瑜,彭俊, 等. 维格列汀中间体(S)-1-(2-氯乙酰基)吡咯烷-2-甲腈的合成[J]. 化学研究与应用,2013, 25(10):1422-1425. TAO Zhu,DENG Yu,PENG Jun, et al. Synthesis of vildagliptin intermediate(S)-1-(2-chloroacetyl) pyrrolidine-2-carbonitrile[J]. Chemical Research and Application,2013, 25(10):1422-1425.
[19]杨璐,皮昌桥,张莉, 等. 一种制备维格列汀关键中间体(S)-1-(2-氯乙酰基)吡咯烷-2-甲腈的新方法[J]. 辽宁化工,2016, 45(2):145-146. YANG Lu,PI Changqiao,ZHANG Li, et al. A new method to synthesis of vildagliptin intermediate(S) -1-( 2-chloroacetyl) pyrrolidine-2-carbonitrile[J]. Liaoning Chemical Industry,2016, 45(2):145-146.
[20]杨金路,王秋艳,张勇. 维格列汀的合成路线改进[J]. 中国新药杂志,2015,24(11):1295-1297. YANG Jinlu, WANG Qiuyan, ZHANG Yong. An improved synthetic route of vildagliptin[J]. Chinese Journal of New Drugs,2015,24(11):1295-1297.
[21]陈国良,李美玉,陈仙明,等. 正相高效液相色谱法测定4-AA对映异构体含量[J]. 亚太传统医药,2014, 10(3):31-32. CHEN Guoliang, LI Meiyu, CHEN Xianming, et al. Determination of enantiomer of fosaprepitant dimeglumine by HPLC[J]. AsiaPacific Traditional Medicine,2014, 10(3):31-32.
[22]张丽萍,冯中. 高效液相色谱法测定福沙匹坦二甲葡胺对映异构体[J]. 中国医院药学杂志,2016, 36(20):1767-1769. ZHANG Liping, FENG Zhong.Determination of enantiomer of fosaprepitant dimeglumine by HPLC[J]. Chinese Journal of Hospital Pharmacy,2016, 36(20):1767-1769.
[23]陆云霞,潘星燕,姚军.HPLC测定奥贝胆酸片含量[J].河北科技大学学报,2017,38(2):158-162. LU Yunxia,PAN Xingyan, YAO Jun.Content determination of obeticholic acid tablets by HPLC[J]. Journal of Hebei University of Science and Technology, 2017,38(2):158-162.
[24]曲建文,周艳,李树波, 等. 高效液相色谱法检测缬沙坦胶囊中对映异构体[J]. 中国药业,2012, 21(14):55-57. QU Jianwen, ZHOU Yan, LI Shubo, et al. Determination of enantiomers content in valsartan capsules by HPLC[J].China Pharmaceutical,2012, 21(14):55-57.
[25]陈洁,吕旭幸,王丽云. 正相高效液相色谱法测定注射用埃索美拉唑钠的对映异构体[J]. 海峡药学,2014, 26(9):61-63. CHEN Jie,LYU Xuxing,WANG Liyun.Determination of enantiomers of esomeprazole sodium for injection by HPLC[J]. Strait Pharmaceutical Journal,2014, 26(9):61-63.
Determination of the vildagliptin intermediate enantiomer by chiralce-columns
LI Weina1, HU Jia1, ZHAI Mengyu1, GAO Zibin1,2
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2.State Key Laboratory Breeding Base-Key Laboratory of Molecular Chemistry for Drug of Hebei Province, Shijiazhuang, Hebei 050018, China)
In order to establish a NP-HPLC method for the determination of enantiomer in vildagliptin intermediate, the determination is carried out on the column of Chiralpak®AD-H(250 mm×4.6 mm, 5 μm), with the mobile phase ofn-hexane, ethanol and methanol(volume ratio of 65∶25∶10)at flow rate of 0.8 mL/min. The sample volume is 10 μL, the wavelength is 210 nm and the column temperature is 35 ℃. The result shows that the vildagliptin intermediate and its enantiomer could be well separated and detected effectively; blank solvent doesn't interfere with the enantiomer assaying; the detection limit is 27 ng/mL and the quantification limit is 81 ng/mL; in repetitive test, the RSD of enantiomer assaying of samples are no more than 2.0%; in stability test, the RSD are no more than 2.0% in 12 h; the vildagliptin intermediate and its enantiomer could be well separated in the test of durability with all RSDs below 2.0%. The method is simple, reliable, accurate and durable, and can be used for determination of enantiomer in vildagliptin intermediate.
chromatography; vildagliptin intermediates; HPLC; enantiomer; content determination
1008-1542(2017)03-0249-06
10.7535/hbkd.2017yx03006
2017-01-22;
2017-03-22;责任编辑:张士莹
国家“重大新药创制”科技重大专项(2014ZX09507001)
栗伟娜 (1991—),女,河北石家庄人,硕士研究生,主要从事药物制剂方面的研究。
高子彬教授。E-mail:zbgao74@163.com
O175.8
A
栗伟娜,胡 佳,翟梦宇,等.手性色谱柱测定维格列汀中间体对映异构体[J].河北科技大学学报,2017,38(3):249-254. LI Weina,HU Jia,ZHAI Mengyu,et al.Determination of the vildagliptin intermediate enantiomer by chiralce-columns[J].Journal of Hebei University of Science and Technology,2017,38(3):249-254.
