皱皮木瓜总酚酸提取工艺研究
2017-06-28吴士筠杨文婷杨光忠
刘 虹,肖 敏,覃 瑞, 吴士筠,杨文婷,杨光忠
(1中南民族大学 生命科学学院,武汉 430074;2 武汉工商学院 环境与生物工程学院,武汉 430065;3 中南民族大学 药学院,武汉 430074)
皱皮木瓜总酚酸提取工艺研究
刘 虹1,肖 敏1,覃 瑞1, 吴士筠2,杨文婷2,杨光忠3,*
(1中南民族大学 生命科学学院,武汉 430074;2 武汉工商学院 环境与生物工程学院,武汉 430065;3 中南民族大学 药学院,武汉 430074)
为研究皱皮木瓜总酚酸的提取工艺,在单因素试验基础上,考察了料液比、乙醇浓度、提取温度、提取时间、提取次数等对皱皮木瓜总酚酸提取率的影响,以总酚酸含量为指标,结合正交试验优选了最佳提取条件. 结果表明:4种影响提取率的因素依次为:提取温度>提取时间>料液比>乙醇浓度,提取温度对总酚酸提取影响较为明显. 最佳提取工艺为:乙醇浓度体积比60%,提取温度90℃,料液比为1︰40(g·mL-1),提取5 h,1次. 在最佳提取工艺下,皱皮木瓜总酚酸浸膏得率38.9%,总酚酸含量0.303 g·g-1,最后提取率为34.22%,此提取总酚酸工艺简便准确易行.
皱皮木瓜;总酚酸;提取工艺
木瓜的正品皱皮木瓜[Chaenomelesspeciosa(Sweet.) Nakai],为蔷薇科植物贴梗海棠的果实,又名铁脚梨(河北)和宣木瓜(安徽). 果实椭圆形,长约10 cm,皮黄色质坚硬,外表面皱褶[1],是我国南北各地广泛栽培的重要果树资源,药用价值和营养保健价值极大,在我国已有3000多年的栽培历史[2]. 皱皮木瓜含超氧化物歧化酶、三萜类、皂苷、黄酮、鞣质、苹果酸、酒石酸、柠檬酸、维生素C以及富马酸等多种活性成分,是一种药食兼用的水果,以药用为主[3],它具有保肝、抗肿瘤、抗炎镇痛、祛风湿、抗氧化和清除自由基等作用[4]. 在各种有效成分提取中,多糖[5]、有机酸[6]、皂苷[7]、超氧化物歧化酶[8]和黄酮类[9]化合物的提取工艺以及生物活性研究进展有较多的报道,而酚酸类的提取工艺报道较少,且酚酸类化合物具有广泛的药理活性. 本文主要就皱皮木瓜总酚酸的提取工艺进行了研究,为大规模工业生产提供数据参考,以及后续的纯化工艺及生物活性等研究提供理论基础.
1 材料和方法
1.1 材料和仪器
皱皮木瓜产地湖北长阳,经中南民族大学生命科学学院刘虹博士鉴定为Chaenomelesspeciosa(Sweet.) Nakai. 对照品没食子酸(上海源叶生物科技有限公司),其他试剂均为分析纯(国药集团化学试剂有限公司).
水浴锅(DK-98-II,天津市泰斯特仪器),可见分光光度计(UV1800C,上海美谱达仪器),旋转蒸发仪(RE-200A,上海亚荣生化仪器厂),电子分析天平(CP224C,上海奥豪斯仪器),循环水式多用真空泵(SHB-111A,上海卫凯仪器).
1.2 没食子酸标准曲线的绘制
福林酚法[10]测定总酚含量的方法,精密称取干燥至恒重的没食子酸对照品100 mg,置于100 mL容量瓶中,加入甲醇溶解并稀释至刻度. 量取没食子酸对照品溶液1,2,3,4,5 mL,分别置于100 mL容量瓶中,各加入甲醇定容至刻度,摇匀,分别取1 mL至比色管,加入5 mL 体积比10%福林酚试剂,反应10 min后加入5 mL质量浓度为2% Na2CO3溶液摇匀,25℃条件下静置1 h后在760 nm处测定各标准溶液的吸光度,以没食子酸质量浓度(x)对其吸光度(y)作曲线,计算回归方程(y为吸光度,x为没食子酸质量浓度).
1.3 皱皮木瓜总酚酸的提取
精密称取5.000 g皱皮木瓜粉末,置于圆底烧瓶中,设置提取温度、时间、料液比、乙醇浓度等不同条件,放入水浴锅回流加热→过滤→洗涤滤渣→合并滤液和洗液→浓缩→干燥至恒重→称量浸膏质量.
1.4 皱皮木瓜总酚酸含量的测定
用甲醇溶解提取物浸膏,定容,取1 mL作为供试品待测液,按照没食子酸含量测定方法的测定待测品总酚酸含量. 提取率(%)= 浸膏质量/原药材质量 × 0.5+总酚酸质量/浸膏质量 × 0.5.
1.5 单因素试验
1.5.1 乙醇提取浓度对总酚酸提取率的影响
精密称量皱皮木瓜药材粉末5.000 g,分别加入上述提取剂体积比为90%,80%,70%,60%,50%乙醇50 mL,在80℃下回流提取75 min过滤,滤液旋蒸回收溶剂至干,真空减压干燥. 测定提取物中总酚酸的含量和浸膏得率.
1.5.2 提取温度对总酚酸提取率的影响
精密称量皱皮木瓜药材粉末5.000 g,分别加入体积比为80%的乙醇各50 mL,分别在50℃,60℃,70℃,80℃,90℃加热回流提取1次,提取时间75 min 过滤,旋蒸回收溶剂至干,真空减压干燥. 测定提取物中总酚酸的含量和浸膏得率.
1.5.3 提取时间对总酚酸提取率的影响
精密称量皱皮木瓜药材粉末5.000 g,分别加入体积比为80%的乙醇各50 mL,80℃加热回流提取1次,各样品提取时间1,2,3,4,5 h. 过滤,旋蒸回收溶剂至干,真空减压干燥. 测定提取物中总酚酸的含量和浸膏得率.
1.5.4 料液比对总酚酸提取率的影响
精密称量皱皮木瓜药材粉末5.000 g,分别加入体积比为80%的乙醇25, 50, 100, 150, 200 mL在80℃下回流提取75 min 过滤,旋蒸回收溶剂至干,真空减压干燥. 测定提取物中总酚酸的含量和浸膏得率.
1.5.5 提取次数对总酚酸提取率的影响
精密称量皱皮木瓜药材粉末5.000 g,分别加入体积比为80%的乙醇各50 mL,80℃加热75 min,回流提取1,2,3次. 各样品溶液过滤,旋蒸回收溶剂至干,真空减压干燥. 测定提取物中总酚酸的含量和浸膏得率.
1.6 正交试验
根据单因素试验结果,选取对皱皮木瓜总酚酸提取率有显著影响的因素和水平进行正交试验设计.
2 结果与分析
2.1 含量测定方法学考察
2.1.1 线性关系考察
按照上述的标准曲线的绘制方法,获得回归方程y=0.0132x-0.0004,R2=0.9996(见图1),总酚含量测定的线性范围为0~50 μg·mL-1.
2.1.2 精密性考察
按照上述测定步骤,将样品连续测定6次,记录吸光度,测定吸光度的RSD=0.1399%,表明仪器的精密度良好.
2.1.3 稳定性考察
分别记录待测样品在0, 2, 4, 8, 16, 24 h的吸光度,RSD=8.15%,24 h内不稳定;记录在10, 20, 30, 40, 50, 60 min的吸光度,RSD=1.28%,1 h内稳定.
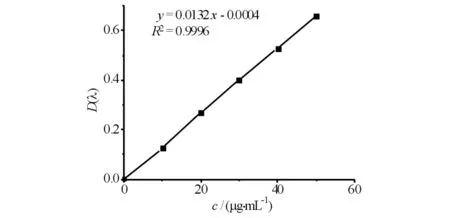
图1 没食子酸标准曲线Fig.1 Standard curv of gallic acid
2.1.4 重复性考察
取同一批药材所得浸膏,精密称量6份,按照上述方法测定总酚酸含量,平行测定,RSD=1.62%,表明重复性良好.
2.1.5 加样回收率考察
精密称量皱皮木瓜原药材粉末6份,按上述要求提取获得浸膏,精密称量浸膏0.50 g,测定平均总酚酸质量0.1241 g,向待测液中加入0.1241 g没食子酸标准品,再次测定总酚酸含量,计算回收率平均值为101.51%,RSD=1.68%,说明本方法准确度较高.
2.2 单因素试验
2.2.1 乙醇提取浓度对提取率的影响
乙醇浓度对提取率的影响结果见图2.由图2可知:在选取的5个浓度梯度中,随着乙醇浓度的增加提取率先上升后下降,在乙醇体积浓度为60%时提取率有最大值,所以将乙醇浓度水平设置在50%~70%.
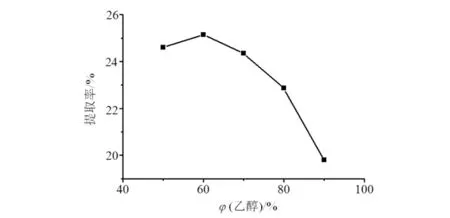
图2 乙醇浓度对提取率的影响Fig.2 Effects of ethanol concentration on the extraction rate
2.2.2 料液比对提取率的影响
料液比对提取率的影响结果见图3.由图3可知:在选取的5个料液比梯度中,提取率先上升后下降,在料液比1︰30时提取率有最大值,故将料液比设置在1︰20~1︰40.
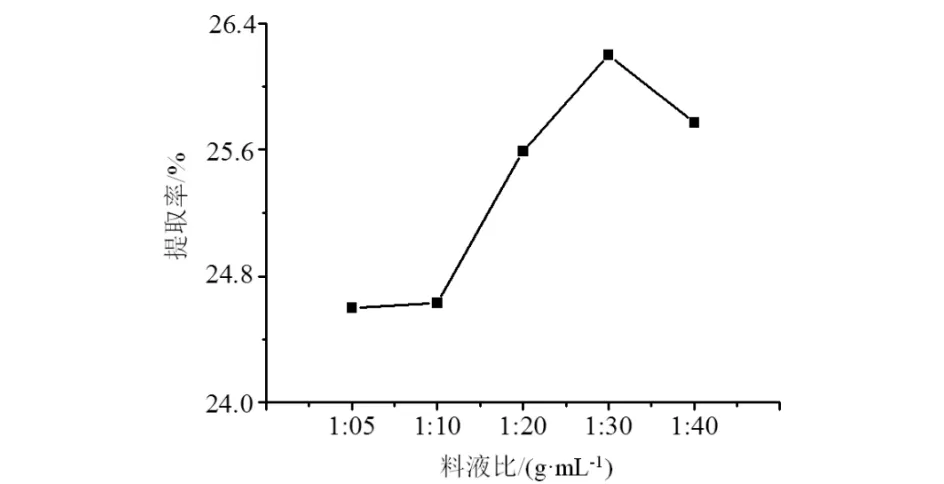
图3 料液比对提取率的影响Fig.3 Effects of solid-liquid ratio on the extraction rate
2.2.3 提取温度对提取率的影响
提取温度对提取率的影响结果见图4.由图4可知:在选取的5个温度梯度中,提取率逐渐上升,在70~80℃提取率显著上升,80~90℃的提取率上升平缓,故将温度设置在70~90℃.
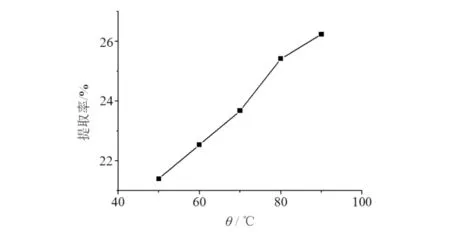
图4 温度对提取率的影响Fig.4 Effects of extraction temperature on the extraction rate
2.2.4 提取时间对提取率的影响
提取时间对提取率的影响结果见图5.由图5可知:在选取的5个提取时间梯度中,提取率逐渐上升,从3~4 h提取率的增幅无显著提高,考虑到工艺成本,将提取时间设置在3~5 h这个区间.

图5 提取时间对提取率的影响Fig.5 Effects of extraction time on the extraction rate
2.2.5 提取次数对提取率的影响
提取次数对提取率的影响结果见图6.由图6可知:提取1,2,3次后,提取率逐渐上升,考虑到工艺成本和节约资源,将提取次数设置为提取1次.

图6 提取次数对提取率的影响Fig.6 Effects of extraction times on the extraction rate
2.3 正交试验
根据上述实验结论,确定提取次数,设计4因素3水平的正交试验,结果见表1和表2.由表1、表2可见:各因素对皱皮木瓜总酚酸提取率的影响程度依次为温度>时间>液料比>乙醇浓度,温度对提取率有极显著影响(p<0.01),提取时间对提取率有显著影响(p<0.05),提取次数、料液比和乙醇浓度对提取率影响不显著(p>0.05).确定提取工艺为90℃,5 h,60%体积比的乙醇,料液比为1︰40,提取1次.在此条件下,皱皮木瓜总酚酸浸膏得率为38.9 %(浸膏得率=浸膏质量/原药材质量×100%),总酚酸含量为0.303 g·g-1(总酚酸含量=总酚酸质量/浸膏质量),提取率为34.22%,提取率/%=(浸膏质量/原药材质量×0.5+总酚酸质量/浸膏质量×0.5)×100%.
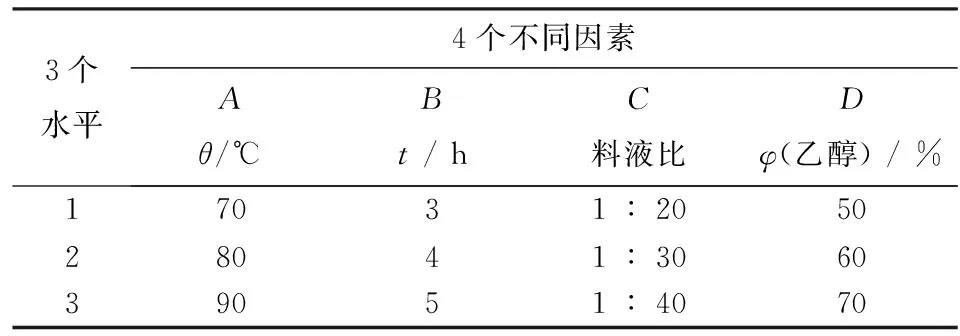
表1 试验因素和水平设计

表2 L9(34)正交试验结果与直观分析
2.4 验证试验
按上述的优化提取条件做3次平行试验,结果稳定,总酚酸的提取率可达34.22%. 故最佳提取工艺为:乙醇浓度体积比60%,提取温度90℃,料液比为1︰40(g·mL-1),提取5 h,1次.
3 结论
(1)影响皱皮木瓜总酚酸提取率的影响因素依次为:提取温度>提取时间>料液比>乙醇浓度,其中提取温度具有极显著影响,提取时间具有显著影响.
(2)皱皮木瓜总酚酸的最佳提取工艺为:乙醇浓度体积比60%,提取温度90℃,料液比为1︰40,提取5 h,1次,此条件下可获得皱皮木瓜总酚酸提取率为34.22%.
[1] 吴延廷, 张 俊. 中药木瓜的基源和性状鉴定[J]. 华西医科大学学报, 1996, 27(4): 404-408.
[2] 项昭保, 任绍光, 石轶松. 木瓜资源的开发与利用[J]. 中国野生植物资源, 2002, 21 (5): 26-27.
[3] 王明明, 王建华, 宋振巧. 木瓜属品种调查与分类初探[J]. 园艺学报,2009, 36 (5): 701-710.
[4] 齐 红, 秦 华, 郭庆梅. 皱皮木瓜组分含量测定及药理作用研究进展[J]. 中国执业药师, 2016,13(8):39-42.
[5] 刘 捷,王 文, 卢 奎,等. 皱皮木瓜多糖的提取及其抗氧化活性研究[J]. 河南工业大学学报, 2011,32(1):48-52.
[6] 刘世尧. 不同产区皱皮木瓜有机酸组成及主要活性成分分离纯化研究[D].重庆:西南大学, 2012.
[7] 李 娜. 野木瓜总皂苷的分离纯化及抗氧化活性研究[D]. 贵阳: 贵州大学, 2007.
[8] 柳建平. 皱皮木瓜超氧化物歧化酶分离纯化研究[J]. 安徽农业科学, 2009 (1): 222-223.
[9] 韦正鑫, 刘世尧, 卞京军.重庆皱皮木瓜果渣总黄酮提取工艺优化研究[J]. 西南大学学报, 2015 (3): 242-249.
[10] 文冰杰, 夏厚林, 李瑞煜. UV法测定叠鞘石斛中总酚含量方法研究[J]. 辽宁中医药大学学报, 2016, 18 (1): 44-46.
Study on Total Phenolic Acids Extraction Technology fromChaenomelesspeciosa(Sweet.) Nakai
LiuHong1,XiaoMin1,QinRui1,WuShijun2,YangWenting2,YangGuangzhong3
(1 College of Life Science, South Central University for Nationalities, Wuhan 430074 ;2 College of Environmental and Biological Engineering, Wuhan Technology and Business University, Wuhan 430065 ;3 College of Pharmacy, South Central University of Nationalities, Wuhan 430074)
To optimize the extraction process for total phenolic acids fromChaenomelesspeciosa(Sweet.) Nakai, effects of solid-liquid ratio, ethanol concentration, extraction time, extraction temperature and extraction cycles on the extraction rate were studied by using the content of total phenolic acids as the index on the basis of the single-factor test with orthogonal test. The results indicated that the influence of the four factors on the extraction rate was in the order of extraction temperature, extraction time, solid-liquid ratio and ethanol concentration. Among these, temperature had relatively significant impacts on the yield of total phenolic acids. The best extraction condition was as follows: 60% ethanol, 90℃ extraction temperature, 1︰40 (g·mL-1) solid-liquid ratio, and extracting 5 h for 1 time. Under this condition, the yield of total phenolic acid fromChaenomelesspeciosa(Sweet.) Nakai was 34.22%, with a total content of 0.303 g·g-1. This method was simple, accurate and convenient for the extraction of total phenolic acids.
Chaenomelesspeciosa(Sweet.) Nakai; total phenolic acids; extraction technology
2016-10-22 *通讯作者 杨光忠 (1968-), 男, 教授, 博士, 研究方向: 天然药物化学, E-mail: yanggz888@126.com
刘 虹(1977-), 女, 副教授, 博士, 研究方向: 植物资源学, E-mail: 3032307@mail.scuec.edu.cn
中央高校基本科研业务费资助项目(CZW16001)
TQ460.6;R284.2
A
1672-4321(2017)02-0049-04
