OsmC基因在豌豆根瘤菌抗氧化和共生中的功能
2017-06-28程国军田梦洋
程国军, 彭 杨, 殷 杰, 田梦洋
(中南民族大学 生命科学学院, 武汉 430074)
OsmC基因在豌豆根瘤菌抗氧化和共生中的功能
程国军, 彭 杨, 殷 杰, 田梦洋
(中南民族大学 生命科学学院, 武汉 430074)
为研究OsmC基因在豌豆根瘤菌抗氧化和共生固氮中的功能,以豌豆根瘤菌RL3841的OsmC基因为研究对象,通过同源重组获得了OsmC基因突变株RLOsmC. 结果表明:OsmC基因突变不影响豌豆根瘤菌的自生生长能力,但对无机氧化物H2O2和低浓度有机氧化物氢过氧化枯烯(CuOOH)都十分敏感. 突变株RLOsmC感染豌豆宿主能形成红色有效根瘤,但是其固氮酶活降低了18.3%.OsmC基因的表达不受H2O2的诱导,但在7 d根瘤类菌体中表达量显著上调.表明根瘤菌OsmC基因在共生和抗氧化功能中发挥了重要的作用.
豌豆根瘤菌;OsmC基因;抗氧化功能;共生功能;实时荧光定量RT-PCR
根瘤菌与豆类植物能形成共生固氮体系.侵染过程中形成的带有根瘤菌的类菌体是N2固定及合成被植物利用的含氮物质所不可缺少的;在共生过程中植物也会提供根瘤菌在固氮过程中所需的营养物质[1].这种共生系统对于不能通过自身合成氮源的农作物有极其重要的意义.
植物、细菌和真菌的新陈代谢过程中都会产生有机过氧化物(ROOH).作用于有机过氧化物的酶均属于过氧化物酶家族和OsmC/Ohr家族.OsmC/Ohr家族为细菌独有的[2],基因编码的Ohr只能被有机过氧化物诱导,此外,ohr基因的破坏会引起细菌对有机氧化物的超敏反应[3],OsmC基因缺失会对H2O2和有机氧化物表现敏感[4].
目前,国内外学者对抗氧化系统的研究日益重视,Hop H T等[5]将Brucellaabortus中编码有机过氧化物抗性蛋白的ohr基因克隆至老鼠中,具有重组Ohr(rOhr)的实验组克隆老鼠与对照组克隆麦芽糖结合蛋白的小鼠相比,实验组避免剧毒B.abortus的感染的能力显著增高.Chuchue T等[6]证明了ohrR和ohr是感应和保护根癌农杆菌(Agrobacteriumtumefaciens)免受有机过氧化物的氧化损伤的主要系统. Klomsiri C等[7]研究了植物病原菌在对脂质过氧化物(LOOH)的抗氧化中,烷基过氧化氢复原酶 (AhpC)和有机过氧化物抗性酶(Ohr)起关键的
作用.田梦洋等[8]研究表明有机过氧化物抗性基因ohrB虽对豌豆根瘤菌的自生生长、共生固氮、根圈定殖无影响,但可在抗氧化及竞争结瘤中发挥重要作用.Caswell C C等[9]发现有机过氧化物抗性蛋白Ohr在体外条件下保护B.abortus2308免受有机过氧化物的毒害.周艳琳等[10]研究发现katG突变体本身不受外源H2O2的诱导,但对OhrB和grxC等抗氧化基因的表达有调节作用,进而在抗氧化和共生中起作用.目前主要集中在对ohr基因的研究,而对OsmC基因的研究较少.因此,本研究构建了豌豆根瘤菌OsmC基因突变株,通过自生和豌豆盆栽共生实验,研究OsmC基因的抗氧化性能和共生固氮功能.
1 材料与方法
1.1 试剂与仪器
限制性内切酶(XbaI、BamH I、Hind III等)、T4DNA连接酶、RNAiso Plus( TaKaRa公司),TaqDNA 聚合酶、phusion 高保真酶(Thermo Scientific),PCR产物回收试剂盒、DNA凝胶回收试剂盒(博大泰克公司),PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒(TaKaRa),抗生素(Sigma).
725型紫外可见分光光度计(上海光谱仪器),PCR仪(Biometra),TGL-16G-B台式高速离心机(湖南星科科学仪器),荧光定量PCR仪(Applid Biosystems),气相色谱仪(北分瑞利仪器).
1.2 菌株、质粒和培养基
菌株主要为豌豆根瘤菌(R.leguminosarum)RL3841和大肠杆菌(Escherichiacoli),RLOsmC为本实验中构建的RL3841的突变体.克隆质粒pk19mob和表达质粒pRK415均来源于牛津大学Philip S Poole教授.植物盆栽实验中所用的甜豌豆为实验室保存.所用的培养基主要为LB培养基(37℃培养大肠杆菌),TY培养基和AMS培养基(30℃培养豌豆根瘤菌).培养根瘤菌的抗生素为:500 μg/mL链霉素(Str),80 μg/mL新霉素(Neo),2 μg/mL四环素(Tc).培养大肠杆菌的抗生素为:5 μg/mL四环素(Tc),20 μg/mL卡那霉素(Km).
1.3 豌豆根瘤菌OsmC基因突变菌的构建
突变菌的构建主要依照周艳琳等[10]的方法进行,以豌豆根瘤菌RL3841总DNA为模板,OsmC的上游和下游引物进行PCR扩增,扩增得到的目的片段和pK19mob分别用限制性内切酶XbaI和BamH I进行两次单酶切,酶切产物经T4DNA连接酶连接过夜,再转化进入大肠杆菌DH5α转化子经酶切和测序验证后,获得阳性转化子pRKOsmC.然后以根瘤菌RL3841为受体菌,大肠杆菌pRKOsmC为供体菌,含pRK2013质粒的大肠杆菌为辅助菌进行三亲本杂交,经抗生素筛选及PCR验证,获得RLOsmC突变株.实验过程中所用的引物列于表1.

表1 PCR引物序列
* 下划线为限制性酶切位点
1.4 无氧化物胁迫条件下的菌株的生长情况
接种突变株RLOsmC和野生株RL3841于TY斜面,2 d后用AMS液体培养基洗脱,接种菌液至AMS液体培养基中,使初始浓度D(600 nm)值为0.01,每种菌3个重复,置于30℃ 200 r/min的恒温振荡器中培养,每隔6 h取一次样测D(600 nm)值.
1.5 抗氧化实验
将活化的突变株RLOsmC和野生株RL3841接种到含相应抗生素的TY斜面,30℃恒温培养箱培养2 d,用无菌水洗脱,并稀释菌液至D(600 nm)值为1,取100 μL菌液涂布AMS琼脂平板,待平板上菌液吹干后,将浸有不同浓度的H2O2和CuOOH的圆形滤纸片分别放置于平板正中央,每个平板放置一张滤纸片.于30℃培养箱正置培养,24 h后测量抑菌圈直径.每组实验均设3个重复.
1.6 根瘤固氮酶活的测定
采用无菌蛭石[12]种植甜豌豆.蛭石经清洗、晾干后,装至塑料烧杯中,加入适量的无氮的豌豆营养液,用保鲜膜封口,121℃ 灭菌1 h.将豌豆种子经95%的酒精和2%的次氯酸钠消毒.消毒后的豌豆分别接种突变菌株RLOsmC和野生型菌株RL3841菌液,并播种于灭菌的蛭石烧杯,每颗豌豆上接种1 mL菌液,每种菌重复3次.在光照培养箱中培养3周后,统计根瘤数量,并用乙炔还原法测定根瘤固氮酶活[13].
1.7 qRT-PCR检测基因的表达量
将活化的野生型菌株RL3841接种到50 mL AMS液体培养基中,每种菌3个重复,置于30 ℃、200 r/min的摇床中培养至对数期[D(600 nm)=0.3~0.6],离心收集菌体并用无菌水清洗后,用0.5 mmol/L H2O2处理1 h,以生理盐水处理1 h的RL3841菌株作为对照组,总RNA的提取采用Trizol法,再利用反转录试剂盒将RNA反转录成cDNA,对cDNA模板进行荧光定量PCR.相关抗氧化基因引物见表1,gyrB1为内参基因.
将野生型RL3841菌株接种豌豆植株,分别于接种10 d和25 d后采集豌豆根瘤.根瘤经液氮速冻后研磨成粉末状,类菌体RNA的提取以及cDNA的制备方法与细菌RNA制备方法相同.进行类菌体中相关抗氧化基因表达分析时,以AMS培养的对数期野生型菌株为对照.
2 结果与分析
2.1 豌豆根瘤菌OsmC基因突变株的构建
按照突变体构建的方法,在添加有Str、Neo的平板上筛选出来的单菌落,用MOsmC/OsmC 上游引物成功扩增出约650 bp的目标片段,获得OsmC基因突变株RLOsmC.
2.2OsmC基因突变对菌株生长的影响
2.2.1OsmC基因突变对菌株正常生长的影响
将突变菌株RLOsmC和野生型菌株RL3841按终浓度D(600 nm)为0.01接种于AMS液体培养基中,摇床培养,每隔6 h取样测D(600 nm)值,并绘制生长曲线见图1.由图1可知:突变株RLOsmC与野生型菌株RL3841的生长状况无很大差异,表明OsmC基因突变不影响豌豆根瘤菌的正常生长.
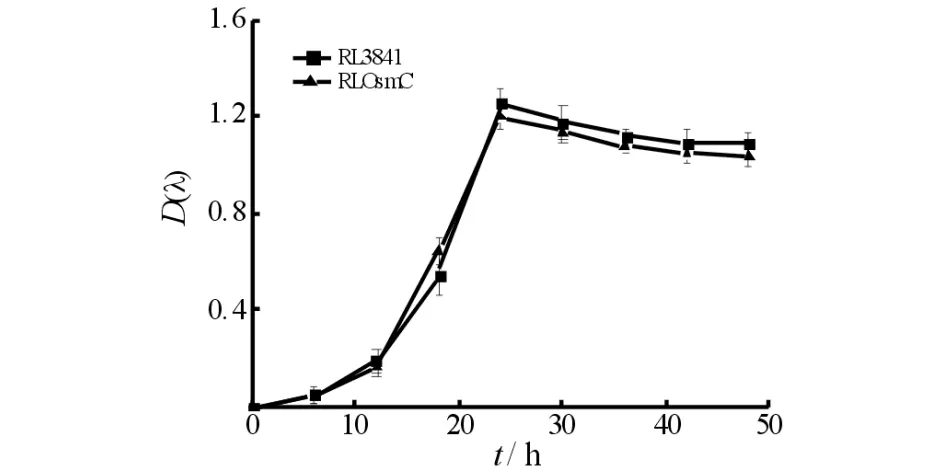
图1 自生条件下RL3841和RLOsmC的生长情况Fig.1 Growth conditions of RL3841 and RLOsmC in free-living condition
2.2.2OsmC基因突变对菌株抗无机氧化物H2O2的影响
抑菌圈实验研究了不同浓度H2O2对突变株RLOsmC和野生株RL3841的抑菌能力,结果见表2.如表2所示:当H2O2浓度分别为20,100,500 mmol/L时,RLOsmC菌株的抑菌圈直径分别为2.40, 3.8, 5.93 cm,均显著大于野生型的抑菌圈直径,说明OsmC基因突变会严重影响豌豆根瘤菌抗无机氧化物H2O2的能力.

表2 不同浓度H2O2对突变株RLOsmC和野生株RL3841的抑菌能力的比较
注:*与野生株Rl3841相比,p<0.05
2.2.3OsmC基因突变对菌株抗有机过氧化物的影响
有机过氧化物 CuOOH对RL3841和RLOsmC的抑菌能力结果如表3所示.表3中当CuOOH浓度在较低的5,20 mmol/L时,突变株RLOsmC的抑菌圈直径分别为1.87, 2.30 cm,显著大于野生型菌株RL3841 的抑菌圈直径;而当CuOOH浓度在较高的100, 500 mmol/L时,突变株RLOsmC和野生型菌株RL3841的抑菌圈直径无显著性差异,说明OsmC基因突变会影响豌豆根瘤菌抗低浓度有机氧化物CuOOH的能力,但对高浓度有机氧化物CuOOH的抗性无影响.

表3 不同浓度有机过氧化物 CuOOH对RL3841和RLOsmC的抑菌能力的比较
注:*与野生株Rl3841相比,p<0.05
2.3 突变菌株RLOsmC接种根瘤的固氮酶活
盆栽3周后,突变株RLOsmC接种豌豆植株形成红色有效根瘤,而且与野生型RL3841相比,突变株形成根瘤数无显著差异,结果见表4.进一步利用乙炔还原法测定固氮酶活,结果表明:与野生型菌株RL3841相比,突变株RLOsmC形成根瘤的固氮酶活降低了18.3%.

表4 突变株RLOsmC和野生株RL3841的共生性能的比较Tab.4 Comparision of symbiotic performance between RLOsmC and RL3841
注:*与野生株Rl3841相比,p<0.05
2.4 荧光定量RT-PCR分析OsmC基因的表达
将清洗后的野生型RL3841经0.5 mM H2O2处理1 h,以生理盐水处理1 h作对照,提取菌体RNA,反转录成cDNA后,进行荧光定量PCR,结果见图2.经2-ΔΔCt计算,发现用0.5 mM H2O2处理1 h的野生菌RL3841中OsmC基因的表达量为未处理的表达量的(1.27±0.36)倍,尚未达到2倍的显著差异水平.OsmC基因在接种25 d根瘤类菌体中表达量为在自生条件下的(0.32±0.13)倍,表达量显著降低.OsmC基因在形成7 d根瘤类菌体中的表达已有相关报道,其表达量为在自生条件下的(9.25±0.01)倍[14],表明OsmC基因在根瘤形成早期表达显著上调.

* p<0.05,control:对数期RL3841中OsmC基因的表达量; A) 0.5 mmol/L H2O2; B) 7 d类菌体;C) 25 d类菌体图2 OsmC基因在H2O2胁迫条件下与在类菌体中的相对表达量Fig.2 Relative expression of OsmC under the stress of H2O2 and in the bacteroid growth
3 讨论

本研究证实了OsmC基因突变对根瘤菌RL3841的自生生长无影响,但当H2O2浓度为20, 100, 500 mmol/L时,OsmC基因突变株的抗氧化能力均显著低于野生菌RL3841,说明OsmC基因突变会严重影响豌豆根瘤菌抗无机氧化物H2O2的能力;且OsmC基因突变会影响豌豆根瘤菌抗低浓度有机氧化物CuOOH的能力. Lesniak等[4]发现E.coli的渗透诱导蛋白OsmC对无机氧化物和有机氧化物都具有过氧化物酶活性,且与有机过氧化物还原酶一样,OsmC也是直接通过半胱氨酸的巯基反应使氢过氧化物还原.
盆栽实验表明,与野生型RL3841相比,突变菌株RLOsmC虽未影响豌豆宿主的结瘤数量,但会显著降低植株根瘤的固氮酶活.定量RT-PCR进一步发现OsmC基因在接种7 d的根瘤表达显著上调.根瘤菌OsmC基因缺失对固氮酶活的影响尚未见报道,但OsmC有机过氧化物酶和Ohr是结构和功能同源的蛋白[15],田梦洋等[8]研究发现豌豆根瘤菌ohrB基因突变会降低菌株的竞争结瘤能力,在接种7 d的根瘤类菌体中ohrB基因的表达量为自由生长的(5.59±0.04)倍,说明OsmC与Ohr一样,在根瘤形成阶段发挥重要作用.
[1] Udvardi M, Poole P S. Transport and metabolism in legume-rhizobia symbioses[J]. Annu Rev Plant Biol, 2013, 64(1): 781-805.
[2] Fontenelle C, Blanco C, Arrieta M, et al. Resistance to organic hydroperoxides requiresohrandohrRgenes inSinorhizobiummeliloti[J]. BMC Microbiol, 2011, 11(1): 100.
[3] Atichartpongkul S, Loprasert S, Vattanaviboon P, et al. Bacterial Ohr and OsmC paralogues define two protein families with distinct functions and patterns of expression [J]. Microbiolog,2001,147(Pt 7): 1775-1782.
[4] Lesniak J, Barton WA, Nikolov D B. Structural and functional features of theEscherichiacolihydroperoxideresistance protein OsmC [J]. Protein Sci, 2003, 12(12): 2838-2843.
[5] Hop H T,Reyes A W,Simborio H L,et al. Immunization of mice with recombinantBrucellaabortusorganic hydroperoxide resistance (Ohr) protein protects against a virulentBrucellaabortus544 infection [J]. J Microbiol Biotechnol,2016,26(1):190-196.
[6] Chuchue T,Tanboon W,Prapagdee B,et al. ohrR and ohr are the primary sensor/regulator and protective genes against organic hydroperoxide stress inAgrobacteriumtumefaciens[J]. J Bacteriol,2006,188(3): 842-851.
[7] Klomsiri C,Panmanee W,Dharmsthiti S,et al. Novel roles of ohrR-ohr inXanthomonassensing,metabolism,and physiological adaptive response to lipid hydroperoxide[J]. J Bacteriol,2005,187(9): 3277-3281.
[8] 田梦洋,何冬兰,李晓华,等. 豌豆根瘤菌ohrB基因的抗氧化和共生固氮表型[J]. 华中农业大学学报,2016(3):54-60.
[9] Caswell C C,Baumgartner J E,Martin D W. Characterization of the organic hydroperoxide resistance system ofBrucellaabortus2308 [J]. J Bacteriol,2012,194(18):5065-5072.
[10] 周艳琳,何冬兰,李晓华,等.katG基因在豌豆根瘤菌抗氧化中的功能[J]. 微生物学报,2015,55(7):843-850.
[11] Poole P S,Blyth A,Reid C J,et al. Myo-Inositol catabolism and catabolite regulation inRhizobiumleguminosarumbv. viciae[J]. Microbiology,1994,140(10): 2787-2795.
[12] Karunakaran R,Ramachandran V K,Seaman J C,et al. Transcriptomic analysis ofRhizobiumleguminosarumbv. viciae in symbiosis with host plantsPisumsativumandViciacracca[J]. Bacteriol,2009,191(12): 4002-4014.
[13] 程国军,周俊初,李友国. 华癸中生根瘤菌脂多糖突变株的共生能力[J]. 中南民族大学学报(自然科学版),2008,27(2):11-13.
[14] Si M,Wang J,Xiao X,et al. Ohr protectsCorynebacteriumglutamicumagainst organic hydroperoxide induced oxidative stres.[J]. Plos One,2015,10(6):e0131634 .
[15] Domingos R M,Meireles D D A,Neto J F D S,et al. Structural and biochemical comparative analysis among Cys-Based Ohr/OsmC protein family: insights on their high reactivity towards hydroperoxides[J]. Free Radical Bio Med,2014,76:S156-S157.
Antioxidative and Symbiosis Function ofOsmCgene inRhizobiumleguminosarum
ChengGuojun,PengYang,YinJie,TianMengyang
(College of Life Science, South-Central University for Nationlities, Wuhan 430074, China)
To study the antioxidative and symbiosis nitrogen fixation function ofOsmCgene inRhizobiumleguminosarum,OsmCmutant RLOsmC was constructed by homologous recombination. The results indicated that mutation ofOsmCgene had no effect on the self-growth ability ofRhizobiumleguminosarum, but it was significantly sensitive to both H2O2and cumene hydroperoxyde (CuOOH) with low concention. Red effective nodules could be formed when mutant strains RLOsmC infected host peas, but the capacity of nitrogenase was reduced by 18.3%.OsmCgene expression could not be induced by H2O2, while its expression was markedly increased in 7 d nodule bacteroids. Overall, it was revealed that rhizobialOsmCgene played an important role in symbiotic and antioxidative function.
Rhizobiumleguminosarum;OsmCgene; antioxidative function; symbiosis function; real-time RT-PCR
2016-07-13
程国军(1976-), 教授, 博士, 研究方向:环境微生物学, E-mail: chengguojun@mail.scuec.edu.cn
湖北省自然科学基金资助项目(2014CFB914);中央高校基本科研业务费专项(CZW15112)
Q935
A
1672-4321(2017)02-0025-05
