羟丙基-β-环糊精包合香荚兰浸膏及增溶特性分析
2020-08-24徐飞李俄艳曲鹏谷风林张彦军王少曼
徐飞,李俄艳,曲鹏,谷风林,张彦军,*,王少曼
(1.中国热带农业科学院香料饮料研究所,海南万宁571533;2.国家重要热带作物工程技术研究中心,海南万宁 571533;3.海南省热带香料饮料作物工程技术研究中心,海南万宁571533;4.云南农业大学热带作物学院,云南普洱665000)
香荚兰浸膏是发酵后的香荚兰豆荚(Vanilla planifolia Andrews)经有机溶剂浸提后,浓缩回收溶剂所得产物,为黏稠的棕褐色[1]。由于其沁人心脾的奶油清香及多种药理活性,与香荚兰豆荚一样,具有补肾、健胃、健脾、强心等作用[2]。因此广泛应用于食品、化妆品及医疗等领域[3]。但由于香荚兰浸膏化学成分复杂、贮存及使用过程中易于挥发、氧化变质。这些问题限制了香荚兰浸膏的进一步工业化应用。目前,浸膏仅仅是简单的粗提物在食品、化妆品等领域使用,采用包合材料对香荚兰浸膏进行包合,不仅可以提高其水溶性,也可通过隔绝外界环境而提高其生物利用度及稳定性。常用的包合材料是β-环糊精(β-cyclodextrin,β-CD),但β-CD由于产生分子内氢键而溶解度较小,对难溶性物质的增溶能力有限,加之刺激性较大。羟丙基-β-环糊精(hydroxypropyl-β-Cyclodextrin,HP-β-CD)是β-CD的羟丙基衍生物,有效克服了分子内氢键的形成而具有良好的溶解度和安全性,已成为难溶性物质增溶的主要包合材料[4],也是美国食品药品监督管理局(US Food and Drug Administration)批准的第一个可用于静脉注射的包合材料。
HP-β-CD在客体包合物的增溶性及改善药物的生物利用率方面具有较多研究。杨云汉等[5]制备长春胺(vincamine,VIN)与羟丙基-β-环糊精(HP-β-CD)的包合物(VIN/HP-β-CD),发现 VIN 与 HP-β-CD 形成包合物后,水溶性和热稳定性得到显著提高,疏水作用、氢键作用和范德华力为包合物形成的主要驱动力。Li-Juan Yang等[6]制备巴西木素/HP-β-CD包合物,并分子模拟演示巴西木素/HP-β-CD复杂的模型。结果表明巴西木素的稳定性得到了较大提高。Matshetshe K I等[7]研究利用β-环糊精/改性壳聚糖对肉桂精油进行有效封装系统制备得到纳米粒子,结果显示,双体系的总肉桂精油(cinnamon essential oil,CEO)释放量为71%,而负载CEO的壳聚糖纳米颗粒单体系的总CEO释放量为49%。释放机制遵循Fickian行为而CEO释放分析显示持续和控制释放了120 h。但在浸膏包合方面的研究较少,裴会娜等[8]以β-CD、HP-β-CD为主体,叶黄素浸膏中的多组分为客体,探索出一种多组分包合技术,以改善叶黄素浸膏的溶解性及稳定性,改进叶黄素浸膏的制剂性能。而香荚兰浸膏包合物及增溶特性研究未见报道。
本研究将采用搅拌法、研磨法及喷雾干燥法制备香荚兰浸膏与HP-β-CD包合物,分析包合物得率、包合率、对包合物进行性能表征、微观结构分析,探究香荚兰浸膏与HP-β-CD的包合效果及增溶特性。为研究香荚兰浸膏的进一步利用提供理论支撑。
1 材料与方法
1.1 材料与试剂
香荚兰浸膏:中国热带农业科学院香料饮料研究所自制;2-羟丙基-β-环糊精(2-HP-β-CD):江苏泰兴一鸣化工厂;无水乙醇(分析纯):国药集团化学试剂有限公司;石油醚、乙醚、二氯甲烷、乙酸乙酯、丙酮(分析纯):西陇科学股份有限公司;甲醇(色谱纯)、冰乙酸(分析纯):阿拉丁公司;香兰素标准品:Sigma公司。
1.2 仪器与设备
UV-2450型紫外可见分光光度计:日本岛津公司;Malvern Panalytical 3000粒径分析仪:马尔文帕纳科(中国)上海思百吉仪器系统有限公司;B-290喷雾干燥仪、R-215旋转蒸发仪:瑞士Buchi有限公司;LXJIIB离心机:上海安亭科学仪器厂;Nicolet 6700傅里叶红外光谱:Thermo fisher公司;1260高效液相色谱仪:美国安捷伦公司;cp213电子分析天平:奥豪斯仪器(常州)有限公司;HJ-6A多头磁力加热搅拌器:常州国华电器有限公司;JDG-0.2真空冻干机:兰州科近真空冻干有限公司;SHZ-B水浴恒温振荡器:上海博迅医疗生物仪器股份有限公司;SB-5200DT超声清洗机:宁波新芝生物科技股份有限公司;GYB 40-10S均质机:上海东华高压均质机厂;Phenom Phenom ProX台式显微能谱一体机:复纳科学仪器(上海)有限公司。
1.3 方法
1.3.1 HP-β-CD与香荚兰浸膏包合物制备
搅拌法:参照范高福等[9]方法略做修改,称取HP-β-CD 21.0 g于烧杯中,按HP-β-CD和水比例为1∶7(质量比)加水溶解,继续称取香荚兰浸膏2.1 g放入HP-β-CD的水溶液中,在40℃下恒温搅拌4 h,缓慢冷却至室温(25±2)℃继续搅拌5 h,静置,取出,放入4℃冰箱保存,用适宜的微孔滤膜过滤取滤液,将滤液真空冷冻干燥,即可得包合物。
研磨法:参照范高福等[9]方法略做修改,称取HP-β-CD 21.0 g于研钵中,加适量的超纯水研磨至糊状,再继续称取香荚兰浸膏2.1 g放入HP-β-CD的研钵中充分研磨1 h后,真空冷冻干燥,即可得包合物。
喷雾干燥法:参照文献[10]方法,按质量比为1∶8称取香荚兰浸膏和HP-β-CD适量,浸膏与乙醇比例为1∶1(质量比)溶解,HP-β-CD与水比例为 1∶20(质量比)溶解,待两溶液完全溶解后混合均质3 min,用0.45 μm微孔滤膜过滤后喷雾干燥。喷雾干燥条件:进料口温度160℃,出料口温度80℃,抽气速度100%,流量2.5 mL/min,蠕动泵设置12%,压缩空气流量500 L/h。
HP-β-CD与香荚兰浸膏混合物制备:精密称取HP-β-CD 7.0 g,香荚兰浸膏0.7 g,放于研钵中搅拌混匀30 s,即得HP-β-CD/香荚兰浸膏物理混合物。
包合物得率公式如下:

1.3.2 HP-β-CD与香荚兰浸膏中油脂包合率分析
表面油含量测定:分别称取包合物2.0 g于4个烧杯中,再向烧杯中分别加入10 mL的石油醚、乙酸乙酯、二氯甲烷、丙酮,用超声振荡处理20 min,然后将滤液过滤至恒重瓶中并蒸发至再次保持恒重。
总油含量测定:参照朱红梅[10]的碱性乙醚萃取法稍作修改,将1.25 mL氨溶液加入10 mL样品溶液中,充分混合后加入10 mL乙醇,然后摇动3 min~5 min至完全混合,将其放入50℃的水浴中保持5 min。冷却后加入25 mL乙醚溶液,随后振动5 min,静置30 min,重复萃取2次~3次后收集有机层。

式中:m为称取样品的质量,g;m1为恒重瓶的质量,g;m2为恒重瓶加滤液干燥后的质量,g。

1.3.3 HP-β-CD与香荚兰浸膏包合物表征
称取一定量的香荚兰浸膏、HP-β-CD、包合物、物理混合物。用红外光谱法表征包合效果。以上样品在红外灯下干燥3 h,采用压片法将待测样品和KBr混合并研磨成粉末,在制片模具中压成薄片,再将其放入样品槽测定红外吸收光谱。香荚兰浸膏先用电热鼓风干燥箱烘干后,取适量与KBr粉末研磨,压片、测定。
1.3.4 包合物的粒径分析
分别对HP-β-CD、包合物、物理混合物进行样品粒度分析。使用Malvern Panalytical 3000 Aeros干法测试,颗粒类型为非球型,测量持续时间(背景测量10 s、样品测量持续时间15 s),测量遮光度范围(上限6%,下限0.5%)、气压0.25 MPa,进样速度50%。
1.3.5 HP-β-CD及香荚兰浸膏包合物微观结构分析
利用扫描电镜分别对HP-β-CD、包合物、物理混合物观察样品微观结构。样品置于具有导电胶的样品台上,氮气吹10 s后喷金60 s。进行扫描电镜观察。
1.3.6 包合物溶解度分析
参照邹金凤[11]方法略做修改,分别取香荚兰浸膏及包合物各5.0 g加50 mL蒸馏水溶解,在(37±1)℃恒温加热搅拌40 min,在4 000 r/min下离心15 min,将上清液倒入预先准确称重过的玻璃皿中,于100℃下烘干,准确称重,按公式计算其溶解度。公式如下:
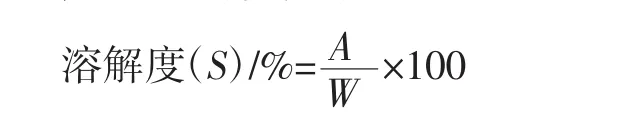
式中:A为上清液烘干至恒重后的质量,g;W为绝干样品的质量,g。
1.3.7 HP-β-CD对香荚兰浸膏的增溶试验
1.3.7.1 色谱条件
参照刘双双等[12]方法略作改动,色谱柱:Agilent ZORBAX XDB-C18 柱(5 μm,4.6 mm×150 mm);流动相:甲醇 ∶0.5%冰乙酸(体积分数)=20∶80;流速:1.0 mL/min;柱温:26 ℃;进样量:3 μL;检测波长:280 nm;灵敏度:0.01 AUFS。外标法峰面积定量。
1.3.7.2 标准溶液的配制
准确称取香兰素标准品100 mg于100 mL容量瓶中,溶液用甲醇-0.5%冰乙酸(50∶50,体积比)混合液溶解并定容,质量浓度为1 000 mg/L的香兰素标准液,从中分别吸取香兰素标准液 4.00、5.00、6.00、7.00、8.00、9.00、10.00 mL于7个50 mL容量瓶中定容,分别配置浓度 80、100、120、140、160、180、200 mg/L 的香兰素标准溶液,进样量3 μL。
1.3.7.3 增溶试验分析
参照库德热提·阿吉等[13]方法略作修改,分别称取HP-β-CD 0、5、10、15、20、30、40、50 g,加入 100 mL 水中,制备不同质量浓度的HP-β-CD水溶液。取上述溶液10 mL,加入2 mL香荚兰浸膏,密封,超声1 h后,置于45℃恒温水浴锅内振荡24 h,取下层清液,用0.45 μm 微孔滤膜过滤,取续滤液,备用。按“1.3.7.1”项下色谱条件进样测定,计算香兰素浓度和增溶倍数(增溶倍数=包合后溶液中香兰素的浓度/包合前溶液中香兰素的浓度)。
1.4 统计分析
所有试验重复3次进行,以减少试验误差;数据以平均值±标准差的方式显示;使用SPSS 19.0软件处理进行显著性分析,p<0.05表明差异显著;使用origin 2018软件绘制图形。
2 结果与分析
2.1 香荚兰浸膏包合物的制备
香荚兰浸膏包合物制备采用搅拌法、研磨法和喷雾干燥法3种方法,以得率、感官以及包合率为指标,香荚兰浸膏是复杂的化合物,具有亲油性的成分,也具有亲水性的成分,经过HP-β-CD包合后以不同极性的有机溶剂(丙酮、乙酸乙酯、石油醚、二氯甲烷)萃取表面未被包合的物质,以总油含量作为包合油脂类物质的总量。香荚兰浸膏、HP-β-CD、混合物及3种制备方法下得到包合物见图1,研磨法下包合物(YM包合物)、搅拌法下包合物(JB包合物)、喷雾干燥法下包合物(PW包合物)。包合物得率见表1。

图1 不同制备方法下包合物Fig.1 Inclusion compounds under different preparation methods

表1 不同制备方法的包合物得率Table 1 Yields of inclusion compounds by different preparation methods
图1可见不同制备方法下的包合物感官特性具有较大区别,香荚兰浸膏为黑褐色或者棕褐色,色泽较深,而HP-β-CD为纯白色,当两者混合物直接冻干后发现颜色为土黄色。研磨法得到的包合物为棕色、搅拌法得到包合物为浅黄色,如果香荚兰浸膏被包合后,HP-β-CD中的空腔能全部或者部分包合住浸膏,形成均一超分子体系,呈现的是HP-β-CD的纯白色或者乳白色。说明这几种方法下制备得到的包合物不能很好的把香荚兰浸膏包合形成超分子体系,呈现的仍然是浸膏的色泽。而吴秋燕等[14]用β-环糊精/羟丙基-β-环糊精混合研磨法能较好的包合叶黄素浸膏,这可能是由于包合壁材与浸膏性质不同的原因。喷雾干燥方法下得到包合物为乳黄色,说明喷雾干燥法已使得香荚兰浸膏与HP-β-CD形成超分子体系,较好把香荚兰浸膏包合。而感官风味也验证了这一包合效果,香荚兰浸膏为清甜、豆香、香气浓郁,在混合物、研磨法、搅拌法下得到的包合物还能闻到香荚兰浸膏的清甜、豆香味。喷雾干燥法下闻到的是2-HP-β-CD的无臭、味微甜味道,说明喷雾干燥法很好的把香荚兰浸膏包合到2-HP-β-CD的空腔中。通过表1可知,3种方法制备得到包合物得率:搅拌法>研磨法>喷雾干燥法。喷雾干燥法得到的包合物得率不高,但是结合图1分析得到喷雾干燥法得到的包合物品质最好。3种制备方法通过不同极性的有机溶剂萃取表面未被包合的物质后得到包合物的包合率见图2。

图2 不同极性有机溶剂萃取表面油后浸膏中油脂的包合率Fig.2 Inclusion rate of grease in extracts after extraction of surface oil with different polar organic solvents
图2可知搅拌法在丙酮、乙酸乙酯、二氯甲烷、石油醚4种不同有机溶剂萃取表面油后浸膏中油脂的包合率分别为79.35%、90.17%、94.26%、97.53%;研磨法在丙酮、乙酸乙酯、二氯甲烷、石油醚4种不同有机溶剂萃取表面油后浸膏中油脂的包合率分别为84.20%、83.00%、87.02%、89.40%;喷雾干燥法在丙酮、乙酸乙酯、二氯甲烷、石油醚4种不同有机溶剂萃取表面油后浸膏中油脂的包合率分别为68.57%、95.95%、95.84%、98.03%。由于浸膏是复杂的化合物,因此部分成分未被包合,与刘双双等[15]采用辛烯基琥珀酸淀粉钠包埋香草兰精油相比,精油成分相对单一,因此产率相比浸膏较高,油脂包埋率变化不大。石油醚萃取表面油后在3种方法中所测的包合率均为最高,4种有机溶剂的极性分别为丙酮>乙酸乙酯>二氯甲烷>石油醚,说明石油醚萃取得到的未被包合的表面物质较少,大部分的极性油脂已被包合。包合率是包合物制备工艺中重要指标。3种制备方法得到的包合物显示喷雾干燥法制备得到包合物的包合率是最高的。综上所述,喷雾干燥法虽得率较低,但包合物的色泽及包合率均表现为最佳,所以喷雾干燥法为最佳的制备包合物的方法。
2.2 香荚兰浸膏包合物的表征
分别把香荚兰浸膏、HP-β-CD、香荚兰浸膏/HP-β-CD物理混合物、PW包合物(选择最佳制备方法下包合物)采用压片法将待测样品和KBr混合并研磨成粉末,在制片模具中压成薄片,再将其放入样品槽测定红外吸收光谱。光谱范围4 000 cm-1~400 cm-1,分辨率为4.00 cm-1,扫描次数为64次见图3。
图3 不同制备方法下IR图Fig.3 IR diagram under different preparation methods
如图3所示,在香荚兰浸膏的红外图谱a中在3 421.10、2 923.55、2 854.13 cm-1附近存在 3 个分别归属于O-H键、C-N键、饱和C-H键的伸缩振动引起的特征吸收峰,在2 400 cm-1~800 cm-1处无明显特征吸收峰。HP-β-CD b 在 3 874.29 cm-1~3 037.33 cm-1范围处的吸收峰归因于O-H键的伸缩振动,且-CH和-CH2中的C-H伸缩振动吸收带位于3 037.33 cm-1~2 830.99 cm-1,而在 2 400 cm-1~800 cm-1处其与香荚兰浸膏图谱差异明显。物理混合物c的红外谱图是香荚兰浸膏图谱与HP-β-CD图谱的简单叠加,香荚兰浸膏图谱的C-N键、饱和C-H键吸收峰减弱。香荚兰浸膏被HP-β-CD包裹后形成的PW包合物d,而PW包合物中香荚兰浸膏的O-H键特征吸收峰发生明显偏移,与HP-β-CD图谱的O-H键特征吸收峰基本重合,PW包合物中香荚兰浸膏的C-N键、饱和C-H键吸收峰消失,PW包合物图谱中2 400 cm-1~800 cm-1处显示为HP-β-CD的图谱的特征吸收峰,说明PW包合物图谱主要显示为HP-β-CD的骨架结构。香荚兰浸膏与HP-β-CD包合前后红外吸收光谱的变化,说明了客体香荚兰浸膏与主体HP-β-CD发生反应进而形成了包合物。
2.3 香荚兰浸膏包合物的粒径分析
分别对HP-β-CD、包合物、物理混合物进行样品粒径分析,分析结果见表2及图4。
香荚兰浸膏经过不同制备方法得到包合物后发现喷雾干燥下粒径最小,表2所见50%以下都是8.74 μm。与朱红梅等[16]文献中比较,朱红梅利用4种不同壁材制备香草兰精油微胶囊,粒径最高为600 nm,最低为200 nm,这可能是壁材不同且精油中主要成分均为脂肪酸,容易形成较为均一的超分子体系,而浸膏中有酯类、醇类、酚类、酸类、酮类等化合物[17],化学成分较为复杂,形成的超分子体系不均匀。图4可见,各制备方法下包合物粒径为:混合物>研磨>搅拌>环糊精>喷雾干燥,说明喷雾干燥下包合物粒径最小。
2.4 HP-β-CD及香荚兰浸膏包合物微观结构分析
利用台式显微能谱一体机分别对HP-β-CD、包合物(YM、JB、PW)、物理混合物观察样品微观结构。各样品微观结构图见图5。

表2 不同制备方法下包合物粒径分析Table 2 Particle size analysis of inclusion compounds under different preparation methods μm

图4 不同制备方法下包合物粒径分布图Fig.4 Particle size distribution of inclusion complexes under different preparation methods

图5 不同制备方法下包合物微观结构Fig.5 Microstructure of inclusion complex under different preparation methods
由图5可知,几种方法对比下,喷雾干燥法得到的包合物效果较好,而研磨法,搅拌法已破坏了原有HP-β-CD结构。
2.5 香荚兰浸膏及包合物的溶解度分析
选择品质较好的喷雾干燥方法制备得到的香荚兰浸膏包合物(PW包合物)及香荚兰浸膏分析其溶解度结果见表3。

表3 香荚兰浸膏及包合物溶解度分析Table 3 Solubility analysis of vanilla concentrate and inclusion compounds
在称取相同样品量及加入相同的溶剂条件下,香荚兰浸膏的溶解度为5.12%,而包合物的溶解度达93.38%,溶解度增加了18.24倍,说明HP-β-CD的溶解效果较好,能较好的增加香荚兰浸膏的溶解度。
2.6 香荚兰浸膏增溶倍数分析
2.6.1 香兰素标准曲线绘制
香荚兰浸膏中已鉴定出匹配度90以上的挥发性成分62种,分别为醛类、酯类、醇类、酚类等化合物,关键呈香物质是醛类,主要的香气成分为香兰素,香兰素(4-羟基-3-甲氧基苯甲醛)作为最主要且含量最高的香气物质,对香草兰整体香气(香草香气及浓郁的奶香)的贡献率高达1/3~1/2以上,是人们普遍喜爱的奶油香草香精的主要成分,也是香精香料工业中最大的品种[18]。图6为香兰素标准曲线,以香兰素标准品浓度为横坐标(x)、色谱峰面积为纵坐标(y),得回归方程及相关系数分别为:y=20.97x-25.91,R2=0.999 9。由回归方程及相关系数结果表明香兰素标准品浓度在80 mg/L~200 mg/L的范围内与色谱峰面积呈现良好的线性关系。
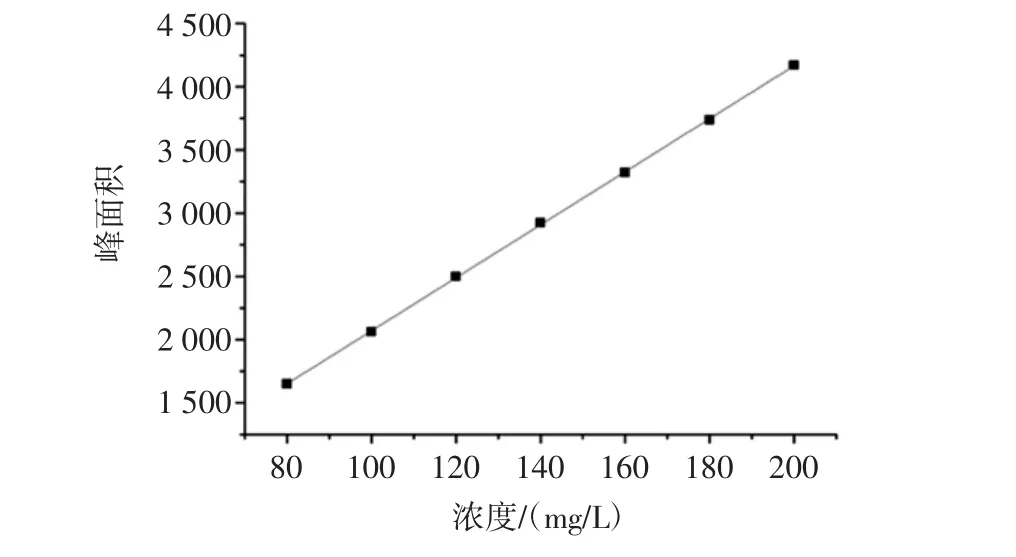
图6 香兰素标准曲线Fig.6 Vanillin standard curve
2.6.2 增溶倍数分析
张静姝等[19-20]研究表明HP-β-CD与其它药物具有较好的增溶作用,而香荚兰浸膏中的主要成分为香兰素,HP-β-CD与香荚兰浸膏包合后其总体的溶解度有显著的增加,但对其主要成分香兰素的包合效果及其增溶倍数不清晰,因此为了分析HP-β-CD与香荚兰浸膏包合后主要成分的增溶效果,在香荚兰浸膏中加入不同质量浓度的HP-β-CD后分析香荚兰浸膏中香兰素浓度和增溶倍数。HP-β-CD对香荚兰浸膏中香兰素具有一定的增溶作用,增溶效果呈现先增加后降低的趋势,30%的HP-β-CD水溶液可以增加浸膏中香兰素33%的溶解度,结果见表4。与库德热提·阿吉等[13]中50%的HP-β-CD水溶液可以提高桉油精溶解度7.6倍相比,HP-β-CD与浸膏包合后对香兰素增溶倍数相对较低,这可能是由于包合单一成分能较好提高其溶解度,而浸膏中成分相对较多。用HP-β-CD与香荚兰浸膏包合后,不能包合所有物质,但能有效提高香荚兰浸膏中有效成分的增溶性,对浸膏整体的溶解度、稳定性及提高浸膏的生物利用率具有一定意义。

表4 不同质量浓度的HP-β-CD后香荚兰浸膏中香兰素的浓度和增溶倍数Table 4 Concentration and solubation multiple of vanillin in vanilla concentrate after HP-β-Cd with different mass concentration
3 结论与讨论
采用搅拌法、研磨法和喷雾干燥法3种方法对香荚兰浸膏/HP-β-CD包合物进行制备,以感官品质、包合物得率、不同极性有机溶剂萃取表面油(化合物)后包合率为指标,筛选得到最佳制备包合物的方法为喷雾干燥法,包合物得率为62.53%,浸膏中油脂包合率为98.03%。利用红外光谱法对香荚兰浸膏包合物进行表征,分析了包合前后样品粒径及微观结构,结果发现主体、客体、主-客包合物和主-客体物理混合物之间在结构性质与微观形貌上均存在着显著差异,这些差异揭示了包合物的形成。对香荚兰浸膏和包合物的溶解度进行研究,发现包合物的溶解度远高于香荚兰浸膏的溶解度,说明HP-β-CD/香荚兰浸膏形成包合物后具有较好的溶解特性。同时以香荚兰浸膏中的主要有效成分香兰素为指标,通过高效液相色谱法分析形成HP-β-CD/香荚兰浸膏包合物后对其增溶效果,结果发现HP-β-CD对香荚兰浸膏中香兰素的增溶效果呈现先增加后降低的现象,30%的HP-β-CD水溶液可以增加浸膏中香兰素33%的溶解度。
综上所述,本研究采用不同的方法对包合物的制备、包合作用及溶解性进行了研究,在试验范围内说明HP-β-CD对改善香荚兰浸膏的稳定性及溶解性具有一定的优势。主-客体包合模式将对今后超分子药物/食品的定量构效关系探讨提供理论参考。但是,由于香荚兰浸膏是一种复杂的混合物,HP-β-CD能对浸膏中的部分成分进行包合,但没有单一成分包合效果好,能有效提高香荚兰浸膏中有效成分的增溶性,对浸膏整体的溶解度、稳定性及提高浸膏的生物利用率具有一定理论意义。其生物利用率的有效提高还需要进一步对浸膏进行纯化后针对主要成分进行包合及临床服用量等进行研究。
