角蛋白高效降解菌Fea-10的筛选与鉴定
2017-06-28杨文翰刘亚勇贾良辉马怡茗
颜 华, 柯 欣,吴 佳, 杨文翰 ,刘亚勇,贾良辉,*,马怡茗,*
(1西北农林科技大学 生命科学学院,杨凌 712100; 2中国科学院 微生物研究所,北京100101)
角蛋白高效降解菌Fea-10的筛选与鉴定
颜 华1, 柯 欣1,吴 佳1, 杨文翰1,刘亚勇2,贾良辉1,*,马怡茗1,*
(1西北农林科技大学 生命科学学院,杨凌 712100; 2中国科学院 微生物研究所,北京100101)
采用透明圈和完整羽毛降解相结合的方法,从养鸡场长期堆积废羽毛中分离出了一株能高效降解羽毛角蛋白的菌株Fea-10. 经16S rDNA序列分析表明,Fea-10属于链霉菌属,与微白黄链霉菌的相似性达99.86%. 经形态、生理生化和系统发育树综合鉴定,命名为微白黄链霉菌Fea-10. Fea-10全基因组大小约为7.25 Mb,GC含量为73.36%,其含有丰富的次级代谢产物基因簇. 菌株Fea-10发酵培养36 h后角蛋白酶活性达到最高值,最佳培养温度为35 ℃.
角蛋白降解;微白黄链霉菌Fea-10;角蛋白酶;菌株筛选
角蛋白是一类在自然界中广泛存在的不可溶蛋白,是表皮、羽毛、羊毛、鱼鳞、头发、蹄以及指甲的主要组成部分. 角蛋白相当稳定且难降解,主要是由于角蛋白紧密交联的氢键、疏水作用以及二硫键的存在,这也使得它们不易被木瓜蛋白酶、胶原酶、胃蛋白酶和胰蛋白酶水解[1-3]. 但是,这些性质稳定的不可溶蛋白却可以被分泌角蛋白酶的特殊微生物降解[1-4].
目前已发现有许多微生物可以产生角蛋白酶,主要是细菌、真菌和放线菌[5-7]. 各种来源的角蛋白酶可广泛应用于医药、洗涤剂、化妆品、皮革和生物降解塑料制造等方面[4,5]. 有些角蛋白酶能够降解朊病毒,可以用来治疗朊病毒引起的疯牛病、羊搔痒病以及人类克雅氏病[6]. 许多角蛋白酶可以将羽毛转变为氨基酸和可溶蛋白,并代替食品谷物作为更加便宜的动物饲料[4,5,8]. 鉴于其广泛应用潜力,越来越多的研究着重于筛选活性更好、降解效率更高的角蛋白酶及其产生菌株.
本研究采用透明圈和完整羽毛降解相结合的方法,从养鸡场长期堆积废羽毛中分离出一株能高效降解羽毛角蛋白的菌株Fea-10. 通过对其进行分类鉴定,全基因组测序及其产酶特性的研究,为该菌株的进一步开发利用奠定基础.
1 材料与方法
1.1 主要材料、试剂及培养基
将鸡羽毛洗净,121 ℃高压灭菌20 min,然后80 ℃烘24 h,冷却后粉碎过100目筛,用于培养基制备和微生物发酵. 选择培养基:羽毛粉10 g、NaCl 0.5 g、K2HPO41 g、KH2PO40.4 g、琼脂20 g,补水至1000 mL.发酵培养基:羽毛粉10 g、NaCl 0.5 g、K2HPO40.7 g、KH2PO40.35 g,补水至1000 mL.种子培养基:牛肉膏 5 g、蛋白胨10 g、NaCl 0.5 g、K2HPO41 g、KH2PO40.4 g,补水至1000 mL.牛奶琼脂培养基:脱脂奶粉0.5%、琼脂粉2%,补水至1000 mL.
1.2 菌株的分离筛选
采集腐烂羽毛及其周围土壤,称取适当样品,梯度稀释后涂布于以羽毛粉为唯一碳氮源基础平板上,28 ℃倒置培养 3 d 左右,挑取有明显水解圈的菌落进行传代培养和驯化,将菌株富集培养,接种于仅含有完整羽毛的无菌生理盐水中摇瓶发酵,观察羽毛降解情况,筛选降解羽毛速度最快的菌株并命名为Fea-10[9-12].
1.3 菌落形态观察
将菌株Fea-10接种在羽毛培养基平板上,于28 ℃下恒温培养24~96 h. 肉眼观察菌落的形状、颜色、表面质地、透明度和菌落边缘.革兰氏染色后光学显微镜(LIOO JS-500)下观察菌体的形态. 28 ℃插片培养96 h后,固定制片后使用扫描电子显微镜(日本日立公司)观察菌体形态.
1.4 生理生化特征测定
参照《微生物分类学》和《伯杰氏细菌鉴定手册》进行菌株Fea-10生理生化特性的测定.
1.5 16S rDNA序列测定、系统发育分析及全基因组测序
提取总DNA作为PCR扩增的模板,以16S rDNA通用引物进行16S rDNA的扩增. 引物和PCR程序见文献[13,14]. PCR扩增产物胶回收后克隆至pMD18-T载体,转化E.coliDH5α,阳性克隆委托上海生工公司测序. 结果在GenBank以及EZbiocloud网站进行BLAST分析,用DNAMAN 6.0.3.99进行序列相似性分析,并通过Mega 5.0以Neighbour-Joining方法构建系统发育树,用Bootstrap(重复数为1000)进行检验. 提取Fea-10总DNA,对其进行全基因组测序(诺合致源公司)并用生物合成基因簇分析工具antiSMASH 3.0分析次级代谢产物基因簇.
1.6 菌株产角蛋白酶活性测定及产酶条件优化
1.6.1 粗酶液的制备
将角蛋白降解菌Fea-10种子液以5%(v/v)的接种量接于发酵培养基中,30 ℃、200 r/min下震荡培养3 d. 10000 r/min离心30 min,去除残余羽毛杂质,离心后上清经0.22 μm滤膜真空抽滤去除菌体和杂质得到滤液,加入饱和(NH4)2SO4溶液至产生沉淀,4 ℃静置过夜. 10000 r/min离心10 min,弃上清. 将沉淀溶于蒸馏水,得到粗酶液.
1.6.2 酶活力单位测定
10 mg羽毛粉与2 mL Tris-HCl (50 mmol/L,pH 8.5)混匀,加入1 mL粗酶液. 30 ℃反应1 h后加入10%三氯乙酸(TCA)终止反应;冰浴10 min,10000 r/min离心10 min,取上清,紫外分光光度计测定280 nm处吸光值. 对照组反映前即加入2 mL 10% TCA. 酶活定义:每1 mL酶液反应1 h后,A280每增加0.01为一个酶活单位.
1.6.3 最适产角蛋白酶条件优化
底物1%(w/v)羽毛,接种量5% (v/v),pH 7.5,30 ℃,200 r/min下震荡培养6、12、18、24、30、36、42、48和60 h,取粗酶液,测定无菌上清的角蛋白酶活性. 在此基础上,将培养温度分别设定为25、30、35、40、45、50、55和60 ℃,取培养36 h时的发酵液测定无菌上清的角蛋白酶活性. 在最适培养时间和温度条件下,培养基初始pH分别设定为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0,35 ℃培养36 h后,测定发酵液上清角蛋白酶活性.
2 结果与分析
2.1 Fea-10角蛋白降解效果观察
Fea-10有很强羽毛降解能力. 接种一定量的Fea-10菌体到100 mL含有1 g完整羽毛的羽毛培养基中,28 ℃恒温培养,3 d后1 g羽毛被完全降解(图1).
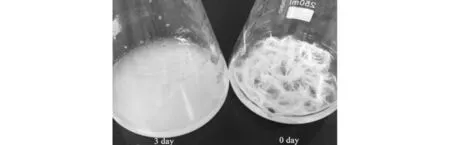
图1 Fea-10对整根羽毛的降解Fig.1 Degradation of intact chicken feathers by Fea-10
2.2 菌体形态特征和菌落形态特征
菌株Fea-10在富集培养基上28 ℃恒温培养24~96 h,菌落呈圆形,表面平坦,有白色孢子气丝. 幼龄菌落呈淡褐色,随着菌龄的增加菌落产生白色或淡黄色孢子. 菌株Fea-10在富集培养基上28 ℃恒温培养48 h,扫描电镜观察表明(图2):基丝呈暗黄色,直径约0.5~0.6 μm,无隔不断裂;气丝蛛网灰色,直径约0.6~0.7 μm,菌苔表面平坦;孢子丝钩状,顶端螺旋. 孢子呈短杆状,两端整齐,大小1.0~1.5 μm.

图2 Fea-10电子显微镜下的菌体形态Fig.2 Electron microscope photograph of Fea-10
2.3 菌株Fea-10生理生化特征
菌株Fea-10革兰氏呈阳性,能利用葡萄糖、阿拉伯糖、甘露醇及乳糖. 菌株Fea-10在不含NaCl的培养基中生长良好,可在含有7% NaCl的培养基中生长. 菌株Fea-10在pH 5.0~9.0范围内生长良好,说明菌株Fea-10的pH适应范围较广. 菌株Fea-10的生理生化特征见表1.
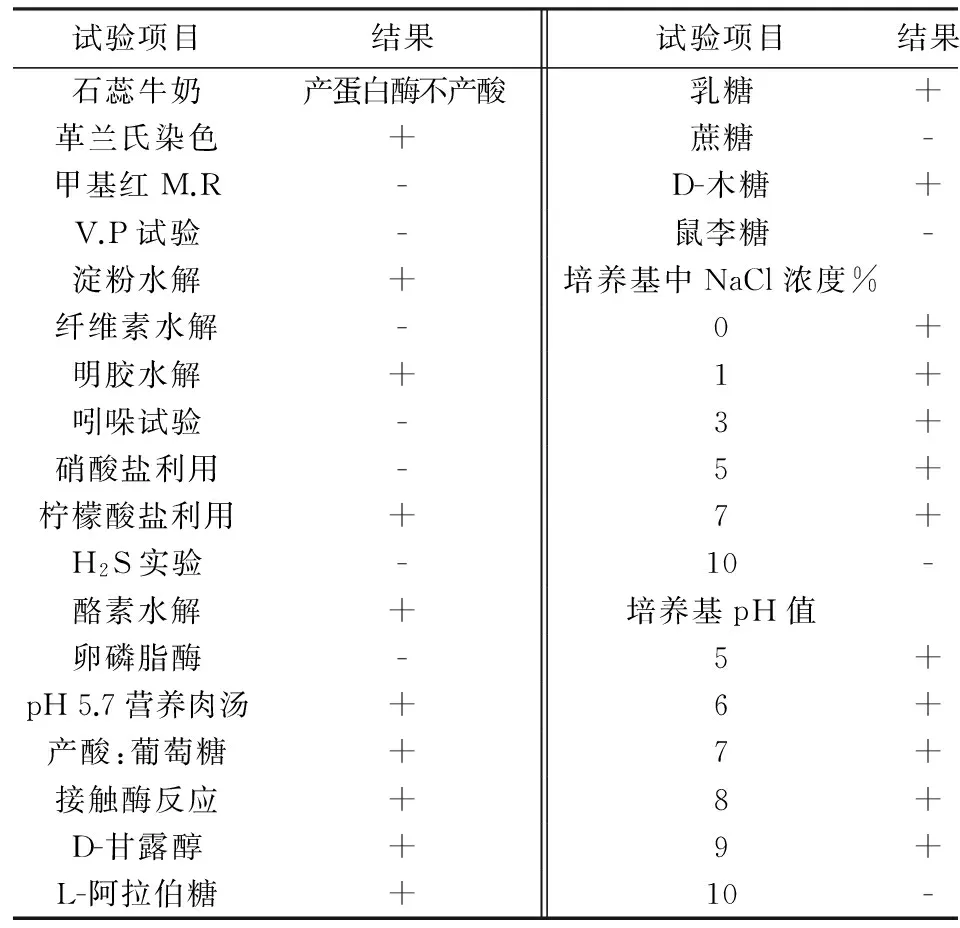
表1 菌株Fea-10的生理生化特征
注:"+"表示阳性反应;"-"表示阴性反应
2.4 16S rDNA PCR克隆和系统发育树
Fea-10的16S rDNA PCR扩增如图3.

图3 菌株Fea-10 16S rDNA PCR扩增Fig.3 16S rDNA PCR of Fea-10
根据16S rDNA测序结果,构建系统发育树(图4). 结果表明,该菌株与微白黄链霉菌(Streptomycesalbidoflavus)的相似性最高,达到99.86%,因此,综合形态学、生理生化鉴定结果,将菌株命名为微白黄链霉菌Fea-10(StreptomycesalbidoflavusFea-10).

图4 邻接法构建的菌株Fea-10 16S rDNA序列的系统发育树Fig.4 Phylogenetic neighbour-joining tree based on the 16S rDNA gene sequences of strain Fea-10
2.5 Fea-10全基因组草图测序与分析
采用Illumina Miseq高通量测序技术对菌株Fea-10全基因组草图进行测序. 测序数据使用SOAPdonovo软件进行组装. Fea-10全基因组大小约为7.25 Mb,GC含量为73.36%. 将Fea-10全基因组草图序列提交到antiSMASH网站,分析可能的次级代谢产物及抗生素生物合成基因簇,结果见表2.该菌株具有产生较为丰富的次级代谢产物资源的潜力,有较高的开发利用价值.

表2 Fea-10 全基因组序列antiSMASH分析结果
2.6 最适产角蛋白酶条件优化
发酵时间对角蛋白酶产量实验测定的结果表明,培养36 h后,该菌上清中酶活性达到最高值,其后趋于稳定(图5).

图5 发酵时间对角蛋白酶产量的影响Fig. 5 Effect of fermentation time on keratinase yield
在此基础上,取培养36 h,温度分别设定为25、30、35、40、45、50、55和60 ℃的发酵液测定无菌上清的角蛋白酶活性. 发现温度为35 ℃时,上清液中角蛋白酶活性最高(图6).

图6 培养温度对角蛋白酶产量的影响Fig. 6 Effect of temperature on keratinase yield
在最适培养时间和最适培养温度的条件下,测定培养基最适pH值结果表明,培养36 h后上清液中角蛋白酶活性显示,培养基初始pH为7.5时,角蛋白酶活性最高(图7).

图7 培养基初始pH对角蛋白酶产量的影响Fig.7 Effect of fermentationinitial pH on keratinase yield
5 讨论
许多细菌、真菌和放线菌都可以降解角蛋白. 其中放线菌越来越引起研究者的关注. 主要是由于放线菌可以产生丰富的次级代谢产物,可以抑制病原菌. 同时,放线菌的生活史有基质菌丝和气生菌丝阶段,这样的特点非常有助于侵入羽毛等硬质角蛋白,从而有助于角蛋白的完全降解. 真菌虽然也有侵染能力强的特点,但是真菌往往具有致病性,从而限制了其工业应用. 菌株Fea-10具有高效羽毛角蛋白降解能力,同时,对Fea-10的全基因组序列进行antiSMASH分析表明,该菌株具有26个潜在次级代谢产物生物合成基因簇. 我们对Fea-10抑菌活性进行检测发现,该菌株对苹果腐烂菌、小麦根腐菌及小麦赤霉菌均具有拮抗作用(结果未展示). 这些都表明Fea-10有很好的应用前景,值得进一步研究.
Fea-10的全基因组测序已经完成,这为设计引物,克隆角蛋白酶基因创造了有利条件. 通过生物信息学软件和基因组注释分析,结合ORF Finder、Blast、Multiple alignment等在线分析工具发现该基因组中存在着多个可能的角蛋白酶编码基因,有较好的理论和应用研究价值. 相关基因的异源表达工作将逐步展开.
[1] Kublanov I V, Perevalova A A, Slobodkina G B, et al. Biodiversity of thermophilic prokaryotes with hydrolytic activities in hot springs of Uzon Caldera, Kamchatka (Russia) [J]. Applied and Environmental Microbiology, 2009, 75(1): 286-291.
[2] Son H J, Park H C, Kim H S, et al. Nutritional regulation of keratinolytic activity inBacilluspumilis[J]. Biotechnology Letters, 2008, 30(3): 461-465.
[3] Suzuki Y, Tsujimoto Y, Matsui H, et al. Decomposition of extremely hard-to-degrade animal proteins by thermophilic bacteria [J]. Journal of Bioscience and Bioengineering, 2006, 102(2): 73-81.
[4] Macedo A J, da Silva W O, Gava R, et al. Novel keratinase fromBacillussubtilisS14 exhibiting remarkable dehairing capabilities [J]. Applied and Environmental Microbiology, 2005, 71(1): 594-596.
[5] Gupta R, Ramnani P. Microbial keratinases and their prospective applications: an overview [J]. Applied Microbiology and Biotechnology, 2006, 70(1): 21-33.
[6] Langeveld J P, Wang J J, Van de Wiel D F, et al. Enzymatic degradation of prion protein in brain stem from infected cattle and sheep [J]. The Journal of Infectious Diseases, 2003, 188(11): 1782-1789.
[7] Verma A, Singh H, Anwar S, et al. Microbial keratinases: industrial enzymes with waste management potential [J]. Critical Reviews in Biotechnology, 2017,37(4):476-491.
[8] Gupta R, Rajput R, Sharma R, et al. Biotechnological applications and prospective market of microbial keratinases [J]. Applied Microbiology and Biotechnology, 2013, 97(23): 9931-9940.
[9] 齐志国,张铁鹰,董杰丽,等. 角蛋白降解菌分离、鉴定及其降解机制研究[J]. 饲料工业,2012,(17):19-24.
[10] 聂康康. 一株高效羽毛角蛋白降解菌的分离鉴定、发酵试验及其角蛋白酶酶学性质研究[D].南京:南京农业大学,2009.
[11] 王 晶. 一株新的羽毛角蛋白降解菌的鉴定、研究与应用[D].上海:东华大学,2007.
[12] 刘志恒,姜成林.放线菌现代生物学与生物技术[M].北京:科学出版社,2004.
[13] 黄 艳. 厌氧角蛋白降解菌KD-1的系统发育分析及其角蛋白酶研究[D].北京:中国农业科学院,2013.
[14] 陈亚楠,黄 涛,唐中林,等.猪FOX03基因的多态性和生长性状关联分析[J].石河子大学学报(自然科学版),2016,34(2):154-157.
Isolation and Identification of a High Efficient Feather-Degrading Strain Fea-10
YanHua1,KeXin1,WuJia1,YangWenhan1,LiuYayong2,JiaLianghui1,MaYiming1
(1 College of Life Sciences, Northwest A&F University, Yangling 712100, China; 2 Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China)
A high efficient keratin-degrading strain (Fea-10) was isolated from decomposed feathers by combining the method of clearance zone diameter and complete feather degradation. 16S rDNA sequence similarity analysis showed that strain Fea-10 belonged to the genus Streptomyces with the highest sequence similarity toStreptomycesalbidoflavus. Combined with morphological, physiological characteristics and phylogenetic tree analysis, the strain was then designated asStreptomycesalbidoflavusFea-10. Strain Fea-10 had one linear chromosome of 7.25 Mb with a G + C content of 73.36%. Analysis of the genome sequence of Fea-10 revealed that it contained abundant secondary biosynthesis gene cluster. The keratinase activity reached to the maximum value after fermenting for 36 hours with an optimum culture temperature of 35 ℃.
Keratin-degrading;StreptomycesalbidoflavusFea-10; keratinase; strain screening
2017-03-28 *通讯作者 马怡茗,研究方向:应用微生物学,E-mail: 1530821179@qq.com;贾良辉,研究方向:微生物天然产物,E-mail:jialianghui@nwsuaf.edu.cn
颜 华(1976-),女,副教授,博士,研究方向:微生物资源开发,E-mail:yanh99@gmail.com
陕西省农业科技创新与攻关项目(2015NY066),中央高校基本科研业务费项目(Z109021426、Z109021432)
TQ920;Q93-331
A
1672-4321(2017)02-0030-05
