昆仑雪菊提取物对STZ诱导糖尿病大鼠血清SOD、MDA、GSH-PX的影响*
2017-06-19杨丽霞姜良恩张邦能康万荣张延英万生芳
舒 畅,范 强,杨丽霞,姜良恩,张邦能,康万荣,张延英,万生芳
(1.甘肃中医药大学,甘肃 兰州 730000; 2.甘肃省中医药研究院,甘肃 兰州 730050;3.甘肃省中医院,甘肃 兰州730050)
·实验研究·
昆仑雪菊提取物对STZ诱导糖尿病大鼠血清SOD、MDA、GSH-PX的影响*
舒 畅1,范 强1,杨丽霞2,姜良恩1,张邦能3,康万荣1,张延英1,万生芳1
(1.甘肃中医药大学,甘肃 兰州 730000; 2.甘肃省中医药研究院,甘肃 兰州 730050;3.甘肃省中医院,甘肃 兰州730050)
目的:观察昆仑雪菊提取物对STZ诱导的糖尿病大鼠血清超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)含量的影响。方法:将造模成功的35只雄性STZ诱导的糖尿病Wistar大鼠随机分为模型对照组,昆仑雪菊提取物低、中、高剂量组和吡咯列酮组5组,每组7只;另选7只SPF级雄性Wistar大鼠为正常对照组。正常对照组和模型对照组灌服生理盐水,昆仑雪菊低、中、高剂量组分别按100,200,400 μg/(g·d)剂量灌胃,吡咯列酮组灌服吡咯列酮10 μg/(g·d)。连续4周。4周后,心包外抽血,离心取血清。检测大鼠血清空腹血糖(FPG)、餐后2小时血糖(P2hPG)、胰岛素(INS)、SOD、MDA、GSH-PX含量。结果:与模型对照组对比,昆仑雪菊提取物各剂量组大鼠体质量降低不明显(P>0.05),但FPG和P2hPG降低,INS增高,其中昆仑雪菊提取物高剂量组作用明显,差别有统计学意义(P<0.05)。与模型对照组对比,昆仑雪菊提取物组和吡咯列酮组大鼠MDA水平降低,SOD、GSH-PX水平升高,差别有统计学意义(P<0.05),其中昆仑雪菊提取物高剂量组与吡咯列酮组接近。结论:昆仑雪菊提取物在一定程度上具有降低2型糖尿病大鼠血糖、MDA水平,升高抗氧化酶SOD、GSH-PX水平,促进胰岛素分泌,改善胰岛素抵抗的作用,其作用机制可能与其抗氧化应激反应有关。
昆仑雪菊提取物/药效学;2型糖尿病;血糖;氧化应激;胰岛素抵抗;动物模型;大鼠
昆仑雪菊,植物学名是蛇目菊、金鸡菊(Coreopsis),因主要分布在我国新疆和田地区的昆仑山区,而得名为昆仑雪菊,具有清热解毒、活血化瘀、和胃健脾的功效,是近年来开发的一种具有广阔的市场前景和研究价值的新品种药材[1]。临床上,雪菊花及复方制剂已用于多种疾病的治疗[2]。胰岛素抵抗(insulin resistance,IR)、胰岛β细胞受损是2型糖尿病发病的主要原因,高血糖、高血脂导致机体细胞线粒体在代谢过程中产生大量活性氧,使线粒体受损,产生代谢产物丙二醛(MDA),引起氧化应激反应,从而激活细胞内一系列应激信号通路。这些应激信号通路的激活可导致胰岛素作用通路的阻断,导致胰岛素抵抗的发生及促进胰岛β细胞的凋亡等[3]。血清超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)具有清除活性氧、拮抗氧化应激反应产生的作用。昆仑雪菊提取物的主要成分是黄酮类化合物[1],有研究发现,其具有抗氧化、降血压、抗癌等生物活性和药理作用[4]。本研究通过检测糖尿病大鼠血糖及血清SOD、MDA、GSH-PX含量,探索抗氧化应激反应与2型糖尿病发病机制的关系。
1 材料与方法
1.1 动 物
70只SPF级雄性Wistar大鼠,体质量(200±20)g,购于甘肃中医药大学,许可证号:SCXK(甘)2004-0006。饲养于甘肃中医药大学屏障级动物实验室,每天自由饮水、摄食。
1.2 药品、试剂与仪器
昆仑雪菊,产地青海,购于青海优润堂商贸有限责任公司,由上海友思生物技术有限公司提取;盐酸吡格列酮片,北京太洋药业有限公司产品,批号130605。链脲佐菌素(STZ),Sigma公司产品,批号046K1206。ELISA试剂盒:胰岛素(INS),批号CSB-E05070r,CUSABIO公司产品;超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX),均为南京建成生物工程研究所产品,货号依次是A001-1,A003-1,A005。罗氏活力型血糖试纸,德国Roche Diagnostics GmbH公司产品。罗氏活力型血糖仪,德国Roche Diagnostics GmbH公司产品;2700型全自动生化仪,日本奥林巴斯公司产品;Bio-rad 680型酶标仪,美国伯乐公司产品。
1.3 糖尿病大鼠模型的建立
大鼠适应性饲养1周后,除正常对照组7只外,其余大鼠均给予高糖高脂饲料喂养;8周末尾静脉注射STZ 25 μg/(g·d);l周后尾静脉取血测定血糖。随机血糖稳定>13.9 mmol/L者诊断为2型糖尿病;随机血糖小于13.9 mmol/L的大鼠,追加注射STZ 25 μg/(g·d)继续造模,并监测血糖。连续两次测随机血糖>13.9 mmol/L者视为造模成功。
1.4 分组与给药方法
造模成功后,随机选取35只大鼠,随机分为模型对照组,昆仑雪菊提取物低、中、高剂量组和吡格列酮组5组,每组7只。另选7只SPF级雄性Wistar大鼠为正常对照组。正常对照组和模型对照组灌服生理盐水,昆仑雪菊提取低、中、高剂量组分别按100,200,400 μg/(g·d)剂量灌胃,吡咯列酮组灌服吡咯列酮10 μg/(g·d),灌胃量为10 μL/g。所有药品用生理盐水配成所需的质量分数,1 d 1次,连续4周。4周后,禁食8 h,麻醉后,一次性心脏采血,血液静置2 h,以4 ℃、3 500 r/min离心20 min,取血清,-20 ℃保存待测。
1.5 检测指标
1.5.1 一般情况及血糖
观察大鼠精神状态、活动状况、毛色等一般情况,并称体质量,每周测空腹血糖(FPG)、餐后2 h血糖(P2hPG)和胰岛素(INS)。
1.5.2 血清SOD、MDA、GSH-PX含量
按照试剂盒说明书进行。检测前先对所有样本进行低温离心,在反应孔中加标准品或待测标本,每孔剂量为100 μL。在空白对照孔中加入稀释液,剂量为100 μL;在37 ℃电热培养箱内进行孵育,孵育后对检测板进行洗涤;加酶标抗体进行酶联免疫反应;反应终止后,将检测板在酶标仪上进行检测。以空白对照孔调零,检测条件为450 nm,测定各孔OD值。
1.6 统计学方法
2 结 果
2.1 各组大鼠一般情况对比
正常对照组大鼠皮毛光泽,精神状态表现良好,动作反应灵敏,行为活跃。模型对照组大鼠皮毛干枯无光泽,精神状态较差,动作迟缓,反应较慢,活动度差,并随着饲养时间程度加重。昆仑雪菊提取物各剂量组和吡格列酮组与模型对照组对比,上述情况有不同程度的改善。
2.2 各组大鼠体质量、FPG、P2hPG、INS水平对比
与正常对照组对比,模型对照组大鼠的体质量降低,FPG与P2hPG升高,并伴随胰岛素水平降低,差别有统计学意义(P<0.05)。经昆仑雪菊提取物治疗后,各组大鼠体质量变化不明显,但FPG与P2hPG有不同程度的降低,其中昆仑雪菊提取物高剂量作用最为显著。与模型对照组对比,昆仑雪菊提取物各剂量组大鼠INS水平增高,差别有统计学意义(P<0.05)。在降低FPG与P2hPG及促进其胰岛素分泌方面,高剂量昆仑雪菊提取物与吡咯列酮作用接近。见表1。
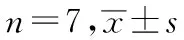

组 别剂量/(μg·g-1)体质量/gFPG/(mmol·L-1)P2hPG/(mmol·L-1)INS/(μIU·L-1)正常对照组—432.1±43.14.30±0.206.05±0.4390.03±18.72模型对照组—220.0±28.5*26.20±3.80*30.90±1.60*19.41±19.36*吡咯列酮组10231.4±41.025.45±7.3323.95±3.1943.44±57.10#昆仑雪菊低剂量组100239.4±51.618.34±7.1127.74±3.8239.30±35.70#昆仑雪菊中剂量组200244.4±37.416.91±7.33#25.93±4.2435.37±42.38#昆仑雪菊高剂量组400238.3±32.016.73±4.97#23.65±6.7742.53±49.67#
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05。
2.3 各组大鼠血清SOD、MDA、GSH-PX水平对比
与正常对照组对比,模型对照组大鼠血清MDA水平升高(P<0.05),而SOD、GSH-PX水平降低,差别有统计学意义(P<0.05)。与模型对照组对比,昆仑雪菊提取物各剂量组与吡咯列酮组能降低大鼠血清MDA水平,增加SOD、GSH-PX水平。见表2。
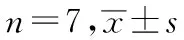

组 别剂量/(μg·g-1)SOD/(U·mL-1)MDA/(μmol·L-1)GSH-PX/(U·mL-1)正常对照组—54.22±66.1720.60±11.682.84±29.10模型对照组—4.26±25.42*46.31±13.46*-9.21±8.29*吡咯列酮组1029.28±47.79#5.60±31.30#-6.75±5.32昆仑雪菊低剂量组1000.42±15.1834.17±26.33-6.05±7.33昆仑雪菊中剂量组2006.58±49.66#32.26±20.29#2.51±7.22#昆仑雪菊高剂量组40014.59±79.78#23.21±20.20#14.03±29.60#
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05。
3 讨 论
糖尿病是一种与遗传因素、自由基和免疫功能紊乱等多种致病因子相关的代谢紊乱综合征,是人类健康的严重威胁之一[5]。目前,已有大量研究证实氧化应激是糖尿病及其并发症的共同发病途径之一[6-7]。氧化应激产生过多的自由基会促进胰岛β细胞的凋亡,增加胰岛素抵抗而引起胰岛素分泌不足,使血糖升高并导致脂质的过氧化[8-9]。MDA是脂质过氧化反应产物,其含量可以体现氧自由基的含量和脂质过氧化程度[10];SOD、GSH-PX通过清除超氧阴离子(O2-)而保护细胞免受损伤,它们的活性高低间接反映机体清除自由基的能力[11],也就是机体抗氧化的能力。因此,SOD、GSH-PX具有减轻胰岛素抵抗的作用。
从表1可以看出,与模型对照组对比,灌服昆仑雪菊提取物的各组大鼠FPG和P2hPG有不同程度的降低,其中昆仑雪菊提取物高剂量作用显著;同时,灌服昆仑雪菊提取物的各组大鼠INS分泌显著增加(P<0.05)。说明昆仑雪菊提取物对糖尿病症状改善有一定的作用。从表2可以看出,昆仑雪菊提取物组能显著降低大鼠血清MDA水平(P<0.05),增加SOD、GSH-PX水平(P<0.05),说明昆仑雪菊提取物能提高机体清除自由基的能力,即提高机体抗氧化的能力,从而通过保护胰岛细胞,减轻胰岛素抵抗,改善糖尿病症状。
综上所述, 昆仑雪菊提取物可改善2型糖尿病大鼠的血糖水平和抗氧化能力;昆仑雪菊提取物可能是通过改善2型糖尿病大鼠的抗氧化机制来实现其抗氧化功效。由于受药物提取浓度、灌胃时间等因素影响,本课题还处于动物实验研究阶段,缺乏深入性,且缺乏相应的临床研究,这将是本课题以后研究的重点,希望能为临床防治糖尿病提供思路和依据。
[1]买买提·艾买提,木合布力·阿不力孜,孟磊.新疆昆仑雪菊水溶性总黄酮的含量测定[J].海峡药学,2010,22(10):56-58.
[2]茹克娅·胡加阿不都拉,斯依提尼沙汗·吴满尔.雪菊花药用功能及临床应用体会[J].中国名族民间医药,2011,19(2):41-42.
[3]孙晓菲,刘红.氧化应激激活信号转导通路与胰岛素抵抗[J].内科,2008,3(6):889-890.
[4]郑大成,木合布力阿·不力孜,阿依努尔·吐鲁洪,等.昆仑雪菊黄酮的制备及初步鉴定[J].亚太传统医药,2010,6(10):18-20.
[5]谢欣梅,庞晓斌,李晓婷,等 .覆盆子酮对糖尿病模型小鼠的降血糖作用及其机制研究[J].中国药学杂志,2012,47(23):1899-1904.
[6]NAKATSUI H,KISHIDA K,FUNAHASHI T,et al.Three monthtreatment with pioglitazone reduces circulating levels of thiobarbituricacid-reacting substances,a marker of reactive oxidative stress,with-out change in body mass index,in Japanese patients with type 2 diabetes[J].Atherosclerosis,2010,212(1):243-245.
[7]RAIINS JL,JANIN SK.Oxidative stress,insulin signaling,anddiabetes[J].Free Radical Bio Med,2011,50(5):567-575.
[8]NAGATANI S,SUDO T,MURAKAMI Y,et al.Edaravone,afree radical scavenger,promotes engraftment of intraportallytransplanted isletcells[J].Pancreas,2011,40(1):126-130.
[9]THAYERT TC,DELANO M,LIU C,et al.Superoxide production by macrophages and T cells is critical for the induction of autoreactivity and type 1 diabetes[J].Diabetes,2011,60(8):2144-2151.
[10]张绪东,蒋伟哲,焦阳,等 .龙眼参黄酮抗心肌缺血再灌注引起的脂质过氧化损伤的研究 [J].时珍国医国药,2008,19(3):607-609.
[11]HONGBIN Chen,RUIZHI Feng,YI GUO,et al.Hypoglycemic effects of aqueous extract of Rhizoma Polygonati Odorati in mice and rats[J].J Ethnopharmacol,2001,74(3):225-229.
(编辑 陶 珠)
1001-6910(2017)04-0070-03
R587.1
B
10.3969/j.issn.1001-6910.2017.04.30
舒畅(1978-),女(汉族),重庆人,副教授,硕士,主要从事中医药防治糖尿病的研究。通信作者:杨丽霞,副主任医师,博士,13038770310@163.com
甘肃省自然科学基金项目(1308RJZA106);兰州市科技局项目(2014-1-20)
2016-09-05;
2017-01-17
