典型樱亚属植物基因组DNA改良提取方法研究
2017-06-07柳新红蒋冬月李因刚杨少宗刘华红
吴 帆,柳新红,蒋冬月,李因刚,杨少宗,刘华红,倪 穗
(1.宁波大学,应用海洋生物技术教育部重点实验室,浙江 宁波 315211;2.浙江省林业科学研究院,浙江 杭州 310023;3.杭州市园林绿化股份有限公司,浙江 杭州 310020)
典型樱亚属植物基因组DNA改良提取方法研究
吴 帆1,2,柳新红2,蒋冬月2,李因刚2,杨少宗2,刘华红3,倪 穗1*
(1.宁波大学,应用海洋生物技术教育部重点实验室,浙江 宁波 315211;2.浙江省林业科学研究院,浙江 杭州 310023;3.杭州市园林绿化股份有限公司,浙江 杭州 310020)
本实验在传统的CTAB法及试剂盒法的基础上,利用DNA提取缓冲液作为样品预处理液,配合其他操作步骤的优化,设计出针对樱亚属植物基因组DNA的新型提取方法,并对提取的DNA进行ISSR-PCR分子标记实验以检验其质量。实验结果表明,改进后的CTAB法及试剂盒法均能有效地去除样品中含有的多糖、色素、黄酮等杂质,而试剂盒法提取的DNA纯度和质量总体而言高于CTAB法。ISSR-PCR结果显示,两条引物对样品DNA均能进行有效扩增,并且扩增条带清晰,无明显降解。改良后的两种方法能高效高质量地提取樱亚属植物DNA,并且具有较高的通用性,可以运用于其他物种DNA的提取工作中。
典型樱亚属;DNA提取;CTAB;试剂盒
典型樱亚属(Subg.Cerasus)隶属于蔷薇科(Rosaceae)樱属(Cerasus),为多年生落叶乔木或灌木。该亚属植物在北半球温和地带,包括亚洲、欧洲、北美洲等均有分布记录。亚属中主要原生种分布于亚洲,集中在日本、朝鲜及我国西部和西南部地区,包括福建、浙江、云南、四川等省份[1-2]。我国产48种,包括迎春樱(Cerasusdiscoidea)、山樱花(Cerasusserrulata)、尾叶樱(Cerasusdielsiana)、华中樱(Cerasusconradinae)等常见种及天山樱(Cerasustianshanica)、鹤峰樱(Cerasushefenensis)等地区特有种[3-4]。该亚属的植物多生长于向阳山坡、山顶或林缘地带的阳面,种类分布受海拔及坡向影响较大。
前人研究发现,樱亚属植物叶片中含有大量次生代谢产物,如多糖[5]、黄酮[6]、单宁和色素[7]等。分子生物学家将诸如樱亚属类具有大量次生代谢产物的植物称为顽拗植物(recalcitrant plant)[8],若对这些植物采用传统的DNA提取手段,会导致杂质的大量残留,不仅影响DNA的提取质量,还会影响后续基于DNA片段的相关研究,这会给樱亚属植物分子生物学研究带来障碍,限制其进一步的开发利用。目前,针对樱亚属植物基因组DNA提取的报道较少,且提取的DNA质量较低,不能满足后续分子实验的需求。本研究在传统的CTAB法及试剂盒法的基础上进行改良优化,以改良后的方法提取典型樱亚属植物基因组DNA,并对其进行产量、纯度测定、ISSR-PCR分子标记分析,验证提取方法的质量。旨在为提取高质量的樱亚属植物DNA提供理论依据。
1 材料与方法
1.1 实验材料
实验材料均来自于浙江省内14个县(市、区)(表1),现场采集新鲜完整的叶片放入变色硅胶中干燥保存,后存放于-20 ℃冰柜中备用。
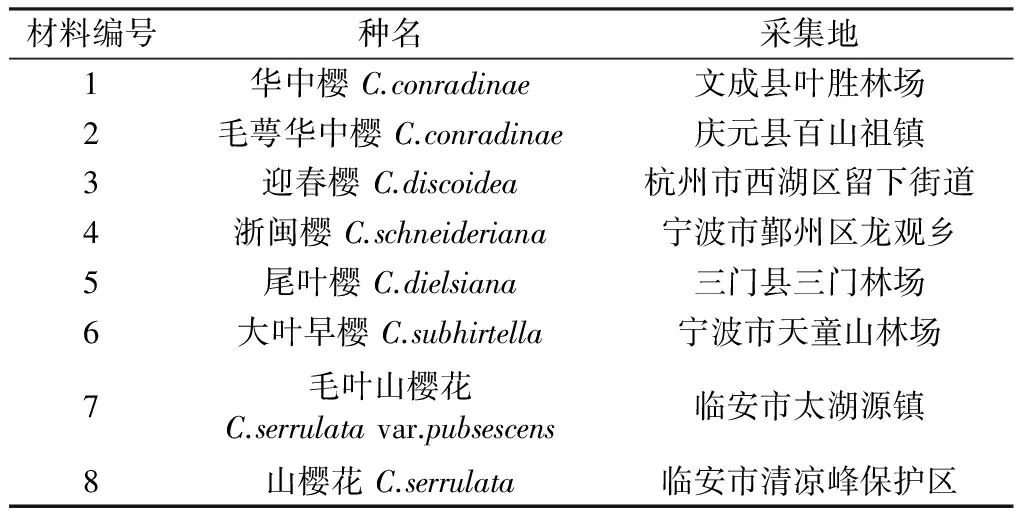
表1 供试材料及采集地
1.2 DNA提取方法
1.2.1 提取缓冲液制备
为有效地去除样品叶片中的次生代谢产物,结合DNA结构特点,设计提取缓冲液对样品叶片进行预处理,去除大量杂质后再进行后续提取实验会极大地提高提取效率。缓冲液(100 mL)具体配方如下:在50 mL蒸馏水中加入1.461 g NaCl,另取15mL蒸馏水加入2.4 g Tris碱,完全溶解后利用HCl调节pH至8.0,后转移到50 mL水中;另取15 mL蒸馏水,先加入少许NaOH使溶液呈碱性,后加入1.8 g EDTA(Ethylenediaminetetraacetic acid,乙二胺四乙酸),再利用NaOH调节pH至8.0,后转入上述混合液中。取2 g PVP(Polyvinyl pyrrolidone,聚乙烯吡咯烷酮)加入混合液中,待完全溶解后加入1 ml β-巯基乙醇,蒸馏水定容至100 ml,混匀后冰箱4℃保存,备用。
1.2.2 改良CTAB法提取DNA
取干燥后的样品叶片于预冷的研钵中,加入少量PVP粉末,液氮迅速研磨至样品彻底成为粉末,后迅速转移至2 mL预冷离心管中。加入1.5 mL预冷的缓冲液,混合均匀后冰浴器上静置20 min。4 ℃下3 000 r/min离心5 min,弃上清液和胶状粘稠物质及壁上残留。若上清液颜色较深则重复抽提1次。在沉淀中加入700 μL 65℃预热的CTAB缓冲液、14 μL β-巯基乙醇,65 ℃水浴40 min。期间轻摇离心管数次,后4 ℃10 000 r/min离心10 min。将上清液转移至新的2 mL预冷灭菌离心管内,加入等体积的氯仿-异戊醇,轻轻上下颠倒2 min,静置5 min后4 ℃10 000 r/min离心10 min。后重复此步骤1次。取上清液于新的2 mL预冷灭菌离心管内,加入2.5倍体积的-20℃预冷的无水乙醇。上下轻轻颠倒至完全混合均匀后-20 ℃冷冻过夜。后4 ℃10 000 r/min离心10 min,1 mL-20℃预冷的无水乙醇洗涤沉淀1次,再4 ℃ 10 000 r/min离心10 min。加入60 μL EB缓冲液将固体溶解,后加入4 μL 碧云天生物公司生产的RNA酶,金属浴加热器中37 ℃存放1.5 h,取出后-40 ℃冷冻备用。
1.2.3 改良试剂盒法提取DNA
称取约30 mg干燥叶片样品于2 mL离心管内,加入2粒球形钢珠,放于液氮中使其与液氮充分接触,约5 min后取出放于水平震荡仪上,30 Hz震荡90 s,间隔2 min后相同频率再震荡90 s,使样品被充分粉碎。加入750 μL预冷的核分离液,后续预处理过程同CTAB法。后参照北京BioTeKe生物公司生产的DNA提取试剂盒说明书提取样品中的DNA。
1.3 ISSR-PCR反应
为验证改良DNA提取方法的效果,选择两条由美国哥伦比亚大学研制开发的ISSR-PCR引物,分别为UBC813(CTCTCTCTCTCTCTCTT)和UBC836(AGAGAGAGAGAGAGAGA),对提取的样品基因组DNA进行扩增。
PCR反应体系经过预实验优化,确立为20 μL。其中2×TSINGKE PCR Master(blue)预混体系10 μL,ISSR引物0.6 μL,DNA模板1μL,ddH2O补足20 μL。PCR反应程序为94 ℃预变性5 min;然后94℃ 30s,适当退火温度(UBC813为49.8 ℃;UBC836为50.3 ℃)30 s,72 ℃ 90 s,35个循环;72 ℃ 7 min,16 ℃保存。将扩增后的产物点样于1.5%琼脂糖凝胶中,150 V电泳30 min检验结果。
2 结果与分析
2.1 电泳检测结果
利用改良后的CTAB法及试剂盒法对不同种典型樱亚属植物基因组DNA进行提取(图1)。
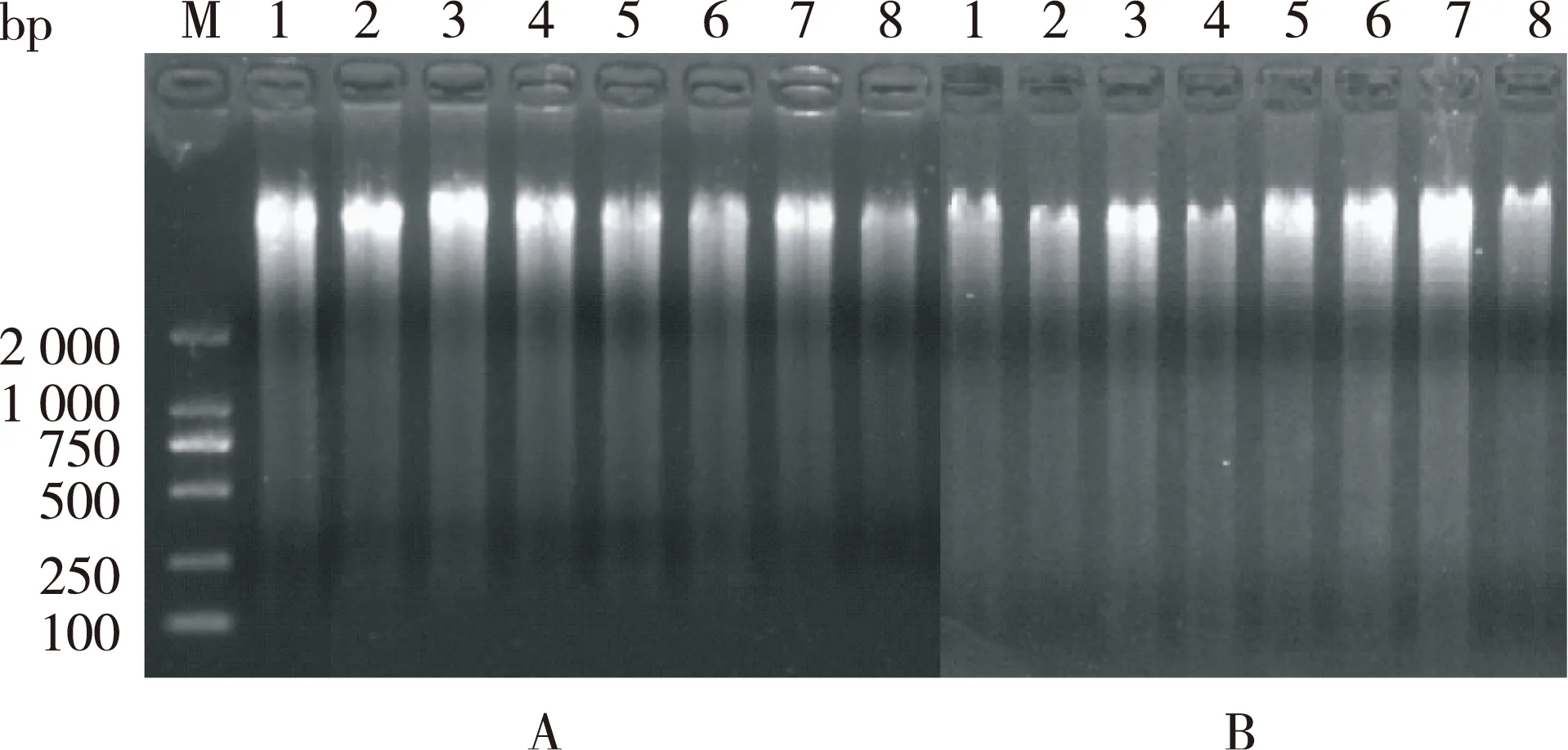
A.改良试剂盒提取;B.改良CTAB法提取
结果表明,部分样品如B-7,由于DNA含量过高,产生带出现象;部分样品如A-6、B-5,DNA存在降解弥散现象;少部分样品如B-2、B-4,条带亮度不高,对应含量偏低。总体而言改良后的两种方法对DNA的提取效率明显提高,几乎没有杂质影响。此外,从图1中可以看出,A-8与B-8号样品的得率均不高,可见DNA的提取效率也受到样品种类影响。
2.2 紫外检测结果
从表2中可以看出,两种方法提取DNA的OD260与OD280比值在1.6~1.9之间,总体来说提取纯度较高,蛋白质、RNA等杂质污染较少;两种方法中,改良的试剂盒法提取的DNA的OD260/OD280相对更稳定,总体来说DNA浓度高于传统的CTAB法。DNA浓度最高的是改良的CTAB法提取的毛叶山樱花样本(B-7),最低为改良的CTAB法提取的浙闽樱样本(B-4),由此可见DNA提取效率受到样品本身影响较大,不同种樱亚属植物提取浓度存在明显差异。
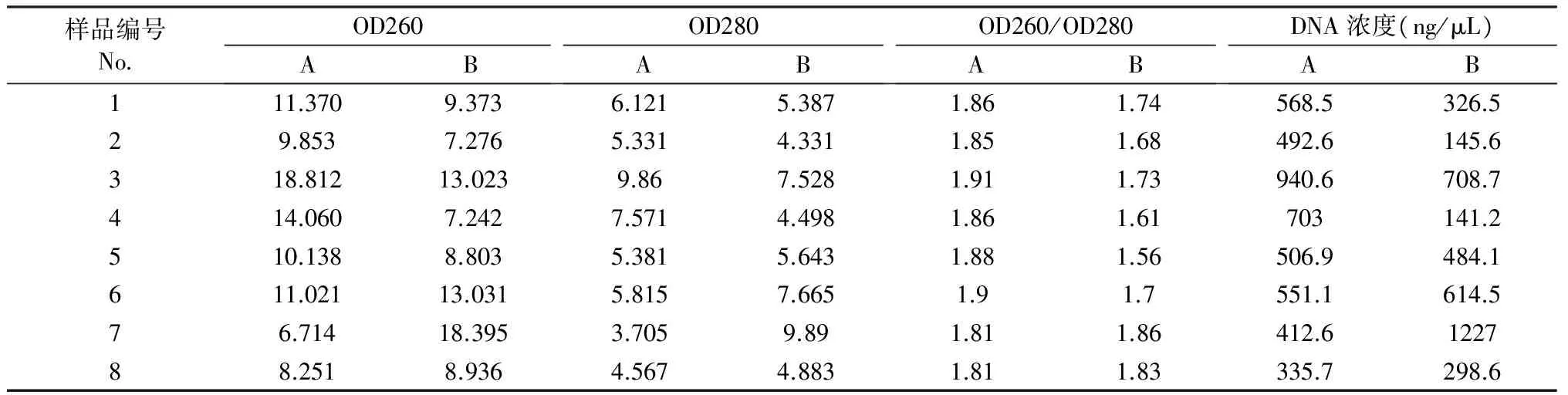
表2 不同方法提取样品DNA吸光度及浓度
注:A为改良的试剂盒提取;B为改良的CATB法提取。

A.引物UBC813;B.引物UBC836
2.3 ISSR分子标记结果
实验结果表明,两条ISSR引物对所有DNA样本扩增的条带大小约在250bp~2000bp左右,不同DNA样本之间多态性差异较大,不同ISSR引物之间扩增的多态性也存在较大差异。图中所有条带均没有出现明显的拖尾或降解现象,且条带较亮,说明模板DNA链本身具有较高的完整度。
3 讨 论
3.1 缓冲液对DNA提取效率分析
实验结果证明,在正式开始提取实验之前加入缓冲液进行预处理,可以极大程度地提高提取效率。缓冲液的成分,包括Tris碱、EDTA、 PVP、β-巯基乙醇等,均为后续提取实验中会用到的试剂。所以不必考虑缓冲液会对后续实验造成试剂污染。缓冲液中的各种成分的配比有利于多糖、色素、单宁、黄酮等杂质的溶解,离心后便可去除;若杂质过多,会使缓冲液极度粘稠,此时可以适当增加缓冲液洗涤次数,以确保杂质的去除效率。此外,由于缓冲液中的盐浓度不高,故缓冲液本身不会大量溶解DNA,即不会降低DNA的含量。
值得注意的是缓冲液中含有β-巯基乙醇,此药物是在缓冲液处理样品时的抗氧化剂[9],在高温下会挥发和分解[10],故在配置过程中最好在最后一步再加入;配置好的缓冲液应当放置于4℃冰箱中保存,且整个处理过程最好在低温环境下进行。此外,缓冲液中的PVP可以增加溶液中其他药品的亲水性,使其余药品能更好地溶解[11]。但实验过程中发现,其本身与水结合后会形成胶体状物质,故可以利用加热型磁力搅拌器加速PVP本身的溶解。
在实验过程中发现在去除缓冲液的时候离心转速和旋转时间也是一个非常重要的参数。若转速和时间过高虽然可以有效地分离缓冲液和固体样品,但是会导致样品挤压过实,从而影响后续提取试剂对样品的处理;若转速和时间过低又无法将固液完全分离。马辉[12]等在对白术DNA提取过程中,将此步骤的转速设定在4 000 r/min,时间为5 min;而笔者在实验过程中发现,以3 000 r/min的转速离心5 min,也可以达到和上述条件一样的效果。为节省时间提高工作效率,故将实验条件定为3 000 r/min离心5 min。
3.2 改良后两种提取法的比较分析
由上述图表可以看出,改良后的两种提取方法对DNA均有较高的提取效率。相比较而言,在DNA提取的质量方面,两种方法相差不大;在浓度方面,利用试剂盒法提取得到的DNA浓度总体而言高于CTAB法。这有可能是因为使用的CTAB缓冲液中含有β-巯基乙醇,而操作步骤中对的加热过程导致β-巯基乙醇的挥发或者降解,从而导致DNA在提取时的抗氧化剂失效,从一定程度上降低了DNA的提取效率。在实验操作时间方面,试剂盒法明显优于传统的CTAB法。利用试剂盒提取DNA,从缓冲液预处理算起,一般耗时1.5 h;而CTAB法需要超过6 h。从实验要求的操作熟练程度而言,CTAB法步骤更为繁复,在细节方面要求更多,故对实验员的熟练程度要求更高;而试剂盒由于已经是规范化生产,配合离心柱,按照说明书要求一步步操作即可,故对实验员的技术要求没有CTAB高。且CTAB法在操作过程中需要运用到氯仿异戊醇等有毒试剂,虽然其成本比试剂盒要低一些,但总体而言还是试剂盒法更为高效和安全。
3.3 其他操作步骤改进
在CTAB法提取实验步骤中与试剂盒法不同,由于样品研磨是在空气中直接进行,为防止在研磨过程中空气对DNA的氧化,故在研钵中提前放入少量PVP粉末,以确保此步骤不会造成DNA被氧化。此外,由于不同物种叶片硬度不一样,有些样品在研磨时需要加入少量石英砂以确保能充分被研磨[13-14],但由于樱亚属植物叶片多为纸质,利用硅胶干燥后已经可以直接进行研磨,故在此实验中未添加石英砂。在DNA析释过程中,前人有使用异丙醇作为DNA的析释剂[15]。虽然异丙醇可以将DNA从溶液中析释出来,但是同时也会将残留的蛋白质等杂质同时析出,造成二次污染;且异丙醇本身具有一定毒性,会对身体产生危害。故本实验利用事先冷冻的冰乙醇代替异丙醇,大大降低了毒性同时不会影响DNA的析释效率。在最后DNA溶解剂的选择方面,前人使用TE缓冲液[16]或纯净水[17]对DNA进行溶解。在本实验中,针对两种提取方法得到的DNA,笔者均使用试剂盒中原装的EB缓冲液进行溶解。原本三种试剂对DNA的溶解力相差不大,为方便实验步骤,故直接选用EB缓冲液。此外,尽管在实验步骤上进行诸多改进,但实验样品本身的新鲜程度也是影响实验结果的重要因素。一般来说,在采样时尽量选择无破损、虫蛀、枯萎发黄的新鲜叶片或嫩芽[18],会对DNA的提取效率有显著提高。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第37卷 蔷薇科[M].北京:科学出版社,1990.
[2] 浙江植物志编辑委员会.浙江植物志:1992-1993版 1~7卷合订[M].杭州::浙江科学技术出版社,1992.
[3] 王铖.漫淡我国樱花现状与应用[J].园林,2010(3):14-16.
[4] 王贤荣.中国樱花品种图志[M].北京:科学出版社,2014.
[5] 李友伟,温东东.樱花多糖提取工艺的优化及抗氧化性研究[J].中国药事,2015(1):58-62.
[6] 卫强,纪小影.聚酰胺-大孔树脂联用纯化樱花叶总黄酮及其抗炎活性[J].中国医院药学杂志,2015,35(13):1204-1209.
[7] 赵峰,罗家刚,张泽俊.樱花色素的提取[J].昭通学院学报,2014(5):36-37.
[8] BI I V,HARVENGT L,CHANDELIER A,et al.Improved RAPD amplification of recalcitrant plant DNA by the use of activated charcoal during DNA extraction[J].Plant Breeding,1996,115(3):205-206.
[9] 闫光照,郑根昌,王伟,等.β-巯基乙醇与PVP在红干椒DNA提取中的比较研究[J].内蒙古民族大学学报(自然科学版),2009,24(1):51-54.
[10] 薛丽梅,胡永玲,赵桂红.β-巯基乙醇的合成及精馏研究[J].化学与粘合,2010,32(4):24-26.
[11] 靖博宇,郑霞,杨瑞,等.亲水性聚合物对自乳化药物传递系统稳定性的影响[J].中国药房,2016(7):910-912.
[12] 马辉,张智俊,罗淑萍,等.药用植物白术DNA提取方法的研究[J].新疆农业大学学报,2007,30(2):13-16.
[13] HU Y P,XIE X L,LI W,et al.An effective and low-cost method for DNA extraction from herbal drugs of Rheum tanguticum(Polygonaceae)[J].African Journal of Biotechnology,2010,8(12):2691-2694.
[14] ZENG J,ZOU Y,BAI J,et al.Preparation of Total DNA from "Recalcitrant Plant Taxa"[J].Acta Botanica Sinica,2002,44(6):694-697.
[15] CUI H,HE Y,WANG J,et al.Cotton plant event A2-6 and primer and method for use in detection thereof:2013170399.3[P].2013-11-23.
[16] 王兰,龙云铭,刘耀光.一种用于PCR的植物基因组DNA快速制备方法[J].分子植物育种,2009,7(2):425-428.
[17] 王小蓉,陈涛,汤浩茹,等.一种适合富含多糖类植物的干燥叶片DNA提取方法:CN103756994A[P].2014-04-30.
[18] HANANIA U,VELCHEVA M,SAHAR N,et al.An improved method for isolating high-quality DNA from Vitis vinifera nuclei[J].Plant Molecular Biology Reporter,2004,22(2):173-177.
Study on A New Extraction Method of Genomic DNA from Subg.Cerasus
Wu Fan1,2,Liu Xinhong2,Jiang Dongyue2,Li Yingang2,Yang Shaozong2,Liu Huahong3,Ni Sui1*
(1.Key Laboratory of Applied Marine Biotechnology of Ministry of Education,Ningbo University,Ningbo 315211,China;2.Zhejiang Forestry Academy,Hangzhou 310023,China;3.Hangzhou Landscaping Co.,Ltd.,Hangzhou 310020,China)
In the present study,a new method used to extract the genomic DNA of Subg.Cerasuswas developed based on the traditional methods of CTAB and kits.In the new method,the DNA extraction buffer was used as the pre-treatment buffer,and other procedures were also optimized.The new method was assayed through ISSR-PCR using the DNA extracted by the new method.The results showed that several impurities including polysaccharide,pigment,and flavone could be eliminated effectively by the new method,while the purity and quality of DNA extracted through the method of kit were better.The results of ISSR-PCR showed that the two pairs of primers could be used for amplification in the sample DNA,while the amplified bands were clear and there is no obvious degradation.In conclusion,the two new methods could be used to the extraction of genomic DNA of Subg.Cerasus.The new methods could be applied to the work of other species because of their high generalization.
Subg.Cerasus;DNA extraction;CTAB;kit
10.3969/j.issn.1006-9690.2017.02.007
2016-08-18
浙江省科技厅院所专项—国产樱花新品系无性快繁技术体系研发(2016F50024);浙江省林科院院企合作项目—樱花种质资源库建设及新品种选育。
吴帆,男,硕士研究生,主要研究方向为植物分子生物学。E-mail:eiknarf@126.com
*通讯作者: 倪穗,教授,主要从事植物生物技术研究。E-mail:nisui@nbu.edu.cn
Q943
A
1006-9690(2017)02-0024-04
