大苞鞘石斛组织培养快繁研究
2017-05-30王伟卢珊葛冰郜爱玲金荷仙
王伟 卢珊 葛冰 郜爱玲 金荷仙

摘 要 为筛选出大苞鞘石斛组培快繁体系各阶段最适培养基配方,以大苞鞘石斛无菌苗茎段为外植体,通过正交试验研究不同因素对大苞鞘石斛植株再生的影响。结果表明:拟原球茎诱导最适培养基为1/2MS+2,4-D 0.2 mg/L+蔗糖30 g/L,诱导出的拟原球茎直径1.5 mm时将其从茎段上剥离,并接入原培养基继续诱导15~20 d;拟原球茎增殖最适培养基为1/2MS+NAA 1 mg/L+蔗糖30 g/L+椰乳10%,继代周期25~30 d;拟原球茎分化最适培养基为1/2MS+NAA 0.5 mg/L+蔗糖30 g/L+椰乳10%,分化培养需40 d;将分化的无菌苗继代于花宝2号3 g/L+蛋白胨2 g/L+IBA 1 mg/L+蔗糖30 g/L+椰乳10%生根诱导效果最好,培养45 d;生根壮苗最佳培养基为花宝1号3 g/L+蛋白胨2 g/L+蔗糖30 g/L+活性炭1 g/L,培养50 d。
关键词 大苞鞘石斛;组织培养;再生体系;拟原球茎
中图分类号 Q943.1 文献标识码 A
Abstract In order to study the effects of different factors on the tissue culture and plant regeneration of Dendrobium wardianum, three kinds of factors of three levels were used by an orthogonal design. The stem segments of D. wardianum were used as the explants for tissue culture. Results showed that the optimum PLBs induction medium was 1/2MS+2,4-D 0.2 mg/L+Sugar 30 g/L. When the shoot bud diameter reached to 1.5 mm, it must be detached and transferred to the same media for 15-20 days. The optimum medium for PLBs proliferation was 1/2MS+NAA 1 mg/L+Sugar 30 g/L+CW 10% and the appropriate subculture cycle was about 25 to 30 days. The optimum PLBs differentiation medium was 1/2MS+NAA 0.5 mg/L+Sugar 30 g/L+CW 10%. The aseptic seedling which obtained from the former culture stage was cultured on the root induction media of Hyponex No.2 3 g/L+Peptone 2 g/L+IBA 1 mg/L+Sugar 30 g/L+CW 10% for 45 days. The optimal medium of strong plantlets and rootage was Hyponex No.1 3 g/L+Peptone 2 g/L+Sugar 30 g/L+Activated carbon 1 g/L.
Key words Dendrobium wardianum; tissue culture; regeneration system; PLBs
doi 10.3969/j.issn.1000-2561.2017.04.011
大苞鞘石斛(Dendrobium wardianum L.)又名騰冲石斛,药用商品名为扁黄草[1],含dendrowardine等生物碱[2]、多糖[3]、氨基酸及微量元素等活性成分[4-5],产于中国云南高海拔地区,常附生于树干上,对生境要求苛刻,自然状态下繁育率极低,加之常被作为观赏植物和中药材使用,因此被盗挖者过度采集,野生资源数量已非常稀少。针对该现状,对大苞鞘石斛种质资源的保护和研究逐渐引起了各界学者的重视,研究重点主要集中在组织培养等人工快速繁育技术的探索,通过该技术可加速种群扩繁与品种改良,Luan等[6]发现1/2MS培养基中添加萘乙酸(NAA)0.5 mg/L、椰乳20%、蔗糖30 mg/L可作为大苞鞘石斛无菌播种培养基;张小娟等[7]认为大苞鞘石斛拟原球茎可在MS(或B5)+ NAA 0.5 mg/L+6-苄基腺嘌呤(6-BA)0.2 mg/L+香蕉2.5%+椰乳2.5%+蔗糖25 g/L中进行悬浮培养;吴元玲等[8]、刘晓东等[9]对大苞鞘石斛拟原球茎超低温保存技术体系进行了研究与探讨;Sharma等[10]将大苞鞘石斛拟原球茎制作为人工种子且可在MS培养基上全部萌发;陈娜[11]、卓孝康等[12],初步探讨了大苞鞘石斛快繁体系的构建,为实现大苞鞘石斛种质资源的保护及再生奠定了基础。
目前,对大苞鞘石斛无菌播种技术研究较为成熟,但通过外植体诱导拟原球茎的途径建立快繁体系的研究甚少。通过大苞鞘石斛离体器官诱导拟原球茎,再利用拟原球茎的增殖分化培养获得大量幼苗,这种快繁方法可建立高效的快繁体系,对推进大苞鞘石斛工厂化育苗、遗传学和细胞学研究具有重要意义。基于此,本试验以大苞鞘石斛无菌苗茎段为外植体,通过正交试验设计,研究不同因素对大苞鞘石斛拟原球茎诱导、增殖与分化、生根诱导、生根壮苗等培养阶段的影响,以期筛选出适宜的快繁方案,为大苞鞘石斛种质资源的保育和开发提供科学依据。
1 材料与方法
1.1 材料
试验所用原植物采自中国云南腾冲地区,经上海辰山植物园黄卫昌高级工程师鉴定为兰科石斛属大苞鞘石斛的新鲜植株,用无菌苗是利用以上植株所结蒴果无菌播种,选取长势健壮,茎长2 cm以上。
1.2 方法
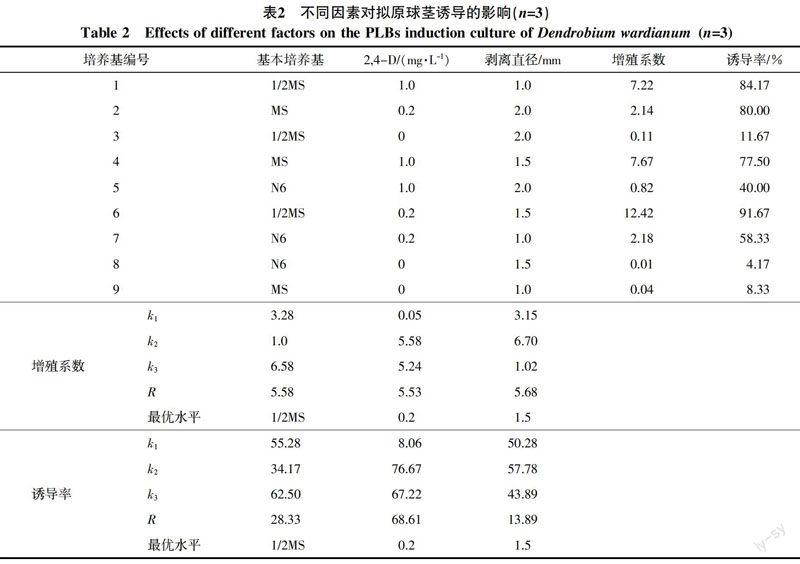
1.2.1 拟原球茎诱导 诱导阶段Ⅰ:去除无菌苗叶片和根部,将茎段切为数段,每段保留1~2个具芽点的节,接入待检培养基;诱导阶段Ⅱ:当芽点生长出拟原球茎后,将其剥离并置于该培养基中继续诱导。设置L9(33)正交试验设计,研究不同培养基、2,4-二氯苯氧乙酸(2,4-D)浓度和拟原球茎剥离直径对拟原球茎诱导的影响,各因素水平分别为:培养基种类[MS、N6、1/2MS(MS培养基大量元素减半)]、2,4-D(0、0.2、1.0 mg/L)和诱导阶段Ⅰ拟原球茎剥离直径(1.0、1.5、2.0 mm)。培养结束时,统计诱导结果。
诱导率/%=(诱导出拟原球茎的外植体数量/外植体总数量)×100
增殖系数=培养后拟原球茎总数量/接种拟原球茎数
1.2.2 拟原球茎增殖与分化 将诱导阶段所得拟原球茎称重,并利用接种勺接入增殖(分化)培养基。设置L9(33)正交试验设计,各因素水平分别为:培养基种类(MS、1/2MS、N6)、NAA(0.5、1.0、2.0 mg/L)和苯基噻二唑基脲(TDZ)(0、0.02、0.1 mg/L)。培养结束时,统计拟原球茎增殖与分化结果。
鲜重增殖倍数=培养后拟原球茎鲜重/接种拟原球茎鲜重
拟原球茎分化率/%=(分化的拟原球茎数量/拟原球茎总数)×100
1.2.3 无菌苗生根诱导 选取已分化且茎长为15~20 mm的无菌苗(若有根需切除,将丛生芽拆分为单芽)接入生根诱导培养基。设置L9(33)正交试验设计,各因素水平分别为:培养基种类[花宝1号(花宝1号3 g/L+蛋白胨2 g/L)]、花宝2号[(花宝2号3 g/L+蛋白胨2 g/L)、CHB]、吲哚丁酸(IBA)(0.5、1.0、2.0 mg/L)和6-BA(0、0.1、0.5 mg/L)。培养45 d后统计诱导结果。
生根率/%=(生根株数/总株数)×100
平均生根数(条)=生根根数/生根株数
1.2.4 无菌苗生根壮苗 选取已生根且茎长大于25 mm的无菌苗(若根长大于15 mm需将根切除,将丛生芽拆分为单芽)接入生根壮苗培养基。设置L9(33)正交试验设计,各因素水平分别为:培养基种类[CHB(C)(CHB+活性炭1 g/L)、花宝1号(C)(花宝1号3 g/L+蛋白胨2 g/L+活性炭1 g/L)、花宝2号(C)(花宝2号3 g/L+蛋白胨2 g/L+活性炭1 g/L)]、IBA(0、0.5、1.0 mg/L)和蔗糖(10、30、50 g/L)。培养50 d后,统计生根情况。
平均生根数/条=生根根数/生根株数
平均根长/mm=根长总和/根总数量
1.2.5 培养条件 利用智能人工气候箱进行培养,培养温度为(23±1)℃,光照强度约2 000 Lux,光照时间16 h/d。以上待检培养基每个处理分别接种8瓶,重复3次,pH5.6,附加蔗糖30 g/L(生根壮苗阶段除外),椰乳10%(原球茎诱导、生根壮苗阶段不添加),琼脂7.6 g/L。
1.2.6 炼苗移栽 将生根壮苗培养瓶开盖置于空调温室[温度(27±2)℃,光照强度约500 Lux,相对湿度60%~80%]中培养7 d,将苗取出洗净,用1 000倍百菌清溶液浸泡20 min,水苔包裹其根部后种植于松皮1份、珍珠岩1份、兰石0.5份的混合基質中(基质经高压蒸汽灭菌消毒),并在温室中按常规水肥管理进行苗期养护。
1.3 数据处理
用SPSS 21.0统计分析软件对各观测指标进行方差分析和极差分析。
2 结果与分析
2.1 不同因素对拟原球茎诱导的影响
外植体在6 d启动,节间部位隆起,9 d拟原球茎可见并继续膨大,20 d拟原球茎直径1.5 mm左右时(图1-A),需将其从茎段上剥离,并继续在原培养基中诱导。剥离并转接3 d拟原球茎启动,一周后增殖为8个(图1-B),15~20 d接入增殖、分化培养基继代培养。方差分析结果表明,2,4-D对拟原球茎诱导试验中诱导率的影响达到显著水平,而各因素对增殖系数的影响未达到显著水平(表1)。对拟原球茎诱导,比较各因素R值可知,对大苞鞘石斛拟原球茎增殖系数起主导作用的为拟原球茎的剥离直径;影响拟原球茎诱导率的三因素主次程度为2,4-D>培养基>剥离直径(表2)。根据各因素水平均值(ki)大小,可初步推断影响拟原球茎诱导的最优水平组合为1/2MS、2,4-D 0.2 mg/L、剥离直径1.5 mm,此条件下,增殖系数为12.42,诱导率达91.67%。
2.2 不同因素对拟原球茎增殖与分化的影响
诱导出的拟原球茎团继代后15~25 d生长最快,形成桑葚状聚合体(图1-C),培养30 d后,最早生成的拟原球茎开始分化为苗(图1-D),而新增殖出的无芽点的拟原球茎则继续增殖。由方差分析结果可知,NAA对鲜重增殖倍数、分化率和株高影响达到显著差异水平(表1)。通过比较表3的R值可知,各因素中对大苞鞘石斛拟原球茎增殖与分化起主导作用为NAA。拟原球茎增殖最佳水平组合为1/2MS、NAA 1 mg/L和TDZ 0 mg/L,拟原球茎鲜重增殖倍数最大,达7.35;拟原球茎分化的最佳配方为1/2MS、NAA 0.5 mg/L和TDZ 0 mg/L,利用该水平组合在相同培养条件下进行验证试验,结果显示拟原球茎分化率为35.71%,分化苗株高为14.39 mm,具有2叶,色泽深绿,长势旺盛且整齐,适合作为生根诱导阶段的外植体进行培养。
2.3 不同因素对生根诱导的影响
接入7 d,无菌苗根茎处可见不定根,25 d节间伸长开始高生长,部分幼苗生长出分蘖,45 d可继代(图1-E、F)。方差结果显示,各因素对生根诱导的影响具有一定差异性,培养基对平均根数的影响达到显著水平,而6-BA对生根率的影响达到显著水平(表1)。根据表4各因素R值大小可知,影响生根率强弱的因素表现为6-BA>培养基>IBA;对平均根数影响大小排序为培养基>6-BA>IBA。生根诱导的最佳培养配方为花宝2号、IBA 1 mg/L和6-BA 0 mg/L,生根率达100%,平均根数为4.75条。
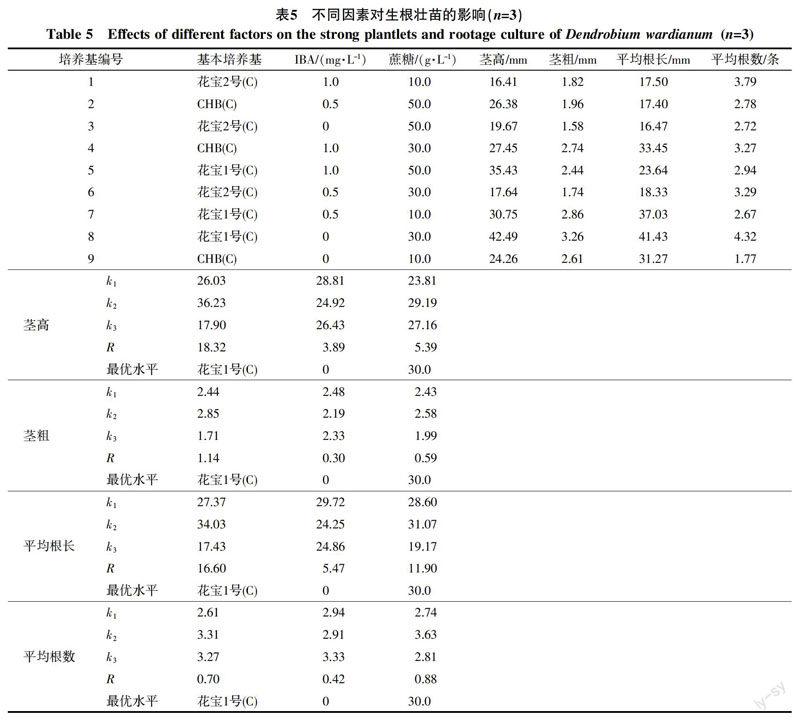
2.4 不同因素对生根壮苗的影响
观察显示,接入5~25 d无菌苗根系生长明显,20~40 d高生长旺盛节间伸长快,少部分植株老化死亡,并由新生萌蘖接替生长,35~50 d茎秆明显增粗(图1-G)。由方差分析结果可知,培养基对茎高影响达到极显著性水平,对茎粗影响达到显著水平(表1)。由表5各因素R值大小可知,培养基对于茎高、茎粗、平均根长的影响起主导作用,而影响平均根数各因素的主次程度为蔗糖>培养基>IBA。大苞鞘石斛生根壮苗阶段的最佳培养配方组合为花宝1号(C)、IBA 0 mg/L和蔗糖30 g/L。该条件下,无菌苗茎高达42.49 mm,茎粗3.26 mm,平均根数4.32条,平均根长41.43 mm。
2.5 移栽驯化培养
炼苗移栽培养30 d后,茎基部老叶易黄化脱落,69%植株已生出1片新叶,新生叶质地硬且厚(图1-H),根生长明显,新生根3.1条/株,且新生根易吸附于树皮上生长,成活率为92%。
3 讨论
大苞鞘石斛可利用多种组织器官诱导拟原球茎,如Sharma等[13]、陈娜[11]成功利用大苞鞘石斛茎尖、无菌萌发的种胚、幼苗根颈等诱导出了拟原球茎及可转化为拟原球茎的愈伤组织;而本试验成功利用大苞鞘石斛茎节上尚未分化的腋芽来诱导拟原球茎。本试验结果显示,在茎段上诱导出的拟原球茎需在直径1.5 mm时剥离母体,若直径过大或不剥离会直接分化成苗,过小则会增加死亡率;剥离母体后,诱导时间需控制在15~20 d,过长则会导致拟原球茎团变异或死亡。李守岭等[14]研究结果发现,利用齿瓣石斛茎段诱导拟原球茎无需剥离即可在茎节处增殖,可能是由于培养条件(如激素种类)或外植体基因型导致。
拟原球茎增殖分化阶段为石斛属植物扩繁的关键时期,研究表明,外源激素、碳源类型和浓度[15-16]、多胺类物质[17-18]、光照条件[19]、超声处理[20]和低温处理[15]都对石斛拟原球茎增殖分化有促进作用。其中,激素处理是最常使用的方法,研究者常添加细胞分裂素并配合一定量的生长素提高增殖分化效果,王一诺等[21]认为重唇石斛增殖效果最佳激素组合为6-BA 2.0 mg/L+6-糠氨基嘌呤(KT)0.2 mg/L+NAA 0.4 mg/L,徐玲等[22]发现铁皮石斛拟原球茎分化添加6-BA 1.0 mg/L+NAA 0.5 mg/L效果最好。但本试验结果显示,大苞鞘石斛仅添加NAA 1 mg/L拟原球茎增殖效果最好,NAA 0.5 mg/L分化效果最好,该结果与尹明华等[23]研究结果相似,认为NAA浓度低有利于铁皮石斛拟原球茎分化,浓度提升有利于增殖。
IBA为石斛属植物生根诱导中常用的外源激素,本试验结果显示,大苞鞘石斛生根诱导最佳浓度为1 mg/L IBA;而生根壮苗阶段则采用无激素培养,可能是由于大苞鞘石斛较易产生不定根,且诱导阶段无菌苗体内已有IBA积存。蔗糖在组培中的作用主要为提供碳源和调节渗透压,根据培养目的和外植体的不同,蔗糖浓度也需要调整,李璐等[24]研究结果显示,无激素的1/2MS培养基中添加白糖20 g/L有利于春石斛壯苗生根,添加白糖10 g/L适宜铁皮石斛壮苗生根,而本试验中生根壮苗蔗糖最适浓度为30 g/L。
4 结论
本试验结果表明,(1)诱导阶段:以大苞鞘石斛具有1~2个芽点的无菌苗茎段为外植体,接入拟原球茎诱导培养基1/2MS+2,4-D 0.2 mg/L+蔗糖30 g/L,当节间诱导出的拟原球茎直径达1.5 mm时将其剥离,并接入原培养基继续诱导15~20 d,诱导率达91.67%;(2)增殖阶段:将诱导出的或继代的拟原球茎团拆散,接入增殖培养基1/2MS+NAA 1 mg/L+蔗糖30 g/L+椰乳10%,继代周期25~30 d,拟原球茎鲜重增殖倍数达7.35; (3)分化阶段:将拟原球茎团接入分化培养基1/2MS+NAA 0.5 mg/L+蔗糖30 g/L+椰乳10%,培养40 d,分化率达35.71%,未分化的拟原球茎团可拆散后继续作增殖培养;(4)生根壮苗阶段:将分化的无菌苗接入花宝2号3 g/L+蛋白胨2 g/L+IBA 1 mg/L+蔗糖 30 g/L+椰乳10%进行生根诱导,培养45 d,生根率达100%;而后接入花宝1号3 g/L+蛋白胨2 g/L+蔗糖30 g/L+活性炭1 g/L进行壮苗培养,培养50 d即可炼苗出瓶或作为诱导阶段的外植体;(5)将生根苗炼苗后种植于松皮1份、珍珠岩1份、兰石0.5份的混合基质中30 d,新生根3.1条/株,成活率为92%。本试验为大苞鞘石斛快繁体系的建立及其遗传转化体系的建立提供了参考依据。
参考文献
[1] 管艳红, 马 洁, 张丽霞, 等. 西双版纳石斛属药用植物资源[J]. 中国野生植物资源, 2004, 23(6): 38-39.
[2] Glomqvist L, Brandange S, Gawell L, et al. Studies on orchidaceae alkaloids. XXXVII. Dendrowardine, a quaternary alkaloid from Dendrobium wardianum Wr[J]. Acta Chem Scand, 1973, 27: 1 439-1 441.
[3] 王再花, 章金辉, 李 杰, 等. 3种药用石斛多糖的抗氧化活性比较研究[J]. 华南师范大学学报(自然科学版), 2015, 47(5): 65-70.
[4] 李安华, 周志宏, 沈 妍, 等. 大苞鞘石斛化学成分研究[J]. 天然产物研究与开发, 2012, 24(4): 479-480.
[5] 章金辉, 王再花, 李 杰, 等. 大苞鞘石斛与铁皮石斛主要活性成分比较分析[J]. 热带作物学报, 2015, 36(12): 2 192-2 197.
[6] Luan V Q, Thien N Q, Khiem D, et al. In Vitro germination capacity and plant recovery of some native and rare orchids[C]. Proceedings of International workshop on biotechnology in agriculture. Nong Lam University Ho Chi Minh City. Vietnam, 2006: 175-177.
[7] 张小娟, 卓孝康, 胡庆林, 等. 大苞鞘石斛原球茎悬浮培养研究[J]. 中国园艺文摘, 2016, 32(11): 5-8, 178.
[8] 吴元玲, 申晓辉. 大苞鞘石斛原球茎玻璃化超低温保存技术的研究[J]. 中国细胞生物学学报, 2011, 33(3): 279-287.
[9] 刘晓东, 李晓丹, 吴元玲, 等. 大苞鞘石斛原球茎超低温保存中生理生化变化[J]. 东北林业大学学报, 2013, 41(7): 79-84.
[10] Sharma A, Tandon P, Anjani K. Regeneration of Dendrobium wardianum warner (orchidaceae) from synthetic seeds[J]. Indian Journal of Experimental Biology, 1992, 30: 747-748.
[11] 陳 娜. 两种石斛植物再生体系构建及形态发生的研究[D]. 南京: 南京林业大学, 2008: 13-34.
[12] 卓孝康, 兰思仁, 彭东辉, 等. 大苞鞘石斛胚组织培养及植株再生研究[J]. 福建林学院学报, 2014, 34(4): 289-296.
[13] Sharma A, Tandon P. In vitro culture of Dendrobium Wardianum: MorpHogenetic effects of some nitrogenous adjuvats[J]. Indian Journal Plant Physiol., 1992, 35(1): 80-85.
[14] 李守岭, 王应清, 高 燕, 等. 齿瓣石斛原球茎诱导及植株再生技术试验[J]. 热带农业科技, 2013, 36(3): 28-29, 46.
[15] Luo J P, Christoph W, Brigitte K. Enhanced micropropagation of Dendrobium huoshanense C.Z. Tang et S.J. Cheng through protocorm-like bodies: The effects of cytokinins, carbohydrate sources and cold pretreatment[J]. Scientia Horticulturae, 2009, 123(2): 258-262.
[16] Panisa P, Ronnawich S, Pongsathorn C, et al. Improving the micropropagation efficiency of hybrid Dendrobium orchids with chitosan[J]. Scientia Horticulturae, 2010, 124(4): 490-499.
[17] Wang Y, Luo J P, Wu H Q, et al. Conversion of protocorm-like bodies of Dendrobium huoshanense to shoots: The role of polyamines in relation to the ratio of total cytokinins and indole-3-acetic acidindole-3-acetic acid[J]. Journal of Plant Physiology, 2009, 166: 2 013-2 022.
[18] Wei M, Wei S H, Yang C Y. Effect of putrescine on the conversion of protocorm-like bodies of Dendrobium officinale to shoots[J]. Plant Cell, Tissue and Organ Culture, 2010, 102(2): 145-151.
[19] Lin Y, Li J, Li B, et al. Effects of light quality on growth and development of protocorm-like bodies of Dendrobium officinale in vitro[J]. Plant Cell, Tissue and Organ Culture, 2011, 105(3): 329-335.
[20] Wei M, Yang C Y, Wei S H. Enhancement of the differentiation of protocorm-like bodies of Dendrobium officinale to shoots by ultrasound treatment[J]. Journal of plant physiology, 2012, 169(8): 770-774.
[21] 王一诺, 李林轩, 韦 莹, 等. 不同浓度激素配比对重唇石斛组织培养的影响[J]. 北方园艺, 2016(10): 148-151.
[22] 徐 玲, 陈自宏, 杨晓娜, 等. 不同有机附加物对铁皮石斛原球茎增殖和组培苗生根壮苗的影响[J]. 云南农业大学学报(自然科学), 2016, 30(2): 250-256.
[23] 尹明华, 聂凤琴, 胡文韬, 等. NAA和KT对铁皮石斛原球茎增殖与分化的影响[J]. 黑龙江农业科学, 2011(8): 25-26.
[24] 李 璐, 赖钟雄, 翁 浩. 春石斛和铁皮石斛试管苗壮苗生根条件的优化[J]. 福建农林大学学报(自然科学版), 2011, 40(1): 31-36.
