香叶醇对血管平滑肌细胞增殖和迁移的影响
2017-05-25江金垚陈亚丽
江金垚,陈亚丽
(1天津医科大学第二医院,天津300211;2河北医科大学第三医院)
香叶醇对血管平滑肌细胞增殖和迁移的影响
江金垚1,陈亚丽2
(1天津医科大学第二医院,天津300211;2河北医科大学第三医院)
目的 研究香叶醇对血管平滑肌细胞(VSMCs)增殖和迁移的影响,并探讨其分子机制。方法 取雄性SD大鼠的胸腹主动脉血管,采用贴块法分离、培养VSMCs。将细胞分为阴性对照组、对照组、低浓度组及高浓度组,阴性对照组加入无FBS的DMEM培养液,对照组加入含10% FBS的DMEM培养液,低浓度组加入含10% FBS的DMEM培养液及香叶醇50 μmol/L,高浓度组加入含10% FBS的DMEM培养液及香叶醇400 μmol/L。采用MTT法检测各组细胞增殖情况,细胞划痕实验观察细胞迁移能力,Western blot法检测Ras-MEK1/2-ERK1/2信号通路的表达。结果 对照组细胞增殖的OD值较阴性对照组升高;低、高浓度组OD值低于对照组,且高浓度组低于低浓度组(P均<0.05);对照组迁移细胞数较阴性对照组增加,低、高浓度组迁移细胞数少于对照组,且高浓度组少于低浓度组(P均<0.05);对照组Ras-MEK1/2-ERK1/2信号通路激活较阴性对照组明显;低、高浓度组与对照组相比Ras-MEK1/2- ERK1/2信号通路激活受抑制,且高浓度组较低浓度组抑制效应更明显(P均<0.05)。结论 香叶醇可抑制大鼠血管平滑肌细胞增殖和迁移,其机制之一可能是抑制Ras-MEK1/2-ERK1/2通路的激活。
香叶醇;血管平滑肌细胞;细胞增殖;细胞迁移;Ras-MEK1/2-ERK1/2信号通路;丝裂原活化蛋白激酶
冠心病患者经皮冠状动脉介入治疗(PCI)术后易发生支架内再狭窄(ISR)。PCI术后血管平滑肌的增殖与迁移形成新生内膜,加上各种炎性细胞募集,细胞外基质合成,最终导致ISR发生。尽管药物洗脱支架的应用已大幅减少ISR风险,但其发生率仍超过10%[1]。香叶醇是一种植物单萜醇,具有抗细胞增殖[2]、诱导细胞凋亡[3]、阻滞细胞周期[4]、抗氧化应激[5]、降低血浆TG和TC[6]及抑制脂肪代谢相关酶表达[7]等作用,可发挥抗动脉粥样硬化的心血管保护作用。Ras-MEK1/2-ERK1/2信号通路是丝裂原活化蛋白激酶(MAPK)的经典通路之一,对细胞信号传导、细胞周期调控、细胞增殖和迁移起重要作用。2016年,我们观察了香叶醇对大鼠血管平滑肌细胞(VSMCs)增殖及迁移的影响,并检测Ras-MEK1/2-ERK1/2信号通路,以Ras表达增加及MEK1/2、ERK1/2磷酸化程度增加达到统计学差异为激活状态标准,观察其激活情况,探讨其可能的分子机制,为预防和治疗ISR提供理论依据。
1 材料与方法
1.1 材料 清洁级雄性SD大鼠,体质量80~100 g,由河北医科大学实验动物中心提供。香叶醇(Sigma公司,美国);胎牛血清(FBS);DMEM培养基;0.25%胰蛋白酶(Gibco公司,美国);MTT试剂盒(Millipore,美国);抗Ras、MEK1/2、P-MEK1/2、ERK1/2、P-ERK1/2、β-actin抗体(Cell Signaling Technology,美国),抗兔第二抗体(Rockland公司,美国)。
1.2 VSMCs的分离和培养 将大鼠常规处死,取胸腹主动脉血管,分离血管周围组织,纵向剖开血管,剪成表面积0.5~1 mm2的组织块,平铺于含FBS的无菌培养瓶底部,37 ℃、5% CO2培养箱孵育7 d,待细胞融合至80%时,用0.25%胰蛋白酶消化传代,取3~6代细胞进行实验。
1.3 细胞分组与处理 细胞生长至80%融合后,换用无FBS的DMEM培养液饥饿培养16 h,使细胞处于静止期。将细胞分为4组,阴性对照组继续用无FBS的DMEM培养液培养,对照组加入含10% FBS的DMEM培养液,低浓度组加入含10% FBS的DMEM培养液+香叶醇50 μmol/L,高浓度组加入含10% FBS的DMEM培养液+香叶醇400 μmol/L。
1.4 细胞增殖能力观察 采用MTT法。四组细胞处理24、48 h后,每孔加入MTT 5 mg/mL 40 μL,37 ℃、5% CO2孵育4 h,弃培养液,每孔加入二甲基亚砜100 μL,振荡10 min,置酶标仪上,于490 nm波长处测各孔吸光度OD值。
1.5 细胞迁移能力观察 采用细胞划痕实验。四组细胞处理24、48 h后,用无菌吸头在细胞生长至80%融合的6孔板上划一细痕。PBS洗去被刮下的细胞,继续培养24 h,低倍镜下观察细胞迁移情况。任取3个视野计数迁移细胞数量。
1.6 Ras-MEK1/2-ERK1/2相关通路蛋白检测 采用Western blot法。四组细胞培养48 h后,PBS洗涤,刮取细胞,加入PBS,离心弃上清。加入细胞裂解液裂解细胞,再以超声波粉碎细胞,离心收集上清。加入蛋白酶抑制剂,按照BCA试剂盒说明测定上清液中的蛋白浓度,收集上清蛋白样品-80 ℃保存待用。配制12% SDS-PAGE分离胶和5%浓缩胶,蛋白样品与2×上样缓冲液1∶1混合,沸水浴10 min,上样至凝胶孔,进行SDS聚丙烯酸胺凝胶电泳,5%脱脂奶粉封闭2 h,依次加入一抗(1∶200)、二抗(1∶2 000),室温孵育,TBST洗膜,加发光剂显色,Bio-Rad Geldoc 2000图像分析仪进行扫描分析。以Ras蛋白与内参β-actin的比值表示Ras的相对表达量,以磷酸化MEK通路(P-MEK)蛋白与总的MEK通路(T-MEK)蛋白的比值表示MEK的磷酸化程度,以磷酸化ERK通路(P-ERK)蛋白与总的ERK通路(T-ERK)蛋白的比值表示ERK的磷酸化程度。
2 结果
2.1 各组细胞增殖能力比较 与阴性对照组比较,对照组OD值较阴性对照组升高;低浓度组和高浓度组OD值低于对照组,且高浓度组低于低浓度组(P均<0.05)。见表1。
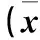
表1 各组细胞增殖能力比较±s)
注:与阴性对照组比较,aP<0.05;与对照组比较,bP<0.05;与低浓度组比较,cP<0.05。
2.2 各组细胞迁移数比较 阴性对照组、对照组、低浓度组、高浓度组细胞迁移数分别为(6.28±1.18)、(57.39±4.81)、(36.11±4.20)、(12.83±2.41)个。对照组较阴性对照组增加,低、高浓度组较对照组减少,高浓度组少于低浓度组(P均<0.05)。
2.3 各组Ras-MEK1/2-ERK1/2信号通路激活水平比较 与阴性对照组比较,对照组Ras信号通路激活明显,高浓度组和低浓度组Ras信号通路与对照组相比激活受抑制,且高浓度组较低浓度组抑制效应更明显(P均<0.05)。同样,对于Ras信号通路下游的MEK1/2和ERK1/2信号通路,对照组发生明显磷酸化,低、高浓度组磷酸化受抑制,且高浓度组较低浓度组抑制效应更明显(P均<0.05)。见表2。
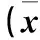
表2 各组Ras信号通路表达及MEK1/2、ERK1/2信号通路磷酸化程度比较±s)
注:与阴性对照组比较,aP<0.05;与对照组比较,bP<0.05;与低浓度组比较,cP<0.05。
3 讨论
PCI术后ISR的发生机制较复杂,目前一般认为是由于球囊扩张破坏粥样硬化斑块,致血小板黏附、聚集和激活,活化的血小板释放多种细胞因子、趋化因子和生长因子,引发平滑肌细胞增生、白细胞募集和凝血瀑布激活,平滑肌细胞由收缩状态 转变为合成状态,在血管中膜开始增殖,并逐渐由中膜迁移到内膜,随后形成新生内膜,各种炎性细胞如单核细胞、T细胞和少量B细胞在这一过程中被募集,再加上透明质酸、胶原蛋白等细胞外基质的合成,最终导致ISR的发生[8,9]。ISR实际上是局部血管损伤后的再修复过程,这个过程涉及血管弹性回缩、血栓形成、炎症因子活化以及血管平滑肌细胞增殖和凋亡[10]。
天然香叶醇能够通过抑制细胞迁移、下调增殖细胞核抗原(PCNA)表达、抑制Ras-ERK信号通路磷酸化、抑制活性氧生成等途径抑制细胞增殖以及抑制B淋巴细胞瘤-2(Bcl-2)基因家族蛋白等途径诱导细胞凋亡[2,11],抑制肿瘤细胞生长。最新研究显示,香叶醇可通过减少血浆TG、TC及抑制脂肪代谢相关酶表达发挥其抗动脉粥样硬化的作用[6,7]。本研究发现,香叶醇能显著抑制大鼠VSMCs增殖和迁移,且随着浓度增高,抑制效应更趋明显。同时发现,香叶醇能抑制增殖相关Ras-MEK1/2-ERK1/2通路的激活,且随浓度增高,抑制效应更明显。Ras-MEK1/2-ERK1/2信号通路是MAPK的经典通路,在细胞信号传导、细胞周期调控中起重要作用[12]。在这一通路中,Ras是上游信号蛋白,引导细胞周期由G1期进入S期,而ERK1/2对细胞增殖和迁移至关重要[13]。多种细胞因子、生长因子、炎症因子等刺激信号,激活Ras原癌基因所介导的Ras-MEK1/2-ERK1/2信号传导通路,引起ERK1/2发生磷酸化激活,导致细胞周期蛋白Cyclin D等合成增加,引起蛋白合成和细胞增殖[14]。
综上所述,香叶醇具有抑制大鼠VSMCs增殖和迁移的作用,其机制与抑制增殖相关Ras-MEK1/2-ERK1/2信号通路激活有关,为香叶醇用于预防ISR提供了理论依据。
[1] Giacoppo D, Gargiulo G, Aruta PT, et al. Treatment strategies for coronary in-stent restenosis: systematic review and hierarchical Bayesian network meta-analysis of 24 randomised trials and 4880 patients[J]. BMJ, 2015,351(6364):1-18.
[2] Wittig C, Scheuer C, Parakenings J, et al. Geraniol suppresses angiogenesis by downregulating vascular endothelial growth factor (VEGF)/VEGFR-2 signaling[J]. PLoS One, 2015,10(7):e0131946.
[3] Galle M, Crespo R, Kladniew BR, et al. Suppression by geraniol of the growth of A549 human lung adenocarcinoma cells and inhibition of the mevalonate pathway in culture and in vivo: potential use in cancer chemotherapy[J]. Nutr Cancer, 2014,66(5):888-895.
[4] Kim SH, Bae HC, Park EJ, et al. Geraniol inhibits prostate cancer growth by targeting cell cycle and apoptosis pathways[J]. Biochem Biophys Res Commun, 2011,407(1):129-134.
[5] Jayachandran M, Chandrasekaran B, Namasivayam N. Geraniol attenuates oxidative stress by Nrf2 activation in diet-induced experimental atherosclerosis[J]. J Basic Clin Physiol Pharmacol, 2015,26(4):335-346.
[6] Galle M, Kladniew BR, Castro MA, et al. Modulation by geraniol of gene expression involved in lipid metabolism leading to a reduction of serum-cholesterol and triglyceride levels[J]. Phytomedicine, 2015,22(7/8):696-704.
[7] Jayachandran M, Chandrasekaran B, Namasivayam N. Effect of geraniol,a plant derived monoterpene on lipids and lipid metabolizing enzymes in experimental hyperlipidemic hamsters[J]. Mol Cell Biochem, 2015,398(1/2):39-53.
[8] Jolly K, Gill P. Ethnicity and cardiovascular disease prevention: practical clinical considerations[J]. Curr Opin Cardiol, 2008,23(5):465-470.
[9] Yin RX, Yang DZ, Wu JZ. Nanoparticle drug- and gene-eluting stents for the prevention and treatment of coronary restenosis[J]. Theranostics, 2014,4(2):175-200.
[10] Guildford AL, Stewart HJ, Morris C, et al. Substrate-induced phenotypic switches of human smooth muscle cells: an in vitro study of in-stent restenosis activation pathways[J]. J R Soc Interface, 2011,8(58):641-649.
[11] Chaudhary SC, Siddiqui MS, Athar M, et al. Geraniol inhibits murine skin tumorigenesis by modulating COX-2 expression,Ras-ERK1/2 signaling pathway and apoptosis[J]. J Appl Toxicol, 2013,33(8):828-837.
[12] Raman M, Chen W, Cobb MH. Differential regulation and properties of MAPKs[J]. Oncogene, 2007,26(22):3100-3112.
[13] Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer[J]. Oncogene, 2007,26(22):3291-3310.
[14] Roovers K, Davey G, Zhu X, et al. Alpha5beta1 integrin controls cyclin D1 expression by sustaining mitogen-activated protein kinase activity in growth factor-treated cells[J]. Mol Biol Cell, 1999,10(10):3197-3204.
10.3969/j.issn.1002-266X.2017.06.009
R541.4
A
1002-266X(2017)06-0029-03
2016-06-15)
