稳定表达Notch1胞内结构域肺腺癌细胞株的构建及鉴定
2017-05-25邹斌吴霞周学亮詹宇亮赖松青刘季春
邹斌,吴霞,周学亮,詹宇亮,赖松青,刘季春
(南昌大学第一附属医院,南昌330006)
稳定表达Notch1胞内结构域肺腺癌细胞株的构建及鉴定
邹斌,吴霞,周学亮,詹宇亮,赖松青,刘季春
(南昌大学第一附属医院,南昌330006)
目的 构建Notch1胞内结构域(N1ICD)稳定表达的肺腺癌A549细胞株。方法 采用PCR方法扩增N1ICD基因,构建慢病毒重组质粒pHBLV-N1ICD-ZsGreen-Puro(LV-N1ICD),采用PCR和基因测序鉴定重组质粒。高纯度无内毒素抽提慢病毒重组质粒和辅助包装原件载体质粒,使用慢病毒空载质粒(LV-ZsGreen-Puro)和LV-N1ICD共转染293T细胞包装慢病毒,利用药物筛选法测定病毒滴度。将A549细胞分成A549-N1ICD组和A549-ZsGreen-Puro组,分别加入LV-N1ICD和LV-ZsGreen-Puro,取制备好的慢病毒感染A549细胞,加入嘌呤霉素筛选稳定转染细胞株,荧光显微镜观察转染效率,以带有绿色荧光的细胞初步视为稳定转染的细胞株。以A549细胞为对照组,进一步采用qPCR和Western blot方法分别检测N1ICD mRNA及蛋白表达。结果 PCR及基因测序结果表明pHBLV-N1ICD-ZsGreen-Puro重组质粒构建成功。LV-N1ICD组病毒滴度为1×108TU/mL,LV-ZsGreen-Puro组病毒滴度为1×108TU/mL。经嘌呤霉素筛选后,荧光显微镜下观察细胞形态无明显变化,A549-ZsGreen-Puro组和A549-N1ICD组70%~80%的细胞带有绿色荧光。对照组、A549-ZsGreen-Puro组、A549-N1ICD组的N1ICD mRNA相对表达量分别为1.59±0.11、1.09±0.10、70.81±6.39,A549-N1ICD组高于其他两组(P均<0.01)。三组N1ICD蛋白相对表达量分别为1.99±0.13、1.73±0.08、6.58±0.43,A549-N1ICD组高于其他两组(P均<0.01)。结论 成功构建了稳定表达N1ICD的肺腺癌A549细胞株。
肺腺癌;Notch蛋白;胞内结构域;慢病毒重组质粒
Notch信号通路是邻近细胞间重要的信息传递方式。Notch蛋白是一种跨膜受体蛋白,包括膜外结构域、跨膜结构域及胞内结构域(ICD)。当Notch受体与细胞膜表面的配体结合后,Notch信号通路被激活,随后受体的ICD被释放进入细胞核,激活下游靶基因,在细胞增殖、分化及凋亡中发挥重要作用[1]。研究发现,非小细胞肺癌(NSCLC)患者Notch1信号通路异常是相对频繁的生物学事件[2],对NSCLC的细胞生物学行为(肿瘤发生、增殖、凋亡等)具有重要影响[3,4],且Notch1信号分子表达与NSCLC患者的预后相关[5~7]。2016年4~7月,我们通过慢病毒感染在肺腺癌A549细胞株中构建稳定表达的Notch1胞内结构域(N1ICD),为进一步探讨Notch1信号通路在NSCLC中的生物学作用奠定基础。
1 材料与方法
1.1 材料 肺腺癌A549细胞株、人胚肾293T细胞株购自ATCC公司;大肠杆菌菌株DH5α购自Invitrogen公司;慢病毒包装系统pHBLV-ZsGreen-Puro,辅助包装质粒pSPAX2、pMD2G购自Hanbio公司。限制性内切酶、DNA ladder,Fermentas公司;一步式克隆试剂盒,南京诺唯赞生物科技有限公司;琼脂糖凝胶回收试剂盒,Axygen公司;质粒DNA大抽提取试剂盒,Qiagen公司;LipofiterTM,Hanbio公司;RPMI1640培养基、0.25%胰蛋白酶,Solarbio公司;胎牛血清,Gibco公司;嘌呤霉素,Sigma公司;Reverse Transcriptase,QPCR mix,TOYOBO公司;兔抗activated Notch1多克隆抗体,Abcam公司;鼠抗β-actin单克隆抗体,Cell signaling technology公司;辣根过氧化物酶标记的山羊抗兔、山羊抗鼠抗体,北京中杉金桥生物技术有限公司;SuperSignal®West Femto试剂盒,Thermo scientific公司。实时荧光定量PCR仪(Roche,LightCycler 96);蛋白电泳仪(Bio-Rad);化学发光成像系统(GE,LAS4000)。
1.2 慢病毒重组质粒的构建及鉴定 根据基因库中的人Notch1基因编码序列(NCBI Reference Sequence:NM_017617.3),Primer Premier 5.0设计N1ICD克隆引物,上游引物:5′-GGATCTATTTCCGGTGAATTCGCCACCATGCTGCTGTCCCGCAA-3′;下游引物:5′-GGATCCGCGGCCGCTTCTAGACTTGAAGGCCTCCGGAAT-3′,EcoRⅠ、XbaⅠ酶切位点由Hanbio公司合成。PCR法获得N1ICD片段,1%琼脂糖凝胶电泳鉴定PCR产物。处理好的目的片段N1ICD及pHBLV-ZsGreen-Puro载体行重组反应,生成重组慢病毒pHBLV-N1ICD-ZsGreen-Puro(LV-N1ICD),转化化学感受态细胞DH5α,接种于含100 μg/mL氨苄青霉素的LB平板培养皿过夜,第2天挑选单克隆菌落,加入含氨苄青霉素的LB液态培养基,37 ℃培养14 h,进行PCR及测序鉴定。
1.3 慢病毒包装、浓缩及滴度测定 制备好的慢病毒重组质粒及其辅助包装原件载体质粒pSPAX2、pMD2G使用大抽试剂盒进行高纯度无内毒素抽提,分成慢病毒空载组(LV-ZsGreen-Puro)和LV-N1ICD组,两组共转染293T细胞,加入LipofiterTM转染试剂,转染后6 h更换为完全培养基,分别于培养48、72 h收集2次病毒,将病毒离心浓缩。采用药物筛选法测定病毒滴度。将病毒进行3倍梯度稀释,连续6个稀释度,分别加入生长状态良好的293T细胞,24 h后,将培养液更换为含嘌呤霉素2.5 μg/mL的培养液。48 h后在显微镜下观察结果,以活细胞10%~30%的孔计算病毒滴度。病毒滴度=细胞数×感染复数(MOI)×病毒稀释倍数×103。
1.4 慢病毒载体介导N1ICD稳定表达A549细胞株筛选 将A549细胞按5×105/孔加入6孔板,分成A549-N1ICD组和A549-ZsGreen-Puro组,分别加入LV-N1ICD和LV-ZsGreen-Puro。先加入含慢病毒(MOI=20)的半量培养液(含5 μg/mL聚凝胺),4 h后再补充另半量培养液(含5 μg/mL聚凝胺),24 h后换完全培养基。48 h后更换含嘌呤霉素2 μg/mL的完全培养液进行筛选,每隔2~3 d换液、传代。由于该病毒同时带有GFP报告基因及嘌呤霉素抗性基因,成功转染后的细胞将存活,并在荧光显微镜下呈绿色荧光。反复筛选2周左右,带有绿色荧光的细胞初步视为稳定转染的细胞株。
1.5 稳定表达N1ICD的A549细胞株鉴定 取A549-N1ICD组和A549-ZsGreen-Puro组细胞,以A549细胞为对照组。
1.5.1 N1ICD mRNA检测 采用qPCR方法。TRIzol法提取细胞总RNA,逆转录酶合成cDNA。以GAPDH为内参基因,设计并合成引物。N1ICD引物序列为:上游5′-ACCAATACAACCCTCTGCGG-3′,下游5′-GGCCCTGGTAGCTCATCATC-3′;GAPDH引物序列为:上游5′-TCAAGGCTGAGAACGGGAAG-3′,下游5′-TCGCCCCACTTGATTTTGGA-3′。qPCR反应条件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 20 s,共40个循环。读取基因扩增的Ct值,以GAPDH为内参,采用2-ΔΔCt法计算N1ICD mRNA的相对表达量。
1.5.2 N1ICD蛋白检测 采用Western blot法。使用细胞裂解液提取细胞总蛋白,BCA法测定蛋白浓度。聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,分离胶浓度为10%。采用湿转法将蛋白转移到硝酸纤维素膜,5%牛奶室温封闭1 h。分别加入稀释的一抗、兔抗activated Notch1多克隆抗体(1∶500)、鼠抗β-actin单克隆抗体(1∶2 000),4 ℃过夜。加入辣根过氧化物酶标记的二抗(1∶2 000),室温孵育1 h,化学发光成像系统检测。Quantity One软件对蛋白条带进行半定量分析,以目标蛋白与β-actin的比值表示N1ICD蛋白的相对表达量。实验重复3次取平均值。
1.6 统计学方法 采用SPSS17.0统计软件。组间样本比较采用Student-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 LV-N1ICD重组质粒鉴定结果 PCR扩增N1ICD序列,1%琼脂糖凝胶电泳,获得一条与预计相符的特异性条带(图1)。扩增序列及pHBLV-CMVIE-ZsGreen-Puro载体经酶切回收后进行重组反应,转化化学感受态细胞DH5α,挑选单克隆菌落摇菌,菌液行PCR鉴定,可见一条与预计相符的特异性条带(图2)。阳性克隆菌液经测序公司测序,与NCBI数据库中基因序列对比分析,核苷酸序列完全一致。测序无突变的克隆命名为LV-N1ICD重组质粒。
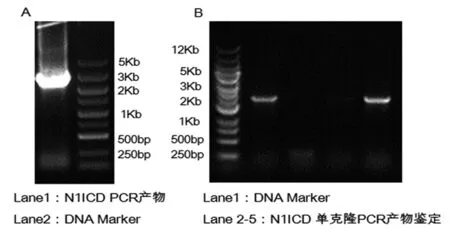
注:1为 N1ICD PCR产物;2为DNA Marker。
图1 N1ICD PCR产物鉴定

注:1为DNA Marker;2~5为N1ICD单克隆PCR产物。
图2 pHBLV- N1ICD-ZsGreen-Puro重组质粒鉴定
2.2 N1ICD慢病毒滴度 LV-N1ICD组病毒稀释倍数为30倍,活细胞数估计为4×103,MOI=1,滴度约为1×108TU/mL。LV-ZsGreen-Puro组病毒滴度为1×108TU/mL。
2.3 慢病毒载体介导N1ICD稳定表达的A549细胞株筛选结果 经嘌呤霉素筛选后,荧光显微镜下观察细胞形态无明显变化,A549-ZsGreen-Puro组和A549-N1ICD组70%~80%的细胞带有绿色荧光。
2.4 稳定表达N1ICD的A549细胞株鉴定结果 对照组、A549-ZsGreen-Puro组、A549-N1ICD组的N1ICD mRNA相对表达量分别为1.59±0.11,1.09±0.10,70.81±6.39,A549-N1ICD组高于其他两组(P均<0.01)。三组N1ICD蛋白相对表达量分别为1.99±0.13、1.73±0.08、6.58±0.43,A549-N1ICD组高于其他两组(P均<0.01)。提示慢病毒载体介导N1ICD稳定表达的A549细胞株构建成功。
3 讨论
Notch信号通路异常与多种恶性肿瘤相关[8~10]。其作为癌基因或抑癌基因在肿瘤形成过程中发挥重要作用。10%的NSCLC患者存在Notch1基因的激活突变,30%的NSCLC患者因抑制因子Numb下调导致N1ICD激活[2]。Meta分析显示,Notch1高表达与淋巴结转移及更晚TNM分期相关,Notch1表达与NSCLC总生存率呈负相关,其靶基因Hes1的过表达与总生存率低相关[5]。然而,一些体外研究表明,Notch1信号通路对NSCLC细胞增殖和凋亡的影响取决于微环境[11~14]。例如,过表达N1ICD可诱导肺腺癌细胞凋亡,而在缺氧环境下,Notch1又可促进细胞增殖和存活[11,13]。因此,研究Notch1信号通路对NSCLC细胞的生物学影响,必须考虑肿瘤微环境因素。近年研究发现,Notch信号通路在诱导和维持肺癌干细胞特性中发挥重要作用[15]。
慢病毒转染系统是构建稳定过表达或干扰表达细胞系的主要方式[16]。慢病毒插入细胞基因组可获得稳定表达,持续时间较长。而腺病毒尽管滴度高、转染效率较高,但其不整合到基因组,无法稳定表达,不适合长周期实验。本研究采用慢病毒作为载体,通过筛选稳定转染细胞株,解决其转染效率低的问题。A549细胞是体内、体外实验常用的NSCLC细胞株,常规培养条件下A549细胞的N1ICD呈低表达状态[11]。为研究Notch1信号通路对其生物学影响,选择慢病毒过表达载体激活该信号通路是较好的方式。本研究应用慢病毒载体系统先构建pHBLV-N1ICD-ZsGreen-Puro重组质粒,PCR鉴定及基因测序确保构建的准确性。我们采用较低病毒浓度感染A549细胞,以尽量减小病毒对细胞活力的影响。利用该病毒带有嘌呤霉素抗性,采用药物筛选法筛选出稳定转染的细胞株。成功转染后的细胞对嘌呤霉素产生抵抗,而未转染的细胞对其敏感。经反复药物筛选,稳定转染的细胞存活。同时该病毒带有GFP报告基因,成功转染后的细胞将表达绿色荧光蛋白,在荧光显微镜下可以观察到。本研究观察到70%~80%的细胞呈绿色荧光,剩余细胞荧光较弱或未见荧光,这可能与未转染的细胞原发性耐药或者转染后细胞活力降低有关。进一步行qPCR和Western blot检测显示A549-N1ICD组N1ICD水平明显高于其他两组。荧光显微镜、qPCR和Western blot结果共同验证了N1ICD稳定表达的肺腺癌细胞株构建成功,从而为后续实验奠定了良好的基础。
[1] Hori K, Sen A, Artavanis-Tsakonas S. Notch signaling at a glance[J]. J Cell Sci, 2013,126(10):2135-2140.
[2] Westhoff B, Colaluca IN, D′Ario G, et al. Alterations of the Notch pathway in lung cancer[J]. Proc Natl Acad Sci USA, 2009,106(52):22293-22298.
[3] Baumgart A, Mazur PK, Anton M, et al. Opposing role of Notch1 and Notch2 in a KrasG12D-driven murine non-small cell lung cancer model[J]. Oncogene, 2015,34(5):578-588.
[4] Wael H, Yoshida R, Kudoh S, et al. Notch1 signaling controls cell proliferation, apoptosis and differentiation in lung carcinoma[J]. Lung Cancer, 2014,85(2):131-140.
[5] Donnem T, Andersen S, Al-Shibli K, et al. Prognostic impact of Notch ligands and receptors in nonsmall cell lung cancer[J]. Cancer, 2010,116(24):5676-5685.
[6] Li Y, Burns JA, Cheney CA, et al. Distinct expression profiles of Notch-1 protein in human solid tumors: Implications for development of targeted therapeutic monoclonal antibodies[J]. Biologics, 2009,4(4):163-171.
[7] Yuan X, Wu H, Xu H, et al. Meta-analysis reveals the correlation of Notch signaling with non-small cell lung cancer progression and prognosis[J]. Sci Rep, 2015,5(25):421-441.
[8] Dang TP, Gazdar AF, Virmani AK, et al. Chromosome 19 translocation, overexpression of Notch3, and human lung cancer[J]. J Natl Cancer Inst, 2000,92(16):1355-1357.
[9] Grabher C, Von BH, Look AT. Notch 1 activation in the molecular pathogenesis of T-cell acute lymphoblastic leukaemia[J]. Nat Rev Cancer, 2006,6(5):347-359.
[10] Santagata S, Demichelis F, Riva A, et al. JAGGED1 expression is associated with prostate cancer metastasis and recurrence[J]. Cancer Res, 2004,64(19):6854-6857.
[11] Chen Y, De Marco MA, Graziani I, et al. Oxygen concentration determines the biological effects of NOTCH-1 signaling in adenocarcinoma of the lung[J]. Cancer Res, 2007,67(17):7954-7959.
[12] Ji X, Wang Z, Geamanu A, et al. Inhibition of cell growth and induction of apoptosis in non-small cell lung cancer cells by delta-tocotrienol is associated with notch-1 down-regulation[J]. J Cell Biochem, 2011,112(10):2773-2783.
[13] Chen Y, Li D, Liu H, et al. Notch-1 signaling facilitates survivin expression in human non-small cell lung cancer cells[J]. Cancer Biol Ther, 2011,11(1):14-21.
[14] Ding XY, Ding J, Wu K, et al. Cross-talk between endothelial cells and tumor via delta-like ligand 4/Notch/PTEN signaling inhibits lung cancer growth[J]. Oncogene, 2012,31(23):2899-2906.
[15] Hassan KA, Wang L, Korkaya H, et al. Notch pathway activity identifies cells with cancer stem cell-like properties and correlates with worse survival in lung adenocarcinoma[J]. Clin Cancer Res, 2013,19(8):389-416.
[16] Khetawat D, Broder CC. A functional henipavirus envelope glycoprotein pseudotyped lentivirus assay system[J]. Virol J, 2010,7(1):2760-2761.
Construction and identification of lung adenocarcinoma cell line with stable expression of N1ICD
ZOUBin,WUXia,ZHOUXueliang,ZHANYuliang,LAISongqing,LIUJichun
(TheFirstAffiliatedHospitalofNanchangUniversity,Nanchang330006,China)
Objective To construct a lung adenocarcinoma cell line A549 with stable expression of Notch1 intracellular domain (N1ICD). Methods The N1ICD fragment was amplified by PCR, which was used to construct pHBLV-N1ICD-ZsGreen-Puro plasmid (LV-N1ICD). The recombinant plasmid was identified by PCR and gene sequencing. LV-N1ICD was packaged by transfection of 293T cells with recombinant plasmid and auxiliary plasmids which were purified without endotoxin extraction. Lentivirus empty plasmid(LV-ZsGreen-Puro)was also constructed. Drug screening method was used to determine the titer of LV-N1ICD and LV-ZsGreen-Puro. A549 cells were divided into A549-N1ICD group and A549-ZsGreen-Puro group. Puromycin was used to screen stable transfection cell line after infection of A549 cell with LV-N1ICD or LV-ZsGreen-Puro. Transfection efficiency was observed by fluorescence microscope and cells with green fluorescent were preliminarily identified as stable transfection cell lines. Taking A549 cells as the control group, and N1ICD mRNA and protein expression was further detected by qPCR and Western blotting, respectively. Results PCR and gene sequencing showed that pHBLV-N1ICD-ZsGreen-Puro plasmid was successfully constructed. The titer of LV-N1ICD was 1×108TU/mL and the LV-ZsGreen-Puro was 1×108TU/mL. Cells shape had no obvious changes and green fluorescence was detected in about 70%-80% cells of the A549-ZsGreen-Puro and A549-N1ICD group by fluorescence microscope after Puromycin screening. The N1ICD mRNA expression of the control group, A549-ZsGreen-Puro group and A549-N1ICD group was 1.59±0.11, 1.09±0.10 and 70.81±6.39, respectively and the N1ICD mRNA expression of the A549-N1ICD group was significant higher than that of the other two groups (allP<0.01). The N1ICD protein expression of the three groups was 1.99±0.13, 1.73±0.08 and 6.58±0.43, respectively and the N1ICD protein expression of the A549-N1ICD group was significant higher than that of the other two groups (allP<0.01).Conclusions A lung adenocarcinoma cell line A549 with stable expression of N1ICD was successfully constructed.
lung adenocarcinoma; Notch protein; intracellular domain; lentivirrus
国家自然科学基金资助项目(81570262);江西省研究生创新专项资金(YC2015-B009)。
邹斌(1980-),主治医师,博士研究生。主要研究方向为肺癌的综合治疗。E-mail: doctorzb@sina.cn
刘季春(1960-),博士,教授,主任医师。主要研究方向为肺癌的综合治疗。E-mail: liujichun999@163.com
10.3969/j.issn.1002-266X.2017.06.002
R734.2
A
1002-266X(2017)06-0005-04
2016-09-24)
