影响羊乳中环核苷酸质量浓度的化学因素
2017-05-17于玲玲张富新邵玉宇雷飞艳候院林
于玲玲, 张富新, 邵玉宇, 云 丹, 雷飞艳, 候院林, 艾 对
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
影响羊乳中环核苷酸质量浓度的化学因素
于玲玲, 张富新*, 邵玉宇, 云 丹, 雷飞艳, 候院林, 艾 对
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
研究了pH、金属离子和抗氧化剂等化学因素对羊乳中环核苷酸质量浓度的影响。结果表明,羊乳中pH为3时cAMP质量浓度最高,pH为2时cGMP质量浓度最高;Ca2+、Cu2+、Fe2+、Ni2+、Mg2+、Mn2+、Zn2+对羊乳中cAMP质量浓度有促进作用,而Cd2+可降低羊乳中cAMP的质量浓度;Ca2+、Co2+、Mg2+、Zn2+对羊乳中cGMP质量浓度有促进作用,而Fe2+、Ni2+对羊乳中cGMP质量浓度有降低作用;在羊乳贮存2~4 d内抗氧化剂可降低羊乳中cAMP和cGMP的质量浓度,在4 d后可促进羊乳中cAMP和cGMP质量浓度。
环核苷酸;pH值;金属离子;抗氧化剂
羊奶营养丰富,富含蛋白质、脂肪、乳糖、矿物质和维生素等多种营养物质以及环核苷酸(Cyclic Nucleotides,CNT)、生长因子等生物活性物质[1-2]。相对于牛奶,羊奶具有独特的生理功能[3],羊奶脂肪球较小,易于消化吸收,且羊奶中含有蛋白质过敏原αs1-酪蛋白较少[4-5],适用于易过敏人群。除此之外,羊奶还含有一定量的环核苷酸,主要包括环腺苷酸(cyclic adenosinemonophosphate,cAMP)和环鸟苷酸(cyclic guanosinemonophosphate,cGMP),有益于大脑健康发育[6]。近年来,人们对乳中环核苷酸十分关注,有研究发现一些维生素以及人体必须的微量元素等对乳中环核苷酸的质量浓度有影响,维生素C可清除体内过氧化物,保护生物膜的完整结构,增强核苷酸环化酶(Nucleotides cyclase,NC)的活性,使乳中环核苷酸质量浓度增加[7];Wickson[8]研究发现,金属离子Li2+和Ca2+有改变核苷酸环化酶(NC)和磷酸二酯酶 (phosphodiesterase,PDE)活性的作用,对体内环核苷酸质量浓度有一定影响。作者较为系统地研究了基本化学因素pH、金属离子和抗氧化剂对羊乳中环核苷酸质量浓度的影响,为开发功能性羊乳产品提供参考。
1 材料与方法
1.1 材料与仪器
羊奶:来自西北农林科技大学羊场的混合乳样,取后分装于50mL的离心管中,立即在-40℃下冷冻保存,分析前在4℃下解冻;
主要试剂:氯化铜(CuCl2)、氯化镁(MgCl2)、氯化锌(ZnCl2)、氯化钙(CaCl2)、氯化亚铁(FeCl2)、氯化钴(CoCl2)、氯化镉(CdCl2)、氯化镍(NiCl2)、氯化锰(MnCl2)、氯化氢(HCl)、氢氧化钾(KOH)、三氯乙酸(TCA)、高氯酸(HClO4)(AR):天津天力化学试剂有限公司产品。
抗氧化剂:叔丁基对苯二酚(TBHQ)、2,6-二叔丁基对甲酚(BHT)、叔丁基羟基茴香醚(BHA)、没食子酸正丙酯(PG)、抗坏血酸(VC)、生育酚(VE)(食品级):西安晶博试剂有限公司产品。
主要仪器:TGL-16B型台式离心机:上海安亭科学仪器厂产品;PHS-3C pH计:上海精科仪器有限公司产品;GSP-9080MBE型隔水式恒温培养箱:上海博迅实业有限公司医疗设备厂产品;Multiskan Go型全波长酶标仪:美国热电公司产品。
1.2 实验方法
1.2.1 pH值对羊乳中环核苷酸质量浓度影响 取15 mL乳样于20mL试管中,用1 mol/L HCl或1 mol/L KOH调节乳样的pH分别为2、3、4、5、6、7、8、9、10、11、12、13,在室温下保存2 h,测定其CNT质量浓度。以未处理乳样作为空白对照。
1.2.2 金属离子对羊乳中环核苷酸质量浓度影响取990μL的乳样于2 mL的试管中,分别加入10 μL浓度为 100μmol/L或 10 mmol/L的 CuCl2、MgCl2、ZnCl2、CaCl2、FeCl2、CoCl2、CdCl2、NiCl2、MnCl2溶液,使乳样中金属离子最终浓度分别达到1 μmol/L或100μmol/L后,将其混合均匀,于室温下保存2 h,测定其CNT质量浓度。以未处理乳样作为空白对照。
1.2.3 抗氧化剂对羊乳中环核苷酸质量浓度影响称取0.02 g的TBHQ、BHT、BHA、PG、VC、VE分别加入到100 mL的羊乳中,用涡旋振荡器振荡1 min,使其充分混匀。取1 mL添加抗氧化剂的乳样于2 mL的试管中,在4℃下保存8 d,每隔1 d取样测定其CNT质量浓度。同时将未处理乳样在同条件贮藏,作为空白对照。
1.2.4 环核苷酸的测定 样品处理:取0.5 mL乳样于2mL离心管中,加入等体积的体积分数1%的高氯酸和体积分数10%的三氯乙酸(TCA),混合均匀后在3 000 g下离心15min,去除上层脂肪和沉淀。取上清液,用1 mol/L的KOH调节其pH至6.7(羊乳天然pH),用于CNT质量浓度测定。
环核苷酸测定:cAMP和cGMP采用酶联免疫(ELISA)试剂盒测定。将试剂盒在室温(20℃)下平衡20min后,取出试剂盒中板条。取10μL处理后的样品加入板条反应孔中,接着加入样品稀释液40 μL,再加入辣根过氧化物酶(HRP)标记的抗体液50 μL,用封板膜封住反应孔后,在37℃下保温60 min。然后弃去反应孔中液体,将板条翻转,在滤纸上拍干。在反应后的反应孔中加入350μL洗涤液,静置1 min后,弃去洗涤液,在滤纸上拍干,如此重复5次。在洗涤后的板条反应孔中加入底物A、B各50μL,37℃避光保温15min。最后在反应孔中加入终止液50μL,15min内在450 nm波长处测定各孔吸光度。每个样品重复3次。
环核苷酸标准曲线的绘制:用上述方法检测不同质量浓度cAMP(cGMP)标准品的吸光度,然后以质量浓度为横坐标(X),OD值为纵坐标(Y),绘制cAMP(cGMP)标准曲线。计算线性回归方程,按回归方程计算各样品cAMP和cGMP质量浓度。
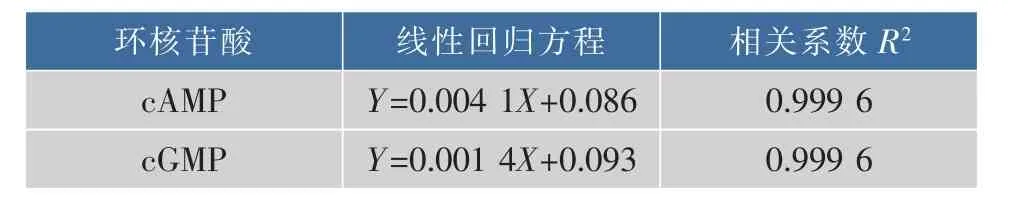
表1 环核苷酸的回归方程及相关系数Table 1 Linear regression equations and their correlation coefficients of CNT
1.3 数据分析
数据分别采用Excel 2003、DPS 7.05软件绘图和方差分析。
2 结果及分析
2.1 pH对羊乳中环核苷酸质量浓度的影响
由图1可以看出,当pH为2时,羊乳中cAMP质量浓度为(2 558.92±54.16)ng/mL;pH为3时,羊乳中cAMP质量浓度明显增大,达到 (5 493.12± 94.36)ng/mL;当pH大于3时,羊乳中cAMP的质量浓度逐渐降低;当pH为13时,羊乳中cAMP质量浓度降低到(638.41±19.51)ng/mL。羊乳中cGMP质量浓度在pH为2时最高,达到 (18 000.77± 240.61)pg/mL,之后随pH的增大呈逐渐降低的趋势;当pH达到13时,羊乳中cGMP质量浓度降低到(4 871.40±262.33)pg/mL。未经pH处理的乳样中cAMP和cGMP质量浓度分别为 (1 592.59±68.21)ng/mL和(4 982.29±268.84)pg/mL,在pH为3时羊乳中cAMP质量浓度达最高,比未处理乳样增加了245%,pH大于3时,羊乳中cAMP的质量浓度逐渐下降,当pH大于7时,羊乳中cAMP质量浓度均显著低于未处理羊乳中cAMP质量浓度;在pH为2时羊乳中cGMP质量浓度最高,比未处理乳样增加了261%。由此可见,在酸性环境下羊乳中cAMP和cGMP质量浓度明显增大,而在碱性环境下羊乳中cAMP和cGMP质量浓度明显降低。

图1 pH对羊乳中CNT质量浓度的影响Fig.1 Effect of pH on contents of CNT
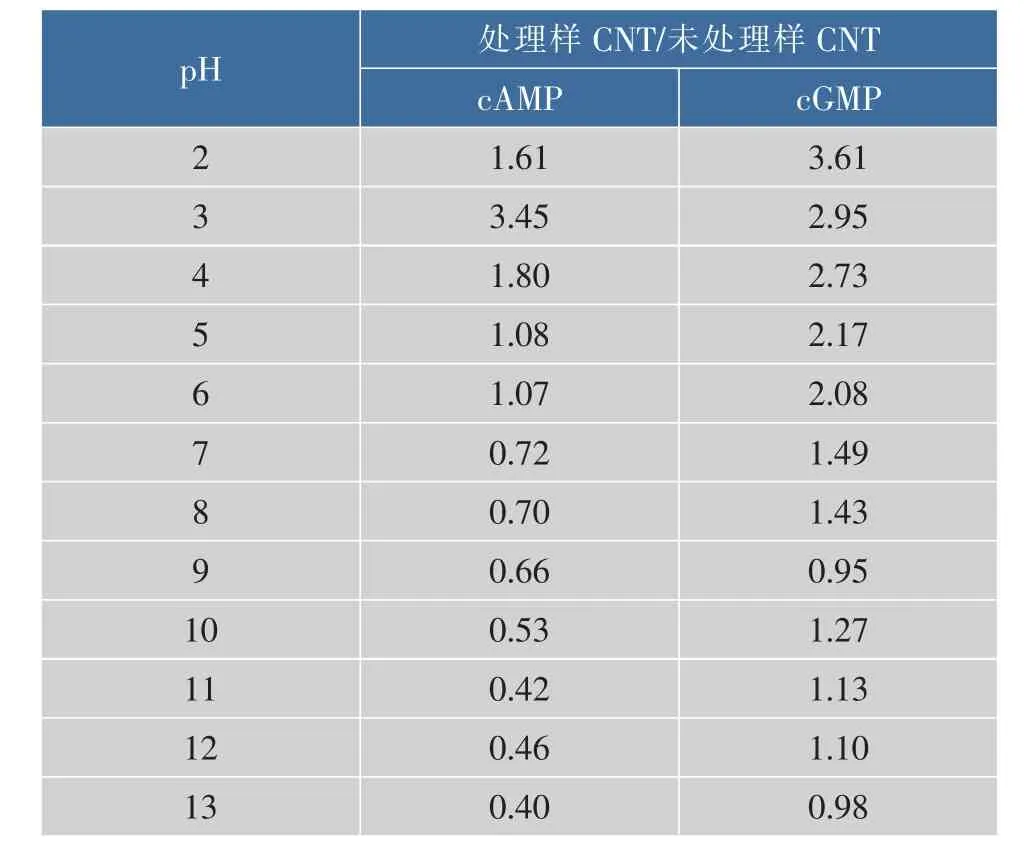
表2 不同pH处理羊乳与未处理羊乳中CNT的质量浓度比Table 2 Ratio between CNT contents in different pH treated goat m ilk and CNT contents in untreated goatm ilk
2.2 金属离子对羊乳中环腺苷酸质量浓度的影响
由表3、表4可知,当羊乳中Ca2++、Cu2+、Fe2+、Ni2+、Mg2+、Mn2+和Zn2+浓度为1μmol/L时,羊乳的cAMP质量分数分别增加了70%、44%、113%、37%、74%、79%和72%;当羊乳中这些离子浓度增加到100μmol/L时,羊乳中cAMP质量浓度也有不同程度的增加,表明Ca2+、Cu2+、Fe2+、Ni2+、Mg2+、Mn2+和Zn2+离子对羊乳中cAMP质量浓度有促进作用。当羊乳中Cd2+浓度为1μmol/L时,羊乳中cAMP质量浓度下降了88%;当羊乳中Cd2+浓度增加到100μmol/L时,羊乳中cAMP质量浓度也有所降低,表明Cd2+离子对羊乳中cAMP质量浓度有降低作用。然而Co2+对羊乳中cAMP质量浓度有不同的影响,当羊乳中Co2+浓度为1μmol/L时,羊乳中cAMP质量浓度较未处理乳样增加36%,而当羊乳中Co2+浓度为100 μmol/L时,羊乳中cAMP质量浓度比未处理羊乳降低18%,表明低浓度(1μmol/L)Co2+对羊乳中cAMP质量浓度有促进作用,而高浓度(100μmol/L)Co2+对羊乳中cAMP有降低作用。
由表3、表4可知,当羊乳中Ca2+、Co2+、Mg2+和Zn2+浓度为1μmol/L时,羊乳中cGMP质量浓度分别增加了22%、6%、13%和11%;当羊乳中这些离子浓度增加到100μmol/L时,羊乳中cGMP质量浓度也有不同程度的增加,表明Ca2+、Co2+、Mg2+和Zn2+离子对羊乳中cGMP质量浓度有促进作用。当羊乳中Fe2+和Ni2+浓度为1μmol/L时,羊乳的cGMP质量浓度分别降低了4%和6%;当羊乳中Fe2+和Ni2+浓度增加到100μmol/L时,羊乳中cGMP质量浓度也有所降低,表Fe2+和Ni2+离子对羊乳中cGMP质量浓度有降低作用。当羊乳中Mn2+浓度分别为1μmol/L和100μmol/L时,羊乳中cGMP质量浓度变化不大,表明Mn2+离子对羊乳中cGMP质量浓度影响较小。同时可以看出,羊乳中低浓度(1μmol/L)Cd2+和Cu2+对羊乳中cGMP质量浓度有一定促进作用,而高浓度 (100μmol/L)Cd2+和Cu2+对羊乳中cGMP质量浓度具有抑制作用。

表3 金属离子处理的羊乳中CNT的质量浓度Table 3 Contents of CNT in metal ions treated goatm ilk

表4 金属离子处理羊乳与未处理羊乳中CNT的质量浓度比Table 4 Ratio between CNT contents in differentmental ion treated goatm ilk and CNT contents in untreated goatm ilk
2.3 抗氧化剂对羊乳中环核苷酸质量浓度的影响
由图2、表5可以看出,加入6种抗氧化剂的羊乳中cAMP的质量浓度变化趋势基本一致。未处理空白乳样贮存期间cAMP质量浓度无明显变化(p<0.05);加入抗氧化剂的羊乳在贮存第2~4 d时羊乳中cAMP质量浓度略有下降,其中添加BHA的羊乳中cAMP在第2 d时达到最低值(946.17±24.55)ng/ mL,降低了37%,添加BHT、TBHQ、PG、VC、VE的羊乳中cAMP在第 4 d时达到最低值 (411.59± 12.15)ng/mL、(546.67±36.89)ng/mL、(890.05± 27.75)ng/mL、(824.66±25.90)ng/mL、(813.48± 26.65)ng/mL,分别降低了73%、64%、41%、45%和46%;第4 d后添加不同抗氧化剂的羊乳中cAMP质量浓度均有不同程度增加。表明抗氧化剂对贮存2~4 d的羊乳中cAMP质量浓度具有降低作用,对贮存4 d后羊乳中cAMP质量浓度具有促进作用。
由图3、表6中可以看出,加入6种抗氧化剂的羊乳中cGMP的质量浓度变化趋势基本一致。未处理空白羊乳贮存期间cGMP质量浓度无明显变化(p<0.05);加入抗氧化剂的羊乳在贮存第2~4 d时羊乳中cGMP质量浓度略有下降,其中,添加TBHQ、BHA第 2 d的羊乳中cGMP质量浓度最低为 (2 803.12±89.42)pg/mL、(4 200.86±139.46)pg/ mL,相比未处理羊乳,分别降低了40%、11%,添加BHT、PG、VC、VE的羊乳中cGMP到第4 d时达到最低分别为 (3 422.25±138.70)pg/mL、(3 004.39± 202.85)pg/mL、(3 118.61±131.69)pg/mL、(4 205.74± 194.95)pg/mL,降幅分别为27%、36%、34%和10%;第4 d后添加不同抗氧化剂的羊乳中cGMP质量浓度均有不同程度增加。表明抗氧化剂对贮存2~4 d的羊乳中cGMP质量浓度具有降低作用,对贮存4 d后的羊乳中cGMP质量浓度具有促进作用。

图2 抗氧化剂处理的羊乳中cAMP质量浓度的变化Fig.2 Changes of cAMP concentration in antioxidants treatment goatm ilk

图3 抗氧化剂处理的羊乳中cGMP质量浓度的变化Fig.3 Changes of cGMP concentration in antioxidants treatment goatm ilk

表5 抗氧化剂处理羊乳与未处理羊乳中cAMP的质量浓度比Table 5 Ratio between cAMP contents in different antioxidants treated goatm ilk and CNT contents in untreated goatm ilk

表6 抗氧化剂处理羊乳与未处理羊乳中cGMP的质量浓度比Table 6 Ratio between cGMP contents in different antioxidants treated goatm ilk and CNT contents in untreated goatm ilk
3 讨论
环核苷酸是由三磷酸核苷酸经核苷酸环化酶(NC)催化合成,能被磷酸二酯酶(PDE)催化水解成单核苷酸;Wada[10]研究表明pH对NC和PDE的催化特性产生影响,并且在pH 7.5时PDE的活性最高,因此pH可通过影响NC和PDE的活性而影响CNT的含量。研究中羊乳中cAMP和cGMP质量浓度在碱性条件时下降较多,这可能与羊乳pH在中性偏碱性条件下PDE活性较高,使羊乳中已有的环核苷酸分解,引起CNT质量浓度下降有关。底物类似物和竞争性抑制剂也可以诱导PDE变构或激活PDE,因此羊乳中CNT也能调节PDE的活性[11]。酶的结构变化以及CNT的质子化作用均与pH影响CNT质量浓度有关[9],CNT的重要基团有环上的磷酸基团和嘌呤环上的氨基基团,其中磷酸基团易在pH 7.4时解离,这或造成CNT在pH 7.5时水解度达最高[10];CNT中互变异构化的烯醇基团在更高pH值时有助于PDE对CNT的水解,因此高pH对羊乳中cAMP和cGMP含量有一定降低作用。
Thomas[12]研究发现,金属离子的存在会加速或抑制CNT被相关PDE水解,部分金属离子可与PDE的磷酸基团络合,降低其活性,从而减缓CNT的水解,一些金属离子则会对PDE起激活作用,加速CNT的水解。胞内CNT水平部分是由多种PDE的活性所调节的,这些酶的活性受二价金属离子调节[13]。研究发现,Mg2+、Zn2+、Mn2+、Ni2+、Co2+能调节牛心脏中依赖CNT的PDE的活性[12,14],因此在羊乳中这些金属离子也可通过改变羊乳中PDE活性调节CNT含量。Law[15]研究发现Zn2+的主要作用是抑制PDE的活性,Zn2+处理的羊乳中CNT高于未处理羊乳,该结果与Law的研究一致;体内Mg2+较其他金属离子浓度高,对体内PDE活性的调节起主导作用[14],Ca2+、Fe2+、Cu2+离子对PDE活性也有不同程度的调节作用[8,16-17]。二价金属离子可以和CNT的磷酸或含氮氨基结合[18],如Mn2+可以通过螯合CNT而调节羊乳中CNT质量浓度。重金属Cd2+通过cGMP/ NO通道对身体产生负面影响[19],研究了Cd2+对CNT的影响,结果显示低浓度的 Cd2+可减少羊乳中cAMP的质量浓度。
TBHQ、BHT、BHA、PG、VE属于酚型抗氧化剂,可有效清除自由基,自由基清除剂能借助键的均裂,释放出体积小、亲合性强的氢自由基[20],与反应生成的自由基结合而生成分子态化合物,将高势能的极活跃的自由基转变为较稳定的分子,从而中断链反应的传递速度,VC属于脱氧剂[21],这些物质对氧有强的亲合力,可保护腺苷酸环化酶和鸟苷酸环化酶的活性。抗氧化剂一方面可抑制PDE活性,阻止CNT水解成单核苷酸[22-23],另一方面,抗氧化剂可清除自由基,保护AC和GC不受影响[24-25]。羊乳中CNT在抗氧化剂加入第2~4 d,羊乳中CNT质量浓度降低,第4 d后羊乳中CNT质量浓度逐渐升高,可能与羊乳中腺苷酸环化酶和鸟苷酸环化酶有关。
4 结语
对影响羊乳中环核苷酸质量浓度的化学因素的研究,表明酸性环境可提高羊奶中cAMP和cGMP的质量浓度,而碱性环境可降低羊乳中cAMP和cGMP质量浓度;金属离子Ca2+、Cu2+、Fe2+、Ni2+、Mg2+、Mn2+和Zn2+对羊乳中cAMP质量浓度的增加有促进作用,Cd2+降低了cAMP的质量浓度;Ca2+、Co2+、Mg2+、Zn2+对羊乳中cGMP质量浓度有增加的作用,Fe2+和Ni2+对羊乳中cGMP质量浓度有降低的作用;抗氧化剂对贮存初期的羊乳中cAMP和cGMP有明显的抑制作用。
[1]HAENLEIN G FW.Goatm ilk in human nutrition[J].Small Rum inant Research,2004,51(51):155-163.
[2]AIDui,ZHANG Fuxin,YU Lingling,et al.Optim ization of head space solid phase m icro-extraction conditions for volatile components in goatmilk[J].Journal of Food Science and Biotechnology,2015,34(1):40-46.
[3]GU Haofeng,ZHANG Fuxin,LIANG Lei,etal.Comparison of nutritional components for goatmilk,cow milk and humanmilk [J].Science and Technology of Food Industry,2012,33(8):369-373.
[4]WANG Pan,ZHANG Fuxin,LUO Jun,etal.Screening fine fermentation strains forgoat’s yogurt[J].Journal of Food Science and Biotechnology,2010,29(3):442-447.
[5]CLARK S,SHERBON JW.A lphas1-casein,milk composition and coagulation properties of goatm ilk[J].Small Rum inant Research,2000,38(2):123-134.
[6]SKALA JP,KOLDOVSKY O,HAHN P.Cyclic nucleotides in breastmilk[J].American Journal of Clinical Nutrition,1981,34(3):343-350.
[7]JOHANNA G,CHRISTIAN C,KATHRIN B,etal.Immunoregulatory impactof food antioxidants[J].Current Pharmaceutical Design,2013,20(6):840-849.
[8]W ICKSON RD.Activation of3',5'-cyclic adenosinemonophosphate phosphodiesterase by calcium ion and a protein activator[J].Biochem istry,1975,14(4):669-676.
[9]ESSAYAN DM.Cyclic nucleotide phosphodiesterase(PDE)inhibitorsand immunomodulation[J].Biochem ical Pharmacology,1999,57(9):965-973.
[10]WADA H.Effects of pH on allosteric and catalytic properties of the guanosine cyclic 3’,5’-phosphate stimulated cyclic nucleotide phosphodiesterase from calf liver[J].Biochem istry,1987,26(20):6565-6570.
[11]杨炼,沈燕霆,李英雨,等.肌苷酸和鸟苷酸的热稳定性和酸稳定性[C]//第十四届中国国际食品添加剂和配料展览会,北京:2010.
[12]THOMASE.Donnelly.Effects of zinc chloride on the hydrolysis of cyclic GMP and cyclic AMP by the activator-dependent cyclic nucleotide phosphodiesterase from bovineheart[J].Biochim ica et Biophysica Acta,1978,522(1):151-160.
[13]Téllez-Inón M T,TORRESH N.Cyclic nucleotide phosphodiesterase activities in raterythrocytes[J].M olecular and Cellular Biochem istry,1982,43(3):161-166.
[14]FAZAKERLEY G V,JACKSON G E,PHILLIPSM A,et al.A quantitative investigation of the interaction of copper(II)and manganese(II)w ith some purine bases,nucleosides and nucleotides by nuclearmagnetic resonance[J].Inorganica Chim ica Acta,1979:151-160.
[15]LAW JS,MCBRIDE SA,GRAHAM S,et al.Zinc deficiency decreases the activity of calmodulin regulated cyclic nucleotide phosphodiesterases in vivo in selected rat tissues[J].Biological Trace Element Research,1988,16(3):221-226.
[16]KACZMAREK P,JEZOWSKA B M.Coordination properties of 3’,5’-cyclic adenosinemonophosphate towards copper(II)ions[J].Inorganica Chim ica Acta,2005,358(6):2073-2076.
[17]LOMOZIK L,GASOWSKA A,BASINSKIK,etal.Potentiometric and spectral studies of complex formation in the Cu(II),3’,5’-cyclic adenosinemonophosphate,and tetram ine systems[J].Journal of Coordination Chem istry,2013,66(2):261-273.
[18]JANCSO A,M IKKOLA S,LONNBERG H,et al.Phosphodiester cleavage of ribonucleoside monophosphates and polyribonucleotides by homo-and heterodinuclear metal complexes of a cyclohexane-based polyam ino-polyol ligand[J]. Chem istry,2003,9(21):5404-5415.
[19]WATJENW,BENTERSJ,HAASEH,etal.Zn2+and Cd2+increase the cyclic GMP level in PC12 cells by inhibition of the cyclic nucleotide phosphodiesterase[J].Toxicology,2001,157(3):167-175.
[20]ZAKNUN D,SCHROECKSNADEL S,KURZ K,et al.Potential role of antioxidant food supplements,preservatives and colorants in the pathogenesis of allergy and asthma[J].International Archives of Allergy and Immunology,2012,157(2):113-124.
[21]刘奕博.婴幼儿配方奶粉中维生素C稳定性研究[D].长沙:中南林业科技大学,2013.
[22]DOSTALER T V,BEDARD F,GUILLEMETTEC,etal.Cyclic adenosinemonophosphate(cAMP)-specific phosphodiesterase is functional in bovinemammary gland[J].Journal of Dairy Science,2009,92(8):3757-3765.
[23]CALLAHAN S M,CORNELL N W,DUNLAP P V.Purification and properties of periplasmic 3’,5’-cyclic nucleotide Phosphodiesterase[J].Journal of Biological Chem istry,1995,270(29):17627-17632.
[24]TANG Shengqiu,DONG Xiaoying,ZHOU Xiaoting.Studies on 3’,5’-cyclic adenosinemonophosphate and its applications in animalnutrition[J].Chinese Journal of Animal Science,2006,42(5):53-56.
[25]COHRSR J.Effect of vitamin E succinate and a cAMP-stimulating agenton the expression of c-myc and N-myc and H-ras in murineneuroblastoma cells[J].International Journal of Developmental Neuroscience,1991,9(2):187-194.
Research on Effects of Chem ical Factors on Contents of Cyclic Nucleotides in Goat M ilk
YU Lingling, ZHANG Fuxin*, SHAO Yuyu, YUN Dan, LEIFeiyan, HOU Yuanlin, AIDui
(College of Food Engineering and Nutritional Science,Shanxi Normal University,Xi'an 710119,China)
Effects of chem icals,such as pH,metal ions and antioxidants,on the cyclic nucleotides contentin goatmilkwere studied.The resultsshowed thatcyclic adenosinemonophosphate(cAMP)got the highest concentration at pH 3,while highest concentration of cyclic guanosine monophosphate(cGMP)wasachieved atpH 2.The contentof cAMP in goatm ilk was increased by Ca2+,Cu2+,Fe2+,Ni2+,Mg2+,Mn2+and Zn2+,while decreased by Cd2+.The addition of Ca2+,Co2+,Mg2+and Zn2+could improve cGMP content in goatm ilk,while Fe2+and Ni2+negatively affected cGMP content.The contents of cAMP and cGMP in goatm ilk was decreased by antioxidants during first 2~4 days,but improved after 4 days.This study could provide references for the development of functionalgoatm ilk products.
cyclic nucleotides,pH values,mental ions,antioxidants
TS 252.1
A
1673—1689(2017)04—0393—07
2015-06-09
国家“十二五”科技支撑计划项目(2013BAD18B00);农业部公益性行业(农业)科研专项(201103038);陕西省农业攻关项目(2014K01-17-05)。
*通信作者:张富新(1962—),男,陕西咸阳人,教授,主要从事乳品科学研究。E-mail:fuxinzh@snnu.edu.cn
于玲玲 ,张富新,邵玉宇,等.影响羊乳中环核苷酸质量浓度的化学因素[J].食品与生物技术学报,2017,36(04):393-399.
