玉米粉对灵芝菌体形态及胞外多糖的影响
2017-05-17杨静静丁重阳顾正华石贵阳
杨静静, 丁重阳*, 顾正华, 张 梁, 石贵阳
(1.江南大学 生物工程学院,江苏 无锡 214122;2.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡214122)
玉米粉对灵芝菌体形态及胞外多糖的影响
杨静静1,2, 丁重阳*1,2, 顾正华2, 张 梁1,2, 石贵阳1,2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡214122)
研究了灵芝液体深层发酵中,玉米粉对灵芝菌体形态和胞外多糖产量、相对分子质量、单糖组成的影响。发酵过程中随着玉米粉质量分数增加,灵芝菌球直径逐渐减小,中小型(S型和M型)菌球利于灵芝多糖生产;对不同质量分数玉米粉发酵获得的多糖相对分子质量及单糖组成比较,结果显示,玉米粉对灵芝多糖的相对分子质量没有影响,但对灵芝多糖的单糖组成及其比例有很大影响,添加玉米粉发酵获得的灵芝多糖中含有阿拉伯糖和木糖,但是岩藻糖和甘露糖的比例相对减少。
灵芝;胞外多糖;玉米粉;菌体形态
灵芝(Ganoderma lucidum)是名贵的食药用真菌,灵芝多糖是灵芝的主要活性物质之一。大量研究表明,灵芝多糖具有抗肿瘤[1-3]、降血糖[4]、抗氧化[5-7]、提高免疫力[8-10]等多种生物活性。近年来灵芝多糖的抗肿瘤活性研究较为深入,诸多学者报道具有低相对分子质量或含有半乳糖等单糖组成或含有β-1,3糖苷键等都是其具有抗肿瘤活性的主要原因[11-12]。以传统的固态发酵方式获得灵芝子实体,具有产量小、耗费人力、周期较长等缺点,很难满足人们日益增长的需求。与固态发酵相比,液体深层发酵技术,不仅可以免受气候季节的影响、缩短培养周期、降低生产成本等优点,还可以大大增加菌丝体以及多糖、灵芝酸等产量,成为现代灵芝发酵的主要方式。
丝状真菌菌体形态会受到培养环境的影响,而菌体形态的变化也会直接或间接的影响代谢物的合成。玉米粉可作为碳源等营养物质的来源,在多种真菌的液态发酵中都有广泛的应用,但玉米粉对灵芝多糖等主要活性物质发酵的作用尚未明确,且对灵芝菌体形态的影响尚不清楚,因此作者通过在培养基中添加不同浓度玉米粉分析多糖产量和菌体形态的变化以进行探讨。
1 材料与方法
1.1 实验材料
1.1.1 培养基 PDA斜面培养基(g/L):土豆200,葡萄糖20,琼脂条20~22;种子培养基(g/L):葡萄糖20,胰蛋白胨 5,无氨基酵母氮源 5,KH2PO43,MgSO4·7H2O 2,pH 6.0,培养基灭菌条件为110℃灭菌20 min,葡萄糖单独灭菌后加入培养基;发酵培养基 (g/L):葡萄糖+玉米粉共40(玉米粉分别为0,10,20,30,40),胰蛋白胨5,无氨基酵母氮源5,KH2PO43,MgSO4·7H2O 2,pH 6.0,培养基灭菌条件为115℃灭菌20min,葡萄糖单独灭菌后加入培养基。1.1.2 菌种 灵芝(G.lucidum)菌株由江南大学粮食发酵工艺与技术国家工程实验室保藏。
1.1.3 主要试剂 常用的试剂均为国产分析纯;无氨基酵母氮源 (YNB)为拜尔迪公司;胰蛋白胨(Tryptone)为英国Oxoid公司。
1.2 实验方法
1.2.1 液体发酵培养 种子培养时,250mL三角瓶装液量为80 mL,高压灭菌,待培养基冷却后,从菌种斜面中取4块0.5 cm2大小的活化菌种接入三角瓶内,在150 r/min、30℃条件下培养10 d。发酵培养时,500mL三角瓶装液量为150mL,接种量大约0.5 g(菌体湿质量),在150 r/min、30℃条件下培养10 d。
1.2.2 菌体形态分析 液体发酵如2.2.1所示,发酵条件为30℃、pH 6.0、150 r/min,考察发酵时间及玉米粉质量分数对灵芝菌体形态及多糖合成的影响,(葡萄糖+玉米粉)质量分数4%(玉米粉质量分数分别为0%,1%,2%,3%,4%)。
将枪头一端剪平,小心吸取5 mL发酵液到小玻璃平皿中,每一个样品中都至少含有20个菌球,并往平皿中加15 mL蒸馏水,使菌球处于悬浮状态,使用数码相机进行拍照,接下来用Image-proplus软件对菌球当量直径D进行分析,并按照公式计算。

式中,A为菌球面积,mm2;D为菌球当量直径,mm。
1.2.3 菌体生物量测定 均匀、准确量取菌体溶液于5mL离心管中,冰浴冷却10min,然后10 000 r/ min,4℃离心5min,弃上清液。用预冷的体积分数5%三氯乙酸溶液洗涤沉淀2次。洗涤后的菌体加入适量的体积分数5%三氯乙酸溶液,在80℃水浴中抽提25min。抽提结束后置冰浴中冷却,用上述条件离心10min。上清液用体积分数5%三氯乙酸溶液适当稀释,用紫外分光光度计测定其260 nm处的吸光度值。
以260 nm处吸光度值对菌体浓度作图,得到标准曲线,求出菌体干质量(mg)关于吸光度值的线性方程,Y=1.320 7x(R2=0.997 6)。将测得的发酵液总核酸含量代入标准曲线即可得到发酵液的菌体干重,换算出菌体浓度。
1.2.4 灵芝胞外多糖含量测定及提取 取1 mL发酵液上清,加4倍体积分数为95%的乙醇,漩涡震荡充分混合后于4℃冰箱静置过夜,10 000 r/min,离心5min去上清,室温挥发残余酒精,加4 mL纯净水溶解沉淀,取200μL上清用苯酚-硫酸法测定多糖含量。
量取一定量发酵液上清,加入4倍体积分数95%的乙醇,充分混合,置于4℃过夜,10 000 r/min,离心5min去上清,室内挥发去除酒精,加适量纯净水溶解沉淀,10 000 r/min,离心5 min,上清液冷冻干燥后即为灵芝胞外多糖。
1.2.5 还原糖的测定 取100μL发酵液上清,用DNS法测还原糖。100μL发酵液上清,加1.9mL去离子水,加1 mL DNS,在沸水中煮沸5 min,冷却后定容至25mL,在540 nm测OD值。
1.2.6 水溶性淀粉测定 25mL棕色容量瓶中加入0.02%I2-KI标准溶液4 mL,加滤液100μL,定容至25mL,摇匀。以空白溶液为参比溶液,用1 cm比色皿,在最大吸收波长610 nm处,测定样品溶液的吸光度。根据标准曲线,计算出样品中淀粉含量。
1.2.7 气相色谱分析灵芝多糖的单糖组成 称取20mg的灵芝粗多糖于玻璃水解管中,加入2mL的1mol/L H2SO4,用保鲜膜封管,于105℃条件下水解8 h。在水解的样液中加适量碳酸钡粉末,直至上清液由酸性变为中性,离心,保留上清,沉淀以蒸馏水洗涤2次,离心后上清液并入,至此得到的上清液为游离单糖溶液。
衍生化:在游离单糖溶液中加入1 mg肌醇做内标,经冷冻干燥后得到的粉末,加10 mg盐酸羟胺,0.5mL吡啶于90℃水浴中保持30 min,取出冷却后加入0.5 mL乙酸酐于90℃水浴中保持30 min,待样品冷却后进行GC分析。
GC色谱分析条件:检测器为氢火焰离子鉴定器;检测器和气化室温度分别为 250℃和260℃;OV1701石英毛细管柱;采用程序升温,起始柱温120℃,持续3min,随后以10℃/min的速度升至195℃,保持0.1 min,然后以3℃/min的速度升温至240℃,保持10min载气压力(N2)0.60 kg/cm2,燃气压力(H2)0.65 kg/cm2,助燃气压力(空气)0.50 kg/ cm2,分流比为30∶1。单糖分析:以内标法定出各单糖质量分数。

式中Ai为某单糖样品峰面积;AIi为样品中加入的肌醇内标峰面积;AIs为标样中加入的肌醇内标峰面积;As为某单糖标样峰面积;ms为某单糖标样的质量 (mg);mIs为标样中加入的肌醇内标的质量(mg);mIi为样品中加入的肌醇内标的质量(mg);m为称取糖样品的质量(mg)。
1.2.8 高效液相排阻色谱色谱分析灵芝多糖的相对分子质量 冷冻干燥后的粗多糖,称取适量于5 mL的EP管中,加入2mL纯净水使之溶解,用0.22 μm水膜过滤的糖液利用液相色谱进行分析。Waters600高效液相色谱仪 (美国Waters公司),配备2410示差折光检测器和Empower工作站。分析条件:色谱柱:LtrahydrogelTMLinear 300mm×7.8mm;流动相:0.1 mol/L NaNO3;流量:0.9 mL/min;柱温:45℃;进样量:20μL。
根据以上色谱条件分别测出各种葡聚糖标准样 (Mw分别为 135 350、36 800、9 750和 2 700,Sigma)的色谱峰保留时间。以标样的lg Mw为纵坐标,色谱峰保留时间Rt为横坐标,使用线性方程拟合得标准校正曲线方程为lg Mw=-0.488 9x+14.514,R2=0.998 2,相关性良好。
2 结果与分析
2.1 玉米粉对灵芝菌球直径的影响
利用Image-pro-plus软件分析灵芝菌球当量直径。见图1,菌球的平均直径随着发酵时间的延长而显著增大,尤以未添加玉米粉培养最显著;玉米粉添加量为质量分数1%和2%时,菌球的平均直径随着发酵时间的延长而缓慢增大;玉米粉添加量为质量分数3%和4%时,菌球的平均直径从第3天起下降,第5天平均直径最小,然后菌球平均直径开始缓慢增大。

图1 玉米粉发酵灵芝菌球平均当量直径变化Fig.1 Effect of corn powder on average pellet diameter of G.lucidum
在灵芝的液体发酵过程中,接种时种子培养基中的灵芝球形菌体在生长过程中产生突刺,突刺从第一代菌球上脱落后形成小菌球,成为第二代菌[13]。灵芝发酵的第5天,添加玉米粉培养的灵芝菌球平均直径呈现出缓慢增加趋势,而且随着玉米粉质量分数增加,平均直径的变化幅度也在变大,可能是由于玉米粉浓度增大导致培养基中营养物质的增加使得灵芝菌体生长迅速,固形物量的增大又使得菌体之间的摩擦系数增大,促使突刺急剧脱落形成二代菌球,因而玉米粉质量分数越高,其平均直径越小。
2.2 玉米粉对灵芝胞外多糖的影响
灵芝胞外多糖在发酵过程中浓度变化如图2(a)所示,在发酵初始的第3天开始,多糖质量浓度大部分会先下降然后在第5天达到最高,随后开始逐渐下降。图2(b)显示淀粉质量分数随着发酵时间的消耗过程,发酵结束时基本耗尽。玉米粉是一种复合碳源,包含大量淀粉类多糖,较多文献选择玉米浆或者玉米淀粉为碳源,目的是提高所需目的产物的产量,包括灵芝多糖、灵芝酸及蛋白酶。
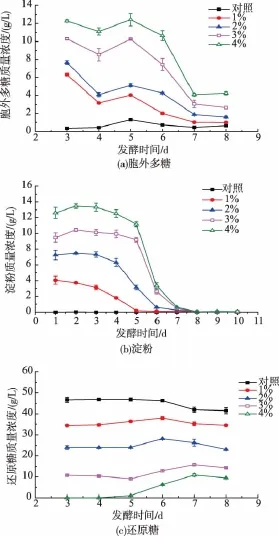
图2 灵芝液体深层发酵过程中的多糖、淀粉和还原糖质量浓度Fig. 2 Content of exopolysaccharrides,starch and reducing sugar during submerged fermentation of G.lucidum
Wagner[13]在研究中发现,在缺乏葡萄糖的发酵环境中添加葡萄糖,其多糖产量要比初始培养基中存在葡萄糖更高。对灵芝发酵过程中的还原糖含量进行检测发现(图2(c)),未添加玉米粉的发酵液还原糖含量是逐渐降低的,而添加质量分数1%、2%和3%玉米粉的发酵液中,分别在第6天和第7天达到最大,然后开始下降。质量分数4%玉米粉的培养基中并没有添加葡萄糖,发酵第5天开始在发酵液中出现还原糖,在发酵第7天达到最大质量浓度后开始下降。在所有添加玉米粉条件中,质量分数4%玉米粉所获得的灵芝多糖产量最高,此条件与Wagner研究结果类似。所有添加了玉米粉培养的灵芝发酵液中都出现了还原糖含量随着发酵时间增加的现象,结合发酵液中淀粉质量浓度结果(图2(b)),应该是灵芝发酵过程中产生了淀粉酶,继而水解发酵液中的淀粉,从而还原糖的质量浓度有了升高,并且质量分数4%玉米粉组有了一定的还原糖积累,第7天达最大值,然后开始下降。
2.3 菌体形态和胞外多糖产量的关系
因为灵芝多糖产量在第5天达到最高,因此对第5天不同质量分数玉米粉条件下灵芝菌球直径进行分析,结果见图3。随着玉米粉质量分数的提高,S型菌球所占的比例逐渐增大,在质量分数4%玉米粉组里占最大比例(67.8±6.7%),而M型菌球所占比例先增大后减小,在质量分数1%,2%和3%组均为最大比例,L型菌球所占比例随着玉米粉浓度的提高而逐渐减少,XL型菌球是4种菌球类型中比例从未占过最大的一组菌球,虽然其所占比例一直很小,随着玉米粉浓度提高,其所占比例也逐渐减少。
灵芝液体发酵过程中,添加玉米粉发酵测得的灵芝多糖质量浓度远远大于对照(图4(a)和(b))。对照中的灵芝菌球随着发酵时间延长,S和M型菌球比例逐渐减少,X和XL型菌球比例逐渐增加,主要是中大型菌球,而质量分数4%玉米粉发酵获得菌球一直以S和M型菌球为主,这与作者前期研究结果相似,即中小菌球是合成多糖的主要菌球,玉米粉是通过改变菌球形态进而影响多糖产量的[14]。Fang有研究证明,相比于D≧1.6 mm菌球,D<1.2 mm的菌球最利于灵芝多糖的合成,可以获得较高的灵芝胞内多糖产量[15]。

S:D<0.8mm;M:0.8≤D<1.6mm;L:1.6≤D<2.5mm;XL:D≧2.5mm图3 发酵第5天玉米粉对灵芝产多糖和菌体形态的影响Fig.3 Effect of corn powder on EPS yield and the m ycelium morphologyof G.lucidumon day 5

图4 玉米粉对灵芝菌球形态及胞外多糖产量的影响Fig.4 Effect of corn powder on EPS yield and the mycelium morphologyduring submerged fermentation of G.lucidum
2.4 玉米粉对灵芝多糖相对分子质量及单糖组成的影响
经过对灵芝多糖相对分子质量进行分析,发现灵芝多糖在不同时间中是由多种不同相对分子质量的多糖组分组成通过不同多糖组分的峰面积进行比较后发现,未添加玉米粉的培养基发酵产生的多糖,在第5天和第7天主要有两种,相对分子质量较大所占比例较小,而相对分子质量分布在2 700左右的多糖所占比例高于98%。在添加玉米粉后,在发酵第5天时,高相对分子质量灵芝多糖比例达50%以上,而在第7天时小相对分子质量多糖比例与对照结果相似,面积比提高到98%以上(表1)。发酵过程过程出现的高比例大分子多糖,可能是由于培养基中添加的玉米粉中所含淀粉等物质引起,但在发酵第7天时大分子多糖所占比例已远远低于正常发酵中多糖相对分子质量比例,此结果说明发酵结束时玉米粉基本不影响发酵结束后灵芝多糖的性质。此外,添加玉米粉后灵芝多糖相对分子质量在发酵结束后与对照实验中多糖的相对分子质量基本一致,说明玉米粉的添加并未影响灵芝多糖的相对分子质量。
在对灵芝多糖和玉米粉的单糖组成进行分析后发现,未添加玉米粉的培养基发酵产生的灵芝多糖主要由葡萄糖、甘露糖和半乳糖组成,其中葡萄糖的摩尔比例在90%以上,而添加玉米粉后灵芝多糖的葡萄糖仍为主要单糖,但增加了岩藻糖、阿拉伯糖和木糖,随着玉米粉浓度的增加葡萄糖所占比例不断增大,而甘露糖和阿拉伯糖比例逐渐降低。同时,发酵第7天葡萄糖的摩尔比例对比发酵第5天有所下降,而甘露糖和阿拉伯糖逐渐提高。此结果说明,虽然玉米粉的添加并未影响灵芝多糖的相对分子质量,但改变了灵芝多糖的单糖组成和比例。有研究结果表明,多糖中相对分子质量和单糖组成的改变会对其生物活性造成影响[12]。因此玉米粉的添加造成的灵芝多糖单糖组成的改变可能是调节其生物活性的重要策略和手段。另外,葡萄糖的单糖组成比例远远高于其他单糖组成,选择某一种单糖(葡萄糖,甘露糖,阿拉伯糖,半乳糖及木糖)做唯一碳源时,培养的灵芝多糖中该单糖组成的比例最高。

表1 灵芝多糖平均相对分子质量及其面积比Table 1 Averagemolecular weight and area ratio of G.lucidum polysaccharides
3 结语
液体深层发酵中,丝状真菌的代谢物产量会受菌体形态和菌球大小的影响,因此通过改变和控制菌体形态和菌球大小可以获得较高的目的代谢物。作者在灵芝液体深层发酵中添加了不同浓度玉米粉,发现玉米粉导致灵芝菌球的当量直径减小,促进灵芝胞外多糖的产量。对不同玉米粉发酵获得的灵芝多糖的相对分子质量及单糖组成分析发现,玉米粉对灵芝胞外多糖的相对分子质量几乎没有影响,对单糖组成影响较大,增加阿拉伯糖和木糖,岩藻糖和甘露糖比例下降。
药用真菌是一种资源丰富的食用菌,目前已开发的药用真菌主要以多糖成分为主,而药用真菌除含有多糖外还含有生物碱、甾醇类和萜类等化合物。药食用真菌有待进一步深入研究。
[1]HAMA O,IBRAHIM D,BARAGE M,et al.Utilisations de quelques espèces de Macromycètes dans la pharmacopée traditionnelle au Nigeroccidental(Afrique de l’Ouest)[J].Journal of Applied Biosciences,57:4159-4167.
[2]GAO Y,GAO H,CHAN E,et al.Antitumor activity and underlying mechanisms of ganopoly,the refined polysaccharides extracted from Ganoderma lucidum,inmice[J].Immunological Investigations,2005,34(2):171-198.
[3]LIU Gaoqiang,WANG Xiaoling.Structure-activity relationship and anticancer mechanisms of ganoderma lucidum polysaccharides[J].M ycosystema,2006,25(3):430-438.(in Chinese)
[4]GAO Y,LAN J,DAI X,et al.A phase I/II study of ling zhi mushroom Ganoderma lucidum (W.Curt.:Fr.)Lloyd(Aphyllophoromycetideae)extract in patients with type II diabetes mellitus[J].International Journal of Medicinal Mushrooms,2004,6(1).
[5]CHEN Y,XIE M Y,NIE S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodiesof Ganoderma atrum[J].Food Chem istry,2008,107(1):231-241.
[6]LIU W,WANG H,PANG X,et al.Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodiesof Ganoderma lucidum[J].International Journal of Biological M acromolecules,2010,46(4):451-457.
[7]LEE JM,KWON H,JEONG H,et al.Inhibition of lipid peroxidation and oxidative DNA damage by Ganoderma lucidum[J]. Phytotherapy Research,2001,15(3):245-249.
[8]BAO X,LIU C,FANG J,et al.Structural and immunological studies of a major polysaccharide from spores of Ganoderma lucidum(Fr.)Karst[J].Carbohydrate Research,2001,332(1):67-74.
[9]LIY Q,FANG L,ZHANG K C.Structure and bioactivities of a galactose rich extracellular polysaccharide from submergedly cultured Ganoderma lucidum[J].Carbohydrate Polymers,2007,68(2):323-328.
[10]ZHU X L,CHEN A F,LIN Z B.Ganoderma lucidum polysaccharides enhance the function of immunological effector cells in immunosuppressedm ice[J].Journal of Ethnopharmacology,2007,111(2):219-226.
[11]LIPingzuo,ZHANG Kechang.Isolation,purification and bioactivitiesofexopolysaccharides from fermented broth of Ganoderma lucidum[J].Acta M icrobiologica Sinica,2002,40(2):217-220.(in Chinese)
[12]PENG Y,ZHANG L,ZENG F,et al.Structure and antitumor activities of the water-soluble polysaccharides from Ganoderma tsugae mycelium[J].Carbohydrate Polymers,2005,59(3):385-392.
[13]WAGNER R,M ITCHELL D A,SASSAKIG L,et al.Links between morphology and physiology of Ganoderma lucidum in submerged culture for the production ofexopolysaccharide[J].Journal of Biotechnology,2004,114(1):153-164.
[14]QIAO Shuangkui,PENG lin,DING zhongyao,etal.effectof differentculture conditionsonmycelium morphology and activity of exopolysaccharides from ganoderma lucidum in submerged culture[J].Journal of Food Science and Biotechnology,2014,33(10):1070-1076.(in Chinese)
[15]FANG Q H,TANG Y J,ZHONG JJ.Significance of inoculation density control in production of polysaccharide and ganoderic acid by submerged culture of Ganoderma lucidum[J].Process Biochem istry,2002,37(12):1375-1379.
Effect of Corn Powder on M ycelium M orphology and Exopolysaccharides of Ganoderma lucidum in Submerged Culture
YANG Jingjing1,2, DING Zhongyang*1,2, GU Zhenghua2, ZHANG Liang1,2, SHIGuiyang1,2
(1.Jiangnan University Biological Engineering,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Technology,Jiangnan University,Wuxi 214122,China)
Theeffectsof corn powderonmycelium morphology,exopolysaccharidesproduction and the monosaccharide composition were investigated in the liquid submerged fermentation of G. lucidumto obtain the high yield and activity of polysaccharidesusing solid composite carbon source. The pelletswere divided into four categories by the diameter of G.lucidum.The results showed that the pellets diameter decreased w ith the corn powder concentration increased during the fermentation process.The high percentage of S and M was beneficial to the exopolysaccharides production.The corn powder had no effect on the molecular weight of exopolysaccharides.However,it greatly affected themonosaccharide composition and proportion ofexopolysaccharides,inwhich therewere arabinoseand xylosewhile the proportion of fucoseandmannose declined.
Ganoderma lucidum,exopolysaccharides,corn powder,morphology
TS 201
A
1673—1689(2017)04—0383—06
2015-04-17
国家自然科学基金项目 (31271918);国家863计划项目 (2012AA021505);中央高校基本科研业务费专项资金项目(JUSRP51319B)。
*通信作者:丁重阳(1975—),男,江苏南通人,工学博士,教授,主要从事发酵过程优化控制及食药用真菌生物技术研究。
E-mail:zyding@jiangnan.edu.cn
杨静静,丁重阳,顾正华,等.玉米粉对灵芝菌体形态及胞外多糖的影响[J].食品与生物技术学报,2017,36(04):383-388.
