射波刀治疗原发性肝癌合并梗阻性黄疸11例疗效观察
2017-05-13范毓泽孙颖哲段学章
范毓泽,孙 静,李 欢,孙颖哲,段学章
射波刀治疗原发性肝癌合并梗阻性黄疸11例疗效观察
范毓泽,孙 静,李 欢,孙颖哲,段学章
目的评价立体定向放射治疗技术(射波刀)治疗肝癌合并梗阻性黄疸的疗效和不良反应。方法对11例肝癌合并梗阻性黄疸的患者行射波刀治疗。单次分割剂量5~7 Gy,照射次数为7~10 次,肿瘤计划靶区剂量48~50 Gy,连续照射。其中2例TBIL>300 μmol/L的患者在放疗前联合经皮肝穿刺胆道引流术或经内镜逆行性胰胆管造影术进行治疗。结果随访12~28个月,治疗结束后12个月患者肿瘤局控率为81.8%,临床获益率为81.8%,12个月生存率为81.8%,且TBIL、ALT、ALP、谷氨酰转肽酶等相关临床指标明显改善。结论射波刀治疗肝癌合并梗阻性黄疸,肿瘤局控率高,胆红素明显下降,疗效确切,不良反应小。
原发性肝癌;梗阻性黄疸;射波刀;立体定向放射治疗
原发性肝癌合并的梗阻性黄疸可引起进行性加重的黄疸、肝衰竭、严重感染、凝血功能异常和肾衰竭[1]。此类病例生存期较短,若不积极治疗,生存期一般为3个月左右[2]。目前有经皮肝穿刺胆道引流术(percutaneous transhepatic cholangial drainage, PTCD)或经内镜逆行性胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)引流胆汁,引流后胆红素可下降,为部分患者争取了手术机会。但仍有部分肝癌患者因无法耐受或主观拒绝不能完成手术治疗,故未能针对梗阻灶进行治疗,从根本上解决黄疸。立体定向放射治疗(stereotactic body radiation therapy, SBRT)是一种高精度的放疗手段,具有高剂量、损伤小、疗效确切等优点。在2016年《原发性肝癌治疗指南》中明确指出SBRT适用于不可手术、局部多发、转移等原发性肝癌的治疗[3]。本文观察并随访了部分SBRT病例,发现在解决原发性肝癌引起的恶性梗阻性高胆红素血症及肿瘤局部控制方面,均有独特的优势。
1 对象与方法
1.1 对象 研究对象为解放军第三〇二医院肿瘤放射治疗中心自2013年5月-2015年1月收治的11例原发性肝癌合并梗阻性黄疸患者,男性8例,女性3例,年龄25~77岁(中位年龄56岁)。所有病例肝癌诊断标准为《2011年原发性肝癌诊疗规范》[4],其中7例为原发性肝细胞癌合并乙型肝炎肝硬化代偿期,4例为胆管细胞癌,无肝病基础。入组条件:①明显的梗阻性黄疸;②均经B超、CT、磁共振胰胆管造影或PET-CT提示为恶性梗阻性黄疸[5];③患者卡氏评分均≥80分;④完善血常规、凝血功能、心电图、肺CT等检查,评估患者能耐受放疗者;⑤无感染、远处转移(允许合并门静脉癌栓),并排除其他系统恶性疾病;⑥入组病例经多学科会诊,均不适合手术治疗。
1.2 治疗方法 立体定向放疗设备采用美国Accuray公司生产的G4 射波刀,放疗前须CT引导下向肝内病灶周边植入金标3~5颗,5~7 d后用三维CT进行定位,定位采用真空垫固定,制作放疗体位固定装置。放疗中采用金标追踪及呼吸追踪技术。选用64排CT扫描图。CT扫描图像输送到治疗计划系统,由医师和物理师共同勾画靶区和危及器官。结合CT、MRI或PET-CT等影像学资料,勾画大体肿瘤体积(gross tumor volume, GTV),GTV外放后为计划靶区(planning target volume, PTV),上下、前后、左右分别外放0~5 mm,避开重要器官(胃、十二指肠、胰腺、肾脏、脊髓等)。定位1~2 d后开始针对肿瘤病灶行射波刀治疗。放疗时以70%~80%等剂量线覆盖PTV,并以此为靶区处方剂量,单次靶区处方剂量5~7 Gy,连续照射,每日照射1次,单个靶区总剂量48~50 Gy,分7~10 次完成。其中2例患者因TBIL过高(>300 μmol/L)联合PTCD或ERCP治疗。放疗期间监测血常规、肝肾功能、凝血功能相关指标。
1.3 观察指标 从开始放疗起,每周行梗阻性黄疸相关指标检测:TBIL、ALT、ALP、谷氨酰转肽酶(glutamyl transpeptidase, γ-GT或GGT),连续1个月,此后每2~4周进行上述相关指标检测;每3个月进行腹部增强CT或MRI影像学检查及AFP、CA199等肿瘤标志物检测。
1.4 疗效评价 ①TBIL下降情况。②肿瘤局控率及临床获益率。结果按照RECIST 1.1实体瘤的疗效标准判定疗效,分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、稳定(stable disease, SD)、进展(progressive disease, PD)。③肿瘤标志物的变化:其中肝细胞癌的患者主要观察指标为AFP,而胆管细胞癌的患者主要观察指标为CA199。④放疗不良反应发生率:放疗开始至90 d内出现的毒性,根据Common Toxicity Criteria(CTC)标准,而91 d以后则采用Radiotherapy Oncology Group/European Organization for Research on Treatment of Cancer(RTOG/EORTC)迟发性放疗反应评价标准进行分级。
1.5 随访 本组病例随访至2016年3月(最短随访期为放疗后12个月,最长为放疗后28个月),其中1例失访,失访患者自末次随访之日起按死亡统计。
1.6 统计学处理 采用SPSS 18.0 统计软件。计量资料如果呈正态分布或近似正态分布,则用±s表示,2组比较使用配对t检验;非正态分布者用中位数(最小值,最大值)表示,2组比较使用配对秩和检验。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 肿瘤局控率、临床获益率及生存率 患者随访至放疗后12个月时,肿瘤局控率为81.8%,临床获益率为81.8%,12个月生存率为81.8%;1例于放疗结束后12个月时失访,1例于放疗后10个月因肝癌脑转移、脑疝死亡。表1为成功随访病例的肿瘤大小,放射后肿瘤明显缩小。
图1~3分别为患者A放疗前肿瘤影像、放疗靶区图、放疗后肿瘤靶区影像。其中图1为肝区增强MRI影像学,从diffusion weighted imaging(DWI)可见明显肿瘤压迫胆管并引起肝内胆管扩张;图2为射波刀治疗肿瘤靶区图,其中左图为等剂量分布图,蓝色线条为等剂量线,右图为靶区勾画图;图3为患者A放疗结束后12个月复查时肝区增强MRI影像学,从DWI及增强影像可见肿瘤已无活性,且肝内胆管已无扩张。
表1 9例随访患者放疗后12个月肿瘤大小变化(±s,cm)Tabel 1 Tumor size changes of 9 patients after radiotherapy for 12 months(±s, cm)

表1 9例随访患者放疗后12个月肿瘤大小变化(±s,cm)Tabel 1 Tumor size changes of 9 patients after radiotherapy for 12 months(±s, cm)
指标放疗前放疗后 差值d t值 P值肿瘤大小 11.2±6.9 3.5±1.6 7.7±5.7 3.317 0.016
2.2 相关临床指标变化 于放疗结束时10例(90.9%)TBIL明显下降,1例(9.1%)较治疗前上升;但于放疗后12月复查时,除死亡及失访的2例外,其余病例中有8例TBIL降至正常范围,1例降至正常后再次上升。同时AFP、ALT、 ALP、GGT亦明显下降,相关指标变化如表2所示。(因我院CA199的检测上限为1000 IU/ml,而本组胆管细胞癌的患者中,CA199结果大部分以>1000 IU/ml显示,故未做统计学分析)。
2.3 放疗反应 本组病例治疗过程中,1级上消化道损伤(仅恶心)有2例,2级(恶心、呕吐,予甲氧氯普胺对症治疗后明显改善)有1例。经对症治疗后,所有病例均未影响放疗进程。所有病例均无重度消化道反应、重度乏力,无感染、发热、体质量下降等。后期随访过程中,均未发现胃穿孔、肠穿孔、肠梗阻、放射性肺炎、放射性肠炎等晚期并发症。由于入组患者多数有肝炎肝硬化病史,且合并脾功能亢进,血小板、白细胞等基础指标均低于正常范围且不稳定,对结果严重干扰,因此未对骨髓抑制情况进一步评估。
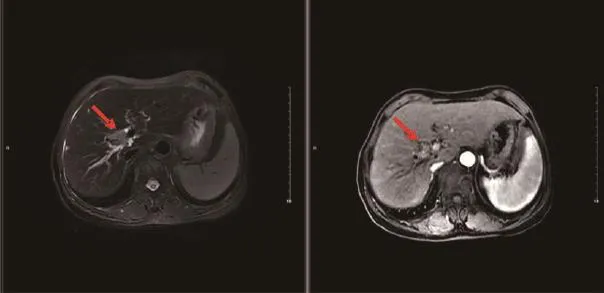
图1 患者A射波刀治疗前肝区MRI的DWI及增强像(红色箭头所指为肿瘤位置)Figure 1 DWI and enhanced image of MRI in the liver area before treatment by cyberknife within patient A (red arrow for tumor location)
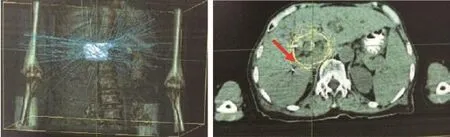
图2 患者A的射波刀放疗图(红色箭头所指为肿瘤位置)Figure 2 Radiotherapy map of cyberknife within patient A (red arrow for tumor location)

图3 患者A射波刀治疗后肝区MRI的DWI及增强像(红色箭头所指为原肿瘤位置)Figure 3 DWI and enhanced image of MRI in the liver area after treatment by cyberknife within patient A (red arrow for tumor location)
3 讨 论
原发性肝癌因其解剖位置的特殊性,成为恶性梗阻性黄疸的主要原因。而恶性肿瘤合并高胆红素血症不但对患者的生活质量造成影响,还会缩短患者的生存期。梗阻性黄疸目前在治疗上常用手术及介入治疗。外科手术包括根治切除术和姑息性外科胆肠吻合术;介入治疗包括ERCP或PTCD,并可辅助以支架置入治疗。
恶性梗阻性黄疸传统治疗以手术治疗为主,其优点是引流效果好,符合机体生理。但手术创伤大、并发症发生率高、手术使Oddi括约肌功能丧失,反流性胆管炎的发生率仍较高[6]。而患者胆红素增高会影响凝血功能,使手术风险进一步增高。目前有PTCD、ERCP可引流胆汁,减少高胆红素血症的危害,但很多研究表明:术前胆道引流会增加术后严重并发症的发生率[7-8]。同时有可能因时间太短不能有效改善肝功能和全身状况,时间太长则延误手术根治时机[9-10]。因此,抓紧治疗时机,针对病灶行及时有效地治疗是目前的研究方向。

表2 9例随访患者放疗后12个月相关临床指标变化Tabel 2 Relevant clinical index changes of 9 patients after radiotherapy for 12 months
射波刀结合了金标追踪及呼吸追踪技术,因此可使肿瘤获得比常规放疗高的剂量,而肿瘤周围正常组织的照射量明显减少,从而可能提高肿瘤的局部控制率和无严重并发症的生存率。一般认为射波刀治疗适宜应用于复杂解剖部位、形态极不规则、周围有放射敏感的正常组织结构、常规放疗控制率差的肿瘤。而肝癌合并梗阻性黄疸兼具上述特点,常规放疗周围有放射的敏感器官如小肠、十二指肠、胃、肾、脊髓等,无法提高放射剂量而疗效较差。而射波刀可以达到单次高剂量,对肝癌的治疗可取得良好疗效。而我治疗中心一项针对原发性肝癌治疗的研究中(我治疗中心常规推荐针对肝癌的治疗方案为射波刀联合介入),射波刀联合介入术后1年的生存率可达85.45%,而单纯介入术后1年生存率仅为30.91%[11]。国内外常规针对肝癌的放疗,一般要求TBIL<2~3 mg/dl[12-13],而本组病例中均为高胆红素血症(放疗前TBIL最低者为66.9 μmol/L),其原因为梗阻所致,考虑解除压迫后可改善黄疸,故在多学科会诊认为无手术机会后积极予射波刀治疗,其疗效亦证明了此推测。
本组治疗结果显示肿瘤12个月局控率及生存率均为81.8%,而国内近期报道三维适形放疗治疗梗阻性黄疸的肿瘤局控率为89.1%,1年生存率仅为56.6%[14],而在1项针对外科手术、PTCD、 ERCP 3种治疗恶性梗阻性黄疸的报道中,其1年生存率最高仅为62.5%[15]。文献报道姑息引流手术平均生存期为6~9 个月[16-20]。而且射波刀避免了手术创伤大、术后切口恢复时间长、住院时间长、感染机率高、患者精神压力大等劣势,具有痛苦小、恢复快、并发症少且轻、住院时间短等优势。
放疗后,随着瘤体组织缩小、胆道梗阻解除,TBIL于放疗结束时复查即开始下降,放疗结束后1周较放疗前下降约为28.4%,而曾有报道外科手术术后1周胆红素下降率约为45.6%[15]。放疗后胆红素下降速度要慢于手术治疗,考虑与手术后梗阻迅速解除,而放疗后病变逐渐缩小、梗阻完全解除需时较长有关。但本组所有病例均在治疗后6.5个月内胆红素降至完全正常,并持续6~22个月不等。
国内有研究资料表明,外科手术、PTCD、ERCP 3种治疗恶性梗阻性黄疸的方案对比中,近期严重并发症(包括感染、发热、消化道出血、胆漏等)的发生率分别为28.0%、18.2%、8.3%;而在1篇关于三维适形放疗治疗恶性梗阻性黄疸的文献中,其近期并发症发生率约为42.9%,无严重并发症的发生[21]。这也体现了精准放疗的优势。而在我治疗中心使用射波刀针对恶性梗阻性黄疸的治疗中,其近期并发症共3例(27.3%),主要表现为恶心、呕吐,予对症治疗后明显改善,无严重并发症的发生。其原因考虑与射波刀精度高,剂量梯减速度快、对周围组织影响小有关。
本组患者中有2例在接受射波刀治疗前也接受了PTCD或ERCP治疗(各1例)。高胆红素血症可对机体多系统造成损害,甚至死亡。虽然单纯射波刀治疗可明显有效缓解梗阻性黄疸,一般在临床上,TBIL>300 μmol/L时行外科手术及其他微创治疗时均应慎重,亦有学者认为,TBIL<300 μmol/L时行外科手术比较安全[22]。故我科对于TBIL>300 μmol/L的情况推荐联合PTCD或ERCP,可加快TBIL下降趋势,减少其危害,提高患者生活质量,更有利于放疗进行。
4 小 结
综上所述,射波刀在针对原发性肝癌合并梗阻性黄疸的治疗中疗效确切。虽然本研究为回顾性资料,样本量小、随访时间较短,可能对结果造成一定的偏倚,但其不仅在针对原发性肝癌的局控率上、同时对于梗阻性黄疸反映出的显著疗效,均值得进一步临床观察。
[1] 张凯,任建庄,段旭华. 双介入治疗恶性梗阻性黄疸发展及现状[J]. 介入放射学杂志,2014,23(4):360-364.
[2] 雷进元. 胆道支架介入治疗恶性梗阻性黄疸[J]. 青海医药杂志,2012,42(3):21.
[3] National Comprehensive Cancer Networks(NCCN). NCCN Clinical Practice Guidelines in Oncology[EB/OL]. [2016-05-06]. https://www.nccn.org/professionals/physician_gls/f_guidelines. asp#hepatobiliary.
[4] 中国人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,16(10):929-946.
[5] Singh A, Mann HS, Thukral CL, et al. Diagnostic accuracy of MRCP as compared to ultrasound/CT in patients with obstructive jaundice[J]. J Clin Diagn Res, 2014, 8(3):103-107.
[6] 谭毓诠,王贵民. 论胆肠吻合[J]. 中国普通外科杂志,2005,14(8):564-566.
[7] Lin SC, Shan YS, Lin PW. Adequate preoperative biliary drainage is determinative to decrease postoperative infectious complications after pancreaticoduodenectomy[J]. Hepatogastroenterology, 2010, 57(101):698-705.
[8] Bonin EA, Baron TH. Preoperative biliary stents in pancreatic cancer[J]. J Hepatobiliary Pancreat Sci, 2011, 18(5):621-629.
[9] Qiu YD, Bai JL, Xu FG, et al. Effect of preoperative biliary drainage on malignant obstructive jaundice: a meta-analysis[J]. World J Gastroenterol, 2011, 17(3):391-396.
[10] 徐新保,张辉,肖梅,等. 术前减黄对70岁以上高龄低位胆管恶性梗阻性黄疸患者胰十二指肠切除术疗效的影响[J].空军总医院学报,2010,26(1):20-23,37.
[11] 薛慧,钟青,刘虎,等. 射波刀联合经导管肝动脉化疗栓塞治疗原发性肝癌的疗效及预后分析[J]. 传染病信息,2015,28(5):301-305.
[12] Lee MT, Kim JJ, Dinniwell R, et al. Phase I study of individualized stereotactic body radiotherapy of liver metastases[J]. J Clin Oncol, 2009, 27(10):1585-1591.
[13] 姜万荣,孙向东,韩成龙,等. 射波刀治疗35 例肝脏肿瘤的临床分析[J]. 现代肿瘤医学,2014,22(10):2410-2413.
[14] 曾琼,王莉莉. 三维适形放疗治疗恶性梗阻性黄疸的相关研究[J]. 临床急诊杂志,2012,13(2):136-137.
[15] 程黎娜,丁辉,杨惠,等. 老年晚期恶性梗阻性黄疸3种姑息治疗方法的疗效比较[J].中国内镜杂志,2015,21(11):1148-1151.
[16] Pohl J, May A, Aschmoneit I, et al. Double-balloon endoscopy for retrograde cholangiography in patients with choledochojejunostomy and Roux-en-Y reconstruction[J]. Z Gastroenterol, 2009, 47(2):215-219.
[17] Petillon S, Vibert E, Gorden DL, et al. Hepatectomy and intrahepatic biliary enteric anastomosis: a rescue surgery for obstructed metallic biliary stents in chronic pancreatitis[J]. Gastroenterol Clin Biol, 2010, 34(4-5):310-313.
[18] Artifon EL, Sakai P, Cunha JE, et al. Surgery or endoscopy for palliation of biliary obstruction due to metastatic pancreatic cancer[J]. Am J Gastroenterol, 2006, 101(9):2031-2037.
[19] Baron TH. Palliation of malignant obstructive jaundice[J]. Gastroenterol Clin North Am, 2006, 35(1):101-112.
[20] Lesurtel M, Dehni N, Tiret E, et al. Palliative surgery for unresectable pancreatic and periampullary cancer: a reappraisal[J]. J Gastrointest Surg, 2006, 10(2):286-291.
[21] 何兴鸿,贺敏. 三维适形放疗治疗恶性梗阻性黄疸35例[J].现代肿瘤医学,2009,17(12):2408-2409.
[22] van der Gaag NA, de Castro SM, Rauws EA, et al. Preoperative biliary drainage for periampullary tumors causing obstructive jaundice; DRainage vs. (direct) OPeration (DROP-trial) [J]. BMC Surg, 2007, 7:3.
(2016-08-05收稿 2016-11-10 修回)
(本文编辑 胡 玫)
Curative effect observation of 11 cases of primary liver cancer with obstructive jaundice treated by cyberknife
FAN Yu-ze, SUN Jing, LI Huan, SUN Ying-zhe, DUAN Xue-zhang*
Tumor Radiotherapy Center, 302 Military Hospital of China, Beijing 100039, China
ObjectiveTo evaluate the efficacy and adverse effects of stereotactic radiotherapy (cyberknife) in the treatment of primary liver cancer patients with obstructive jaundice.MethodsCyberknife for 11 cases of primary liver cancer patients with obstructive jaundice were conducted. A total of 48~50 Gy was continuously delivered to planning target volume with single dose of 5~7 Gy and 7 to 10 fractions. The combined treatment of percutaneous transhepatic cholangio-drainage or endoscopic retrograde cholangiopancreatography was conducted for two patients with TBIL>300 μ mol/L before radiotheraphy.ResultsThese patients were followed up for 12 to 28 months after cyberknife treatment. Twelve months after the treatment, the tumor control rate was 81.8%, and clinical benefit rate was 81.8%. The survival rate was 81.8%. The related clinical indicators such as TBIL, ALT, ALP, GGT were significantly improved.ConclusionsThe treatment of liver cancer with obstructive jaundice by cyberknife has a high tumor control rate with significant decrease of serum bilirubin, exact curative effect and small adverse reaction.
primary liver cancer; obstructive jaundice; cyberknife; stereotactic radiotherapy
R512.91;R373.9;R774.11
A
1007-8134(2017)02-0099-05
10.3969/j.issn.1007-8134.2017.02.008
首都特色基金(Z151100004015002)
100039 北京,解放军第三○二医院肿瘤放射治疗中心(范毓泽、孙静、李欢、孙颖哲、段学章)
段学章,E-mail: duanxuezhang2006@163.com
*Corresponding author, E-mail: duanxuezhang2006@163.cm
