基于斑马鱼模型的昆海姜辛汤组分配伍的抗炎作用研究
2017-05-10彭维兵周玲晓付先军何秋霞王振国刘可春
彭维兵, 周玲晓,,3, 付先军,何秋霞, 王振国*, 刘可春*
(1.山东省科学院生物研究所,山东省生物传感器重点实验室,山东省科学院药物筛选技术重点实验室,山东 济南 250014;2.山东中医药大学中医医史文献学泰山学者工作室,山东 济南 250355;3.石药集团抗肿瘤药事业部,河北 石家庄 050035)
【药理与毒理】
基于斑马鱼模型的昆海姜辛汤组分配伍的抗炎作用研究
彭维兵1, 周玲晓1,2,3, 付先军2,何秋霞1, 王振国2*, 刘可春1*
(1.山东省科学院生物研究所,山东省生物传感器重点实验室,山东省科学院药物筛选技术重点实验室,山东 济南 250014;2.山东中医药大学中医医史文献学泰山学者工作室,山东 济南 250355;3.石药集团抗肿瘤药事业部,河北 石家庄 050035)
为了研究海洋中药复方昆海姜辛汤组分配伍的抗炎作用,利用硫酸铜溶液诱导建立斑马鱼炎症模型,分别以不同浓度的昆海姜辛汤组分配伍溶液(100、50、25 μg/mL)干预此模型,在体视荧光显微镜下观察其对斑马鱼巨噬细胞数量的影响。结果表明,昆海姜辛汤的合方组分配伍溶液使硫酸铜诱导的斑马鱼炎症模型的巨噬细胞的数量明显减少,具有抗炎作用。
昆海姜辛汤;组分配伍;斑马鱼;抗炎
海洋中药用于防治疾病在我国已经有几千年的历史,是中药宝库中的重要组成部分,其研发和产业化已经成为国家海洋经济重要的增长点之一[1-3]。中药有效组分配伍模式是以中医药理论为基础,以系统的科学思想为指导,遵循传统方剂配伍理论和原则,经严谨规划,针对有限适应病证,利用中药中成(组)分明确、药理作用清楚的生物活性物质,研究具有某一特定药理作用的中药成(组)分配伍组方[4]。研究克服了饮片配伍提取量大,化学物质繁杂,质量控制标准低、效应不强、针对性差等缺点,从长远看,亦有利于节约中药资源,实现中药的可持续发展。
本文研究的复方昆海姜辛汤,是付先军等[5-6]基于古代文献中的研究成果,收集几万条归肺经的中药及其配伍规律、化学成分、药理作用、临床功效等信息,应用数据挖掘技术、化学信息技术、海洋植物中药归经作用预测及组方设计技术而得到的。
炎症是具有血管系统的活体组织对损伤因子所发生的防御性反应,巨噬细胞的迁移与吞噬过程在炎症反应中具有重要作用。研究发现,许多疾病的发生与发展都与炎症有着密切的关系,因此有效控制炎症的发生与发展引起众多学者的关注。
体外研究发现,昆海姜辛汤的多种组分具有增强免疫和抗炎活性。昆布多糖可明显增强巨噬细胞吞噬功能,其富含的岩藻糖、甘露糖和硫酸基,可激活巨噬细胞而达到增强免疫的目的[7]。褐藻多糖硫酸酯可诱导巨噬细胞活化,分泌NO、TNF-a、IL_6 等炎性细胞因子[8]。Zhang[9]等的研究发现,褐藻多糖硫酸酯减少了实验性炎症过程中选择素介导的白细胞浸润和组织损伤。干姜具有镇痛抗炎、抗肿瘤、利胆、抗菌、抗病原体的作用,可能是通过抑制PG合成、对抗5-羟色胺和组胺以及促皮质激素样作用产生抗炎效应。细辛挥发油可降低炎症渗出液中组胺含量,亦可抑制对大鼠胸腔注射角叉菜胶引起的白细胞游走及大鼠棉球肉芽肿[10]。因此,本研究选取昆布多糖、褐藻多糖、姜辣素、细辛脂素作为主要组分,在中医“君臣佐使”理论基础的指导下进行配伍,验证其体内抗炎活性[5]。
斑马鱼(Daniorerio)体型较小,成鱼体长4~6 cm,具有繁殖力强、性成熟周期短、体外受精、胚胎透明、基因与人类基因保守度高等特点。因此,斑马鱼目前已经成为一种研究人类疾病的模式动物。本研究利用硫酸铜特异性损伤侧线毛细胞,造成炎症病灶,建立斑马鱼炎症模型,探讨昆海姜辛汤组分配伍的体内抗炎作用。
1 实验材料
1.1 斑马鱼品系
巨噬细胞荧光转基因斑马鱼(zlyz:egfp),取自山东省科学院生物研究所斑马鱼药物筛选平台,其养殖和培育参照Westerfield所述方法[11]。选择成熟的斑马鱼,按照雌鱼与雄鱼1∶1或者1∶2的比例置入繁殖缸内,次日清晨取出受精卵,加入亚甲基蓝溶液,放入28 ℃培养箱中孵化,备用。
1.2 材料与试剂
昆布多糖购自济南汇丰科贸有限公司(质量分数99%,批号:14092923);褐藻多糖购自中国海洋大学(质量分数90%,批号:14072526);姜辣素购自成都普菲德生物技术有限公司(质量分数99%,批号:140914);细辛脂素购自成都普菲德生物技术有限公司(质量分数99%,批号:151116);二甲基亚枫(DMSO)购自国药集团化学试剂有限公司(批号:20150530);硫酸铜购自北京益利精细化学品有限公司(批号:20140512);4%多聚甲醛购自北京益利精细化学品有限公司;Tween20,TEMED,购自美国Sigma公司。
2 实验方法
2.1 配制样品溶液
2.1.1 昆海姜辛汤各组分溶液的配制
昆布多糖、褐藻多糖、姜辣素、细辛脂素用胚胎培养用水配制成1 mg/mL的储液;对于水溶性较差的姜辣素、细辛脂素,以二甲基亚砜为溶剂配制1 mg/mL的储液,放入4 ℃冰箱备用。
2.1.2 硫酸铜溶液的配制
硫酸铜粉末用纯净水配成10 mmol/L的储液,工作液浓度是20 μmol/L。
2.1.3 收集胚胎
雌雄斑马鱼分开喂养,水温控制在28 ℃,照明 14 h 与黑暗10 h交替进行,以人工颗粒状饵料和刚孵出的卤虫无节幼体(Artemia) 定时喂养。取卵时,于傍晚取健康性成熟的成年雌雄斑马鱼各两条放于底部具有筛板的交配缸内,中部用透明挡隔开,次日上午将挡板撤去,10时左右收集受精卵( 透明状,小米大小)。收集后,移入质量分数0.5%亚甲基蓝溶液中(胚胎培养用水配制),清洗消毒胚胎(消毒液以170 mL 培养用水中加入0.1 mL 5%次氯酸钠溶液制得),几分钟后将其移入清洁的胚胎培养用水中,28 ℃下控光培养72 h 后,在体视显微镜下挑选发育正常的胚胎,即获得实验用动物模型。
2.1.4 昆海姜辛汤与仔鱼共孵育
取48孔培养板,每6孔为一组,取适量的样品母液,用胚胎培养用水稀释得到不同浓度的样品溶液,二甲基亚砜的质量分数不大于0.5%。选择受精后3 d的巨噬细胞标记荧光的转基因斑马鱼仔鱼放入48孔板,每孔2 mL培养水,8条仔鱼,不同浓度的昆海姜辛汤提前 30 min 与斑马鱼仔鱼孵育,以利于中药成分进入斑马鱼体内。昆海姜辛汤各组分配伍(寒寒组:昆布多糖+褐藻多糖;热热组:姜辣素+细辛脂素;寒热组:昆布多糖+褐藻多糖+姜辣素+细辛脂素)的浓度分别为100 、50 、25 μg/mL。然后,向各个实验组中加入终浓度为20 μmol/L的硫酸铜溶液处理仔鱼1 h,同时设定溶剂对照组。随后加盖封闭,放于可控温光照培养箱中恒温( 28 ℃)共同孵育。
2.1.5 结果观测
孵育完成后,吸出培养基,以4%多聚甲醛溶液(pH = 7.4)于室温下固定仔鱼1 h,然后用 PBS-Tween20 洗3次,每次5 min。GFP标记斑马鱼固定后一天,在荧光显微镜和倒置显微镜下观察巨噬细胞的数量,以观察其炎症反应。为方便观察巨噬细胞的数量,可将斑马鱼侧躺于凹槽载玻片里,尽量吸干载玻片上的固定液。
2.1.6 数据分析
所有数据统计分析都采用数据统计软件SPSS16.0对实验数据进行处理,并进行样本组间多重比较。如果p<0.05,则认为存在显著性差异。
3 实验结果
从图1、图2结果可以发现,空白对照组和硫酸铜组的斑马鱼,其巨噬细胞在头部、卵黄囊、躯干部以及尾部均出现聚集,但硫酸铜组的巨噬细胞的数量明显多于空白对照组,说明利用硫酸铜诱导斑马鱼炎症模型是成功的[12-13]。
在中医“君臣佐使”理论基础的指导下,本研究将昆海姜辛汤各中药质量比设定为3∶3∶2∶1,同时筛选各味中药中所占质量分数较多、文献报道具有抗炎活性的组分。通过文献查询,选取昆布多糖、褐藻多糖、姜辣素、细辛脂素作为主要组分,组分的质量比同样设定为3∶3∶2∶1。根据昆海姜辛汤中各味药材的药性,在中药药性理论指导下进行组分配伍[5]。分为寒热两类,分别进行配伍,昆布多糖与褐藻多糖(质量比1∶1)为寒寒组,姜辣素与细辛脂素(质量比2∶1,)为热热组,昆布多糖、褐藻多糖、姜辣素和细辛脂素(质量比3∶3∶2∶1)为寒热组。
在溶液浓度为100 μg/mL时,昆布多糖与褐藻多糖配伍溶液的斑马鱼组中,其巨噬细胞的数量明显减少;姜辣素和细辛脂素组分配伍溶液的斑马鱼组中,其巨噬细胞的数量没有明显的减少;但是在昆布多糖、褐藻多糖、姜辣素和细辛脂素合方的组分配伍溶液的斑马鱼组中,其巨噬细胞的数量减少得更为明显。
在溶液浓度为50 μg/mL时,昆布多糖与褐藻多糖组分配伍溶液的斑马鱼组中,其巨噬细胞的数量有所减少,但并不明显;在姜辣素和细辛脂素组分配伍溶液的斑马鱼组中,其巨噬细胞的数量没有明显的减少;但是在昆布多糖、褐藻多糖、姜辣素和细辛脂素合方的组分配伍溶液的斑马鱼组中,其巨噬细胞的数量减少得比较明显。
在溶液浓度为25 μg/mL时,昆布多糖与褐藻多糖组分配伍溶液的斑马鱼组中,其巨噬细胞的数量没有明显减少;在姜辣素和细辛脂素的组分配伍溶液的斑马鱼组中,其巨噬细胞的数量没有明显的变化;但是在昆布多糖、褐藻多糖、姜辣素和细辛脂素合方的组分配伍溶液的斑马鱼组中,其巨噬细胞的数量亦没有明显的减少。
以上分析说明,昆海姜辛汤不同浓度的组分配伍可以使硫酸铜诱导的斑马鱼炎症模型的巨噬细胞的数量明显减少,说明昆海姜辛汤合方的组分配伍具有抗炎作用。
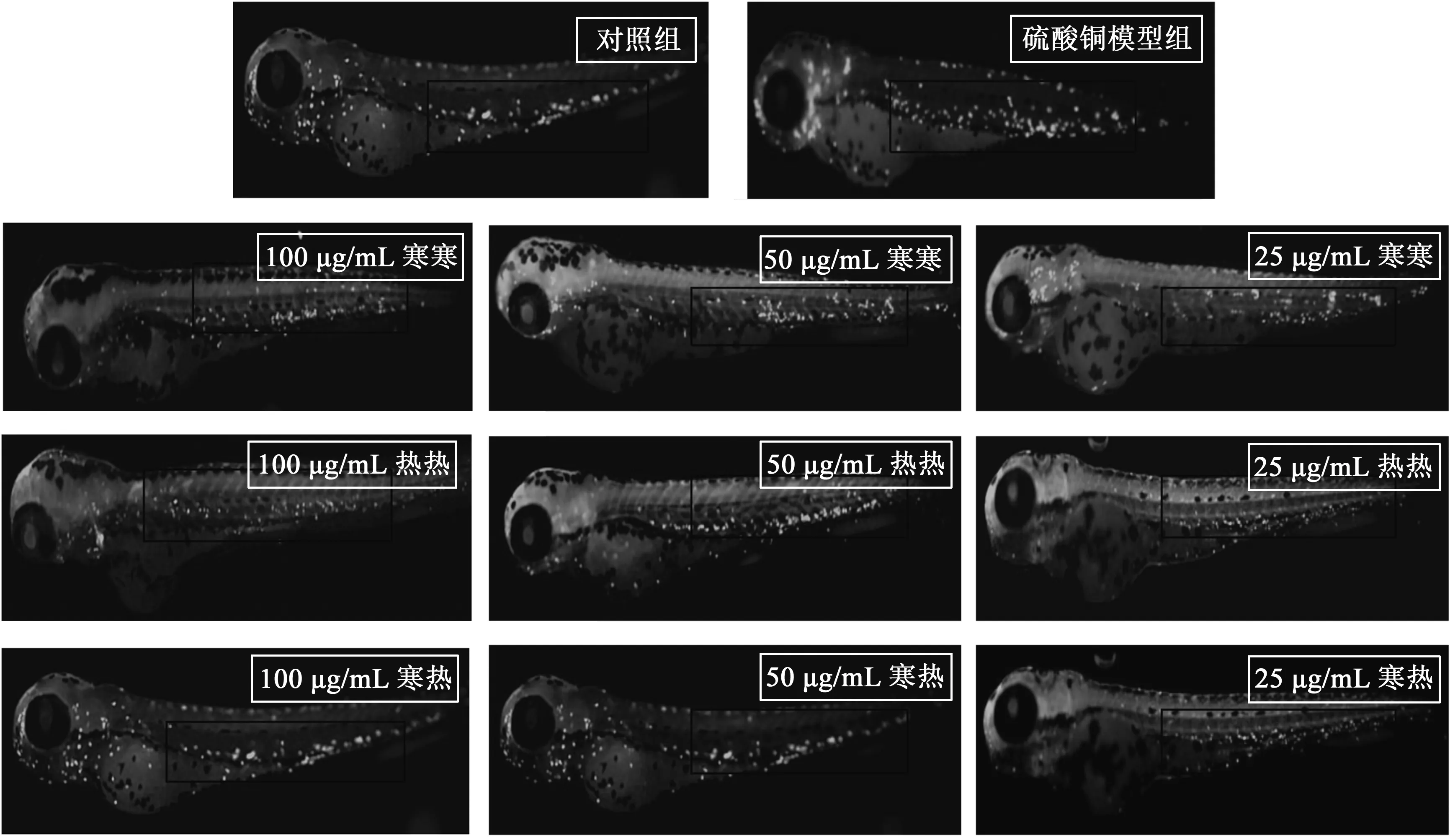
寒寒组:昆布多糖+褐藻多糖;热热组:姜辣素+细辛脂素;寒热组:昆布多糖+褐藻多糖+姜辣素+细辛脂素。图1 昆海姜辛汤组分配伍对斑马鱼炎症反应的影响Fig.1 The anti-inflammatory effect of component from Kunhai ginger decoction on zebrafish inflammatory model

寒寒组:昆布多糖+褐藻多糖;热热组:姜辣素+细辛脂素;寒热组:昆布多糖+褐藻多糖+姜辣素+细辛脂素。与模型组相比,**P<0.01;*P<0.05。图2 昆海姜辛汤组分对斑马鱼仔鱼侧线巨噬细胞数量的影响Fig.2 The effect of component from Kunhai ginger decoction on the number of macrophage on zebrafish lateral line
4 讨论
目前,斑马鱼已广泛应用于构建人类疾病模型[14]及相关药物筛选[15-16]等方面,如抗新生血管形成、肿瘤、血液疾病、细胞凋亡和增殖、脂质代谢、炎症和中枢耐受等[17-19]。与线虫、果蝇、鼠等其他模式生物相比,在结构、生理、分子水平等方面,斑马鱼器官与人器官惊人地相似,在蛋白质水平上,关键部位的同源性几乎是100%。荧光标记转基因系斑马鱼胚胎透明,应用转基因技术,通过特异性基因启动子控制下游的绿荧光蛋白(Egfp),在特定的器官或细胞中表达,可以实现对某一特定器官或细胞的示踪。因此,本研究选用巨噬细胞标记荧光的转基因斑马鱼(zlyz:egfp)为模型,建立炎症模型,评价昆海姜辛汤的体内抗炎活性。
研究表明,巨噬细胞是炎症的重要调节细胞,通过定向募集和活化炎症细胞,产生炎性介质,合成并释放控制和调节气道炎症反应的细胞因子参与气道炎症过程,是许多免疫及炎性反应的始动环节,在炎症的发生、发展中起重要作用,在炎症中既是免疫调节细胞,又是免疫效应细胞[20]。因此,本文以昆海姜辛汤组分配伍对斑马鱼侧线炎症病灶中巨噬细胞数量的影响为依据,探讨其抗炎作用。
本研究中,昆海姜辛汤合方的组分配伍溶液可以使硫酸铜诱导的斑马鱼炎症模型的巨噬细胞的数量明显减少,说明寒热药性配伍的昆海姜辛汤合方组分较寒寒组分配伍和热热组分配伍具有更显著的抗炎作用。
昆海姜辛汤中,昆布、海藻属于海洋植物类中药。昆布性寒,具有消痰利水的作用,为君药;海藻的作用与昆布类似,在方中与昆布起协同作用,为臣药;干姜辛热,具有温中散寒、燥湿化痰的功效,治疗痰饮喘咳;细辛辛温,具有祛风散寒、温肺化饮的功效,也可治疗痰饮喘咳。干姜与细辛共为佐使药,一方面可助昆布、海藻化痰,为佐助药;另一方面可制约昆布、海藻的寒性,又可作为佐制药;而且,两位药还可以引君臣二药入肺经而治疗肺经痰饮,因此还可作为使药。昆海姜辛汤主要作用特点体现在寒温并用,方中四味药的配伍,使得全方寒温适度,共奏化痰利水、止咳平喘之功[21]。
中药方剂大多是多组分协同作用,通过多靶标调控进行整合调节。本研究结果提示,昆海姜辛汤中寒热组分配伍的疗效较单纯寒寒配伍和热热配伍明显,为中药方剂的寒热配伍提供了一定的实验依据。
昆海姜辛汤作用的物质基础、分子机制及配伍机制尚不十分明确,下一步的研究可以从疾病生物分子网络的关键调控环节和靶标入手,从分子层次来识别昆海姜辛汤中寒热组分的协同作用机制,为诠释中药寒热配伍提供客观的科学依据。
[1]山东省发改委.山东沿海经济带发展战略研究[EB/OL].[2016-11-20].http://www.docin.com/p-765414801.html.
[2]付先军,管华诗,吴强明,等.海洋中药发展源流初探[J].中华医史杂志,2009, 39(3):168-172.
[3]管华诗,王曙光. 中华海洋本草[M]. 上海:上海科技出版社,2009.
[4]WILSON R,GROSSMAN R. Introduction: the role of bacterial infection in chronic bronchitis[J]. Semin Respir Infect, 2000, 15(1): 1-6.
[5]付先军, 王振国. 传统药性理论指导下的海洋中药复方研究思路探析[J]. 世界科学技术-中医药现代化, 2013,15(3):489-494.
[6]付先军, 王振国, 李学博,等. 基于关联网络的非相关文献知识发现技术挖掘海洋中药用药经验模式[J]. 世界科学技术-中医药现代化, 2014,16(7):1465-1469.
[7]蔡慎初. 海藻消瘿方治疗甲状腺腺瘤的疗效观察[J]. 中国中药杂志,1997,22( 2):120-121.
[8]KIUCHI F, IWAKAMI S, SHIBUYA M, et al.Inhibition of prostaglandin and leukotriene biosynthesis by gingerols and diarylheptanoids [J]. Chem Pharm Bull, 1992,40(2):387-391.
[9]ZHANG X W, LIU Q, THORLACIUS H. Inhibition of selectin function and leukocyte rolling protects against dextran sodium sulfate-induced murine colitis[J]. Scand J Gastroenterol, 2001, 36(3): 270-275.
[10] WILSON R. Evidence of bacterial infection in acute exacerbations of chronic bronchitis[J]. Semin Respir Infect 2000,15(3): 208-215.
[11]WESTERFIELD M. The zebrafish book:A guide for the laboratory use of zebrafish (Daniorerio)[M]. 4th edition. Eugene,OR: Univ of Oregon Press.
[12]D'ALENÇON C A, PEA O A, WITTMANN C,et al. A high-throughput chemically induced inflammation assay in zebrafish[J]. BMC Biol, 2010, 8:151.
[13]WITTMANN C, REISCHL M, SHAH A H, et al. Facilitating drug discovery: An automated high-content inflammation assay in zebrafish[J]. J Vis Exp, 2012,65:e4203.
[14] LANGENAU D M, TRAVER D, FERRANDO A A, et al. Myc-induced T cell leukemia in transgenic zebrafish[J]. Science, 2003, 299: 887-890 .
[15]CHILDS S, CHEN J N, GARRITY D M, et al. Patterning of angiogenesis in the zebrafish embryo[J]. Development , 2002 , 129(4): 973-982.
[16] PARNG C , SENG W L , SEMINO C ,et al. Zebrafish:A preclinical model for drug screening[J] . Assay Drug Develop Technol,2002 ,1(1):41-48.
[17] LANGHEINRICH U. Zebrafish: A new model on the pharma-ceutical catwalk [J]. Bioessays, 2003, 25(9): 904-912.
[18] CROSS L M, COOK M A, LIN S, et al. Rapid analysis of angiogenesis drugs in a live fluorescent zebrafish assay [J]. Arterioscler Thromb Vasc Biol, 2003, 23(5): 911-912.
[19] LIU S, LEACH S D. Zebrafish models for cancer [J]. Annu Rev Pathol, 2011, 6: 71-93.
[20]李磊,王正国,胡承香,等.创伤血清异常蛋白对巨噬细胞功能作用的研究[J]. 中国危重病急救医学,1998,10(8):492-494.
[21]付先军. 中药归经(肺经)理论和肺系方剂配伍规律的解析及在海洋中药研发中的应用[D]. 青岛:中国海洋大学, 2009.
Anti-inflammatory research on component combination of Kunhai ginger decoction based on zebrafish model
PENG Wei-bing1, ZHOU Ling-xiao1,2,3, FU Xian-jun2, HE Qiu-xia1, WANG Zhen-guo2,*, LIU Ke-chun1*
(1.Shandong Provincial Key Laboratory of Biosensors, Key Laboratory for Drug Screening Technology of Shandong Academy of Sciences, Biology Institute,Shandong Academy of Sciences, Jinan 250014,China;2.Taishan Scholar Studio of Specialty of History and Literature of Traditional Chinese Medicine,Shandong University of Traditional Chinese Medicine, Jinan 250355,China;3.CSPC Antineoplastic Drug Company, Shijiazhuang 050035,China)
∶To study the anti-inflammatory effects of one marine medicine, compound Kunhai ginger decoction, whose component was prepared in different combination, zebrafish inflammatory model was established, induced by copper sulfate solution. The model was intervened by different concentrations of component combination solution from Kunhai ginger decoction (100, 50, 25 μg/mL) respectively, and its effect on the number of macrophage cell in zebrafish was observed by stereo fluorescence microscope. The results reveal that the number of macrophage cell in zebrafish inflammatory model induced by copper sulfate is reduced obviously due to the component combination solution from compound Kunhai ginger decoction, which hasinvivoanti-inflammatory effects.
∶Kunhai ginger decoction; component combination; zebrafish; anti-inflammatory
10.3976/j.issn.1002-4026.2017.02.006
2017-02-07
山东省人力资源和社会保障厅博士后创新项目(201102036)
彭维兵(1980—),男,博士,副研究员,研究方向为药理学。E-mail: weibingpeng@hotmail.com
*通信作者,王振国(1963—),男,教授,研究方向为中药药性理论与海洋中药研究。E-mail:zhenguow@126.com 刘可春(1964—),男,博士,研究员,研究方向为药物筛选。E-mail:hliukch@sdas.org
R965.1;R282.77
A
1002-4026(2017)02-0037-06
