不同规格全血制备富血小板血浆的最佳离心条件研究*
2017-04-26王淑君赵广超栾建凤朱培元
王淑君 赵广超 栾建凤 朱培元
不同规格全血制备富血小板血浆的最佳离心条件研究*
王淑君 赵广超 栾建凤 朱培元
目的 研究不同规格全血分离制备富血小板血浆(PRP)的最佳离心条件。方法 共采集54例健康献血者的新鲜全血,根据离心次数和离心条件分为两次离心组(A、B、C三种分离方法)和三次离心组(D、E、F三种分离方法)共6组,每组含200、300和400 ml全血各6袋。检测每组制备PRP的血小板计数和红细胞混入量,计算血小板回收率并进行比较。结果 两次离心法所制备PRP的血小板回收率最高,但红细胞混入量较多,其中200 ml全血采用方法A最佳(即初次850 g离心8 min,第2次4 650 g离心5 min),300 ml全血为方法B(初次1 000 g离心6 min,第2次4 650 g离心5 min),400 ml全血为方法C(初次1 220 g离心5 min,第2次4 650 g离心6 min)。三次离心法与二次离心法相比,红细胞混入量明显减少(P<0.05),但血小板回收率有所降低。 结论 不同规格全血制备PRP应采用不同的离心条件,两次离心法适用于制备新鲜PRP或血小板胶,而三次离心法更适合冰冻或冻干PRP或血小板胶。
富血小板血浆 无偿献血者 制备
富血小板血浆(platelet-rich plasma,PRP)是将新鲜全血通过特定离心方式得到含高浓度血小板的血浆,可用于制备血小板胶(platelet gel,PG)。PRP与PG富含多种生长因子,在难治性溃疡、烧伤、口腔医学及整形外科等领域均为研究热点[1]。绝大部分研究采用患者自体血制备PRP,但由于制备过程需要一定时间,不适合紧急情况下应用,同时部分患者不适合采集自体血[2,3]。笔者在采用无偿捐献者全血制备和保存异体PG的研究中发现,不同规格的全血分离制备PRP须采用不同的离心条件才能获得最佳效果,从而满足不同的使用目的,现报告如下。
对象与方法
1 研究对象 108例健康献血者(男性68例,女性40例),经筛查均符合《献血者健康要求》(GB18467-2011),征得献血者知情同意后采集全血。采血过程中充分混匀血液及血液保存液,在规定时间内完成采集(200 、300、400 ml全血的采集时间不超过5、7.5、10 min),采集后6 h内离心。共采集200、300、400 ml全血各36袋。2 主要仪器及耗材 Cryofuge 6000i大容量低温离心机(德国Kendro公司),XE2100全自动血细胞分析仪(日本Sysmex公司),SE250热合机(韩国森通公司)、CZK-IIC采血秤(苏州市医用仪器厂),一次性使用塑料四联采血袋(山东威高)。3 方法
3.1 实验分组:根据离心次数和离心条件分为两次离心组(A、B、C三种分离方法)和三次离心组(D、E、F三种分离方法),共6组,每组离心分离200、300、400 ml全血各6袋。具体离心条件见表1,离心温度均为(22±2)℃。详见表1。
3.2 两次离心组PRP制备方法:全血经初次离心后将上层血浆分入1号转移袋;将另一袋内的红细胞保存液加入主袋的浓缩红细胞内,用热合机切断连接塑料管即为悬浮红细胞;将血浆袋协同转移袋经过第2次离心,使血小板下沉于底部形成沉淀;分离上层少血小板血浆(platelet-poor plasma,PPP)进入2号转移袋,用热合机切断塑料管,即为新鲜血浆;充分混匀血小板沉淀与剩余约30 ml血浆(1号转移袋内),即为PRP。
3.3 三次离心组PRP制备方法:全血经初次离心后将上层血浆分入1号转移袋;将另一袋内的红细胞保存液加入主袋浓缩红细胞内,用热合机切断连接塑料管即为悬浮红细胞;将血浆袋协同转移袋经过第2次离心使红细胞沉积在底部,分离上层血浆进入2号转移袋,用热合机切断分离1号转移袋;将血浆袋协同转移袋3次离心,使血小板下沉于底部形成沉淀;分离上层PPP进入3号转移袋,用热合机切断塑料管即为新鲜血浆(3号转移袋内);充分混匀血小板沉淀与剩余约30 ml血浆(2号转移袋内)即为PRP。
3.4 检测指标:无菌条件下利用10 ml注射器抽取各组PRP 2 ml,测定血小板计数和红细胞残余量,计算血小板回收率(PRP中血小板含量占全血含量的百分率)。
3.5 统计学处理:应用SPSS20.0软件,数据用±s表示,每种规格全血不同离心方法的PLT回收率、RBC混入量比较采用单因素方差分析的SNK法,P<0.05表示差异有统计学意义。
结 果
两次离心法获得的血小板沉淀中肉眼可见残留红细胞,而三次离心法获得的血小板沉淀中肉眼未见残留红细胞。两次离心法获得的PRP中血小板含量和血小板回收率均较高,但红细胞混入量相应较高;三次离心法获得的PRP中血小板含量和血小板回收率虽略有降低,但红细胞混入量很少。不同规格全血采用不同离心方法制备的PRP中血小板含量、红细胞混入量及血小板回收率见表2~4。
讨 论
用于制备PG的PRP主要采用手工离心分离法或全自动血液分离机制备,全自动设备价格昂贵,目前多采用手工分离法。在众多研究中,采用的离心速度和时间差异很大,终产品的生物特性也不尽相同[4,5],尚缺乏公认的统一制备标准[6]。此外,多数有关PG的研究采用少量全血在试管中制备PRP,制备过程中需多次在试管间转移,获得的血小板数量有限。近年来,虽然利用献血者捐献的全血制备汇集血小板呈上升趋势,但大多数献血者全血中的血小板并未得到有效利用,在去除白细胞和制备血液成分过程中被丢弃。利用献血者全血分离制备大量PRP并进行低温或冻干保存,适用于以下需要采用PG治疗的情况:无条件采集自体血的患者,如大面积烧伤或老年体弱者;需反复治疗的患者,如术后切口不愈合伴窦道形成者;战场或特殊情况下的严重创伤患者。
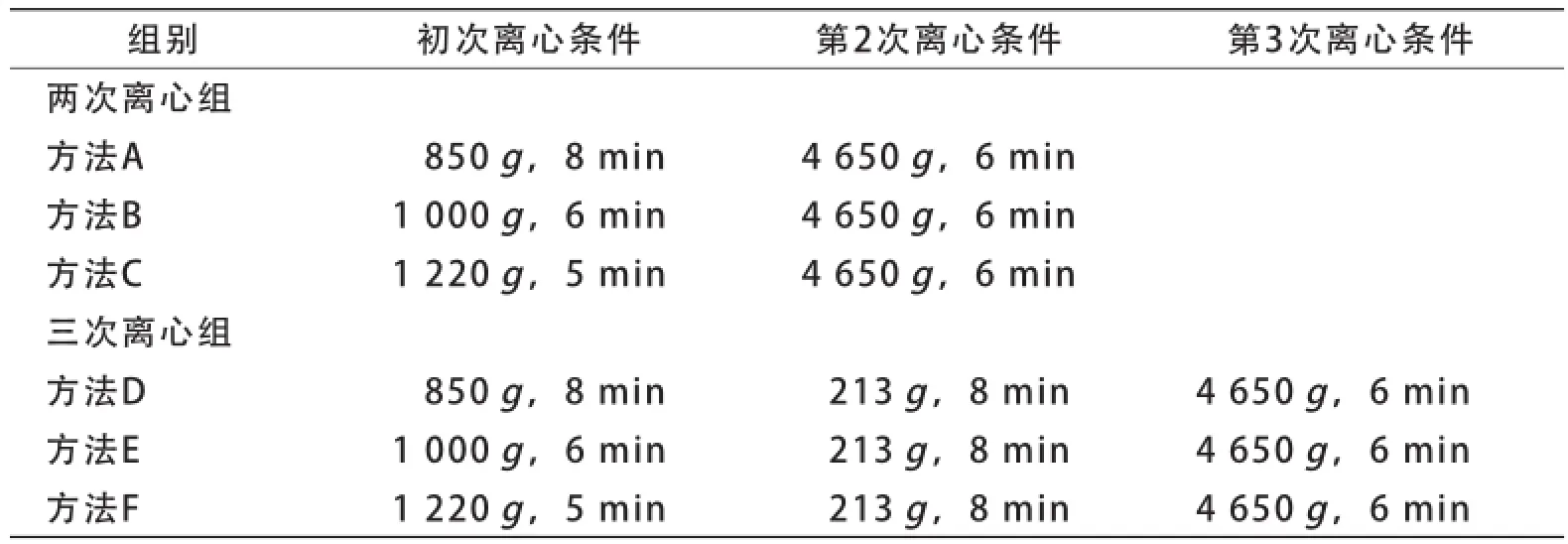
表1 实验分组及离心条件
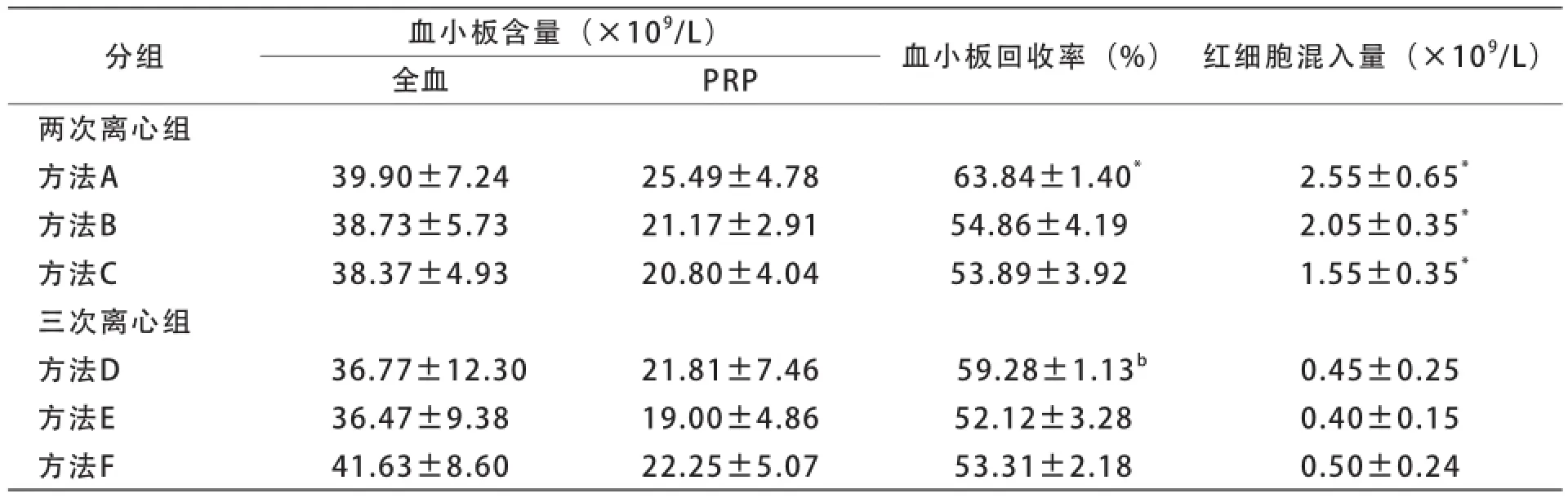
表2 200 ml全血各种离心法的分离效果比较(±s,n=6)
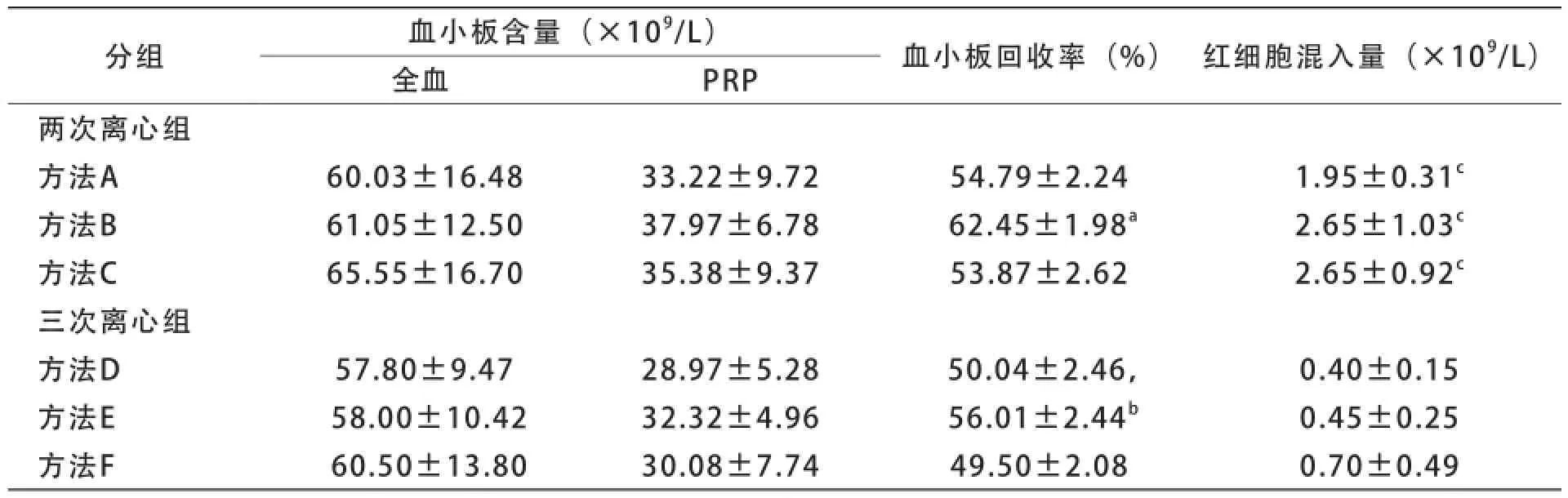
表3 300 ml全血各种离心法的分离效果比较(±s,n=6)
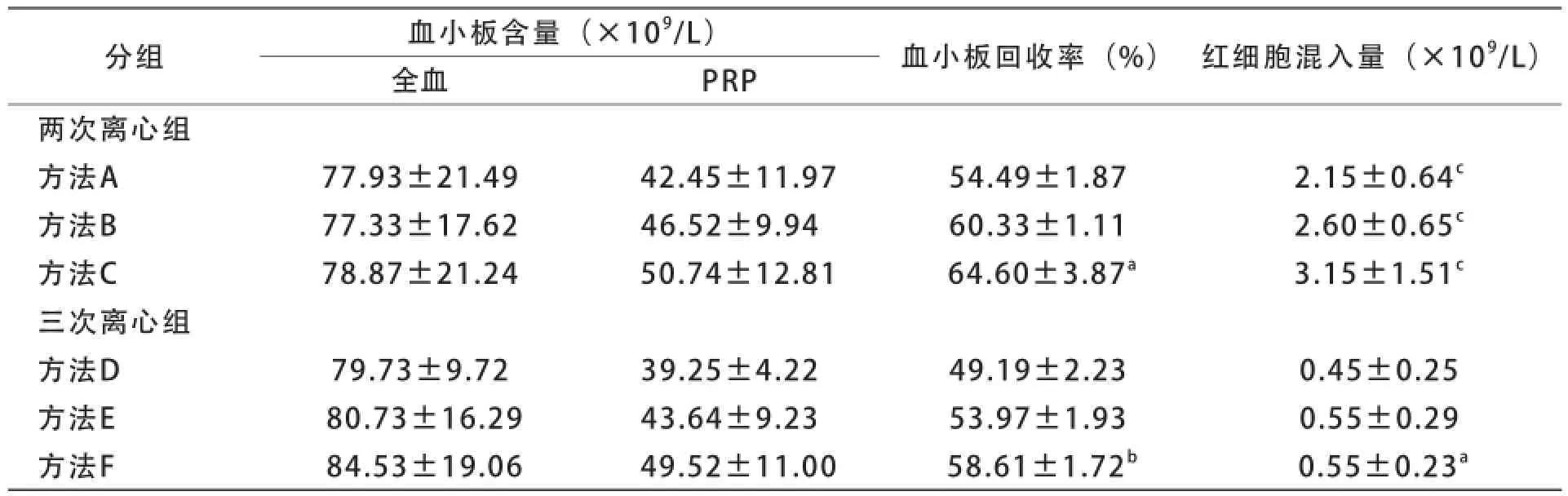
表4 400 ml全血各种离心法的分离效果比较(±s,n=6)
目前,有关采用献血者全血制备PRP的最佳离心条件并无一致意见[7,8]。本研究在预试验中参考《输血技术》(第3版)中制备PRP的条件[9],即首次以离心力1 220 g离心5 min,再以离心力4 650 g离心6 min(即方法C),结果发现200 ml全血在上述离心条件下形成少量白膜,血小板回收率不足,因此考虑针对不同规格的全血设计不同PRP离心制备条件。结果显示,通过降低首次离心的离心力,可提高200、300 ml全血的血小板回收率。对于200 ml全血,首次离心采用离心力850 g离心8 min获得的血小板回收率最高(方法A),300 ml全血首次离心采用离心力1 000 g离心6 min最好(方法B),400 ml全血则维持采用首次1 220 g离心5 min(方法C)。
两次离心法获得的PRP中血小板回收率高,但红细胞混入量相应增加,200 ml全血采用方法A、300 ml全血采用方法B、400 ml全血采用方法C获得的血小板回收率最高。本研究参考文献报道的血小板分离纯化方法[10],设计了三次离心法,即在首次离心后增加1次低速离心(213 g,8 min)以进一步去除残留的红细胞,结果红细胞混入量明显降低,与两次离心组的相应离心方法相比差异有统计学意义(P<0.05)。根据血小板含量、血小板回收率和红细胞混入量综合判断,200 ml全血采用方法D、300 ml全血采用方法E、400 ml全血采用方法F分离制备的PRP,符合国家标准《全血及成分血质量要求》(GB 18469-2012)中关于浓缩血小板的质量控制要求。
综上所述,临床上可根据PRP的使用目的选择不同的离心条件:两次离心法获得的PRP中血小板回收率最高,但红细胞混入量较多,适合制备新鲜PRP或PG;三次离心法制备的PRP中血小板有所损失,但红细胞混入量显著减少,更适合低温冻存或冻干保存PRP或PG。
1 Burnouf T,Goubran HA,Chen TM,et al. Bloodderived biomaterials and platelet growth factors in regenerative medicine[J]. Blood Rev,2013,27(2):77-89.
2 Horimizu M,Kawase T,Nakajima Y,et al. An improved freeze-dried PRP-coated biodegradable material suitable for connective tissue regenerative therapy[J]. Cryobiology,2013,66(3):223-232.
3 De Pascale MR,Sommese L,Casamassimi A,et al.Platelet derivatives in regenerative medicine: an update[J]. Transfus Med Rev,2015,29(1):52-61.
4 Tamimi FM,Montalvo S,Tresguerres I,et al. A comparative study of 2 methods for obtaining plateletrich plasma[J]. J Oral Maxillofae Surg,2007,65(6):1084-1093.
5 Weibrich G,Hansen T,Kleis W,et al. Effect of platelet concentration in platelet-rich plasma on periimplant bone regeneration[J]. Bone,2004,34(4):665-671.
6 Anitua E,Sánchez M,Nurden AT,et al. New insights into and novel applications for platelet-rich fibrin therapies[J]. Trends Biotechnol,2006,24(5):227-234.
7 高加良,雷宇,万科,等. 汇集浓缩血小板滤除白细胞前后质量检测分析[J]. 临床输血与检验,2016,18(1): 71-73.
8 杨建波,王红娜,范泽辉,等. 白膜法汇集浓缩血小板对血小板收集率的影响[J]. 临床输血与检验,2015,17(5): 464-465.
9 王憬惺. 输血技术[M].第3版.北京∶人民卫生出版社,2013: 80-81.
10 Best MG,Sol N,Kooi I,et al. RNA-Seq of tumor-educated platelets enables blood-based panbancer,multiclass,and molecular pathway cancer diagnostics[J]. Cancer Cell,2015,28(5):666-676.
The Optimal Centrifugation for Preparation of Platelet-rich Plasma from Different Volumes of Whole Blood
WANG Shu-jun,ZHAO Guang-chao,LUAN Jian-feng,et al.
Department of Blood Transfusion,Nanjing General Hospital of Nanjing Military Region,PLA,Nanjing 210002
Objective To explore the optimal centrifugation conditions for preparation of platelet-rich plasma(PRP) from different volume of whole blood. Methods Fifty-four bags of freshly collected whole blood from volunteer donors were divided into 6 groups according to centrifugal steps and centrifugal conditions,including 3 two-step(separation method A,B,and C) and three-step centrifugation groups (separation method D,E,and F),with 3 bags of 200 ml,300 ml,and 400 ml whole blood for each group. The platelet count (PLT) and red blood cell count(RBC) of PRP in each group were determined,then PLT recovery was calculated and compared. Results Compared to three-step centrifugation groups,the PRP prepared in two-step centrifugation group had higher PLT recovery and RBC count. The highest PLT recovery in PRP from 200 ml whole blood was prepared by method A (e.g,850×g for 8 min,then 4 650×g for 6min),300 ml whole blood by method B (e.g,1 000×g for 6 min,then 4 650×g for 6 min),and 400ml whole blood by method C (e.g,1 220×g for 5 min,then 4 650×g for 6 min). The RBC count of PRP in each three-step centrifugation group was decreased significantly (P<0.05). Compared with two-step centrifugation group,the PLT recovery in three-step centrifugation group was slightly decreased. Conclusion Different centrifugation conditions should be used for preparation of PRP from different volumes of whole blood . The two-step centrifugation method is suitable for preparation of fresh PG or platelet gel,while the three-step centrifugation method is appropriate for frozen and lyophilized PRP or platelet gel.
Platelet-rich plasma Volunteer donor Preparation
R331.1+43
A
1671-2587(2017)02-0119-04
2016-12-25)
(本文编辑:王敏)
10.3969/j.issn.1671-2587.2017.02.006
*本课题受全军重大课题(No.ANJ13J001),南京军区医院科研基金(No.2015049)资助
21002 江苏省南京军区南京总医院输血科
王淑君(1985–),女,江苏泰州人,医师,硕士,主要从事临床输血工作,(Tel)13851928675(E-mail)shujun0106@sina.com。
朱培元,男,江苏苏州人,副主任技师,硕士,主要从事临床输血研究,(Tel)025-80863323(E-mail)peiyuan.zhu@yahoo.com。
