食品级纳米粒子的合成及其应用
2017-04-13邓苏梦邹立强彭盛峰
邓苏梦,王 健,邹立强,刘 伟,彭盛峰,陈 兴
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
食品级纳米粒子的合成及其应用
邓苏梦,王 健,邹立强*,刘 伟,彭盛峰,陈 兴
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
纳米粒子作为食品领域中重要的一员,近年来被广泛研究。本文综述了国内外近年来食品级纳米粒子的研究进展,介绍了其分类、制备方法及其在食品领域中的应用,旨在为纳米粒子的制备和应用提供技术参考。
纳米粒子,合成,分类,食品,应用
纳米粒子(nanoparticles)是指粒径范围为10~1000 nm的微粒分散体或固体颗粒[1]。与块状材料相比,纳米粒子具有尺寸小的特征,从而产生纳米效应(体积效应、表面效应、宏观隧道效应和量子尺寸效应等),使材料本身在热学、光学、磁学及力学等性能方面有明显的提高,具有重要的研究价值和广阔的应用前景[2]。纳米颗粒由于它们特殊的物理化学性质和功能属性而越来越多的被应用于食品工业原料。纳米颗粒在环境中无处不在,可以来源于自然也可以人工合成。目前,纳米颗粒已经存在于多种产品中,包括食品、饲料和农药,以及应用于农业、水土净化技术和土壤净化中[3-5]。
食品级纳米粒子可以由一些不同的材料制备,包括脂质、多糖和蛋白质等。本文概述了食品级纳米颗粒的制备方法及其优缺点,讲述了其重要应用,并提出了其未来的发展趋势和面临的挑战。
1 纳米粒子的分类及其制备方法
目前对于食品级纳米粒子的研究领域主要是构建相应的壁材和制备方法。根据制备纳米粒子的原材料将其分为脂质纳米粒子、多糖纳米粒子、蛋白质纳米粒子三类。
1.1 脂质纳米粒子的分类及其制备方法
1.1.1 纳米脂质体的制备方法 脂质体(liposome)具有单层或多层的双亲性分子膜,是一种由磷脂双分子层和胆固醇形成的小型球形囊泡分子[6]。脂质体具有细胞亲和性、缓释性、靶向性和生物相容性等优点[7]。纳米脂质体的制备方法主要有薄膜分散法、有机溶剂注入法、冻融法和复合法。薄膜分散法是最早使用且至今仍然常与其他方法连用的方法,薄膜分散法操作简单,不需要特殊设备,但单独使用此方法时制备的脂质体粒径偏大且分布不均匀,药物包封率低,重复性差,不适合批量生产。如Chen等[8]用薄膜分散法制备了姜黄素脂质体,其平均粒径大小为182.64 nm,包封率为68%,在4 ℃可以储存一个月。有机溶剂注入法比较常用,其操作简单迅速,但其包封率偏低,如Gosangari等[9]分别用薄膜分散、乙醇注入和超声三种不同的方法制备了多层囊泡和单层囊泡姜黄素脂质体,研究得出乙醇注入法制备的脂质体的包封率相对较低。冻融法易制备包封率高和稳定性好的纳米脂质体,如Wang等[10]通过冻干法制备了姜黄素纳米脂质体,并探究了在体内外其对颈部鳞状癌细胞株HNSCC的抑制作用,研究得出在体内外姜黄素脂质体都能够抑制HNSCC的增长。为了获得颗粒小(小于100 nm)且均匀的脂质体,通常会在上述基础上再通过挤压、动态高压微射流或超声等技术进行处理,即复合法。例如Chen等[11]采用了薄膜分散法结合动态高压微射流制备了平均粒径为68.1 nm的姜黄素纳米脂质体,其电位为-3.16 mV。
1.1.2 固体脂质纳米颗粒的制备方法 固体脂质纳米颗粒(solid lipid nanoparticles)在1991年提出后发展起来,是一种可代替脂质体、聚合物纳米粒子和脂质体的新型给药系统[12]。固体脂质纳米颗粒的制备方法主要有薄膜分散法、超声/高压均质法和高温乳化-低温固化法等。超声/高压均质法是最常用的固体脂质纳米颗粒的制备方法,是一种高效且可靠的方法,一方面所需制备时间短,另一方面又避免了有机溶剂的加入,同时适用于实验室研究制备和工业大规模生产[13]。如Ramalingamd等[14]通过高压均质和超声技术制备了姜黄素修饰的固体脂质纳米粒子,其粒径范围为(451.80±19.62) nm,电位大小为(26.33±1.92) mV。Hajj Ali等[15]使用非离子型表面活性剂作为稳定剂通过超声技术制备了姜黄素修饰的乳木果固体脂质纳米粒子,其粒径大小为50~230 nm,研究得出纳米粒子粒径越大姜黄素的包埋率越低。薄膜-超声分散法制备的固体脂质纳米粒质地均匀且粒径较小,包封率高。如王靖雯等[16]通过薄膜超声分散法制备了粒径为(62.0±10.3) nm的齐墩果酸固体脂质纳米粒子,并得出其包封率高达98.29%。乳化蒸发-低温固化法是将有机相和水相分别水浴加热至一定的相同温度,在搅拌的条件下将有机相加至水相,不断搅拌使其有机溶剂挥发得到初乳,一定量初乳倒入外水相中在冰浴条件下搅拌后离心取沉淀物再分散于水中得分散液[17]。此方法的优点为制备的纳米粒子外观形态圆整、粒径小且较稳定,但缺点则为若有机试剂残留会有潜在毒性。如Zhang等[18]采用乳化蒸发-低温固化法制备了基于乳脂的纳米脂质且用其运载β-胡萝卜素,粒径大小约为25 nm,它具有很好的储存稳定性,在21 ℃可以储存90 d。
1.2 多糖纳米粒子的分类及其制备方法
天然生物大分子多糖是可食用纳米颗粒物质的潜在来源,通常因其来源广泛、价值低廉,具有生物相容性且低毒性[19]。本文以淀粉、纤维素和壳聚糖对多糖进行讲述。
1.2.1 淀粉纳米粒子的制备方法 淀粉作为生物质能的第二组成部分,是一种满足食品和生物医学需求的优良材料,主要优点为生物可降解和低成本。总结近些年来的研究,淀粉纳米粒子的制备方法主要有:酸水解法、沉淀法、机械法和微乳液法。酸水解法制备淀粉纳米粒的优点主要是操作简单,但缺点则为制备时间长且得率低。例如LeCorre等[20]通过酸水解糯性玉米淀粉制备了淀粉纳米晶。他们改进了制备方法即酸水解前加入淀粉酶进行预处理,此过程缩短了制备纳米粒的时间,从6 d缩短至45 h。沉淀法是将淀粉或其衍生物和沉淀剂混合,降低淀粉在溶液中的溶解度使之析出形成纳米粒。沉淀法制备的淀粉纳米粒步骤简单,所用化学试剂少,对设备要求低,应用前景好。例如Tan等[21]的研究中淀粉由乙酸酐和邻苯二甲酸酐改性后,然后再由一个简单的沉淀过程制备了粒径大小为270 nm的淀粉纳米粒子。机械法是通过剪切、挤压、冲击和摩擦等机械作用力破碎淀粉颗粒以达到所需粒径。此方法原理简单,几乎不需用化学试剂,制备的纳米颗粒安全性高,但却因耗能高而在工业生产中应用少。Wu等[22]将玉米淀粉液反复通过微射流均质机,当均质次数超过多次后,才可制备稳定且粒径小(小于100 nm)的淀粉纳米颗粒。微乳液法原理是在机械搅拌下,淀粉和其衍生物分散至另一不溶相中形成乳液,接着在交联剂的作用下淀粉液滴固化成球,淀粉纳米粒的粒径为10~100 nm。微乳液法虽然对设备要求低,但由于需要较低淀粉浓度和较高油水体积比而使其生产效率低。如Chin等[23]在葵花籽油和淀粉溶液组成的微乳液中(5∶1,v/v)制备了淀粉纳米粒并用其包埋姜黄素,其平均粒径大小为87 nm,包封率为78%。
1.2.2 纤维素纳米粒子的制备方法 纤维素是自然界中分布最广、含量最多的可再生资源[24]。董凤霞[25]等人总结了纤维素纳米粒子的制备方法有机械法、化学法和生物法。机械法主要有高压均质和化学机械法,机械法因需要特殊设备和高耗能而应用较少。化学法包括酸水解法和酶解法,化学法制备纳米纤维素的同时还可以对其进行表面改性,因此目前该方法是制备纳米纤维素常用的方法。Maria V等[26]酸水解蟹壳中的甲壳素制备了甲壳素纳米晶,甲壳素纳米晶的平均粒径大小为240 nm。Kargar等[27]利用酶水解纤维素粉法制备了平均粒径为(415±1.5) nm的微晶纤维素纳米粒子。Kalashnikova等[28]也通过酸水解法制备了棒状纤维素纳米晶,其长度为855 nm。通过微生物法制备的纤维素称为细菌纤维素。生物法制备纳米纤维的优点为无污染和耗能低,所以国内外都在发展此技术。但是其过程复杂、成本高和得率低。如许威震等[29]将湿态细菌纤维素剪碎,加入NaBr、NaClO、TEMPO催化氧化制备了细菌纤维纳米纤维,该纤维素的尺寸约5~8 nm。
1.2.3 壳聚糖纳米粒子的制备方法 壳聚糖具有良好的成膜性、生物相容性、安全性和微生物可降解性,已经作为药物载体研究的热点。壳聚糖纳米粒子的制备方法有离子交联法、凝聚法或沉淀法、自组装法和反相微乳法。离子交联法不使用有机溶剂,反应温和,颗粒粒径可调控,因此使用广泛。例如Hong Ni等[30]用粒子交联法制备了低分子量的壳聚糖纳米粒子,其粒径大小为138 nm。他们的研究得出该方法制备的纳米粒子具有良好的贮存稳定性,在室温下至少能够储存20 d。反相微乳法制备的壳聚糖纳米粒子粒径分布均一,但是反应消耗有机试剂多且制备的纳米粒子浓度低。如Brunel等[31]采用辛酸癸酸甘油三酯(Miglyol 812N)作为油相,span 80作为乳化剂,异丁醇作为助表面活性剂,壳聚糖溶液作为水相制备反相微乳液,滴加TPP溶液于微乳液中制得低浓度纳米微球。自组装法的缺点之一也是制得纳米粒子浓度偏低且工艺复杂。例如Chuang等[32]将壳聚糖溶于乙酸溶液中,充入氮气加热至40 ℃,加入提前加热至40 ℃的硝酸铈铵溶液引发自由基的反应,通过自组装法制备了粒径为295 nm壳聚糖纳米粒子。沉淀法的原理是基于乳化溶剂的扩散作用。Berthold等[33]最先提出沉淀法(沉淀剂为硫酸钠)制备壳聚糖微粒。近年来,沉淀法主要用于制备磁性壳聚糖纳米粒子,如Cao等[34]通过一个简单的还原沉淀法(亚硫酸钠部分还原Fe3+,室温下用氨水沉淀,然后用环氧氯丙烷交联)制备了粒径大小为3~10 nm的磁性壳聚糖纳米粒子。

表1 食品级蛋白纳米粒子的制备方法、形状、粒径大小Table 1 Preparation method,shape and size of food grade protein nanoparticles
1.3 蛋白质纳米粒子的制备方法
蛋白质是生物体内一种极其重要的高分子化合物,蛋白纳米粒子具有很多优点,如生物相容性和生物降解性。蛋白纳米粒子的制备是基于蛋白质的吸引力和排斥力的平衡。一般来说,增强蛋白质的展开面和减少分子内的疏水相互作用(hydrophobic interaction)对蛋白质纳米粒子的形成是至关重要的[35]。蛋白纳米粒子的制备方法有:凝聚/反溶剂法、乳液/溶剂萃取、复凝聚法和电喷雾法。
1.3.1 凝聚/反溶剂法 凝聚法或反溶剂法是基于蛋白质在溶剂中的溶解度与溶剂极性、pH、离子强度和电解质存在函数关系。凝聚过程降低了蛋白的溶解度从而导致相分离,凝聚颗粒的大小可以通过调整工艺参数控制,纳米粒子形成后,它们由交联剂如戊二醛和已二醛交联(如图1)[36]。凝聚/反溶剂法和乳化法是最常用的蛋白纳米粒子的制备方法。
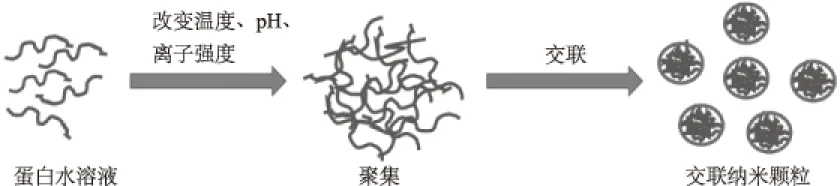
图1 凝聚法或相分离法制备蛋白纳米颗粒Fig.1 Preparation of protein nanoparticles by coacervation or phase separation method
1.3.2 乳液/溶剂萃取法 在此方法中,蛋白质水溶液和油相通过高压均质机或者超声波剪切乳化后在W/O交界面形成纳米粒子,交联剂戊二醛加入乳液中是为了获得粒径大小为100~800 nm的纳米粒子(如图2)[37]。蛋白溶液的浓度和体积比都对粒径大小有所影响,即浓度和体积比的增大都会使纳米粒子粒径的增大。一般来说,乳液/溶剂萃取法制得的纳米粒子的粒径大于凝聚法制备的纳米粒子[38]。乳液/溶剂萃取法已经被用于制备各种蛋白纳米粒子,包括白蛋白和乳清蛋白纳米粒子。
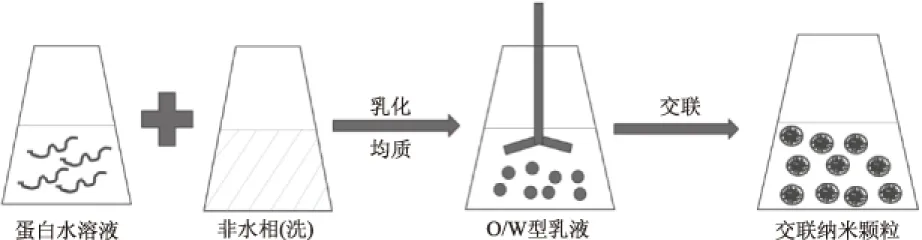
图2 乳液/溶剂萃取法制备蛋白纳米粒子Fig.2 Preparation of protein nanoparticles by emulsion/solvent extraction method
1.3.3 复凝聚法 此种纳米粒子的制备方法适用于DNA的包封,即可用于基因治疗应用。由于蛋白质具有双亲性且带有大量的官能团,它可以通过调节pH高于或者低于蛋白的等电点而分别变成阳离子型或阴离子型。然后带电的蛋白质可以和其它聚合电解质发生静电相互作用,以便通过凝聚将DNA或寡核苷酸包封于纳米粒子(图3)[37]。

图3 复凝聚法制备蛋白纳米粒Fig.3 Preparation of protein nanoparticles by complex coacervation method
1.3.4 电喷雾法 电喷雾法是一种相对较新的蛋白纳米粒子的制备技术,它主要用于制备麦醇溶蛋白和弹性蛋白肽(elastin-like peptide)纳米粒子[39-40]。在此方法中,在微电流泵的作用下,使蛋白质溶液匀速通过不锈钢毛细管,同时在毛细管管尖处施加足够高的电场,把电场力作为蛋白质溶液的驱动力,在液体破裂成雾滴的过程中能够通过调节各种参数获得粒径均匀且单分散的蛋白纳米粒子。食品级蛋白纳米粒子的制备方法和粒径大小等列于表1[41-47]。
2 纳米粒子在食品中的应用
2.1 纳米粒子作为Pickering乳液稳定剂
在过去几年里,生物来源的纳米粒子被广泛应用作食品领域中的乳液稳定剂,比如Pickering乳液。Pickering乳液是由固体胶粒稳定的乳液,与传统表面活性剂稳定的乳液相比,它具有可再生、低成本、低毒、强界面稳定性等优势[48]。然而多种因素影响乳液的整体稳定性,比如粒子大小、粒子浓度、粒子形状、油相类型和比例、pH和电解质浓度[49-50]。
蛋白纳米粒子是最常见的Pickering乳液稳定剂,包括高粱醇溶蛋白纳米粒子、麦醇溶蛋白纳米粒子、大豆蛋白纳米粒子、乳铁蛋白纳米粒子、玉米醇溶蛋白纳米粒子和豌豆蛋白纳米粒子。如Xiao等[51]用高粱醇溶蛋白通过反溶剂法制备高粱醇溶蛋白纳米粒子并制备的Pickering乳液,并得出水相中粒子的浓度越大乳液越稳定,油相比例越大乳液也越稳定。改性后的淀粉纳米颗粒可以稳定水包油型乳液,如Song等[52]用辛烯基琥珀酸酐修饰籼稻淀粉后制得疏水淀粉颗粒作为稳定剂,大豆油作为油相制备了Pickering乳液,系统地研究了影响乳液稳定性的主要因素,颗粒浓度、油相比例、pH对乳液稳定性的影响较大,而盐浓度和蔗糖浓度对其并没有明显的影响。此外,壳聚糖纳米粒子也可以作为皮克林乳液稳定剂,如Wei等[53]通过调节pH制备了平均粒径为50 nm的壳聚糖纳米粒子,研究表明未改性壳聚糖颗粒能够吸附在油水界面形成稳定的O/W型乳液,且pH6.6壳聚糖纳米粒稳定的乳液具有较好的储存稳定性,可以储存2个月。脂质纳米粒子亦可以用于稳定W/O型Pickering乳液,如Rousseau等[54]制备了平均粒径为152 nm、电位-49 mV固体脂质纳米颗粒并制备了Pickering乳液,此乳液可以稳定12周。
2.2 纳米粒子用于运载食品活性成分(纳米载体)
大量的纳米运载系统已经用于运载食品活性成分,各种各样的营养物质可以被封装,如维生素、抗氧化剂、不饱和脂肪酸、类胡萝卜素和生物活性肽等。营养物质的有效性取决于它们的生物利用率,而影响生物利用率的主要是处理过程中的不稳定、在胃肠道的低溶解度/渗透率和在胃肠道降解、代谢。食品科学家一直在开发可用于食品中的口服药物的运载系统[55]。如Huang等[56]制备了表儿茶素弹性脂质体,其平均粒径为35~70 nm,在含有1%吐温80时茶表儿素的包封率高于80%。表没食子儿茶素没食子酸酯(EGCG)具有抗氧化性和抗癌作用而引起广泛的研究,但又因吸收差而在口服应用方面被限制。为了改善此问题,Dube等[57]将EGCG包封于壳聚糖-三聚磷酸盐纳米粒子,此纳米粒子提高了EGCG的口服吸收率。纳米粒子可用于运载生物活性物质从而改善活性物质的水溶性、分散性和化学稳定性,提高生物利用率。如Hu等[58]通过静电作用力制备了玉米醇溶蛋白-果胶复合纳米粒子用于运载姜黄素,封装的姜黄素主要通过疏水相互作用和玉米醇溶蛋白结合。此粒子具有良好的水溶性,聚合纳米颗粒能使姜黄素有效地用于功能性食品饮料和膳食补充剂药品。Tan等[59]制备了β-胡萝卜素脂质体,β-胡萝卜素被包埋于脂质体中,研究得出β-胡萝卜素脂质体可以显著提高β-胡萝卜素的抗氧化性。纳米运载系统可以提高活性成分的抗菌活性,如Bhawana等[60]通过湿加工法制备了姜黄素纳米粒子,从而提高了姜黄素对金黄葡萄球菌、大肠杆菌、枯草杆菌、青霉菌、绿脓杆菌和黑曲霉菌的抗菌活性。
2.3 纳米粒子在食品包装中的应用
目前,各种纳米材料已经作为功能性添加剂被引入到食品包装中,主要有纤维素纳米晶和淀粉纳米晶[61-62]。食品包装中纳米粒子的使用可以提高对食品的保护,比如通过减少气体的渗透、减少损失和增强机械强度与热稳定[63]。每种纳米材料由于化学结构的性质和差异具有独特的性能,从而导致不同的功能包装应用。与普通淀粉相比,淀粉纳米晶在水中表现出较好的分散性,因为淀粉纳米晶的表面积是普通淀粉的400倍[64]。
淀粉纳米晶可以是食品软包装的填料和加固材料,因为它们可以增强机械性能和屏障性能。而且淀粉纳米颗粒不同于普通煮熟的淀粉,它们能形成一个透明且灵活的薄膜。淀粉纳米晶已经应用于美国的麦当劳汉堡蚌壳,代替其传统的粘合剂[65]。淀粉纳米复合材料常应用于生物可降解的食品包装应用中,Alavi等[66]总结了近年来开发的淀粉-聚乙烯醇可降解材料,研究得出淀粉/聚乙烯醇共混物具有良好的机械性能,可代替LDPE薄膜,且Novamont公司(诺瓦拉,意大利)已经将此种材料制备的水溶性洗衣袋商业化。又因淀粉/聚乙烯醇共混物可以有效地隔绝O2和CO2,它们可以保持被包装食品原有的香味和味道。在食品包装领域中,壳聚糖纳米粒子由于其可生物降解、可被吸收和杀菌而被广泛研究[67]。如Lima等[68]制备了壳聚糖/聚甲基丙烯酸(CS/PMAA)纳米粒子并用于食品包装薄膜,结果表明,食品包装膜添加壳聚糖和聚甲丙烯酸复合纳米粒子后可以增加其器械性能,减少水蒸气和氧气渗透。并且通过体内外毒性实验得出只有浓度较高且较大粒径的粒子具有毒性,粒径小的粒子可以安全使用。
3 挑战与展望
纳米粒子的快速发展及在食品领域中的应用,使得其备受关注。纳米粒子虽然可以用于许多食品领域中,但仍然存在一些问题需要解决。首先是纳米粒子在人体体内代谢的毒理学数据较少,其次制备纳米粒子的过程复杂、耗能较高且对环境产生潜在的污染。最后,缺少政府机构对于纳米材料是否安全的验证标准。针对上述问题,应该创建绿色(廉价、低耗能、无污染)的纳米粒子制备方法,如开发廉价的壁材,创建方便、快速和低耗能的制备方法,尽量少用甚至不用有机试剂的方法制备纳米粒子。并且多开展纳米粒子在人体体内代谢的毒理学研究。此外,政府机构迫切需要制定关于制备的纳米颗粒对于环境效应和健康潜在影响的安全指引。
[1]Mohanraj V J,Chen Y. Nanoparticles-A review[J]. Tropical Journal of Pharmaceutical Research,2006,5(1):561-573.
[2]陈梦君,杨万泰,尹梅贞. 纳米粒子的分类合成及其在生物领域的应用[J].化学进展,2012(12):2403-2414.
[3]Li Q,Mahendra S,Lyon D Y,et al. Antimicrobial nanomaterials for water disinfection and microbial control:Potential applications and implications[J]. Water Research,2008,42(18):4591-4602.
[4]Lombi E,Donner E,Taheri S,et al. Transformation of four silver/silver chloride nanoparticles during anaerobic treatment of wastewater and post-processing of sewage sludge[J]. Environmental Pollution,2013,176C(5):193-197.
[5]Sekhon B S. Food nanotechnology-an overview[J]. Nanotechnology,Science and Applications,2010,3(1):1-15.
[6]Wang T,Wang N,Wang T,et al. Preparation of submicron liposomes exhibiting efficient entrapment of drugs by freeze-drying water-in-oil emulsions[J]. Chemistry & Physics of Lipids,2011,164(2):151-157.
[7]Mohanraj V J,Barnes T J,Prestidge C A. Silica nanoparticle coated liposomes:A new type of hybrid nanocapsule for proteins[J]. International Journal of Pharmaceutics,2010,392(1-2):285-293.
[8]Lu Y,Ding N,Yang C,et al. Preparation andinvitroevaluation of a folate-linked liposomal curcumin formulation[J]. Journal of Liposome Research,2012,22(2):110-119.
[9]Gosangari S L,Watkin K L. Effect of preparation techniques on the properties of curcumin liposomes:Characterization of size,release and cytotoxicity on a squamous oral carcinoma cell line[J]. Pharmaceutical Development and Technology,2012,17(1):103-109.
[10]Wang D,Veena M S,Stevenson K,et al. Liposome-encapsulated curcumin suppresses growth of head and neck squamous cell carcinomainvitroand in xenografts through the inhibition of nuclear factor kappaB by an AKT-independent pathway[J]. Clinical Cancer Research,2008,14(19):6228-6236.
[11]Chen X,Zou L Q,Niu J,et al. The Stability,Sustained Release and Cellular Antioxidant Activity of Curcumin Nanoliposomes[J]. Molecules,2015,20(8):14293-14311.
[12]Müller R H,Mäder K,Gohla S. Solid lipid nanoparticles(SLN)for controlled drug delivery - a review of the state of the art[J]. European Journal of Pharmaceutics and Biopharmaceutics,2000,50(1):161-177.
[13]Müller R H,Radtke M,Wissing S A. Solid lipid nanoparticles(SLN)and nanostructured lipid carriers(NLC)in cosmetic and dermatological preparations[J]. Advanced Drug Delivery Reviews,2002,54(Supplement):S131-S155.
[14]Ramalingam P,Sang W Y,Ko Y T. Nanodelivery systems based on mucoadhesive polymer coated solid lipid nanoparticles to improve the oral intake of food curcumin[J]. Food Research International,2016,84:113-119.
[15]Hajj Ali H,Michaux F,Bouelet Ntsama I S,et al. Shea butter solid nanoparticles for curcumin encapsulation:Influence of nanoparticles size on drug loading[J]. European Journal of Lipid Science & Technology,2016,118(8):1168-1178.
[16]王婧雯,汤海峰,沈敏,等. 齐墩果酸固体脂质纳米粒的制备与质量评价[J]. 医学争鸣,2007,28(5):472-474.
[17]夏爱晓,宋倩倩,孙渊. 固体脂质纳米粒制备及应用研究进展[J].药学实践杂志,2012,30(5):331-333.
[18]Zhang L,Hayes D G,Chen G,et al. Transparent Dispersions of Milk-Fat-Based Nanostructured Lipid Carriers for Delivery ofβ-Carotene[J]. Journal of Agricultural & Food Chemistry,2013,61:9435-9443.
[19]Diab R,Jaafar-Maalej C,Fessi H,et al. Engineered Nanoparticulate Drug Delivery Systems:The Next Frontier for Oral Administration?[J]. Aaps Journal,2012,14(4):688-702.
[20]Lecorre D,Vahanian E,Dufresne A,et al. Enzymatic pretreatment for preparing starch nanocrystals[J]. Biomacromolecules,2011,13(1):132-137.
[21]Tan Y,Xu K,Liu C,et al. Fabrication of starch-based nanospheres to stabilize pickering emulsion[J]. Carbohydrate Polymers,2012,88(4):1358-1363.
[22]Liu D,Wu Q,Chen H,et al. Transitional properties of starch colloid with particle size reduction from micro-to nanometer[J]. Journal of Colloid & Interface Science,2009,339(1):117-124.
[23]Chin S F,Yazid S N A M,Pang S C. Preparation and Characterization of Starch Nanoparticles for Controlled Release of Curcumin[J]. International Journal of Polymer Science,2014(1 a):1-8.
[24]陈珍珍,刘爱国,李晓敏,等. 微晶纤维素的特性及其在食品工业中的应用[J]. 食品工业科技,2014,35(4):380-383.
[25]董凤霞,刘文,刘红峰. 纳米纤维素的制备及应用[J].中国造纸,2012(6):68-73.
[26]Tzoumaki M V,Moschakis T,Biliaderis C G. Mixed aqueous chitin nanocrystal-whey protein dispersions:Microstructure and rheological behaviour[J]. Food Hydrocolloids,2011,25(5):935-942.
[27]Kargar M,Fayazmanesh K,Alavi M,et al. Investigation into the potential ability of Pickering emulsions(food-grade particles)to enhance the oxidative stability of oil-in-water emulsions[J]. J Colloid Interface Sci,2012,366(1):209-215.
[28]Kalashnikova I,Bizot H,Cathala B,et al. Modulation of cellulose nanocrystals amphiphilic properties to stabilize oil/water interface[J]. Biomacromolecules,2012,13(1):267-275.
[29]许威震. 细菌纤维素纳米纤维结构调控的初步研究[D]. 南京:南京理工大学,2013.
[30]Fan W,Wei Y,Xu Z,et al. Formation mechanism of monodisperse,low molecular weight chitosan nanoparticles by ionic gelation technique[J]. Colloids & Surfaces B Biointerfaces,2012,90(2):21-27.
[31]Brunel F,Véron L,David L,et al. A Novel Synthesis of Chitosan Nanoparticles in Reverse Emulsion[J]. Langmuir,2008,24(20):11370-11377.
[32]Chuang C Y,Don T M,Chiu W Y. Preparation of environmental-responsive chitosan-based nanoparticles by self-assembly method[J]. Carbohydrate Polymers,2011,84(2):765-769.
[33]Berthold A,Cremer K,Kreuter J. Preparation and characterization of chitosan microspheres as drug carrier for prednisolone sodium phosphate as model for anti-inflammatory drugs[J]. Journal of Controlled Release,1993,193(1):329-339.
[34]Cao C,Xiao L,Chen C,et al. In situ preparation of magnetic Fe3O4/chitosan nanoparticles via a novel reduction-precipitation method and their application in adsorption of reactive azo dye[J]. Powder Technology,2014,260(7):90-97.
[35]Ko S,Gunasekaran S. Preparation of sub-100-nmβ-lactoglobulin(BLG)nanoparticles[J]. Journal of Microencapsulation,2007,23(8):887-898.
[36]Langer K,Balthasar S,Vogel V,et al. Optimization of the preparation process for human serum albumin(HSA)nanoparticles[J]. International Journal of Pharmaceutics,2003,257(1-2):169-180.
[37]Lohcharoenkal W,Wang L,Chen Y C,et al. Protein nanoparticles as drug delivery carriers for cancer therapy[J]. Biomed Res Int,2014,2014:180549.
[38]Müller B G,Leuenberger H,Kissel T. Albumin nanospheres as carriers for passive drug targeting:An optimized manufacturing technique[J]. Pharmaceutical Research,1996,13(1):32-37.
[39]Rasekh M,Young C,Roldo M,et al. Hollow-layered nanoparticles for therapeutic delivery of peptide prepared using electrospraying[J]. Journal of Materials Science:Materials in Medicine,2015,26(11):1-12.
[40]Wu Y,Mackay J A,Mcdaniel J R,et al. Fabrication of elastin-like polypeptide nanoparticles for drug delivery by electrospraying[J]. Biomacromolecules,2009,10(1):19-24.
[41]Joye I J,Nelis V A,McClements D J. Gliadin-based nanoparticles:Fabrication and stability of food-grade colloidal delivery systems[J]. Food Hydrocolloids,2015,44:86-93.
[42]Gulfam M,Kim J E,Lee J M,et al. Anticancer drug-loaded gliadin nanoparticles induce apoptosis in breast cancer cells[J]. Langmuir,2012,28(21):8216-8223.
[43]Ko S,Gunasekaran S. Preparation of sub-100-nmβ-lactoglobulin(BLG)nanoparticles[J]. Journal of Microencapsulation,2006,23(8):887-898.
[44]Xu X,Capito R M,Spector M. Delivery of plasmid IGF-1 to chondrocytes via cationized gelatin nanoparticles[J]. Journal of Biomedical Materials Research Part A,2008,84A(1):73-83.
[45]王丽娟. 玉米醇溶蛋白胶体颗粒的制备及应用研究[D]. 广州:华南理工大学,2014.
[46]Zhang W N,Zhong Q X. Microemulsions as nanoreactors to produce whey protein nanoparticles with enhanced heat stability by sequential enzymatic cross-linking and thermal pretreatments[J]. Journal of Agricultural & Food Chemistry,2009,57(19):9181-9.
[47]Liu F,Tang C H. Soy protein nanoparticle aggregates as pickering stabilizers for oil-in-water emulsions[J]. J Agric Food Chem,2013,61(37):8888-8898.
[48]周君,乔秀颖,孙康. Pickering乳液的制备和应用研究进展[J].化学通报,2012,75(2):99-105.
[49]Aveyard R,Binks B P,Clint J H. Emulsions stabilised solely by colloidal particles[J]. Advances in Colloid and Interface Science,2003,100:503-546.
[50]Binks B P,Clint J H. Solid wettability from surface energy components:relevance to Pickering emulsions[J]. Langmuir,2002,18(4):1270-1273.
[51]Xiao J,Wang X a,Gonzalez A J P,et al. Kafirin nanoparticles-stabilized Pickering emulsions:Microstructure and rheological behavior[J]. Food Hydrocolloids,2016,54:30-39.
[52]Song X,Pei Y,Qiao M,et al. Preparation and characterizations of Pickering emulsions stabilized by hydrophobic starch particles[J]. Food Hydrocolloids,2015,45:256-263.
[53]Wei Z,Wang C,Zou S,et al. Chitosan nanoparticles as particular emulsifier for preparation of novel pH-responsive Pickering emulsions and PLGA microcapsules[J]. Polymer,2012,53(6):1229-1235.
[54]Gupta R,Rousseau D. Surface-active solid lipid nanoparticles as Pickering stabilizers for oil-in-water emulsions[J]. Food & Function,2012,3(3):302-311.
[55]Bigliardi B,Galati F. Innovation trends in the food industry:The case of functional foods[J]. Trends in Food Science & Technology,2013,31(2):118-129.
[56]Huang Y B,Tsai M J,Wu P C,et al. Elastic liposomes as carriers for oral delivery and the brain distribution of(+)-catechin[J]. Journal of Drug Targeting,2011,19(8):709-718.
[57]Dube A,Nicolazzo J A,Larson I. Chitosan nanoparticles enhance the plasma exposure of(-)-epigallocatechin gallate in mice through an enhancement in intestinal stability[J]. European Journal of Pharmaceutical Sciences Official Journal of the European Federation for Pharmaceutical Sciences,2011,44(3):422-426.
[58]Hu K,Huang X,Gao Y,et al. Core-shell biopolymer nanoparticle delivery systems:synthesis and characterization of curcumin fortified zein-pectin nanoparticles[J]. Food Chem,2015,182:275-281.
[59]Tan C,Xue J,Abbas S,et al. Liposome as a delivery system for carotenoids:comparative antioxidant activity of carotenoids as measured by ferric reducing antioxidant power,DPPH assay and lipid peroxidation[J]. Journal of Agricultural & Food Chemistry,2014,62(28):6726-6735.
[60]Bhawana,Basniwal R K,Buttar H S,et al. Curcumin Nanoparticles:Preparation,Characterization,and Antimicrobial Study[J]. Journal of Agricultural & Food Chemistry,2011,59(5):2056-2061.
[61]Nalwa H S,A K Mohanty,M Misra,et al. Packaging Nanotechnology[M]. Los Angeles:American Scientific Publishers,2009.
[62]Tager J. Regulatory failure or institutional corruption?:The case of food standards Australia New Zealand and the ‘regulation’ of nanomaterials in food[J]. Chain Reaction,2014(121):43-45.
[63]Chau C F,Wu S H,Yen G C. The development of regulations for food nanotechnology[J]. Trends in Food Science & Technology,2007,18(5):269-280.
[64]Klass C P. Latest trends in printing,imaging and packaging[J]. Paper,2007,2(11):8-24.
[65]Blasco C,Picó Y. Determining nanomaterials in food. TrAC Trends Anal Chem[J]. Trac Trends in Analytical Chemistry,2011,30(1):84-99.
[66]Tang X,Alavi S. Recent advances in starch,polyvinyl alcohol based polymer blends,nanocomposites and their biodegradability[J]. Carbohydrate Polymers,2011,85(1):7-16.
[67]Coma V,Martial-Gros A,Garreau S,et al. Edible antimicrobial films based on chitosan matrix[J]. Journal of food science,2002,67(3):1162-1169.
[68]De Lima R,Feitosa L,do Espirito Santo Pereira A,et al. Evaluation of the genotoxicity of chitosan nanoparticles for use in food packaging films[J]. J Food Sci,2010,75(6):N89-96.
Synthesis and applications of nanoparticles in food
DENG Su-meng,WANG Jian,ZOU Li-qiang*,LIU Wei,PENG Sheng-feng,CHEN Xing
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
As an important part of food industry,nanoparticles have been widely studied in recent years. In this paper,the research progress of nanoparticles in recent years was reviewed,and the classification,preparation methods and applications of nanoparticles in the field of food were introduced,aiming to provide technical reference for the preparation and application for nanoparticles.
nanoparticles;synthesis;classification;food;application
2016-10-21
邓苏梦(1993-),女,硕士研究生,研究方向:食品新技术与资源综合利用,E-mail:sumengdeng11@163.com。
*通讯作者:邹立强(1987-),男,博士,助理研究员,研究方向:食品新技术与资源综合利用,E-mail:zouliqiang2010@163.com。
国家自然基金(31601468);江西省教育厅青年基金(150089)。
TS201.4
A
1002-0306(2017)07-0365-06
10.13386/j.issn1002-0306.2017.07.062
