竹荪中多酚提取工艺优化及其抗氧化活性研究
2017-04-13吴林秀胡荣康陈艺煊王娟娟刘晓艳
吴林秀,胡荣康,陈艺煊,王娟娟,刘晓艳,*,刘 斌,*
(1.福建农林大学食品科学学院,福建福州 350002; 2.国家菌草工程技术研究中心,福建福州 350002)
竹荪中多酚提取工艺优化及其抗氧化活性研究
吴林秀1,2,胡荣康1,2,陈艺煊1,2,王娟娟1,刘晓艳1,2,*,刘 斌1,2,*
(1.福建农林大学食品科学学院,福建福州 350002; 2.国家菌草工程技术研究中心,福建福州 350002)
本文以长裙竹荪为原料,以多酚得率为考察指标,通过乙醇浓度、料液比、提取温度和提取时间4个单因素实验和正交实验确定竹荪多酚的最佳提取条件;并且通过竹荪提取液对2,2-二苯代苦味酰基(DPPH)自由基和羟基自由基的清除效果,评价竹荪提取液的体外抗氧化活性。结果表明:在乙醇浓度为40%、提取温度为80 ℃、料液比为1∶40 g/mL、提取时间为5 h的条件下,竹荪多酚的得率最高,可达(8.18±0.52) mg/g;竹荪提取液呈现出较好的抗氧化活性,且与浓度存在一定的量效关系,在质量浓度为20 mg/mL时,提取液对DPPH自由基的清除率可达84.28%±1.15%,对羟基自由基清除率达到76.49%±1.14%。
竹荪,多酚,抗氧化性,正交设计
竹荪(Dictyophoraindusiata)属真菌类,又名竹参、竹笙,其香气芬芳,味道鲜美,营养丰富,含有人体所需的各种氨基酸以及维生素,在民间有“真菌皇后”的称号[1],自古就被誉为“草八珍”[2-3];其子实体由菌托、菌柄、菌裙和菌盖4部分组成[1]。近年来,国内外对竹荪的研究主要集中在其子实体提取物的成分分离、鉴定及免疫[4]、抗氧化[5]、抗肿瘤、降血脂等生物活性作用。而目前专门针对竹荪多酚的研究不多,对其提取方法和体外抗氧化活性缺乏系统研究。王彦辉等人[6]用破壁-水提法对竹荪总多酚的含量进行检测,其含量为5.53 mg/g。李小雨等人[7]用福林酚法对竹荪多糖里的多酚进行测定,含量为(2.90±0.10) mg/g。吕瑞等人[8]对竹荪水提物进行抗氧化实验,发现竹荪水提物对羟自由基和DPPH自由基均具有不同程度的清除效果。本文以长裙竹荪作为实验原料,采用Folin-Ciocalten法测定多酚含量,以多酚得率为考察指标,通过单因素实验确定乙醇、料液比、提取温度和提取时间四个因素的合适水平,并在此基础上进行正交实验设计,优化提取工艺以提高竹荪多酚得率,并测定竹荪提取液的抗氧化活性,为竹荪在医药和食品领域提供理论依据。
1 材料与方法
1.1 材料与仪器
长裙竹荪 购于福建省古田县,清洗,烘干(80 ℃)、粉碎、过30目筛备用;没食子酸 Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) Sigma公司;福林酚试剂(Folin-Ciocalteu) 国药集团化学试剂有限公司;其他试剂均为分析纯。
电子分析天平EO2140 赛多利斯科学仪器北京有限公司;数显三用水浴锅 HH 金坛市精达仪器制造厂;台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;循环水式多用真空泵SHB-III 郑州长城科技工贸有限公司;旋转蒸发仪 上海申生科技有限公司;紫外可见分光光度计7200 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 竹荪多酚的提取 准确称取竹荪粉末5.00 g,加一定料液比的乙醇溶液,在一定的温度下回流提取,过滤,离心,取上清液,即为竹荪提取液。
1.2.2 多酚含量的测定 分别取上述溶液0.3 mL,依次加入1.5 mL Folin-Ciocalteu试剂(稀释10倍)和 1.2 mL 2%碳酸钠溶液,45 ℃水浴15 min,在765 nm波长下测定样品的吸光度。
1.2.3 没食子酸标准曲线的绘制 精密称取0.01200 g没食子酸用水定容至100 mL,配成浓度为20、40、60、80、100、120 μg/mL溶液。以没食子酸浓度(μg/mL)为横坐标,吸光值为纵坐标,绘制没食子酸标准曲线,计算回归方程。
1.2.4 竹荪多酚得率的测定 取不同条件下提取的样液,测吸光值,通过上述回归方程计算得到样液中多酚的质量浓度,按下式计算得率。
多酚得率=ρ·n·V/W
式(1)
式中,ρ为竹荪提取液多酚的质量浓度(mg/mL);n为提取液稀释因子;V为提取液体积(mL);W为原料质量(g)。
1.2.5 竹荪多酚提取的单因素实验
1.2.5.1 乙醇浓度对竹荪多酚提取效果的影响 取竹荪粉末5.0 g,按料液比1∶40 (g/mL),分别加入20%、40%、60%、80%的乙醇溶液,置于70 ℃水浴锅中回流提取4 h,过滤,离心,取上清液,即为竹荪提取液。
1.2.5.2 温度对竹荪多酚提取效果的影响 取竹荪粉末5.0 g,按料液比1∶40 (g/mL),加入80%的乙醇溶液,分别置于60、70、80、90、100 ℃水浴锅中回流提取4 h,过滤,离心,取上清液,即为竹荪提取液。
1.2.5.3 料液比对竹荪多酚提取效果的影响 取竹荪粉末5.0 g,按料液比1∶10、1∶20、1∶30、1∶40、1∶50 (g/mL),加入80%的乙醇溶液,置于70 ℃水浴锅中回流提取4 h,过滤,离心,取上清液,即为竹荪提取液。
1.2.5.4 时间对竹荪多酚提取效果的影响 取竹荪粉末5.0 g,按料液比(g/mL)1∶40,加入80%的乙醇溶液,置于70 ℃水浴锅中回流提取1、2、3、4、5 h,过滤,离心,取上清液,即为竹荪提取液。
1.2.6 正交实验 为了进一步优化多酚的提取条件,根据单因素实验结果,以乙醇浓度、提取温度、提取时间、料液比为自变量,进行4因素3水平正交实验设计,以总多酚得率为指标进行正交实验设计,因素水平设计见表1。
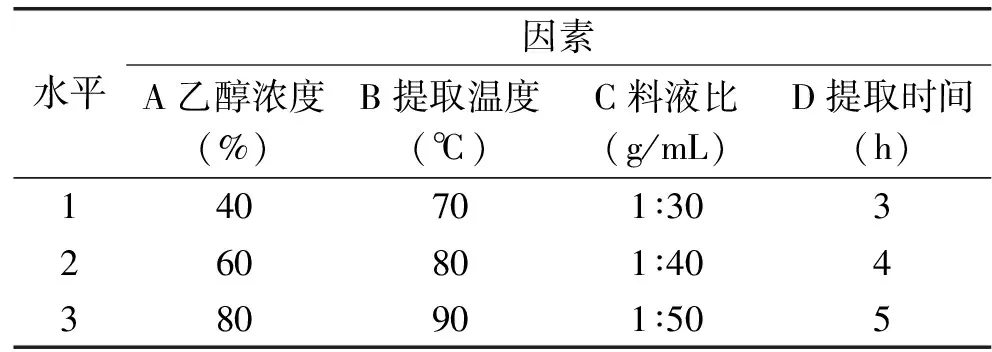
表1 正交因素水平表Table 1 The factors and levels of orthogonal design
1.2.7 体外抗氧化活性的测定
1.2.7.1 DPPH自由基清除能力的测定 参考文献[9]的方法,将DPPH试剂溶解在无水乙醇中,配制成0.4 mmol/L溶液,取2.0 mL DPPH溶液分别与1.25、2.5、5、10、20 mg/mL浓度的样品1∶1混合,于避光处保存35 min,于4500 r/min离心15 min,取其上清液在波长为517 nm处测量其吸光值,以VC做对照,按公式(2)计算清除率。重复3次。
DPPH清除率(%)=[1-(A样品-A对照)/A空白]×100
式(2)
式中:A样品:样品与DPPH反应的吸光值;A对照:蒸馏水代替DPPH的吸光值;A空白:蒸馏水代替样品的吸光值。
1.2.7.2 羟自由基清除能力的测定 参考文献[10],取1.25、2.5、5、10、20 mg/mL浓度的样品溶液1 mL,加入9 mmol/L FeSO41 mL、9 mmol/L水杨酸-乙醇溶液1 mL,最后加8.8 mmol/L H2O21 mL启动反应,在37 ℃水浴下反应30 min,在510 nm下测定各浓度溶液的吸光值。以蒸馏水1 mL代替样品作为空白;以蒸馏水1 mL代替H2O2作为颜色对照,其它反应物不变,按下式计算·OH清除率。重复3次。
·OH清除率(%)=[1-(A样品-A对照)/A空白]×100
式(3)
式中:A样品:样品吸光值;A空白:蒸馏水代替样品的吸光值;A对照:蒸馏水代替H2O2的吸光值。
1.3 统计分析
利用Origin8和SPSS17.0软件对数据进行分析实验,每组实验均重复3次,结果取平均值。
2 结果与分析
2.1 回归方程的确立
以没食子酸标准溶液浓度为横坐标,以其吸光度为纵坐标,绘制标准曲线,计算得没食子酸标准曲线回归方程为:可得其回归方程为y=0.00934x+0.01236,R2=0.99514。没食子酸浓度在0~120 μg/mL范围内,吸光值与没食子酸浓度线性关系良好。
2.2 竹荪多酚提取单因素实验
2.2.1 乙醇浓度对竹荪多酚得率的影响 由图1可知,乙醇浓度在0~20%时,水作为主要的提取溶剂,多酚得率比低浓度的乙醇高,这与王彦辉[6]等人对棘托竹荪孢子粉抗氧化活性研究的结果相近,但由于竹荪的品种和提取工艺的不同,导致结果有所差异;乙醇浓度在20%~80%范围内时,随着乙醇浓度的升高,多酚得率逐渐提高;根据相似相溶原理,当乙醇浓度增大时,溶剂的极性增加,有利于多酚的溶出[11],且80%乙醇的极性与竹荪多酚的极性相近,因而多酚的溶解性较大,有利于提取[12]。因此,乙醇浓度为80%时,多酚得率最高为(7.84±0.61) mg/g。

图1 乙醇浓度对竹荪多酚得率的影响Fig.1 Effect of alcohol concentration on the yield of D. indusiata polyphenols
2.2.2 提取温度对竹荪多酚得率的影响 由图2可知,在提取温度为60~100 ℃之间,随着提取温度的升高,多酚含量先增加后减少;在温度为60~70 ℃之间时,随着温度的升高,细胞组织破坏,使得多酚更好的从细胞中溶出,从而增加多酚的含量;但温度过高,易使多酚氧化、水解[13];因此,提取温度在70 ℃时,多酚得率最高为(6.31±0.55) mg/g。
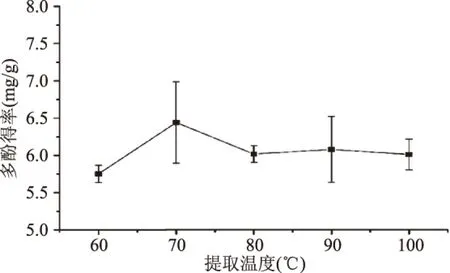
图2 提取温度对竹荪多酚得率的影响Fig.2 Effect of extraction temperature on the yield of D. indusiata polyphenols
2.2.3 料液比对竹荪多酚得率的影响 由图3可知,在料液比为1∶10~1∶50 g/mL之间,随着料液比比值的增大,多酚含量先增加后减少;在料液比为1∶10~1∶40 g/mL之间时,随着溶剂量的增加,竹荪粉末与溶剂的接触面增加,有利于多酚类物质的溶出[14],继续增加溶剂量,多酚得率下降,可能原因是扩散达到了平衡,多酚类物质不再随着溶剂量的增加而增加[15];从浓缩成本考虑,选用料液比为1∶40 g/mL最佳。
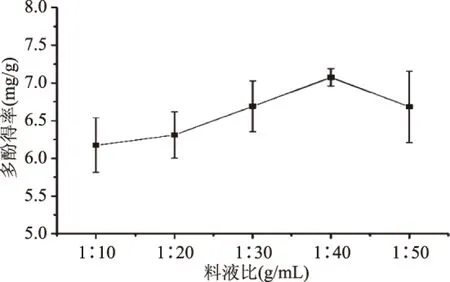
图3 料液比对竹荪多酚得率的影响Fig.3 Effect of substrate to liquid ration on yield of D. indusiata polyphenols
2.2.4 提取时间对竹荪多酚得率的影响 由图4可知,在提取时间为1~5 h之间,随着时间的延长,多酚含量整体呈上升趋势,可能是因为随着时间的增加,多酚逐渐溶出,但提取时间过长,易使多酚受到破坏,而且提取的成本也增加;综合以上原因,提取时间为4 h时较好。

图4 提取时间对竹荪多酚得率的影响Fig.4 Effect of extraction duration on the yield of D. indusiata polyphenols
2.3 正交实验
由表2可知,4个因素对竹荪多酚的影响顺序为B>D>C>A,即提取温度>提取时间>料液比>乙醇浓度,提取温度对总多酚的得率影响最大,在一定范围内,提取温度越高得率越高;最优提取条件为A1B2C2D3,即乙醇浓度为40%、提取温度为80 ℃、料液比为1∶40 g/mL、提取时间为5 h。
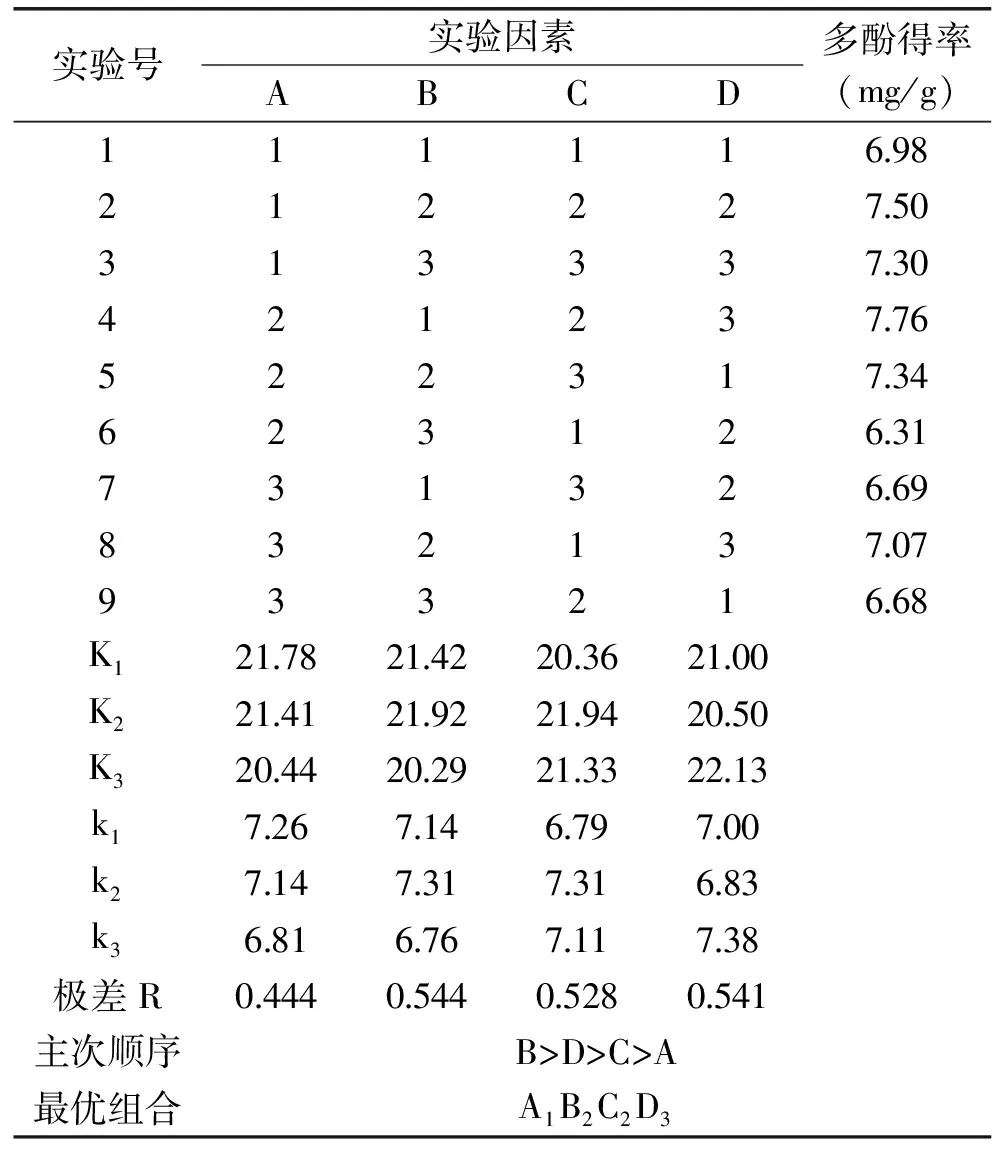
表2 L9(34)正交实验结果Table 2 Orthogonal experiment and its results
2.4 验证实验
取竹荪粉末5.0 g,在最佳提取条件下提取3次,取平均值,验证实验结果。测得竹荪多酚得率为(8.18±0.52) mg/g,明显高于其他组合,说明实验结果与该设计符合良好,优化的提取工艺参数是可靠的,此正交实验具有可行性。
2.5 竹荪多酚抗氧化活性分析
2.5.1 对DPPH自由基清除作用 由图5可知,在多酚质量浓度为1.25~20 mg/mL之间,DPPH自由基的清除率与竹荪提取液的质量浓度呈正相关,当质量浓度为20 mg/mL时,竹荪提取液对DPPH自由基的清除率达到84.28%±1.15%,表明其有一定的抗氧化能力,但其抗氧化能力不及相同条件下等浓度的VC。这与吕瑞等人在研究竹荪水提物体外抗氧化活性的趋势一致,但在相同的清除率下,水提物的抗氧化活性比醇提物效果更好,可能原因是水提物中含有多糖等抗氧化活性较高的物质存在,这与江玉姬等人[16]的研究结果一致。
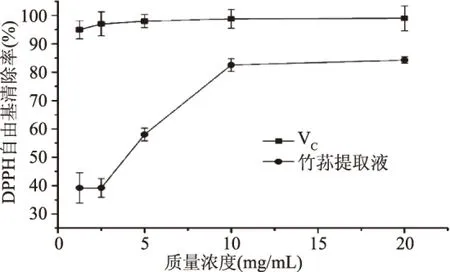
图5 竹荪提取液对DPPH自由基的清除能力Fig.5 DPPH radical scavenging ability of D. indusiata extract
2.5.2 对羟自由基清除作用 由图6可知,当多酚提取液质量浓度在1.25~20 mg/mL之间时,羟自由基的清除率与竹荪提取液的质量浓度呈正相关,当质量浓度为20 mg/mL时,竹荪提取液对羟基自由基清除率达到76.49%±1.14%。竹荪提取液的抗氧化能力比林陈强等人[16]研究报道的较低,可能原因是提取的竹荪种类和工艺条件不同所致。
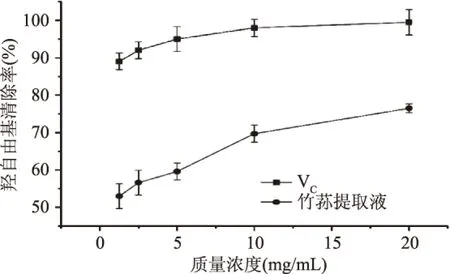
图6 竹荪提取液对羟基自由基的清除能力Fig.6 Hydroxyl free radical scavenging ability of D. indusiata extract
3 结论
通过正交实验,得出竹荪多酚的最佳提取工艺条件为:乙醇浓度为40%、提取温度为80 ℃、料液比为1∶40 g/mL、提取时间为5 h,在该条件下竹荪多酚的得率为(8.18±0.52) mg/g。
体外抗氧化实验研究表明:当竹荪多酚质量浓度为20 mg/mL时,提取液对DPPH自由基、羟基自由基的清除率分别达到84.28%±1.15%和76.49%±1.14%,且其抗氧化能力与提取液浓度存在一定的量效关系。因此,竹荪提取液可以作为天然的抗氧化剂,具有很好的开发前景。
[1]郑杨,邹青青,张岱,等. 竹荪的化学成分及生理活性研究进展[J]. 食品科学技术学报,2013,31(3):39-45.
[2]华洋林,高擎,唐健,等. 同产地竹荪营养成分的比较研究[J]. 食品工业科技,2011,32(10):418-420 .
[3]何慧. 长裙竹荪菌丝体多糖的提取条件及抑菌性研究[J]. 贵州农业科学. 2010,38(9):93-95.
[4]Ker Y,Chen K,Peng C,et al. Structural Characteristics and Antioxidative Capability of the Soluble Polysaccharides Present in Dictyophora indusiata(Vent Ex Pers.)Fish Phallaceae[J]. Evid Based Complement Alternat Med,2011,1:1-9.
[5]Chao Deng,Jingying Shang,Haitian Fu,et al. Mechanism of the immunostimulatory activity by a polysaccharide from Dictyophora indusiata[J]. Int J Biol Macromol,2016,91:752-759.
[6]王彦辉,林陈强,邱宏端,等. 棘托竹荪孢子粉抗氧化活性研究[J]. 天然产物研究与开发,2013,25(11):1576-1581.
[7]李小雨,王振宇,王璐. 食用菌多糖的抗氧化活性及抗细胞增殖活性研究[J]. 食品科技,2013,38(3):179-182.
[8]吕瑞,金莲,周侯全. 竹荪水提物的体外抗氧化活性研究[J]. 江苏农业科学,2015,43(7):347-349.
[9]Jun Liu;Xiao-yuan Wen;Xue-qing Zhang. et al. Extraction,characterization andinvitroantioxidant activity of polysaccharides from black soybean[J]. International Journal of Biological Macromolecules. 2015,72:1182-1190.
[10]乔镜澄,邢春,张妍. 果蔬汁抗氧化性与油炸食品中丙烯酰胺抑制作用关系的研究[J].内蒙古农业大学学报:自然科学版,2016,3:78-82.
[11]李利华. 鱼腥草多酚的超声波辅助提取及抗氧化性能研究[J]. 食品工业科技,2016,37(8):295-298,312.
[12]段宙位,窦志浩,何艾,等. 青金桔皮中多酚的提取及其抗氧化性研究[J]. 食品工业科技,2015,36(10):244-248.
[13]张富敏,王鑫,王睿婷,等. 树莓总多酚的微波辅助提取工艺及抗氧化活性研究[J]. 沈阳药科大学学报,2013,30(11):906-910.
[14]施伟梅,吴龙火,杨翔,等. 超声协同酶法提取紫花苜蓿多酚及其抗氧化性质[J]. 草业科学,2016,33(3):519-526.
[15]蒋志国,李斌,王燕华,等. 菠萝蜜果皮多酚超声微波协同提取工艺优化及抗氧化活性研究[J]. 食品工业科技,2016,37(2):270-275.
[16]Jiang YJ,Wang HY. Antioxidant activities of mushrooms and extraction process optimization for Dictyophora echinovolvata[J]. Chin J Tropical Crops,2011,32:1075-1081.
[17]林陈强,林戎斌,陈济琛,等. 棘托竹荪菌盖提取物的抗氧化活性[J]. 食用菌学报,2013,20(2):32-36.
Study on the extraction and antioxidant activity of total phenolic compounds fromDictyophoraindusiata
WU Lin-xiu1,2,HU Rong-kang1,2,CHEN Yi-xuan1,2,WANG Juan-juan1,LIU Xiao-yan1,2,*,LIU Bin1,2,*
(1.College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China; 2.National Engineering Research Center of JUNCAO Technology,Fuzhou 350002,China)
The contents of polyphenols fromDictyophoraindusiatawere determined by the Folin-Ciocalteu method in the paper. The effects of optimal alcohol concentration,liquid-solid ratio,extraction time and extraction temperature yield ofD.indusiatawere investigated,and the extraction technology was optimized by single-factor experiments and orthogonal design. The antioxidant activity ofD.indusiataphenols was also studied. The results showed that the optimal extraction conditions were found that the optimal alcohol concentration,solid-liquid ratio,extraction time and extraction temperature were 40%,1∶40 g/mL,80 ℃ and 5 h respectively. Under these conditions,the largest extraction quantity of total phenols could reach(8.18±0.52) mg/g. The DPPH radical scavenging ratio and ·OH radicals of the polyphenol extracts reached 84.28%±1.15% and 76.49%±1.14% respectively when the extract concentration was 20 mg/mL.
Dictyophoraindusiata;polyphenol;antioxidant;orthogonal design
2016-09-29
吴林秀(1992-),女,在读硕士生,研究方向:食品化学与营养,E-mail:18359171036@163.com。
*通讯作者:刘斌(1969-),男,博士,教授,研究方向:食品生物技术,E-mail:liubin618@hotmail.com。 刘晓艳(1981-),女,在职博士,助理实验师,研究方向:食品营养,E-mail:liuxiaoyan8112@163.com。
国家科技支撑计划子课题(2014BAD15B01-6);福建省科技重大专硕(2014NZ2002-1);福建农林大学青年基金课题(k13xjj17a)。
TS201.1
B
1002-0306(2017)07-0203-05
10.13386/j.issn1002-0306.2017.07.031
