萝果壳蛋白提取工艺的优化及其抗氧化活性研究
2017-04-13韩冠英
李 敏,郭 斌,韩冠英,崔 錾
(1.锦州医科大学药学院,辽宁锦州 121000;2.锦州医科大学附属第一医院,辽宁锦州 121000)
李 敏1,郭 斌2,*,韩冠英2,崔 錾2
(1.锦州医科大学药学院,辽宁锦州 121000;2.锦州医科大学附属第一医院,辽宁锦州 121000)
采用碱提酸沉法对萝藦果壳蛋白的提取条件进行研究,以蛋白提取率为指标,在单因素实验的基础上,进行正交实验。结果表明在料液比1∶20 (g/mL)、提取液pH11.5、浸提温度60 ℃、提取时间1.0 h的条件下,蛋白提取率最高,为89.18%。并对最佳条件下提取的蛋白进行体外抗氧化实验。结果显示,提取蛋白对DPPH·、·OH的清除率分别为79.45%(8 mg/mL)、55.35%(8 mg/mL),且清除DPPH·、·OH的半抑制浓度(IC50)分别为4.19、3.30 mg/mL,并具有还原能力,但弱于VC。
萝藦果壳,蛋白,正交实验,抗氧化性能
萝藦(Metaplexisjaponica)为萝藦科萝藦属植物,多年生草质藤本。其全草、块根、果实皆可药用[1]。已有对萝藦全草中糖类、黄酮类化合物、生物碱类化合物等的研究[2-3]。大量文献表明,植物蛋白具有多重营养功能。在降低胆固醇、抗肿瘤、降血压和预防心血管疾病等方面作用显著[4]。植物蛋白提取方法主要有盐析法、有机溶剂法、碱提酸沉法等[5]。考虑到盐析法提取蛋白不充分[6],有机溶剂法易引起蛋白变性失活等特点[7],本实验采用碱提酸沉法。利用植物蛋白易溶于碱性溶液,且促进结合物与蛋白分离,从而提高蛋白提取率的特点,对萝藦果壳蛋白进行提取,并对提取的蛋白进行体外抗氧化活性测定,以期为其药理活性的研究提供前期帮助。
1 材料与方法
1.1 材料与仪器
萝藦果壳 采自锦州市周边地区,经由锦州市药品检验所瞿铁红主任药师鉴定为萝藦属萝藦果壳;氢氧化钠(NaOH)、水杨酸、硫酸亚铁(FeSO4)、双氧水(H2O2)、铁氰化钾、三氯化铁 天津永晟精细化工有限公司;1,1-二苯基-2-苦基肼(DPPH) 上海源叶生物科技有限公司;三氯乙酸、考马斯亮蓝G250 天津市光复精细化工研究所;牛血清白蛋白 购自上海蓝季科技发展有限公司;维生素C(VC) 购自国药集团;其他试剂均为国产分析纯。
KDN-08消化炉、KDN-08定氮仪 上海昕瑞仪器仪表有限公司;BP 211D型电子分析天平 德国Sartorius公司;恒温水浴锅 上海腾方公司;PHSJ-4A实验室pH计 上海精密科学仪器有限公司;LD4-2A(Ⅲ)低速离心机 北京京立离心机有限公司;UV-2550型紫外分光光度计 日本岛津;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 萝藦果壳蛋白的提取 将干燥萝藦果壳粉碎,过40目筛。取萝藦果壳粉,按比例加入碱性提取液,并在一定温度下提取。用纱布过滤,在4000 r/min条件下离心20 min。收集上清液,调节pH使蛋白沉淀。离心,去除上清液,调节pH至中性[8],冻干。既得蛋白粗提物。萝藦果壳粉中总蛋白含量采用凯氏定氮法测定,总蛋白质含量=总氮含量×6.25。经测定萝藦果壳粉中总蛋白含量为6.78%。参考文献[9]采用考马斯亮蓝法测定蛋白含量,绘制牛血清白蛋白标准曲线为A=0.0308C+0.0158,R2=0.9965,线性范围在20~100 μg/mL。蛋白提取率(%)=提取的蛋白质量/萝藦果壳粉中总蛋白质量×100
1.2.2 萝藦果壳蛋白等电点测定 取果壳粉10 g,加入200 mL、pH11.0的NaOH溶液,于50 ℃水浴浸提1.0 h。过滤,离心。分别取上清液20 mL,盐酸调节pH,分别为3.4、3.6、3.8、4.0、4.2、4.4、4.6。4000 r/min离心,20 min。将上清液定容至50 mL,采用考马斯亮蓝法测定各上清液的蛋白浓度。以pH为横坐标(X),浓度为纵坐标(Y),绘制浓度-pH的关系图。
1.2.3 单因素实验设计 采用1.2.1中提到的方法,在提取液pH11.0、浸提温度50 ℃、提取时间1.0 h的条件下,考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30,g/mL)对萝藦果壳蛋白提取率的影响;在料液比为1∶20(g/mL)、浸提温度50 ℃、提取时间1.0 h的条件下,考察提取液pH(10.0、10.5、11.0、11.5、12.0)对萝藦果壳蛋白提取率的影响;在料液比为1∶20 (g/mL)、提取液pH11.0、提取时间1.0 h的条件下,考察浸提温度(30、40、50、60、70 ℃)对萝藦果壳蛋白提取率的影响;在料液比为1∶20 (g/mL)、浸提温度50 ℃、提取液pH11.0的条件下,考察提取时间(0.5、1.0、1.5、2.0、2.5 h)对萝藦果壳蛋白提取率的影响。以萝藦果壳蛋白提取率为指标,进行单因素实验。分析各因素对萝藦果壳蛋白提取率的影响。
1.2.4 萝藦果壳蛋白提取工艺优化 在上述单因素实验的基础上,选定料液比、提取液pH、浸提温度和提取时间四个影响因素,每个因素取三个水平作正交实验,以萝藦果壳蛋白提取率为衡量实验结果的指标,对提取工艺进行优化,以期找到更好的提取条件。因素水平表见表1。

表1 正交实验因素与水平表Table 1 Factors and levels of orthogonal experiment
1.2.5 萝藦果壳蛋白体外抗氧化活性实验 进行抗氧化活性实验所用的蛋白均为优化工艺条件下提取的萝藦果壳蛋白,配制浓度分别为0.5、1、2、4、8 mg/mL的样品溶液。
1.2.5.1 DPPH·清除能力的测定 取不同质量浓度的样品溶液2 mL于试管中,加入2 mL DPPH·无水乙醇溶液(0.04 mg/mL),暗处充分混合,反应30 min,于517 nm处测定其吸光度[10]。以蒸馏水代替样品溶液,无水乙醇代替DPPH·溶液,作空白实验调零用。各组平行测定3次,取平均值。VC为阳性对照,清除率计算如式(1):
清除率(%)=[1-(A1-A2)/A0]×100
式(1)
式中:A0为空白组,蒸馏水代替样品溶液的吸光度值;A1为样品溶液吸光度值;A2为样品干扰实验,是无水乙醇代替DPPH·溶液的吸光度值。
1.2.5.2 ·OH清除能力的测定 取不同质量浓度的样品溶液1 mL于试管中,依次加入FeSO4(6 mmol/mL)和H2O2(0.6 mmol/mL)各1 mL,混合均匀后静置10 min;再加入1 mL水杨酸醇溶液(6 mmol/mL),混匀静置30 min,于波长510 nm处测定其吸光度[11],各组平行测定3次,取平均值。VC为阳性对照,清除率计算公式同式(1)。
式中:A0为空白组,蒸馏水代替样品溶液的吸光度值;A1为样品溶液吸光度值;A2为蒸馏水代替H2O2的吸光度值。
1.2.5.3 还原能力的测定 取不同质量浓度的样品溶液1 mL于试管中,加入2.5 mL磷酸盐缓冲液(0.2 mol/L、pH6.6)和2.5 mL的铁氰化钾溶液(1%),混匀后于50 ℃水浴中反应20 min,快速冷却,加入2.5 mL三氯乙酸(10%),混匀,4000 r/min离心10 min,取上清液2.5 mL于试管中,加入0.5 mL三氯化铁溶液(0.1%)、2.5 mL蒸馏水,充分混匀常温反应10 min。于700 nm处测定其吸光值A[12],吸光值越大表示还原能力越强。以蒸馏水为空白,各组平行测定3次,取平均值。VC为阳性对照。
1.2.6 数据处理 实验数据使用SPSS 18.0软件进行方差分析,Origin8.0软件作图。
2 结果与分析
2.1 萝藦果壳蛋白等电点的确定
以pH为横坐标(X),萝藦果壳蛋白浓度(mg/mL)为纵坐标(Y),绘制浓度-pH的关系图,从图1可知,pH为4.2时残留的蛋白浓度最小。说明此时绝大部分蛋白质已经沉淀。因此,在进行加酸沉淀蛋白时,应将离心后所得的碱性蛋白上清液的pH调到4.2,以使蛋白最大程度沉淀。
图1 pH对残留蛋白浓度的影响Fig.1 Effect of pH on residual concentration of protein
2.2 单因素实验
2.2.1 料液比对萝藦果壳蛋白提取率的影响 从图2可知,当料液比在1∶10~1∶20 (g/mL)范围内时,蛋白提取率随着料液比的增加而增加,料液比为1∶20 (g/mL)时,蛋白提取率最大为76.03%。这是因为在一定范围内增加料液比有利于增大浸提物与溶剂的接触面积,使蛋白充分溶出,从而提高萃取效率。但当料液比继续增大时,蛋白提取率反而平缓下降。是因为溶剂继续增加会使蛋白分子与水分子之间的相互作用力增加[13],而使蛋白分子不易沉淀,导致蛋白残留在上清液中,造成提取率下降。

图2 料液比对蛋白提取率的影响Fig.2 Effect of ratios of water to material on extraction yield of protein
2.2.2 提取液pH对萝藦果壳蛋白提取率的影响 从图3可知,在一定范围内,随着pH的升高,蛋白提取率表现出上升趋势,是因为适当的碱性条件加速蛋白酸式解离反应,提高了蛋白的溶解量,而且增大了对蛋白次级键特别是对氢键的破坏,使蛋白质增溶作用增加。在pH11.0时,提取率达到76.53%。当pH高于11.0时蛋白提取率呈现下降趋势,可能因为碱性过强引起蛋白质变性[14],且部分蛋白质会发生水解生成低分子量化合物,以上清液的形式流失,使得蛋白质提取率降低。

图3 提取液pH对蛋白提取率的影响Fig.3 Effect of pH on extraction yield of protein
2.2.3 浸提温度对萝藦果壳蛋白提取率的影响 从图4可知,在浸提温度较低时,升高提取温度提取率随之升高,因为温度升高可以促进分子运动,从而促进蛋白分子浸出,而且热作用对细胞壁有破坏作用,使蛋白质更容易溶出。在50 ℃和60 ℃条件下,萝藦果壳蛋白提取率比较高,之后提取率明显下降。一方面,蛋白质发生凝胶作用而沉淀;另一方面,升高温度增加了蛋白质的热变性程度、降解反应[15],引起蛋白质聚集,从而降低蛋白质溶解度,最终表现为提取率降低。
图4 浸提温度对蛋白提取率的影响Fig.4 Effect of temperature on extraction yield of protein
2.2.4 提取时间对萝藦果壳蛋白提取率的影响 从图5可知,萝藦果壳蛋白的提取率随着浸提时间的延长呈现先增加后降低的趋势,当浸提时间为1.5 h时,提取率达到最大值为61.08%。可能是因为蛋白溶出并达到平衡需要一定时间。而继续延长浸提时间,会导致蛋白变性、水解等,致使浸提时间延长蛋白提取率反而下降,还有可能是萝藦果壳多糖与蛋白结合,从而导致蛋白难以沉淀。
图5 提取时间对蛋白提取率的影响Fig.5 Effect of time on extraction yield of protein
2.3 正交实验结果及数据分析
表2中极差大小反映实验因素对考察指标的影响程度,极差越大,因素对指标的影响就越大。在影响萝藦果壳蛋白提取工艺的四个因素中,对蛋白提取率的影响作用由大到小为:料液比>浸提液pH>提取时间>浸提温度,即料液比对蛋白提取率影响最大,浸提温度影响最小。方差分析结果见表3。
从表2中还可以得出提取蛋白的最佳组合条件A1B3C2D3,即提取时间1.0 h、提取液pH11.5、料液比1∶20 (g/mL)、浸提温度60 ℃。验证实验表明,所得平均提取率为89.18%。
由表3可知,提取时间、浸提液pH、料液比对萝藦果壳蛋白提取率的影响显著,说明上述三个因素对萝藦果壳蛋白提取率的影响起主要作用。浸提温度对萝藦果壳蛋白提取率的影响不显著。
表2 正交实验设计及结果Table 2 Orthogonal test design and results
注:Ki值为同一水平下的分值之和,ki值为同一水平下的平均值,R为不同水平间均值的极差。
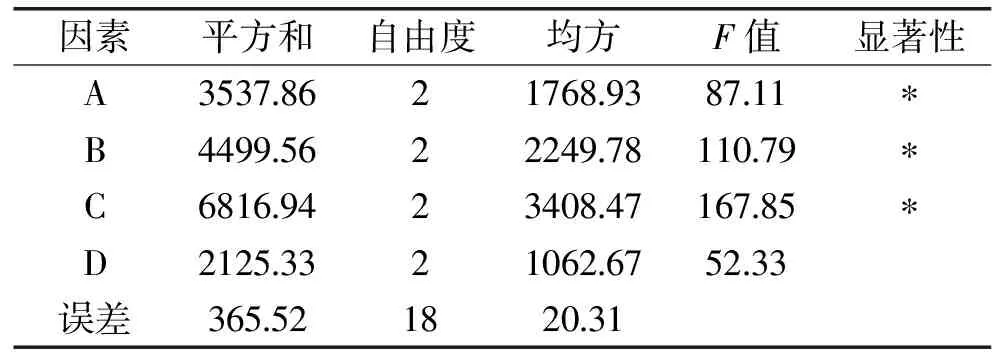
表3 正交实验方差分析Table 3 Analysis of variance of orthogonal test
注:*p<0.05表示影响显著。
2.4 萝藦果壳蛋白抗氧化性实验结果
2.4.1 DPPH·清除能力的测定结果 DPPH·是一种很稳定的氮中心的自由基,在517 nm处有强烈的吸收。但若体系中存在其他抗氧化性物质时,便会由于单电子配对,使其吸收减少。故可以通过记录DPPH·在517 nm处的吸光度值变化来评价抗氧化物质的抗氧化能力强弱。萝藦果壳蛋白对DPPH·的清除作用结果如图6所示,以VC作为对照。从图中可知,当萝藦果壳蛋白质量为8 mg/mL时,清除率就可以达到79.45%,且在一定范围内,随质量浓度增加而升高。其中6.45 mg/mL的萝藦果壳蛋白的清除能力与64.5 μg/mL的VC相当。通过数学模拟方程可知:萝藦果壳蛋白清除DPPH·的IC50为4.19 mg/mL。
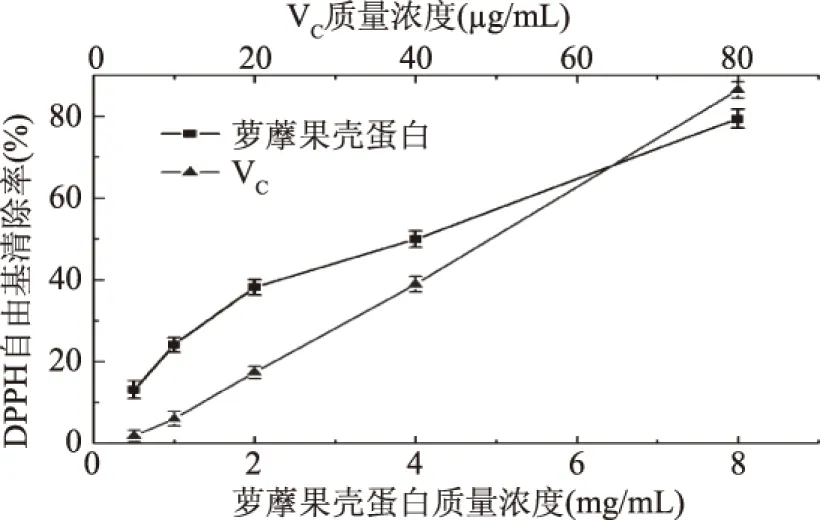
图6 MJNP对DPPH·的清除作用Fig.6 DPPH· radical-scavenging activities of MJNP
2.4.2 ·OH清除能力的测定结果 实验应用Fenton反应,其本质是Fe2+与H2O2在催化作用下生成·OH。·OH被水杨酸捕捉生成2,3-二羟基苯甲酸和2,5-二羟基苯甲酸,并在510 nm处有最大吸收。蛋白溶液加入后会与水杨酸竞争·OH,使510 nm处的吸光度降低,进而可以评价其抗氧化能力[16]。结果如图7所示,萝藦果壳蛋白和VC对·OH都有清除作用,清除率随蛋白浓度的增大不断增加,浓度达到4 mg/mL时清除率达到55.35%,说明萝藦果壳蛋白具有一定的清除·OH作用,但弱于阳性对照组VC。其中6.18 mg/mL的萝藦果壳蛋白的清除能力与61.8 μg/mL的VC相当。通过数学模拟方程可知:萝藦果壳蛋白清除·OH的IC50为3.30 mg/mL。
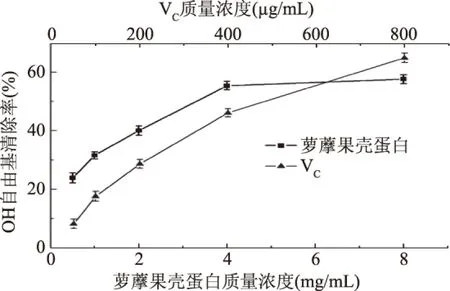
图7 MJNP对·OH的清除作用Fig.7 ·OH radical-scavenging activities of MJNP
2.4.3 还原能力测定结果 铁氰化钾在还原性物质作用下被还原成亚铁氰化钾,其可在酸性条件下与Fe3+反应,生成有色物质,在700 nm处具有特征吸收,且浓度越大,其吸光值越大,即还原能力越强[17]。由图8可知,萝藦果壳蛋白还原能力在一定质量浓度范围内随浓度增大而提高,并呈现明显的量效关系。表明萝藦果壳蛋白具有一定的还原能力,但还原能力明显低于阳性对照组VC。
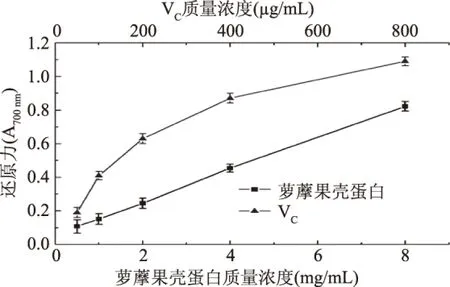
图8 萝藦果壳蛋白的还原能力Fig.8 Reducingt power of MJNP
3 结论与讨论
通过正交实验可知:在料液比1∶20 (g/mL)、提取液pH11.5、浸提温度60 ℃、提取时间1.0 h的条件下,蛋白提取率最高达89.18%。且萝藦果壳蛋白具有体外抗氧化能力。萝藦果壳蛋白清除DPPH·和·OH的IC50分别为4.19、3.30 mg/mL。由方差分析可知,在影响萝藦果壳蛋白提取率的四个因素中,以料液比的影响最大。所以在提取过程中应保证果壳粉与溶剂充分接触,以避免因接触不完全,导致的蛋白溶出不充分,可以采用不断搅拌的方法促进溶出。提取液pH对萝藦果壳蛋白提取率也有较大影响。通过碱性条件变化来影响蛋白解离程度,从而影响蛋白提取率。此外,强碱条件引起蛋白变性也是需要考虑的因素。
对萝藦果壳蛋白抗氧化活性进行评价,以VC为阳性对照。测定其清除DPPH·、·OH的能力和还原能力。结果表明,在一定质量浓度范围内,萝藦果壳蛋白具有一定的抗氧化能力,但弱于VC。
[1]白雨鑫,郭斌.萝藦果壳多糖提取工艺优化及其抗氧化活性研究[J].食品工业科技,2015,36(20):278-283.
[2]杨蕾.萝藦化学成分的分离和分析[D].上海:华东理工大学,2012.
[3]马寅达.萝藦总多糖的提取纯化及药理作用的初步研究[D].锦州:辽宁医学院,2012.
[4]陈贵堂,赵霖.植物蛋白的营养生理功能及开发利用[J]. 食品工业科技,2004,25(9):137-140.
[5]叶晶晶,曹宁宁,殷浩.植物蛋白的研究进展[J].安徽农业科学,2011,39(31):19046-19047.
[6]蔡春尔,何培民.硫酸铵三步盐析对藻胆蛋白纯化的影响[J].生物技术通报,2006,26(4):121-125.
[7]吕微,蒋剑春,徐俊明.蛋白质提取及分离纯化研究进展[J].精细石油化工进展,2010,11(11):52-58.
[8]Daiana D S,Arthur Francisco Sbardelotto,Denize RighettoZiegler,et al. Characterization of rice starch and protein obtained by a fast alkaline extraction method[J]. Food Chemistry,2016,191:36-44.
[9]Zhao P,Wang Y,Zhang Y,et al.The extraction of different proteins in selenium enriched peanuts and their antioxidant properties[J].Saudi Journal of Biological Sciences,2016,23(3):353-357.
[10]Zhao Z,Xu X,Ye Q,et al. Ultrasound extraction optimization of Acanthopanax senticosus polysaccharides and its antioxidant activity[J].International Journal of Biological Macromolecules,2013,59(12):290-294.
[11]Xiu J D,Hong M M,Shuai Z,et al.Chemical analysis and antioxidant activity of polysaccharides extracted from Inonotus obliquus sclerotia[J].International Journal of Biological Macromolecules,2013,62:691-696.
[12]Zheng X W,Ye L,Hui L,et al.Rice proteins,extracted by alkali anda-amylase,differently affectinvitroantioxidant activity[J].Food Chemistry,2016,206(1):137-145.
[13]Bendahou A,Dufresen A,Kaddami H,et al.Isolation and structural characterization of hemicelluloses from palm of Phonenix dactylifera L[J].Carbohydrate Polymers,2007,68:601-605.
[14]李盼盼.银杏蛋白超声波辅助提取及特性研究[D].泰安:山东农业大学,2012.
[15]伍小华,刘丹,陈玉霞.栀子渣中植物蛋白提取工艺的研究[J].食品科学,2008,29(12):336-338.
[16]周晓薇,王静,段浩.铁棍山药蛋白质的分离纯化及体外抗氧化活性[J].食品科学,2011,32(9):31-35.
[17]许小向,洪艳平,胡捷敏.松针多糖微波提取工艺及抗氧化性研究[J].食品工业科技,2015,36(23):222-227.
Optimization of extraction process of protein fromMetaplexisJaponicaMakinonutshell and evaluation of its antioxidative activity
LI Min1,GUO Bin2,*,HAN Guan-ying2,CUI Zan2
(1.School of Pharmaceutical Sciences,Jinzhou Medical University,Jinzhou 121000,China; 2.The NO.1 Affiliated Hospital of Jinzhou Medical University,Jinzhou 121000,China)
The theory of alkali extraction and acid precipitation was employed to optimize the extraction conditions of protein fromMetastasisJaponicaMakinonutshell(MJNP),and protein extraction rate as index,by means of the single factor experiments and orthogonal experiment. The results showed that the optimum conditions were as follows:ratio of solid to liquid of 1∶20(g/mL),solution pH11.5,temperature of 60 ℃ and extraction time of 1.0 h,and the average extraction yield was 89.18%. Antioxidant experiments were primarily evaluated,under the condition of the optimized process,the protein had the scavenging capacity against DPPH· and ·OH with the scavenging rate of 79.45%(8 mg/mL)and 55.35%(8 mg/mL),the IC50value of DPPH·,and ·OH was 4.19 mg/mL and 3.30 mg/mL,respectively. Moreover,the protein extracted fromMetastasisJaponicaMakinonutshell possessed weaker reducing power than VC.
MetaplexisJaponicaMakinonutshell;protein;orthogonal array design;antioxidant activity
2016-10-19
李敏(1992-),女,硕士,研究方向:植物蛋白类物质的研究,E-mail:18841618468@163.com。
*通讯作者:郭斌(1969-),男,博士,教授,研究方向:海洋药物资源的开发研究,E-mail:jyguobin@126.com。
辽宁省科技厅科技攻关计划(2013225305)。
TS201.2
B
1002-0306(2017)07-0166-05
10.13386/j.issn1002-0306.2017.07.024
