一种新型葡聚糖基水凝胶敷料的制备及其性质
2017-04-10吴飞飞张俊芝吴德群
吴飞飞, 张俊芝, 朱 婕, 吴德群, b
(东华大学 a. 纺织学院; b. 纺织面料技术教育部重点实验室, 上海 201620)
皮肤是人体最大的器官,具有抵御外界微生物入侵、排泄及防止水分蒸发、调节体温、维持机体内环境稳定等重要作用[1].由于烧伤、刀伤、擦伤和皮肤溃烂等原因,可能造成大面积皮肤损伤,皮肤受损后会造成体液内水分、蛋白等成分的蒸发和流失,大肠杆菌、金黄色葡萄球菌等病原体容易在伤口上繁殖而引起感染,从而容易引起各种并发症.随着现代生活节奏加快和医疗保健需求的不断增长,传统的敷料例如纱布、无纺布等已经无法满足市场上对于高性能医用敷料的需求[2].理想的敷料[3]应该具有可吸收伤口渗出液,覆盖及保护伤口不受感染,与伤口有较好的黏合力但不与伤口粘连,良好的透气性、抗菌消炎等优点[4].
水凝胶敷料是一种良好的创面敷料,其含有一定水分的三维网状结构的高分子溶胀体,具有良好的吸水性和生物相容性,能与不平整的创面密切贴合但不会发生粘连,减少了细菌滋生的机会且易于更换.由于水凝胶与被固定在其中的药物或生物活性分子的相互作用极其微小,可使被固定的物质保持长时间的活性,可以掺入各种药物和生长因子促进伤口的愈合[5].由此表明,水凝胶敷料较为接近理想敷料的要求.
目前,医用水凝胶敷料的主流研究材料仍是聚丙烯酸类、聚乙烯醇类等人工合成材料[6-8].虽然人工合成材料的力学性能优于天然材料,但其生物相容性和生物安全性风险一直是难以逾越的技术难点.研究者在努力提高人工合成材料的生物相容性的同时,也从未停止寻找更合适的天然生物材料以制备水凝胶[9-10].
葡聚糖(Dextran),又称右旋糖酐,是一种水溶性天然生物性多糖,由葡萄糖单元脱水聚合而成,具有良好的生物相容性、抗蛋白吸附性[11],其主链上含有很多游离的羟基,易于修饰和交联[12].目前报道葡聚糖较多的生理功能主要包括免疫调节、抗肿瘤、抗氧化、抗病毒和抗蛋白吸附[11]等.其中免疫调节功能被认为是最重要的生理活性功能,其能够活化巨噬细胞和嗜中性白血球等,诱导细胞因子产生,有效增强免疫系统,在感染病和创伤治疗方面深受瞩目.文献[13]研究了甲基丙烯酸缩水甘油酯改性葡聚糖的反应机理,即在二甲亚砜(DMSO)中二者发生酯交换反应,得到葡聚糖的甲基丙烯酰化衍生物(GMA-Dex).在此基础上,文献[14]合成了具有pH值敏感性的GMA-Dex与丙烯酸共聚水凝胶.文献[15]研究了将葡聚糖用马来酸酐修饰后,在光引发剂作用下与聚-异丙基丙烯酞胺的(NIPAAm)共聚制备具有温度和pH值双重敏感特性的水凝胶,通过调节聚合单体比例可制备出相转变温度与人体温度相近的水凝胶,用于生物工程、生物技术领域.
上述制备的水凝胶都是通过环氧开环和酯化反应获得侧链上可交联双键.由于酰化反应的产率远远高于环氧开环和酯化反应,本文通过酰化反应提高接枝反应转化率,以提高交联密度,从而提高水凝胶的强度.虽然水凝胶敷料所提供的湿润环境有助于细胞生长和促进伤口的愈合,但同时也有利于有害微生物的滋长,而有关葡聚糖水凝胶的抗菌性能研究报道较少.本文通过化学接枝季铵盐类抗菌剂和预载入广谱抗菌药物洗必泰,使水凝胶具有双重抗菌性.季铵盐类抗菌剂[16]一直是人们研究和应用最广泛的阳离子有机抗菌剂,它能够吸附带负电荷的细菌,引起胞壁结构的破坏,使细胞内物质流出,从而达到抗菌的作用,而且对人体安全无毒,价格较低廉.洗必泰具有高效稳定的抑菌能力,且对人体无害,已被广泛应用于抗菌领域长达30多年[17].
本文将2,3- 环氧丙基三甲基氯化铵开环接枝到葡聚糖大分子上得到葡聚糖季铵盐衍生物,再控制其羧基化的程度,通过原位光交联方法制备得到两种水凝胶敷料,并研究了其结构特征,以及溶胀、降解、药物缓释、抗菌、抗蛋白吸附等性能.
1 试 验
1.1 主要原料
2,2′- (乙烯二氧)双(乙胺)(DA)、1- 羟基苯并三唑、1- (3- 二甲氨基丙基) -3- 乙基碳二亚胺盐酸盐、4- 二甲氨基吡啶、2,3- 环氧丙基三甲基氯化铵(GTMAC)、丁二酸酐(SA)和牛血清蛋白(BSA)购买于上海安耐吉化学有限公司;二碳酸二叔丁酯和氯化锂购买于国药集团化学试剂有限公司;甲基丙烯酸(MA)购买于北京伊诺凯科技有限公司;葡聚糖(MW=20 000)购买于百灵威科技有限公司;浓硫酸、浓盐酸、碳酸氢钠、氯化钠、二氯甲烷、乙酸乙酯、N,N- 二甲基甲酰胺(DMF)和二甲基亚砜(DMSO),均为分析纯,购买于上海凌峰化学试剂有限公司;磷酸盐缓冲液(PBS)购买于上海酶联生物科技;洗必泰购买于梯希爱(上海)化成工业发展有限公司;琼脂,生物纯,购买于中国惠兴生化试剂有限公司;大肠杆菌(E.coli ATCC 8099)和金黄色葡萄球菌(S.aureus ATCC 6538)购买于南京便诊生物科技有限公司.
1.2 合成小分子(DA-MA)
参照文献[18],将二碳酸二叔丁酯(2.0 g、 0.009 18 mol)溶于二氯甲烷(50 mL)中,然后逐滴加入到溶解了DA(8.151 g、 0.055 mol)的二氯甲烷(50 mL)中,于0 ℃条件下反应24 h,用旋转蒸发仪去除多余的二氯甲烷,再用饱和食盐水水洗,乙酸乙酯萃取3次,将有机层干燥得到产物3.
参照文献[19],将产物3(1.0 g、 0.004 0 mol)与MA(0.344 2 g、 0.004 0 mol)加入到二氯甲烷中,再加入1- (3- 二甲氨基丙基) -3- 乙基碳二亚胺盐酸盐(0.766 8 g、 0.004 0 mol)和1- 羟基苯并三唑(0.540 5 g、 0.004 0 mol),在0 ℃条件下反应10 h.再分别用质量分数为5%的盐酸溶液、质量分数为5%的碳酸氢钠溶液、去离子水、饱和食盐水洗涤,分离有机层并将有机溶液去除得到产物5.
将产物5溶于少量乙酸乙酯,通入连续的氯化氢气体至溶液中有固体沉淀析出,去除多余的乙酸乙酯,得到固体产物6[20].
1.3 制备葡聚糖基水凝胶
1.3.1合成葡聚糖基大分子(Dex-GTMAC-SA-DAMA)
参照文献[13],在碱性环境中将GTMAC(4.68 g, 0.031 mol)开环接枝到葡聚糖(5.0 g, 0.031 mol)上,得到葡聚糖季铵盐衍生物.再参照文献[15]将葡聚糖季铵盐衍生物(2.0 g、 0.010 8 mol)与SA(1.082 g、 0.010 8 mol; 2.164 g、 0.021 6 mol)发生酯化反应,得到羧基化的产物11(Dex-GTMAC-SA).
将所得产物11(2.0 g、 0.007 mol)与DA-MA(0.79 g、 0.003 7 mol; 1.33 g、 0.006 2 mol)溶于DMSO中,加入1- (3- 二甲氨基丙基) -3- 乙基碳二亚胺盐酸盐和1- 羟基苯并三唑,在常温下反应10 h,再将产物用异丙醇沉淀析出,得到产物12(Dex-GTMAC-SA-DAMA).
1.3.2制备葡聚糖基水凝胶
将葡聚糖基大分Dex-GTMAC-SA-DAMA及广谱抗菌药物洗必泰溶于蒸馏水中,加入引发剂过硫酸铵,通过紫外光照引发双键交联得到水凝胶.葡聚糖水凝胶合成反应路线如图1所示,各原料的投料比以及GTMAC和SA对葡聚糖大分子的取代度如表1所示.
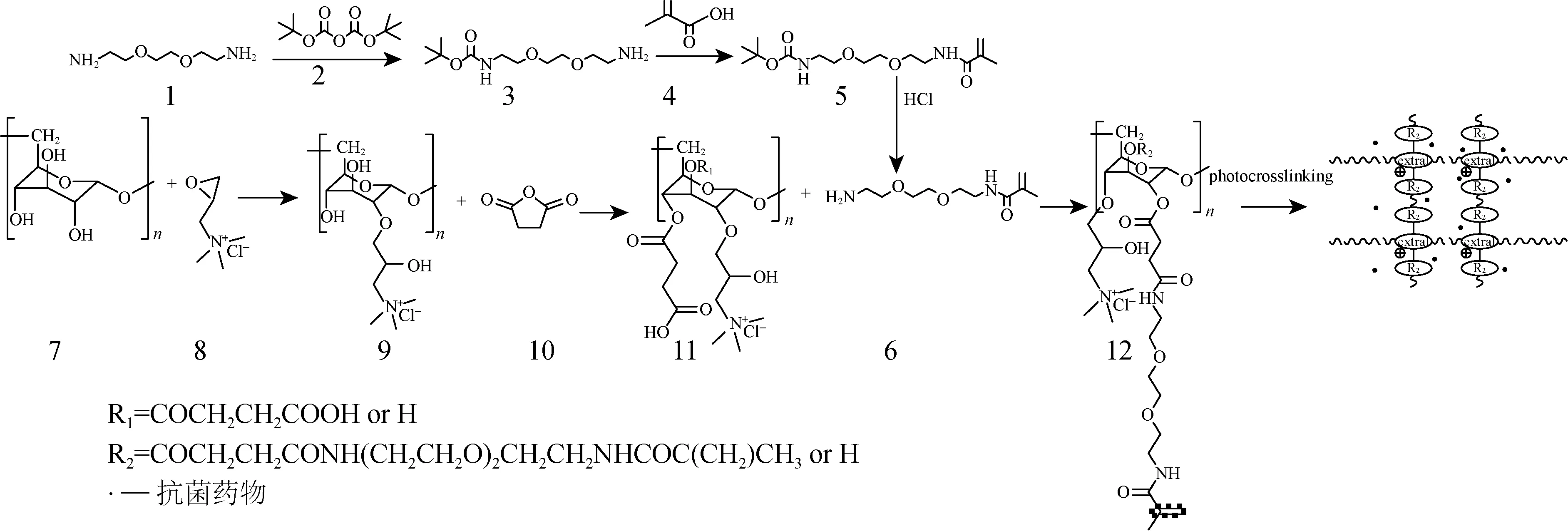
图1 Dex-GTMAC-SA-DAMA水凝胶的合成Fig.1 Synthesis of Dex-GTMAC-SA-DAMA hydrogel
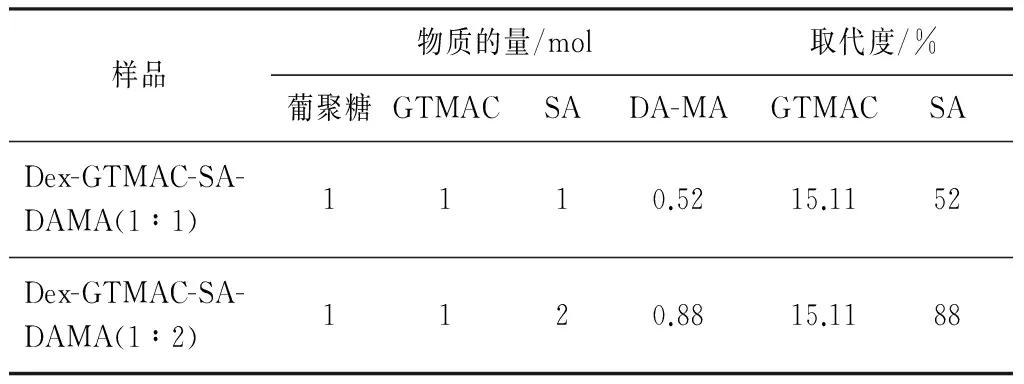
样品物质的量/mol葡聚糖GTMACSADA-MA取代度/% GTMACSADex-GTMAC-SA-DAMA(1∶1)1110.52 15.1152Dex-GTMAC-SA-DAMA(1∶2)1120.88 15.1188
1.4 性能表征与测试
核磁共振氢谱(1H NMR)测试.在核磁管中将单体溶解在1 mL氘代水中,采用Avance 400型核磁共振波谱仪测试其分子内部氢的种类及数量.
傅里叶变换红外光谱(FT-IR)测试.取小块干燥水凝胶置于测试台上,用探测头压紧,采用Nicolet 6700型傅里叶变换红外光谱仪对试验材料进行光谱分析,测试范围为350~7800 cm-1,测试水凝胶的分子组成及结构.
场发射扫描电子显微镜(FE-SEM)测试.将待测样品用导电胶黏到样品台上,喷金后放入S-4800型场发射扫描电子显微镜样品室,在加速电压为5 kV的条件下,观察水凝胶的表面形态.
1.5 水凝胶溶胀性能测试
将冻干后的水凝胶称取质量,记为md,之后浸入PBS中(pH值为7.4, 0.1 mol/L).在预定的时间取出,用湿滤纸吸取水凝胶表面的水分后称取质量,记为ms,直至水凝胶达到溶胀平衡为止.水凝胶的溶胀度(S)计算如式(1)所示.
(1)
1.6 水凝胶降解性能测试
先将达到溶胀平衡的水凝胶冷冻干燥后称取质量,记为mst.再将其静置于100 mL已精确配制好的胰蛋白酶溶液中(0.3 mg/mL), 37 ℃水浴,恒温缓慢降解.每隔24 h从溶液中取出水凝胶,将其冷冻干燥,干燥后准确称取质量,记为mdt.水凝胶的失重率(W)计算如式(2)所示.
(2)
1.7 水凝胶药物缓释测试
在水凝胶制备之前,预先载入微溶于水的广谱抗菌药物洗必泰,使洗必泰均匀地分散在水凝胶三维网络中,再将载药水凝胶放在50 mL的PBS(pH值为7.4, 0.1 mol/L)中浸泡48 h,达到溶胀平衡后,将水凝胶取出放入37 ℃的200 mL的PBS(pH值为7.4, 0.1 mol/L)中,在设定的时间点定时取样2 mL,立即补加等量的PBS(pH值为7.4, 0.1 mol/L),用日立U-4100型紫外可见近红外分光仪在254 nm波长处分别测定其吸光度,从而测定药物累计释放量.洗必泰的体外累计释放率(Q)计算如式(3)所示.

(3)
式中:Mt为释放t时间后洗必泰的累计释放量;M0为预载入水凝胶内的洗必泰质量.
1.8 水凝胶抗菌性能测试
选取金黄色葡萄球菌和大肠杆菌作为测试菌种,采用琼脂平皿扩散法测试表征水凝胶的抗菌效果.将水凝胶置于涂有菌液的琼脂培养基中央,在37 ℃恒温培养箱中培养24 h,测量抑菌带外径宽度.每隔24 h 将水凝胶移植至新的培养皿中,直至抑菌带消失,从而测试其抗菌持久性.抑菌带宽度(H)的计算如式(4)所示.
(4)
式中:D为抑菌带外径的平均值(mm);d为水凝胶的直径(mm).
1.9 水凝胶抗蛋白吸附性能测试
先将测试的水凝胶用高纯水充分清洗,然后将其放置在PBS(pH值为7.4, 0.1 mol/L)中浸泡2 h,然后用0.5 mL的异硫氰酸荧光素标记的牛血清蛋白(FITC-BSA)涂覆在准备好的水凝胶上,于37 ℃孵化2 h,孵化完成后用PBS(pH值为7.4, 0.1 mol/L)充分清洗,用岛津RF-6000型荧光分光光度计在吸入峰495 nm和激发峰525 nm波长处测定蛋白的吸光度.蛋白质吸附量(P)计算如式(5)所示.
(5)
式中:c0、c1分别为水凝胶吸附前后的FITC-BSA质量浓度(g/mL);V0、V1分别为水凝胶吸附前后的FITC-BSA溶液体积(mL);A为样品的总表面积(cm2).
2 结果与讨论
2.1 水凝胶的1H-NMR表征
小分子DA-MA、葡聚糖Dextran和葡聚糖大分子Dex-GTMAC-SA-DAMA的1H-NMR谱图如图2所示.由图2可知:小分子DA-MA上双键的信号峰在化学位移5.3和5.5处,甲基的信号峰在化学位移1.98 处;葡聚糖Dextran上1号位的信号峰在化学位移4.8处,环上其他质子的信号峰在化学位3.3~3.9处;葡聚糖大分子Dex-GTMAC-SA-DAMA的1H-NMR谱图中,出现了DA-MA和Dextran没有的信号峰.在化学位移3.2处的信号峰属于季铵基团上的甲基,在化学位移5.1处的信号峰为葡聚糖结合季铵基团后而引起糖环1号位的化学位移发生变化后的信号峰,在化学位移2.5和2.6处的信号峰属于SA开环后的质子峰.因此,确定Dextran分子链上成功引入了GTMAC、SA及小分子DA-MA.根据g位的氢面积积分(x)与葡聚糖单元环1号位上的氢面积积分(y),通过公式(x/2y)×100%得到产物的实际取代度,葡聚糖季铵盐大分子与SA按摩尔比1∶1和1∶2投料得到的实际取代度分别为52%、 88%,由此得出,SA与Dextran的接枝反应转化率比较高,且反应取代度可控.各个位置质子氢的化学位移归属如图2所示.

图2 DA-MA、 Dextran、 Dex-GTMAC-SA-DAMA的1H-NMR谱图Fig.2 1H-NMR spectra of DA-MA, Dextran, Dex-GTMAC-SA-DAMA
2.2 水凝胶的FT-IR表征


图3 Dextran、 Dex-GTMAC-SA-DAMA水凝胶的傅里叶变换红外光谱图Fig.3 FT-IR spectra of Dextran and Dex-GTMAC-SA-DAMA hydrogels
2.3 水凝胶的FE-SEM表征
水凝胶溶胀样品进行冷冻干燥处理后的电镜照片如图4所示.由图4中可以看出,水凝胶孔洞均匀且贯通,即存在着明显的通道结构,为水分子进出提供了路径,从而有利于水分子的扩散.其中,Dex-GTMAC-SA-DAMA(1∶1)的孔径在10 μm左右;Dex-GTMAC-SA-DAMA(1∶2)的孔径为 6~7 μm.随着SA投料摩尔比的增加,孔洞的密度增加而孔径减小.这是由于葡聚糖大分子上取代度增加,从而使凝胶网络的交联密度增加,孔洞的数量增加,孔径减小.

(a) Dex-GTMAC-SA-DAMA (1∶1)

(b) Dex-GTMAC-SA-DAMA (1∶2)
2.4 水凝胶溶胀率表征
水凝胶在37 ℃的PBS(pH值为7.4, 0.1 mol/L) 中溶胀度随时间的变化规律如图5所示.由图5可以看出,水凝胶的溶胀速率和溶胀度都随着SA取代度的增加而降低,与FE-SEM观察的结果一致.这是由于随着SA投料摩尔比的增加,葡聚糖大分子链上羟基被取代的程度越大,单体的双键接枝率越大,单位体积内交联键所占的百分比越大,交联程度越大,交联孔径越小,因此溶胀能力下降.在48 h后达到溶胀平衡,Dex-GTMAC-SA-DAMA(1∶1)和Dex-GTMAC-SA-DAMA(1∶2)的溶胀率分别达到711.7%和645.0%.

图5 Dex-GTMAC-SA-DAMA水凝胶的溶胀度随时间的变化曲线Fig.5 Swelling kinetics of time for Dex-GTMAC-SA-DAMA hydrogels
2.5 水凝胶酶降解表征
Dex-GTMAC-SA-DAMA水凝胶的酶降解失重曲线如图6所示.由图6可以看出,Dex-GTMAC-SA-DAMA(1∶1)和Dex-GTMAC-SA-DAMA(1∶2)水凝胶随降解时间的延长,其失重速率逐渐减慢,而未经过酶降解的水凝胶的质量几乎无变化.两者分别在96和144 h后,其质量不再发生明显变化,胰蛋白酶结束降解水凝胶的交联侧链上的酯键和酰胺键,此时的失重率分别为28.3%和22.5%[22-23].Dex-GTMAC-SA-DAMA水凝胶的交联密度越高,胰蛋白酶降解破坏交联点引起降解所需时间越长.

图6 Dex-GTMAC-SA-DAMA水凝胶的酶降解曲线图Fig.6 Enzymatic degradation kinetics of Dex-GTMAC-SA-DAMA hydrogels
2.6 水凝胶药物缓释表征
以累计水凝胶体外药物释放率对时间作图得到药物缓释曲线如图7所示.由图7可以看出,随着SA投料比的增加,洗必泰释放速率减小,这是由于水凝胶的交联密度增加引起的.在前期48 h处于爆释状态,Dex-GTMAC-SA-DA-MA(1∶1)和Dex-GTMAC-SA-DAMA(1∶2)水凝胶中的洗必泰缓释率分别达到43.2%和30.1%.爆释之后,负载药物开始缓慢地释放,在240 h后,两种水凝胶中的洗必泰缓释达到平衡,缓释率分别为68.4%和57.9%.

图7 Dex-GTMAC-SA-DAMA水凝胶的药物缓释动力学曲线Fig.7 Cumulative release kinetics of Dex-GTMAC-SA-DAMA hydrogels
2.7 水凝胶抗菌表征
Dex-GTMAC-SA-DAMA(1∶2)不载药水凝胶与载药水凝胶针对大肠杆菌和金黄色葡萄球菌的扩散法照片如图8所示.由图8可以看出,水凝胶对这两种菌种的抗菌效果类似.不载药的水凝胶也具有优越的抗菌活性,对大肠杆菌和金黄色葡萄球菌的抑菌圈宽度分别为(1.76±0.29)mm和(2.25±0.22)mm,抗菌性能达到6 d之久.这是由于Dex-GTMAC-SA-DAMA水凝胶是采用GTMAC以化学键与葡聚糖基体分子相连接的技术制备的抗菌水凝胶,不但抗菌性能优异,而且抗菌剂不会迁移渗出到外面,具有持久的抗菌性能.而载药的水凝胶对大肠杆菌和金黄色葡萄球菌的抑菌圈宽度分别为(4.12±0.34)mm和(3.57±0.39)mm,比不载药的抗菌圈更大,因而具有更优越的抗菌活性.这是由于广谱抗菌药物洗必泰在物理作用下渗出到水凝胶外面,因而抑菌圈明显比未载药的抑菌圈大.

(a) 大肠杆菌

(b) 金黄色葡萄球菌
2.8 水凝胶抗蛋白吸附表征
采用荧光光谱法来测定市售的德国保赫曼的德湿舒水凝胶敷料(Hydrosorb)、 Dex-GTMAC-SA-DAMA(1∶1)和Dex-GTMAC-SA-DA-MA(1∶2)水凝胶表面的蛋白吸附情况,结果如表2所示.由表2可以看出,Dex-GTMAC-SA-DAMA水凝胶的蛋白质吸附量远远低于Hydrosorb水凝胶敷料,表现出良好的抗蛋白吸附能力.这是由于Dex-GTMAC-SA-DAMA水凝胶采用的基材为葡聚糖,葡聚糖能有效地抑制蛋白质和生物体的吸附,具有很好的抗蛋白吸附性能[24].
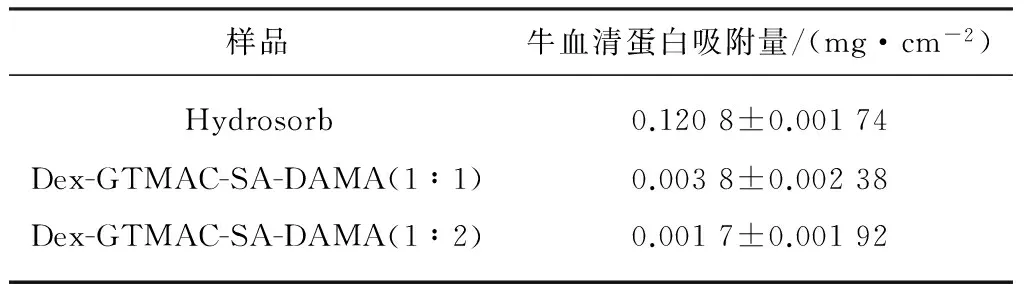
表2 不同水凝胶样品的牛血清蛋白吸附
3 结 论
(1) 采用无毒的光交联技术,通过原位光引发双键聚合,制备葡聚糖基水凝胶.
(2) 通过反应物投料比的不同,制备了不同交联度的水凝胶.随着丁二酸酐投料摩尔比的增加,水凝胶的交联度增大,其孔径减小,溶胀率降低,酶降解的失重率减小,药物缓释率和蛋白吸附量均减小.
(3) 通过化学接枝季铵盐分子及物理载入洗必泰抗菌药物,水凝胶达到双重抗菌的效果.
(4) 本文所制水凝胶符合理想型敷料应该具有的可吸收伤口渗出液、保持伤口接触面的温度及湿度、抗菌消炎、生物相容性好、抗蛋白吸附等优点,因此有望成为一种新型的生物可降解的抗菌水凝胶敷料.
[1] 杨丽丽,汤苏阳,田建广,等.新型创面敷料的研究现状与进展[J].社区医学杂志,2008(14):8-10.
[2] 吴健,郑裕东,刘向阳,等.医用敷料产业发展现状及前景分析与探讨[J].新材料产业,2011(10):70-76.
[3] 谈敏,李临生.敷料与人工皮肤技术研究进展[J].化学通报,2000(11):7-12.
[4] WANG T, ZHU X K, XUE X T, et al. Hydrogel sheets of chitosan, honey and gelatin as burn wound dressings[J]. Carbohydrate Polymers, 2012,88(1): 75-83.
[5] 秦益民.功能性医用敷料[M].北京:中国纺织出版社,2007.
[6] GIBAS I, JANIK H. Review: Synthetic polymer hydrogels for biomedical applications[J]. Chemistry & Chemical Technology, 2010, 4(4): 297-304.
[7] SCHMEDLEN R H,MASTERS K S, WEST J L. Photocrosslinkable polyvinyl alcohol hydrogels that can be modified with cell adhesion peptides for use in tissue engineering[J]. Biomaterials, 2002, 23(22): 4325-4332.
[8] YOSHII F, ZHANSHAN Y, ISOBE K, et al. Electron beam crosslinked PEO and PEO/PVA hydrogels for wound dressing[J]. Radiation Physics and Chemistry, 1999, 55(2): 133-138.
[9] YEO Y, BELLAS E, HIGHLEY C B, et al. Peritoneal adhesion prevention with an in situ cross-linkable hyaluronan gel containing tissue-type plasminogen activator in a rabbit repeated-injury model[J]. Biomaterials, 2007, 28(25): 3704-3713.
[10] BALAKRISHNANA B, MOHANTY M, UMASHANKAR P R,et al. Evaluation of an in situ forming hydrogel wound dressing based on oxidized alginate and gelatin[J]. Biomaterials, 2005, 26(32): 6335-6342.
[11] FRAZIER R A, MATTHIJS G, DAVIES M C, et al. Characterization of protein-resistant dextran monolayers[J]. Biomaterials, 2000, 21(9): 957-966.
[12] SUN G M, SHEN Y I, HO C C, et al. Functional groups affect physical and biological properties of dextran-based hydrogels[J]. Journal of Biomedical Materials Research Part A, 2010, 93(3): 1080-1090.
[13] VAN DIJK-WOLTHUIS W N E, FRANSSEN O, TALSMA H, et al. Synthesis, characterization, and polymeriza-tion ofglycidyl methacrylate derivatized dextran[J]. Macromolecules, 1995, 28(18): 6317-6322.
[14] CHIU H C, LIN Y F, HUNG S H. Equilibrium swelling of copolymerized acrylic acid-methacrylated dextran networks: Effect of pH and neutral salt[J]. Macromolecules, 2002, 35(13): 5235-5242.
[15] ZHANG X Z, WU D Q, CHU C C. Synthesis and characterization of partially biodegradable, temperature and pH sensitive Dex-MA/PNIPAAm hydrogels[J]. Biomaterials, 2004, 25(19): 4719-4730.
[16] 周轩榕,卢滇楠,邵曼君,等.表面接枝季铵盐型高分子材料抗菌过程的特性研究[J].高等学校化学学报,2003,24(6):1131-1135.
[17] 王邃,陶艳玲,陈丹峰等.胍类消毒剂的制备、性能与应用[J].广东化工,2009,36(9):58-61.
[18] WU D Q, LU B, CHANG C, et al. Galactosylated fluorescent labeled micelles as a liver targeting drug carrier[J]. Biomaterials, 2009,30(7): 1363-1371.
[19] SANTOS L S, THEODULOZ C, PILLI R A, et al. Antiproliferative activity of arborescidine alkaloids and derivatives[J]. European Journal of Medical Chemistry, 2009,44(9): 3810-3815.
[20] KOHMURA Y, MASE T. A highly stereoselective synthesis of optically active trisubstituted 1, 2-ethylenediamines: the first example of grignard addition to n-diphenylphosphinoyl ketimines derived from amino acids[J]. Journal of Organic Chemistry, 2004, 69(19): 6329-6334.
[21] QIN C Q, XIAO Q, LI H R, et al. Calorimetric studies of the action of chitosan-N-2-hydroxypropyl trimethyl ammonium chloride on the growth of microorganisms[J]. International Journal Biological Macromolecules, 2004, 34(2): 121-126.
[22] WU D Q, WU J, CHU C C. A novel family of biodegradable hybrid hydrogels from arginine-based poly(ester amide) and hyaluronic acid precursors[J]. Soft Matter, 2013, 9(15):3965-3975.
[23] RONJA M, GORAN F, MARTAIN M. Factors affecting enzymatic degradation of microgel-bound peptides[J]. Biomacromo-lecules, 2013,14(7):2317-2325.
[24] MCARTHUR S L, MCLEAN K M, KINGSHOTT P, et al. Effect of polysaccha-ride structure on protein adsorption[J]. Colloids and Surfaces B-biointerfaces, 2000, 17(1): 37-48.
