诸氏鲻虾虎鱼幼鱼饲料纤维素适宜含量的初步研究
2017-03-31魏远征林忠婷李建军
魏远征,林忠婷,李建军
(广东省实验动物监测所/广东省实验动物重点实验室,广东 广州 510663)
诸氏鲻虾虎鱼幼鱼饲料纤维素适宜含量的初步研究
魏远征,林忠婷,李建军
(广东省实验动物监测所/广东省实验动物重点实验室,广东 广州 510663)
为探讨纤维素含量对诸氏鲻虾虎鱼幼鱼生长的影响,配制了6种不同纤维素含量的配合饲料,饲喂60日龄幼鱼8周,测定存活率(SR)、增重率(WG)、特定生长率(SGR)、摄食率(FR)、饲料系数(FCR)和肥满度(FUL),切片观察各组虾虎鱼的肠道,并测定鱼体基本组分(粗蛋白、粗脂肪、水分和灰分)。结果表明,幼鱼SR随纤维素含量的增加逐渐下降;WG和SGR先上升后下降;FR持续上升,但组间无显著差异;饲料纤维素含量超过2.98%时,幼鱼FUL持续下降;纤维素含量由14.52%增加到20.63%时,FCR极显著增大。同时纤维素含量影响虾虎鱼幼鱼肠道形态,并对鱼体粗蛋白、粗脂肪含量有显著影响,但对水分、灰分均无显著影响。诸氏鲻虾虎鱼幼鱼饲料最适纤维素含量为6.74%。
诸氏鲻虾虎鱼;纤维素;生长;饲料利用
诸氏鲻虾虎鱼(Mugilogobius chulae)是一种广泛分布于香港、菲律宾、日本、泰国及西太平洋海域的暖水性底层小型海水鱼类,属鲈形目(Perciformes)、虾虎鱼亚目(Gobioide)、虾虎鱼科(Gobiidae)、鲻虾虎鱼属(Mugilogobius)[1]。该鱼具有个体小、性成熟时间短、繁殖力强、周年产卵、对有毒有害物质敏感等诸多实验动物开发优势,已广泛应用于海洋环境毒理学研究等领域[2-3]。
研究实验鱼的营养和饲料质量控制是实现实验动物标准化的条件之一,而纤维素作为饲料中的固有成分,是饲料质量控制的重要组成部分。适宜含量的纤维素能促进肠道的蠕动,同时可作为其他营养素的稀释剂和扩充剂,增大与消化酶的接触面积,提高消化率,进而促进鱼体对营养物质的吸收[4]。但过高含量的纤维素会抑制鱼的生长[5-6]。目前饲料纤维素适宜含量的研究多集中在具有经济价值的草食和杂食性鱼类,如草鱼(Ctenopharyngodon idella)[7]、罗非鱼(Oreochromis mossambicus)[5]、虹鳟(Salmo gairdneri)[6]等,对肉食性鱼类的研究非常有限。同时小型实验鱼类由于自身的特点,饲料开发难度较大,极少有针对纤维素适宜含量的研究。斑马鱼(Danio rerio)幼鱼商品饲料中纤维素含量通常不超过2%[8-9],剑尾鱼(Xiphophorus helleri)为5%[10]。由于适宜的纤维素含量受鱼种类、发育阶段等多种因素影响[11-12],且国内外尚无虾虎鱼的相关报道,因此饲料质量控制中需要开展诸氏鲻虾虎鱼适宜纤维素含量的研究。
本试验在前期营养需求研究(粗蛋白、粗脂肪等)的基础上,初步探讨饲料纤维素含量对虾虎鱼幼鱼生长性能和饲料利用的影响,以期为诸氏鲻虾虎鱼专用配合饲料的开发及相关标准的制定提供参考。
1 材料与方法
1.1 实验鱼和条件控制
以60日龄诸氏鲻虾虎鱼幼鱼进行饲喂试验,实验鱼为引种驯化的封闭群子9代(野生种群来源深圳大鹏湾)。试验开始前,每天投喂等量的卤虫和混合实验饲料,集中驯养1周。试验时集中禁食24 h,挑取规格均匀、健壮的幼鱼随机分为6组,每组3个重复,每个重复40尾,平均体重为0.019~0.024 g。
饲养环境为室内加装循环水系统的塑料水族箱(90 cm×45 cm×15 cm),条件控制为水温24~26℃,盐度22 ‰~26 ‰,pH≈7.5,氨氮 ≤ 0.5 mg/L,光周期12 h∶12 h。
1.2 饲料制备与投喂
以微晶纤维素作为饲料纤维素来源,添加量分别为0%、1%、4%、8%、16%、26%;白鱼粉和豆粕为蛋白质源;鱼油和豆油为脂肪源,分别配制相同粗蛋白、粗脂肪含量的6种饲料。所有饲料原料过孔径380 μm筛网后,制粒机(XL,常州市智阳机械设备有限公司)制粒。湿颗粒饲料烘箱70℃干燥后,密封分装于4℃保存备用。依据不同生长期虾虎鱼的口径,手工碾磨并过筛处理,以获得最适粒径的饲料(60~ 90日龄:0.3~0.5 mm;90~120日龄:0.6~0.8 mm)。
以上述0%微晶纤维素作为对照,其余5种配合饲料编号依次为Ⅰ~Ⅴ,饲料原料与基本生化组成见表1。投喂时间为每天9:00和16:00,投喂量以实验鱼20 min内吃完为宜。试验结束时,称5 g饲料放入实验缸中,10 min后回收,70℃烘干称重,计算饲料的溶失率以校正实际摄食量。每天吸污并补充定量海水,测量水质并观察鱼活动情况。

表1 饲料原料及基本成分(%)分析
1.3 幼鱼生长性能和饲料利用效果测定
8周生长实验结束时,计算实验鱼存活率(SR)、增重率(WG)、特定生长率(SGR)、摄食率(FR)、饲料系数(FCR)和肥满度(FUL):

采用SPSS软件进行单因素方差(One-way ANOVA)分析,计算不同饲料投喂对虾虎鱼生长的影响,差异显著时进行Duncan’s 多重比较。
1.4 饲料与鱼体成分的测定
每组取150 g饲料样品,参照GB 5009.5-2010、GB 5009.6-2003测定其粗蛋白、粗脂肪含量。粗蛋白含量采用凯氏定氮法,使用全自动定氮仪蒸馏装置(KDN-812,上海纤检仪器有限公司)测定样品含氮量,再乘以6.25;粗脂肪含量用乙醚溶剂,采用索氏抽提法进行提取。每个样品重复测定3次。饲料中的纤维素含量参照GB/T 5009.88-2008方法,采用酶解法进行测定。
试验结束后,禁食24 h,对各组虾虎鱼计数并称重,随机取其中15尾进行体长和全长的测定。测定结束后每组随机取20尾鱼麻醉处理(MS222,Sigma USA),匀浆后进行生化成分测定。全鱼水分、灰分、粗蛋白、粗脂肪成分的测定参照GB/T18654.10-2008的方法。其中样品水分含量在105℃烘箱中烘至恒重进行测定,灰分含量于马弗炉中550℃充分灼烧测定,其他成分测定方法与饲料测定方法相同。
1.5 组织切片的制备
8周生长实验结束时,各组取3尾虾虎鱼禁食24 h,于10% 中性福尔马林固定液中保存。常规石蜡包埋、固定后,切除头部和尾部,采用自动切片机连续切片(厚度5 μm),苏木精-伊红(HE)染色,中性树胶封片,Leica 显微镜观察并拍照。
2 结果与分析
2.1 幼鱼生长性能和饲料利用效果
8周生长实验结束时,60日龄诸氏鲻虾虎鱼幼鱼体重由0.019~0.024 g增加到0.128 ~0.179 g。各处理诸氏鲻虾虎鱼幼鱼的SR、WG、 SGR、FR、FCR和FUL测定结果见表2。纤维素含量0.85%时,幼鱼SR显著高于其他组;随着纤维素含量的增加,幼鱼SR逐渐下降。SGR和WG均先增大后减小,其中纤维素含量由0.85%增加到2.98%时,WG显著增大;由2.98%增加到7.23%时SGR显著增大;超过14.52%时均显著下降。纤维素含量为20.63%时FR最大,但各处理无显著差异。纤维素含量为7.23%时,FCR最小;由14.52%增加到20.63%时,FCR显著增大。FUL随纤维素含量的增加而减小。
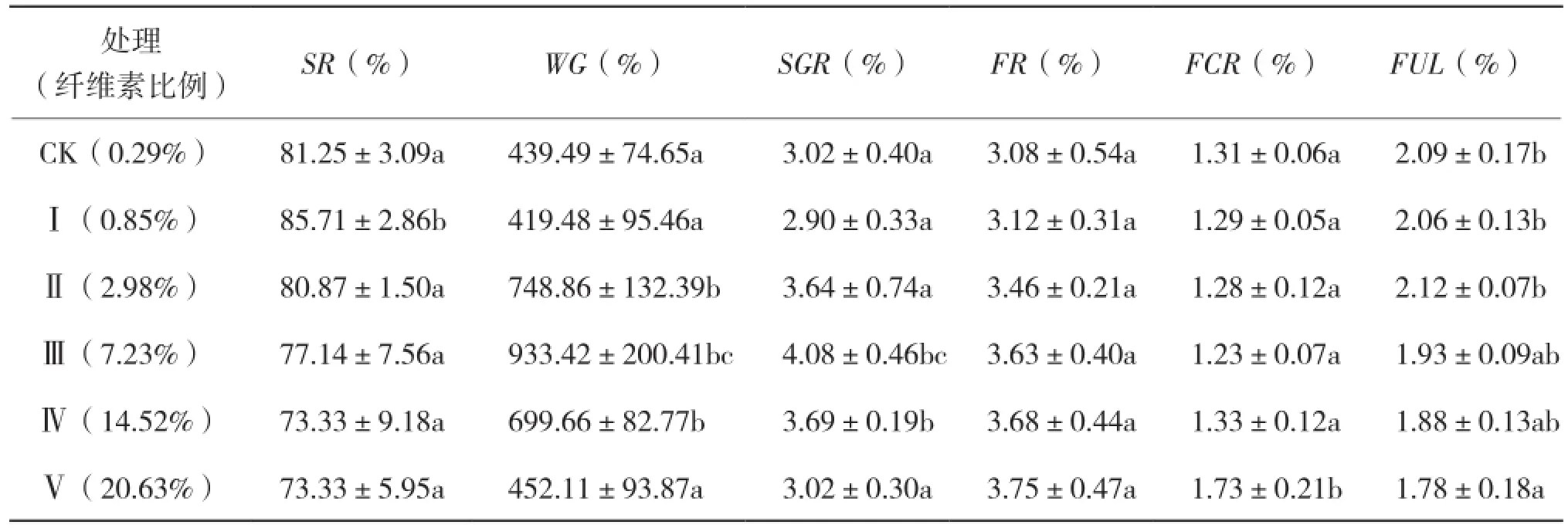
表2 饲料纤维素含量对虾虎鱼生长和饲料利用的影响
虾虎鱼幼鱼的生长参数(SGR、WG)和饲料利用效果(FR、FCR)与纤维素含量的相关性分析见图1。其中幼鱼SGR和WG的回归方程分别为:y=-0.0106x2+ 0.2203x+ 2.923(R2=0.8936)和y=-4.5661x2+ 93.291x+ 423.98(R2=0.8407),均随饲料纤维素含量的增加呈现先上升后下降趋势;SGR和WG最大时的纤维素含量分别为10.39%和10.22%。FR和FCR的回归方程分别为:y=-0.0026x2+ 0.0833x+ 3.104(R2=0.9258)和y=0.0027x2- 0.0364x+ 1.3349(R2=0.9752),FR随纤维素含量的上升而上升,FCR略下降后持续上升,且FCR最小时纤维素含量为6.74%(图1)。
2.2 幼鱼鱼体组分
8周生长试验结束时,对全鱼基本组分进行生化测定,结果(表3)表明,饲料纤维素含量对幼鱼全鱼水分、灰分均无显著影响;纤维素含量2.98%时,幼鱼粗蛋白含量最高;粗脂肪含量随纤维素含量的增加而下降,且由2.98%增加或超过7.23%时,粗脂肪含量显著下降;且纤维素含量超过7.23%时,各组间粗脂肪含量均存在极显著差异。
2.3 组织切片显微观察
大多数鱼类的食物储存、消化场所为前肠,吸收场所在中肠[13-14],因此8周试验结束时,切片观察虾虎鱼中肠(图2,封二)。中肠肠绒毛多数表现为指状、锥状、齿状,局部肠绒毛消失为平坦的肠壁;黏膜层和肌层厚度不均一,杯状细胞丰富。随着饲料纤维素含量的增加,多数肠绒毛由指状逐渐过渡到锥状、齿状,肠壁黏膜上皮细胞高度增加,末端刷状缘明显且平滑;同时靠近肠壁的黏膜固有层和肌层厚度逐渐增加。此外饲料纤维素含量超过7.23%时,肠绒毛上的杯状细胞显著减少。
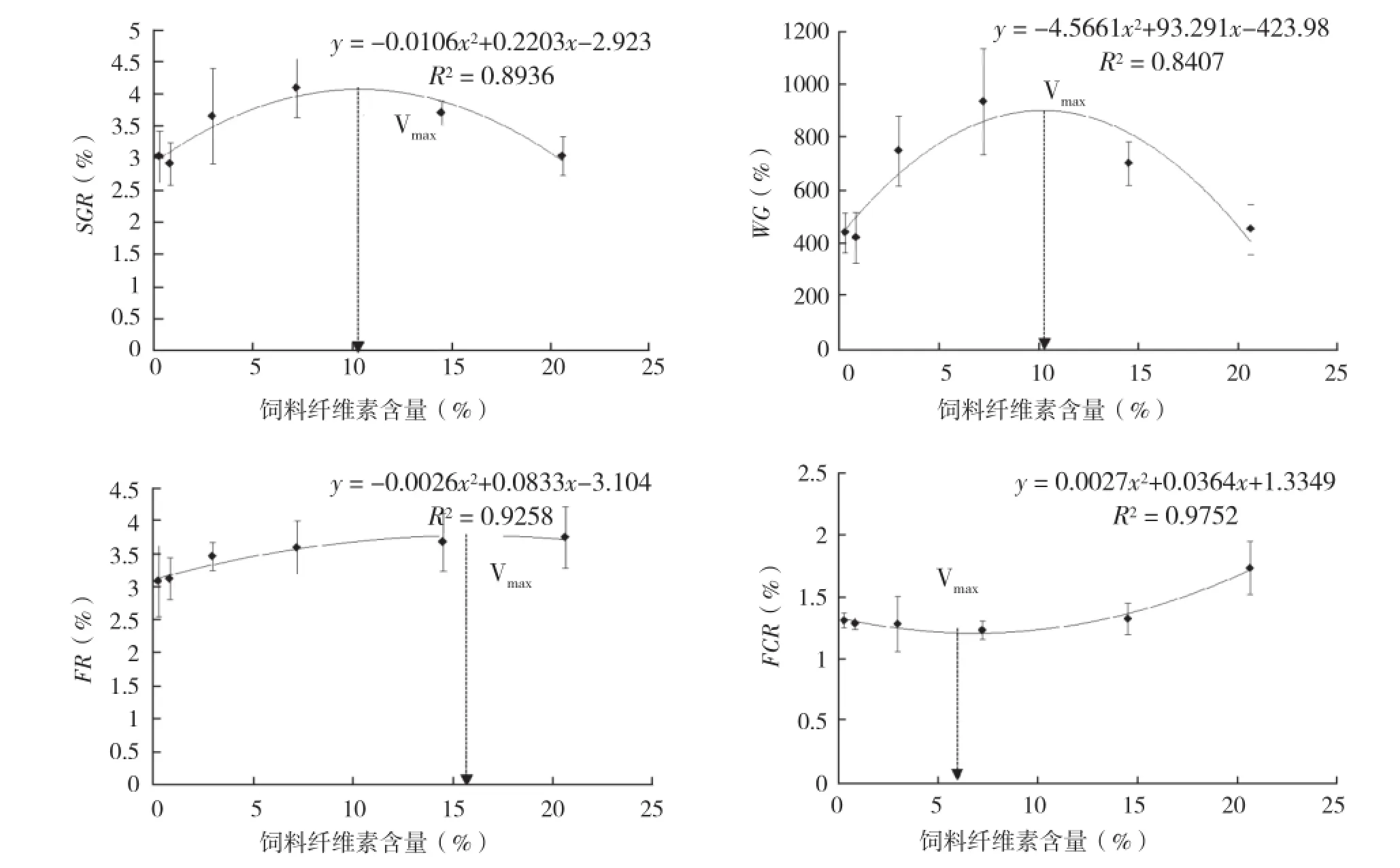
图 1 虾虎鱼幼鱼的生长参数和饲料利用效果与纤维素含量的相关性分析

表3 饲料纤维素含量对虾虎鱼全鱼组分的影响
3 讨论
3.1 诸氏鲻虾虎鱼的食性
通常认为肉食性鱼类饲料中最适纤维素含量为2%~8%,杂食性为8%~12%,草食性为12%~20%。例如,斑点叉尾鮰(Ictalurus punctatus)饲料中粗纤维含量通常不超过7%[15-16];饲料纤维素含量超过8%时,虹鳟(Salmo gairdneri)生长就受到抑制[6];不引起湖红点鲑(Salvelinus namaycush)和虹鳟(Salmo gairdneri)生长抑制的α-纤维素含量为8%[11],而南亚野鲮(Labeo rohita)为16%[12]。本研究中诸氏鲻虾虎鱼饲料纤维素含量为7.23%时,有较好的生长效果;纤维素含量增加到14.52%时,其生长也未受明显抑制,说明该鱼食性介于肉食和杂食,且具较好的可塑性。这与之前的研究相同,野生裸喉新虾虎鱼(Neogobius gymnotrachelus)、岩虾虎鱼(Gobius paganellus)、鳞虾虎鱼(Lepidogobius lepidus)食物组成中虾蟹、桡足类、端足类动物所占比例均超过80%,为典型的肉食性鱼类[17-18]。介于肉食和杂食的食性改变可能与室内长期驯化有关[19]。
3.2 饲料纤维素含量对幼鱼生长性能和饲料利用的影响
虾虎鱼幼鱼SR随饲料中纤维素含量的增加逐渐下降,可能与幼鱼消化道发育不完善、缺乏消化纤维素相关酶有关。幼鱼对饲料中纤维素含量的耐受性较成鱼低,如2 g规格的尼罗罗非鱼(Oreochromis niloticus)饲料中最适纤维素含量小于10%,而5 g规格的鱼苗为14.14%[20]。
幼鱼SGR和WG均随纤维素含量的增加先上升后下降,回归方程分析表明,SGR和WG最大时纤维素含量分别为10.39%和10.22%;但FCR最小时,纤维素含量为6.74%,说明幼鱼生长与饲料利用效果的最适纤维素量有差异。同时纤维素含量的增加导致FR持续增加,FUL持续下降,由于FUL是一个衡量鱼体能量储备水平的粗略指标,FUL的变化可预示鱼体营养状态的改变,因此纤维素含量对幼鱼生长、摄食和能量储存产生显著影响:纤维素含量过高会导致胃肠蠕动加快,消化酶与饲料的接触时间变短,进而导致消化率下降;消化率的下降又会对鱼体的营养摄入和积累产生影响。这与其他鱼的研究结果相同,21%纤维素添加组饲喂的斑点叉尾鮰(Ictalurus punctatus)的生长速度优于未添加组[21];虹鳟(Salmo gairdneri)饲喂高纤维素含量饲料时,饲料干物质的消化率显著下降[6];随着饲料纤维素含量的增加,虹鳟(Oncorhynchus mykiss)对饲料的干物质消化率、蛋白和能量利用率均下降[22]。同时本研究中纤维素含量由2.98%增加到7.23%时,幼鱼全鱼粗脂肪含量显著下降,且与FUL的变化趋势相同,同样证实纤维素含量对鱼体能量储存有影响,因此饲料适宜纤维素含量需要综合考虑生长性能和鱼体能量储存,不足或过量均对生长不利。
3.3 饲料纤维素含量对幼鱼肠道形态的影响
纤维素含量对虾虎鱼幼鱼肠道形态有影响,可能是肠道黏膜对纤维素刺激的一种适应性反应,这与大多数研究结果相同[23-24]:由于纤维素不被肠消化吸收,使肠壁蠕动时承受机械压力增大,肠黏膜厚度增加以增强对机械作用的承受能力。当饲料纤维素含量超过7.23%时,肠绒毛上杯状细胞GC含量显著减少,说明纤维素过多会导致消化率下降,进而影响营养物质的吸收。因此综合考虑生长、饲料利用效果以及形态指标的结果,诸氏鲻虾虎鱼幼鱼饲料中最适纤维素含量宜选用FCR回归分析结果,为6.74%。
本研究选用微晶纤维素作为饲料主要的纤维素源,由于来源单一以及单因素梯度法自身的缺陷,本试验存在一定的局限性。鉴于饲料碳水化合物组成的复杂性以及纤维素对饲料蛋白利用的影响,虾虎鱼配合饲料中纤维素含量的最适范围仍需进一步研究。
[1] 伍汉霖,钟俊生. 中国动物志硬骨鱼纲鲈形目(五)虾虎鱼亚目[M]. 北京:科学出版社,2008.
[2] 李建军,林忠婷,陈小曲,等. 四种重金属离子对诸氏鲻虾虎鱼的单一和联合毒性[J]. 海洋环境科学,2014(2):236-241.
[3] 李建军,吴美慧,叶惠欣,等. 不同发育期诸氏鲻虾虎鱼对钻井液的敏感性比较[J]. 中国比较医学杂志,2013,23(4):48-51.
[4] Ensminger M E,Oldfield J E,Heinemann W W. Feeds and nutrition digest:formerly,feeds and nutrition-abridged[M]. 1990.
[5] Dioundick O,Stom D. Effects of dietary α-cellulose levels on the juvenile tilapia,Oreochromis mossambicus(Peters)[J]. Aquaculture,1990,91(3):311-315.
[6] Hilton J,Atkinson J,Slinger S. Effect ofincreased dietary fiber on the growth of rainbow trout(Salmo gairdneri)[J]. Canadian Journal of Fisheries and Aquatic Sciences,1983,40(1):81-85.
[7] 毛永庆,蔡发盛,林鼎. 幼鲩(草鱼)对蛋白质、糖、脂肪、无机混合盐和纤维素日需要量的研究//鱼类学论文集第四辑[C].北京:科学出版社,1995:81-92.
[8] Rd S A,Garris H W,Jones W T,et al. Growth and survival of zebrafish(Danio rerio)fed different commercial and laboratory diets[J]. Zebrafish,2009,6(3):275-80.
[9] Lawrence C. The husbandry of zebrafish(Danio rerio):A review[J]. Aquaculture,2007,269(1-4):1-20.
[10] Tamaru C S,Cole B,Bailey R,et al. A manual for commercial production of the swordtail,Xiphophorus helleri[M]. Center for Tropical and Subtropical Aquaculture,2001.
[11] Poston H A. Response of lake trout and rainbow trout to dietary cellulose[R]. Center for Integrated Data Analytics,Wisconsin Science Center,1986.
[12] Ashraf M,Abbas S,Rehman M H,et al. Effect of different levels of α-cellulose on growth and survival of Rohu(Labeo Rohita)Fingerlings[J]. Global Journal of Animal Scientific Research,2014,2(4):321-326.
[13] 宋霖. 黄颡鱼和中华绒螯蟹胃肠道形态和功能对投饲的响应[D]. 苏州:苏州大学,2013.
[14] 李贵生,周黎华,梁旭方. 3H-亮氨酸在幼草鱼肠道中的吸收积累作用[J]. 水生态学杂志,2003,23(5):4-6.
[15] Lovell T. Nutrition and Feeding of Fish[J]. Aquaculture,1989,267(1-4):13-70.
[16] Robinson E H,Manning B B,Li M H. 12 Feeds and feeding practices[J]. Developments in aquaculture and fisheries science,2004,34:324-348.
[17] Grossman G D,Coffin R,Moyle P B. Feeding ecology of the bay goby(Pisces:Gobiidae). Effects of behavioral,ontogenetic,and temporal variation on diet[J]. Journal of Experimental Marine Biology and Ecology,1980,44(1):47-59.
[18] Skora K E,Rzeznik J. Observations on diet composition of neogobius melanostomus Pallas 1811(Gobiidae,Pisces)in the Gulf of Gdansk(Baltic sea)[J]. Journal of Great Lakes Research,2001,27(3):290-299.
[19] 陈乃松,肖温温,梁勤朗,等. 饲料中脂肪与蛋白质比对大口黑鲈生长,体组成和非特异性免疫的影响[J]. 水产学报,2012,36(8):1270-1280.
[20] 郝彦周,王瑞军,朱卫孝. 鱼类饲料中粗纤维适宜含量的研究概述[J]. 齐鲁渔业,2007(9):43-45.
[21] Dupree H K,Sneed K E. Response of channel catfish fingerlings to different levels of major nutrients in purified diets[R]. Center for Integrated Data Analytics Wisconsin Science Center,1966.
[22] Glencross B. The influence of soluble and insoluble lupin non-starch polysaccharides on the digestibility of diets fed to rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture,2009,294(3):256-261.
[23] Navarrete P,Fuentes P,la Fuente L,et al. Shortterm effects of dietary soybean meal and lactic acid bacteria on the intestinal morphology and microbiota of Atlantic salmon(Salmo salar)[J]. Aquaculture Nutrition,2013,19(5):827-836.
[24] 陆红佳,张磊,刘金枝,等. 纳米甘薯渣纤维素对高脂膳食大鼠肠道内环境及形态的影响[J]. 食品科学,2015(5):172-178.
(责任编辑 崔建勋)
Preliminary study on suitable cellulose content in formulated diet for juvenile Mugilogobius chulae
WEI Yuan-zheng,LIN Zhong-ting,LI Jian-jun
(Guangdong Laboratory Animals Monitoring Institute/ Key Laboratory of Guangdong Laboratory Animals,Guangzhou 510663,China)
To assess the effects of cellulose level on growth and feed efficiency of juvenile goby(Mugilogobius chulae)and provide reference for exploitation of compound feed and the relevant standards development process,six purified diets with different cellulose levels,that is CK(0.29%),Ⅰ(0.85%),Ⅱ(2.98%),Ⅲ(7.23%),Ⅳ(14.52%)and Ⅴ(20.63%)were formulated. The protein and lipid contents were kept constant in all diets. At the end of 8 weeks growth experiment,Survival rate(SR),Weight gain(WG),Specific growth rate(SGR),Feed conversion ratio(FCR),Feeding rate(FR)and Fullness(FUL)were measured. Gobys’ intestinal morphology and body compositions with different diertary cellulose levels were also measured. The results showed that juvenile fishes’ SR decreased with the rising of cellulose levels. The SR of I(0.85%)was significant different with other groups(P<0.05). All groups’ WG and SGR showed upgraded firstly and then decreased with the increase of dietary cellulose. When cellulose level increased to 7.23%,WG and SGR reached a maximum. Though the FR highly increased related to the increase of cellulose,there was no significant difference among groups. When dietary cellulose content increased to 20.63%,FCR significantly increased(P<0.05). The FUL continuously decreased when dietary cellulose exceeded 2.98%. Meanwhile,dierary cellulose content had effects on the development of goby’s intestinalmorphology. The whole body crude protein and lipid were also significantly influenced(P<0.05)by dietary cellulose,but mositure and ash were not influenced. The optimum cellulose content in diet for juvenile M. chulae is 6.74%.
Mugilogobius chulae;cellulose;growth;feed utilization efficiency
S963.1
A
1004-874X(2017)01-0149-07
2016-11-02
广东省科技计划项目(2014A030304033);国家科技支撑计划项目(2015BAI09B05)
魏远征(1987-),男,硕士,研究实习员,E-mail:yzwei87@163.com
李建军(1972-),男,硕士,高级工程师,E-mail:ljj@gdlami.com
魏远征,林忠婷,李建军. 诸氏鲻虾虎鱼幼鱼饲料纤维素适宜含量的初步研究[J].广东农业科学,2017,44(1):149-155.
