三唑磷农药降解酶的定位及酶学性质研究
2017-03-31汤鸣强陈淑贤
汤鸣强,陈淑贤
(福建师范大学福清分校海洋与生化工程学院,福建 福清 350300)
三唑磷农药降解酶的定位及酶学性质研究
汤鸣强,陈淑贤
(福建师范大学福清分校海洋与生化工程学院,福建 福清 350300)
采用超声波破碎法破碎三唑磷农药降解菌芽孢杆菌TAP-1,研究不同细胞组分对三唑磷农药的降解率,应用液相色谱法研究三唑磷农药降解酶的酶学性质。结果表明,胞外酶、胞间粗酶液和胞内酶对三唑磷的降解率分别为2.8(±0.34)%、12.8(±2.44)%和84.4(±6.71)%。菌株TAP-1降解三唑磷农药的主要活性物质位于降解菌细胞内,属于胞内酶组分。该酶最适作用pH值为6.5~7.0,在pH 5.0~7.5之间,酶活力均能保持在最高酶活力的68%以上。最适反应温度为30℃,在25~40℃温度范围内能保持75%以上的降解活性。不同化学试剂和金属离子对酶活性产生不同的影响。巯基修饰剂、EDTA、Hg2+和Mn2+对酶活性有抑制作用。Mg2+、Co2+和Fe3+对酶活性有促进作用。该降解酶米氏常数(Km)为23.02 μmol/L,最大反应速度(Vmax)为 0.738 μmol/mg·min。
三唑磷降解菌TAP-1;降解酶;酶定位;酶学特性
三唑磷(Triazophos,TAP)是1971年由原西德Farbwerke Hoechs公司开发出来的高效、中毒、广谱的有机磷类杀虫杀螨剂,对粮、棉、果、蔬菜等主要农作物上的许多重要害虫如螟虫、稻飞虱、蚜虫、红蜘蛛、棉铃虫、菜青虫和线虫等有良好的防治效果。研究发现,与传统有机磷农药相比,三唑磷表现为对水稻植株有很强的渗透性、对害虫有较高的胃毒活性和杀卵能力等特点[1],因此,对常见的水稻危害害虫如二化螟和三化螟有较强的触杀活力,从而被大量应用于水稻害虫的防治,目前已成为长江流域防治水稻螟虫的主打药品[2]。我国于20世纪80年代中后期引入三唑磷农药。近年来,随着甲胺磷等5种高毒有机磷农药被禁止生产与流通,三唑磷等农药的需求量呈现上升的趋势。目前,我国已成为三唑磷农药生产、使用及出口大国。
然而,随着这类农药的大量使用,其对生态环境与人类健康的负面影响不容忽视。已有文献报道,三唑磷对蜜蜂和多数鱼类高毒,对土壤微生物生态等也造成了一定的危害[3]。高浓度的三唑磷还可能具有较强的诱变效应。近年来,我国部分养殖海域采用三唑磷作为清埕杀菌和消除虫害的常用农药,直接导致了它通过地表径流进入水体,从而对海洋生态系统造成威胁。此外,三唑磷在水稻害虫防治上的大量使用也导致了稻米中三唑磷残留量的增加。还有研究发现,三唑磷进入水体环境后,由于藻类的累积作用,可通过食物链转移到上一个营养级,对水生生态系统和人类健康有更大的风险[4]。
微生物是生物修复的重要资源,利用微生物及其产生的降解酶处理环境中有机磷农药的方法,已显示出良好的应用前景,是近年来研究有机磷农药降解的主要发展方向[5]。大多数微生物降解农药的反应属于酶促反应,降解酶的农药处理技术具有成本低、效果好、无二次污染、不会受到土著微生物排斥等特点,已被用于杀虫剂和除草剂的处理[6-7]。目前在农药酶降解领域研究比较广泛的是菊酯类农药、三氮苯类农药和有机磷类农药等[8-10]。尽管国内外学者从不同环境中分离到许多有机磷农药的降解菌,但是,有关三唑磷农药微生物降解的研究还少见报道。国内外已分离的三唑磷降解菌主要有苍白杆菌(Ochrobactrum sp.)和伯雷克氏菌(Klebsiella sp.)等[1,11],主要研究了这些菌株的降解特性及降解途径等,鲜见对三唑磷降解酶的研究。
本课题从福建建瓯福农生化有限公司污水处理池活性污泥及其出水口污泥中,通过富集培养基和基础培养基驯化培养分离到5株对三唑磷农药有较高降解率的细菌菌株,采用生理生化实验结合16S rDNA序列比对的方法将降解率最高的菌株鉴定为芽孢杆菌TAP-1(Bacillus sp. TAP-1),通过室内摇瓶发酵法确定菌株的生长与降解特性(另文发表)。本试验采用液相色谱技术,分析TAP-1菌株三唑磷降解酶成分在细胞中的位置,并研究降解酶的酶学性质,为降解酶的实际应用奠定基础,也为有机磷农药污染的生物治理提供理论参考和技术支持。
1 材料与方法
1.1 试验材料
供试菌株:芽孢杆菌TAP-1 (Bacillus sp. TAP-1),在Genbank上的注册登录号为HQ156466。
主要试剂:三唑磷(Triazophos,纯度>98%)购自上海市农药研究所。甲醇(色谱纯)购自德国Merck公司。种子液培养基:胰蛋白胨5.0 g,酵母膏5.0 g,KH2PO41.0 g,去离子水1L,pH 7.0。发酵培养基:牛肉浸膏3.0 g,胰蛋白胨10.0 g,NaCl 5.0 g,葡萄糖5.0 g,去离子水1 L,pH 7.0~7.2。
主要仪器:L-2000日立高效液相色谱仪,配有L-2400紫外检测器,L-2130 蠕动泵;色谱柱:Apollo-C8 (250×4.6 mm,i.d.,5μm);DHG-9070A型电热恒温鼓风干燥箱:上海一恒科技有限公司;THZ-C-1台式冷冻恒温振荡器:太仓市试验设备厂;UV-9100紫外分光光度计:北京瑞利分析仪器公司;SCIENTE-IID超声波细胞粉碎机:宁波新芝生物科技股份有限公司;105810R冷冻离心机:德国Eppendorf公司;ALPHAI-2冷冻干燥机:北京博医康实验仪器有限公司。
1.2 降解菌的培养与降解酶的提取
取活化的TAP-1菌株于100 mL种子液培养基中,32℃、180 r/min培养16 h,15℃,8 000 r/min离心5 min,收集菌体,用pH 7.5、0.2 mmol/L Tris-HCl洗涤3次,用灭菌的双蒸水重悬菌体,调整OD600≈2.0,按2%的接种量(V/ V)转接到100 mL液体发酵培养基中,32℃、180 r/min培养72 h。
经培养的菌液离心后用pH 7.5、20 mmol/L Tris-HCl洗涤3次,按照菌体:缓冲液=1∶4的比例将菌体悬浮于pH 7.5、20 mmol/L Tris-HCl缓冲液中,混合均匀后置于冰浴中用超声波处理15 min,功率为280 W,频率为破碎4 s,间隔9 s,4℃、11 000 r/min离心10 min,除去细胞碎片得降解酶粗酶液。
1.3 酶活性测定
在860 μL pH 7.2、20 mmol /L Tris-HCl缓冲溶液中加入50 μL 500 mg/L三唑磷标准溶液,37℃水浴预热10 min,加入50 μL预热的粗酶液,100 r/min水浴反应1 h,用40 μL 6 mol/L HCl终止反应,每处理重复3次,以50 μL 上述缓冲液代替酶液为对照,计算降解酶活力。酶活力单位定义为:在37℃,pH 7.2条件下,每分钟降解1 μmol三唑磷的酶用量定义为一个酶活力单位(U)。
1.4 酶学性质的测定
在不同温度、pH及不同化学物质下检测酶对三唑磷的降解效率,获得降解酶的最适反应温度、最适作用pH及金属离子化学物质对酶活性的影响。取三唑磷溶液(浓度为20 mg/L)于离心管中,在不同温度(分别为20、25、30、35、40、45和50℃)、pH (5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)、金属离子(Fe3+、Zn2+、Hg2+、Co2+、Mg2+、Mn2+)及化学试剂(十二烷基硫酸钠、巯基乙醇、吲哚乙酸、二硫赤藓糖醇、乙二胺四乙酸、特里通、谷胱甘肽、碘乙酸、对氯高汞苯甲酸、N-乙基马来酰亚胺)下进行酶促反应,分别测定酶活力,以最高酶活力为100%,其他条件下的酶活力与之相比得各自相对酶活力。
将酶液在pH 7.2、20 mmol/L Tris-HCl缓冲液中,于-20、4、20、30、40、50和60℃条件下处理1 h,测定剩余酶活力。将菌体分别悬浮在pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、 9.5、10.0、10.5和11.0的缓冲液(pH 5.0~6.5用40 mmol/L Na2HPO4-0.1mol/L柠檬酸缓冲液,pH 7.0~8.5用20 mmol/L Tris-HCl缓冲液,pH 9.0~11.0用40 mmol/L 甘氨酸-NaOH缓冲液)中,于超声波破碎后得到的粗酶液32℃保温1 h后,分别测定其在pH 7.2、32℃下的剩余酶活力。最适条件下酶活力定义为100%,推算出其他条件下的相对酶活力,研究三唑磷降解酶对温度的耐受性和pH稳定性。
将不同浓度三唑磷(200、250、300、350、450 和500 mg/L)作底物,加入到pH 7.2、20 mmol/L的Tris-HCl缓冲液体系中,32℃下反应测定酶反应速度,运用Lineweaver-Burk作图法求米氏常数(Km)和最大反应速度(Vmax)。
1.5 蛋白质浓度的测定
粗酶液的蛋白含量按Bradford法测定[12],以BSA作为标准蛋白。
1.6 三唑磷浓度的测定
取三唑磷降解液5 mL,4℃,8 000 r/min离心10 min得上清液。取上清液2 mL,用3×2 mL二氯甲烷液-液分配萃取2 h,取下层有机相风干后加入等量甲醇供HPLC分析。HPLC工作条件为流动相:甲醇:水=80:20;流速:1.0 mL/min;进样量:20 μL;检测波长:246 nm;时间:15 min;保留时间:约5.89 min。
用Excel 2003和SPSS 15.0软件对试验数据进行单因素方差分析,差异显著性分析采用LSD多重比较法。
2 结果与分析
2.1 菌株TAP-1三唑磷降解酶的定位
微生物农药降解酶的分布可能在胞内,也可能在胞膜或胞外[13]。近年国内报道的一些有机磷农药降解酶主要是胞内酶[14-15]。以浓度为40 mg/L的三唑磷为底物分别测定不同粗酶液对三唑磷的降解率。结果(图1)表明,菌株TAP-1发酵后细胞不同部位提取液对三唑磷的降解率差异显著。菌株TAP-1胞外粗酶液、胞间粗酶液和胞内粗酶液对三唑磷的降解率分别为2.8(±0.34)%、12.8(±2.44)%和84.4(±6.71)%,胞外和胞间粗酶液酶活明显低于胞内粗酶液。说明菌株TAP-1三唑降解酶属于胞内蛋白组分。

图1 细菌TAP-1三唑磷降解酶的定位
2.2 最适酶促反应温度的确定
温度对酶促反应速度影响很大,在最适温度范围内,降解酶活力最大,酶促反应速度最快。图2表明,温度为30℃时,降解酶表现出最强的降解活性,即该降解酶对三唑磷的最适降解温度为30℃。在25~40℃温度范围内该降解酶均具有较好的降解活性,粗酶活力都能保持最高活力的75%以上,显示了该酶对温度的较好适应性。但在50℃时,酶活性迅速降低,降低到最高酶活力的10.8%。

图 2 温度对三唑磷酶促降解的影响
2.3 最适酶促反应pH的确定

图 3 pH对三唑磷酶促降解的影响
由图3可知,不同酸碱条件对粗酶活性有较大影响。粗酶降解三唑磷的最适pH值范围为6.5~7.0,在pH 5.5~7.5之间粗酶能保持最高活力的68%以上,但pH>7.5时,粗酶活力有明显下降的趋势。
2.4 金属离子及有机试剂对酶的影响
不同的金属离子和有机试剂会对酶组分产生不同的影响,从而促进或抑制酶的作用。试验结果(表1)表明,巯基修饰剂如巯基乙醇(Mercaptoethanol)、碘乙酸(IAA)、对氯高汞苯甲酸(PCMB)、N-乙基马来酰亚胺(NEM)对该酶有强烈的抑制作用,表明巯基基团可能涉及到酶的活性中心。EDTA对酶活的影响也较大,是因为EDTA是一种络合剂,可与金属离子形成络合物。已报道的有机磷农药降解酶多数为金属酶,加入EDTA会与酶活性中心的金属离子螯合,从而降低了酶的活性。不同的金属离子对酶的活性产生不同的影响。Mg2+和Co2+对酶活有明显的激活作用;Fe3+对酶活有一定的促进作用;而Hg2+和Mn2+对该酶活有强烈的抑制作用,其他金属离子和有机溶剂对酶活无明显影响。
2.5 三唑磷降解酶对温度的耐受性
从图4可以看出,粗酶在-20℃和4℃时保存最为稳定,处理1 h后粗酶仍能保持最高酶活力的98%左右。粗酶活力随着保存温度的升高而降低,20℃下处理1 h与30℃下处理1 h酶活力分别保持原有酶活力的85.5%和83.3%,二者间没有显著差异。之后,粗酶活力随着保存温度的进一步升高而呈现明显下降的趋势。40℃、50℃和60℃下处理1 h,粗酶活力分别下降到最高活力的61.3%、34.5%和11.2%,与低中温处理差异显著。可见,温度对粗酶活性的影响较大,较高的温度可使降解酶变性失活。
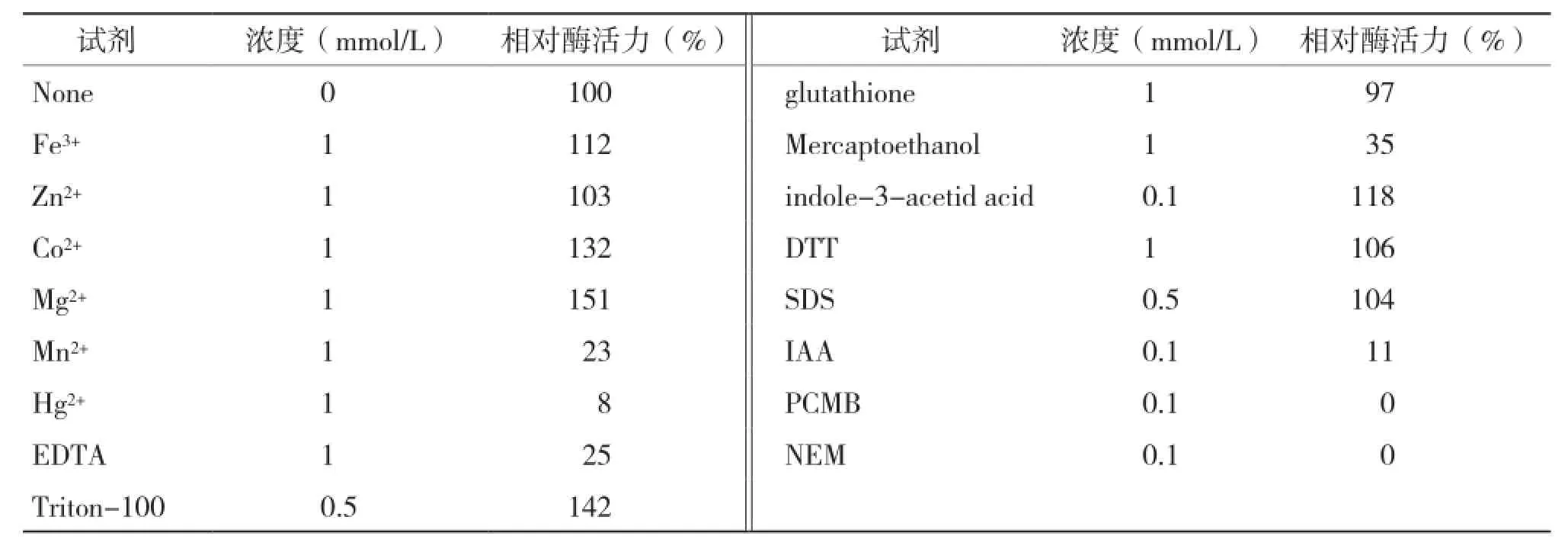
表1 各种化学物质对酶活力的影响

图 4 粗酶对温度的耐受性
2.6 粗酶的pH稳定性
图5表明,用pH为6.5~7.5的缓冲体系处理酶液1 h后,粗酶的剩余酶活力保持90%以上,在pH为8.0的缓冲体系中保存1 h后,酶活力损失不到40%,而在pH为8.5的环境中保存1 h后,酶活力损失近77%。之后,随着缓冲体系pH的升高,粗酶液的剩余酶活力进一步下降,直至为0。
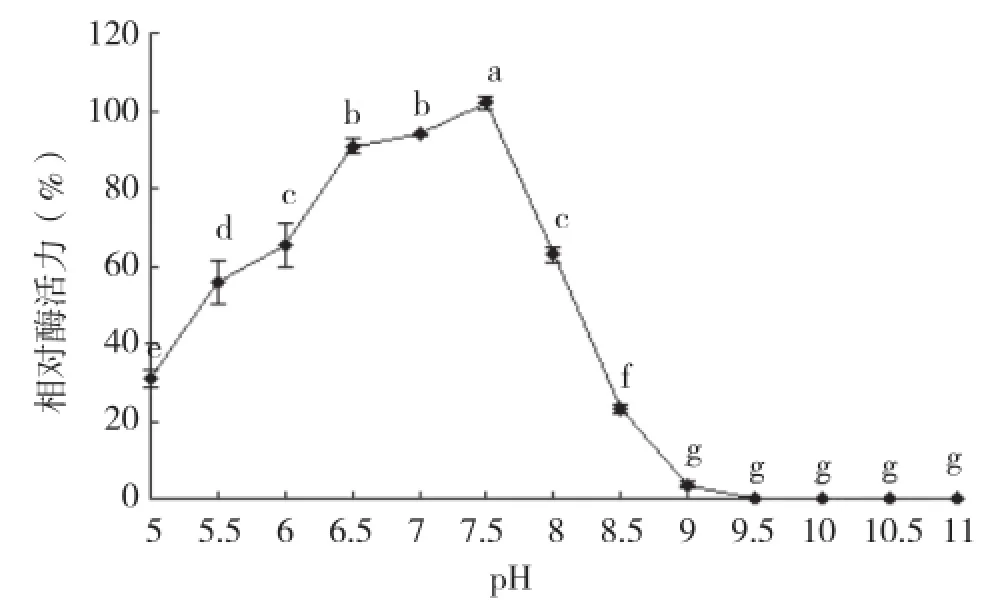
图 5 粗酶对pH的耐受性
2.7 三唑磷降解酶动力学常数
动力学常数可以反映酶与底物的关系,是区别不同反应底物的重要特征性常数。用pH 7.2、20 mmol/L Tris-HCl缓冲液调节三唑磷溶液使之浓度为200、250、300、350、450 和500 mg/L,在32℃水浴中预热10 min后加入50 μL酶液,32℃、100 r/min条件下反应30 min,以不加粗酶液作为对照,计算反应体系中三唑磷的降解速度,以三唑磷浓度的倒数为横坐标,以速度的倒数为纵坐标作Lineweaver-Burk图。结果(图6)表明,三唑磷降解酶米氏常数为23.02 μmol/L,最大反应速度为 0.738 μmol/ mg·min。以牛血清白蛋白为标准蛋白制作标准曲线,在波长595 nm下比色测定,测得粗酶液中可溶性蛋白含量为2.31 g/L。因此,粗酶对三唑磷的最大降解速率为0.319 μmol/mg·min。

图 6 三唑磷降解酶的Lineweaver-burk 图
3 结论与讨论
微生物酶制剂在生物修复方面的成功与否是由多种因素决定的,农药降解酶与所有酶蛋白一样,对于环境条件很敏感。其中,环境温度、pH及重金属离子的种类与浓度等是影响酶制剂作用效果的重要因素。试验结果表明,施氏假单胞菌J7-4 (Pseudomonas stutzeri)有机磷农药降解酶为胞内酶,最适pH为9.0,最适反应温度为45℃。Mg2+、Ca2+等金属离子对其有激活作用,而Mn2+、Fe3+、Zn2+、Al3+、Hg+、Cd2+、Ba2+和Ag+对该酶有强烈的抑制作用[14]。黑曲霉ZHY256乐果降解酶的最适作用温度与pH分别为50℃、7.0,pH 稳定范围为6.0~9.5[16]。有机磷降解酶OPHC2降解甲基对硫磷的最适温度为65℃,最适pH为9,该酶具有很好的热稳定性和pH稳定性,并且对大多数金属离子和化学试剂不敏感[17]。源自真菌的甲基对硫磷和内吸磷降解酶为胞内酶,酶的最适反应温度为45℃,最适pH 7.5,在50℃以下、pH 6.0~9.5范围内活性稳定[18]。同样为胞内酶的毒死蜱降解酶具较好的热稳定性和酸碱稳定性,最适反应温度为40℃,最适作用pH值为 6.8[19]。
本试验对三唑磷降解酶最适反应温度和最适反应pH以及粗酶液的热稳定性、pH稳定性分别进行了研究,为降解酶制剂的规模化生产和应用提供理论依据和技术支持。试验表明,三唑磷降解酶的最适作用温度为30℃,最适作用pH范围为6.5~7.0,pH≥8.0时,粗酶活力有明显下降的趋势。Co2+对酶活有明显的激活作用,进一步说明了Co2+可能作为三唑磷降解酶辅酶成分。表面活性剂Triton-100通过改善细胞表面通透性,促使酶活性的增加。Hg2+、Mn2+、EDTA以及巯基乙醇等巯基修饰剂强烈抑制酶的活性,表明巯基基团可能涉及到酶的活性中心。动力学常数Km值和Vmax体现了酶与底物结合的牢固程度和酶的特异性质,对于研究酶的生理生化功能和催化方向有重要的指导意义。本试验以三唑磷为底物,得到米氏常数为23.02 μmol/L,最大反应速率为0.738 μmol/mg·min,为进一步研究三唑磷降解酶的酶学性质提供了理论依据。
同已有报道的有机磷降解酶相比,本研究从芽孢杆菌TAP-1中提取的粗酶在酶学特性上存在差异,这可能与菌株的遗传性差异、农药本身的化学结构特性以及酶促反应体系不同有关。为了进一步阐明该酶的作用机理,有必要开展酶的分离纯化工作,并且通过固定化和添加酶活性保护剂等方法,为降解酶的实际应用奠定基础。
[1] 戴青华,张瑞福,蒋建东,等. 一株三唑磷降解菌mp-4 的分离鉴定及降解特性的研究[J].土壤学报,2005,42 (1):120-124.
[2] 杨英利,朱小燕,李爱民,等. 3 种淡水藻对三唑磷的降解研究[J]. 环境科学研究,2007,20 (1):85-89.
[3] 邹小明,朱立成,肖春玲,等. 三唑磷的土壤微生物生态效应研究[J]. 农业环境科学学报,2008,27(1):238-242.
[4] 秦曙,乔雄梧,王霞,等. 三唑磷原药及其中相关杂质治螟磷的水解特性研究[J]. 农药学学报,2009,11(1):126-130.
[5] 李冠喜,吴小芹,叶建仁. 多噬伯克霍尔德氏菌WS-FJ9 对草甘膦的降解特性[J]. 生态学报,2013,33(21):6885-6894.
[6] Gomez Jimenez-TR,Moliterni E,Rodriguez L,et a1. Villasefior feasibility of mixed enzymatic complexes to enhanced soil bioremediation processes[J]. Procedia Environmental Sciences,2011(9):54-59.
[7] Goutami B,Scott Craig J S,Walton J D. Improving enzymes for biomass conversion:A basic research perspective[J]. Bioenergy Research,2010,3(1):82-92.
[8] 黄皓,梁卫驱,李艳芳,等. 菊酯类农药降解酶基因原核表达条件的优化[J]. 广东农业科学,2015,42(10):76-79.
[9] 刘幽燕,鄢恒宇,李青云,等. 一株产碱杆菌DN25中降氰酶的提取和特性研究[J]. 环境科学与科技,2008,31(5):11-13.
[10] Rutwik RMT,Sivakami S. Degradation of chlorpyrifos by an alkaline phosphatase from the cyanobacterium Spirulina platensis[J]. Biodegradation,2010,21(4):637-644.
[11] 王丽红,张林,陈欢林. 三唑磷降解菌的筛选及其降解途径研究[J]. 生物工程学报,2005,21(6):954-959.
[12] Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal. Biochem. ,1976,72:248-254.
[13] 张娜,郭庆启,刘晓飞,等. 甲胺磷生物降解酶对韭菜中农残生物修复效果研究[J]. 中国林副特产,2013(3):9-11.
[14] 王继雯,甄静,刘莹莹,等. 一株有机磷农药高效降解菌的筛选及酶学性质研究[J]. 中国农学通报,2013,29 (21):83-87.
[15] 王继雯,刘莹莹,李冠杰,等. 黑曲霉J6有机磷农药降解酶固定化条件的研究[J]. 中国农学通报,2014,30 (6):285-289.
[16] Liu Y H,Chung Y C,Xiong Y. Purification and characterization of a dimethoate-degrading enzyme of Aspergillus niger ZHY256,isolated from sewage[J]. Appl Environ Microbiol. ,2001,67 (8):3746-3749.
[17] 伍宁丰,邓敏捷,史秀云,等. 一种新的有机磷降解酶的分离纯化及酶学性质研究[J]. 科学通报,2003,48(23):2446-2450.
[18] 刘阳,刘玉焕,陈志仕,等. 米曲霉LY-128广谱有机磷农药水解酶的纯化和鉴定[J]. 菌物系统,2003,22(4):557-564.
[19] 谢慧,朱鲁生,王军,等. 真菌WZ-1对有机磷杀虫剂毒死蜱的酶促降解研究[J]. 环境科学,2005,26 (6):164-168.
(责任编辑 杨贤智)
Distribution and properties of triazophos-degrading enzyme
TANG Ming-qiang,CHEN Shu-xian
(School of Ocean and Biochemical Engineering, Fuqing Branch of Fujian Normal University, Fuqing 350300, China)
To investigate the effects of different fractions of bacterial strain Bacillus TAP-1 on the degradation rate of tirazophos, sonication method was applied to lyse the TAP-1 cells to obtain triazophos-degrading enzyme,while HPLC(High Performance Liquid Chromatography)method was used to determine the enzymatic properties. The results showed that the degradation rate of triazophos by intracellular, intercellular and extracellular extracts were 84.4(±6.71)%, 12.8(±2.44)%, and 2.8(±0.34)%, respectively. The active substances of triazophos-degrading were intracellular fractions. The enzyme demonstrated greatest enzymatic activity in the pH range of 6.5-7.0 with its highest activity occurring in the pH range of 5.0-7.5. Enzymatic activity occurred at an optimum temperature of 30℃ for the degradation of triazophos;activity remained above 75% of the maximum over a temperature range of 25℃-40℃. Different chemicals and metallic ions also had different effects on its activity. Its activity can be strongly inhibited by thiol modifier, ETDA, Hg2+and Mn2+, but stimulated by Mg2+,Co2+and Fe3+. The Km value and the maximal degradation rate of triazophos-hydrolase were 23.02 μmol/L and 0.738 μmol/mg·min, respectively.
triazophos-degrading bacteria TAP-1;degrading enzyme;enzyme localization;enzymatic property
X592
A
1004-874X(2017)-01-0115-07
2016-10-11
福建省自然科学基金(2012J01118)
汤鸣强(1966-),男,博士,教授,E-mail:mqt-1022@163.com
汤鸣强,陈淑贤. 三唑磷农药降解酶的定位及酶学性质研究[J].广东农业科学,2017,44(1):115-121.
