紫色马铃薯花色苷稳定性研究
2017-03-28王亚云徐华容樊志霞郭鲜蒲阮金兰
王亚云,徐华容,袁 锴,樊志霞,郭鲜蒲,阮金兰
(1武昌理工学院生命科学学院/生物多肽糖尿病药物湖北省协同创新中心,武汉 430223;2武汉工程大学化工与制药学院,武汉 430073)
紫色马铃薯花色苷稳定性研究
王亚云1,2,徐华容1,2,袁 锴1,樊志霞1,郭鲜蒲1,阮金兰1,2
(1武昌理工学院生命科学学院/生物多肽糖尿病药物湖北省协同创新中心,武汉 430223;2武汉工程大学化工与制药学院,武汉 430073)
探讨pH、光照、温度、氧化剂、还原剂、金属离子、防腐剂对紫色马铃薯花色苷理化稳定性的影响。结果表明:紫色马铃薯花色苷只有在酸性条件下才可以稳定存在;对光、热敏感,稳定性差;氧化剂和还原剂对紫色马铃薯花色苷有较大的破坏作用;Na+、Fe2+对紫色马铃薯花色苷有破坏作用,Mg2+、Mn2+、Cu2+可起到一定辅色作用;苯甲酸钠对紫色马铃薯花色苷稳定性影响不大,抗坏血酸具有减色作用。在今后的加工或贮藏中,应尽量选择避免对紫色马铃薯花色苷具有破坏性的条件。
紫色马铃薯;花色苷;稳定性
紫色马铃薯是采用杂交育种成的马铃薯新品种[1]。紫色马铃薯营养丰富,除具备普通马铃薯的基本营养成分外,还富含花色苷[2]。花色苷是自然界一类广泛存在于植物中的水溶性天然色素[3],相较于人工合成色素,天然花色苷稳定性较低,在生产、贮藏及运输中易受各种因素影响发生聚合或降解,引起制品颜色变化和质量改变,因此,研究花色苷稳定性及其降解规律显得尤为重要[4]。目前,对紫色马铃薯花色苷提取工艺[5]、结构鉴定[6]、生理活性[7-9]的研究已有一些报道,但对紫色马铃薯花色苷稳定性的研究报道不多也不全面,研究内容不够详细统一,甚至所得结论不一。
本试验主要研究不同pH条件下紫色马铃薯花色苷的颜色特征、光谱特性和热稳定性,不同pH环境中花色苷的热降解规律,金属离子、氧化剂、还原剂和防腐剂对紫色马铃薯花色苷稳定性的影响。旨在了解紫色马铃薯花色苷的稳定性,以期为紫色马铃薯花色苷结构改造提供科学依据。
1 材料与方法
1.1 材料与试剂
紫色马铃薯,由华中农业大学宋波涛教授提供;HCl、NaCl、KCl、MgCl2、MnSO4、FeSO4、CuSO4、H2O2、Na2SO3、乙醇、醋酸钾、柠檬酸、柠檬酸钠、醋酸、醋酸钠、抗坏血酸、苯甲酸钠等化学试剂,购于国药集团化学试剂公司,均为市售分析纯;实验用水均为去离子水。
1.2 仪器与设备
BSA224S电子天平,塞多利斯科学仪器有限公司;UV-1800紫外可见分光光度计,日本岛津公司;PHS-3C雷磁pH计,上海仪电科学仪器股份有限公司;Avanti J-26XP贝克曼库尔特高效离心机,美国贝克曼库尔特有限公司;HH-S水浴锅,巩义市予华仪器有限责任公司;SHZ-D(III)循环水式真空泵,巩义市予华仪器有限责任公司;WD-A药物稳定性检测仪,北京恒奥德仪器仪表有限公司。
1.3 方法
1.3.1 紫色马铃薯花色苷提取液的制备 按料液比1∶10、50%乙醇(含0.01%HCl)、60℃水浴回流120 min。倒出粗提液,冷却至室温,抽滤,离心,上清液在40 ℃下,旋转浓缩。4 ℃保存,备用。
1.3.2 试验指标及测定方法 花色苷含量的测定:pH示差法[10];颜色强度 CI=Amax-A720;颜色密度CD=A420+A520+A620;降解指数 DI=A420/ Amax;颜色色调 CT=A420/ A530;花色苷保存率=C/C0×100%;色泽保存率=(样液处理后吸光度值/样液初始吸光度值)×100%[4]。1.3.3 pH值对紫色马铃薯花色苷稳定性的影响 配制pH值为1.0、2.0、3.0、4.0、5.0、6.0的缓冲液。取一定量的供试样品浓缩液,分成若干份,分别以上述缓冲液为稀释剂,稀释供试样品浓缩液至50倍,避光静置0.5 h,以相应缓冲液为对照(CK),扫描样品溶液的可见吸收光谱(400-800nm)并记录A420、A520、A530、Amax、A620、A720以计算其颜色密度(CD)、颜色强度(CI)、降解指数(DI)及颜色色调(CT)。用pH示差法,测定被pH 2.0、3.0、4.0、5.0缓冲液稀释后的供试样液中的花色苷含量,计算紫色马铃薯花色苷的保存率。
1.3.4 温度对紫色马铃薯花色苷稳定性的影响 取一定量的供试样品浓缩液,用pH 3.0柠檬酸-柠檬酸钠缓冲液稀释浓缩液至50倍,分成若干份,在室内弱光条件下,用恒温水浴锅加热,温度分别设定为4 ℃、室温、40 ℃、60 ℃、80 ℃,每隔1 h测定样品Amax,连续测7次。在0、2、4、6 h测定其花色苷含量,考察不同温度下紫色马铃薯花色苷浓缩液的稳定性。
1.3.5 光照对紫色马铃薯花色苷稳定性的影响 取一定量的供试样品浓缩液,用pH 3.0柠檬酸-柠檬酸钠缓冲液稀释浓缩液至50倍,分成若干份,取2份放入药物稳定性检测仪,设置照度为2800Lx,1份供试样品溶液直接放入稳定性试验箱,另取1份用锡箔纸包好放入作为避光处理,测定样品Amax,每天测1次,连续测5d。
1.3.6 氧化剂还原剂对紫色马铃薯花色苷稳定性的影响 取一定量供试样品浓缩液,用pH 3.0柠檬酸-柠檬酸钠缓冲液稀释供试样品浓缩液至50倍,分成若干份,向其中分别加入H2O2和Na2SO3,使H2O2最终浓度分别为0、0.02%、0.1%、0.3%、0.5%、1%、2%,混匀后避光静置,每隔0.5 h取样,以未添加H2O2的样品溶液为对照(CK),测定530 nm处吸光度值,并观测溶液颜色变化;使Na2SO3最终浓度分别为0、0.01%、0.03%、0.05%、0.07%、0.09%、0.11%混匀后避光静置,每隔0.5 h取样,以未添加Na2SO3的样品溶液为对照(CK),测定530 nm处吸光度值,并观测溶液颜色变化。
1.3.7 金属离子对紫色马铃薯花色苷稳定性的影响 取一定量的供试样品浓缩液,用pH 3.0柠檬酸-柠檬酸钠缓冲液稀释供试样品浓缩液至50倍,分成若干份,向其中分别添加Na+、Mg2+、Mn2+、Fe2+和Cu2+使金属离子浓度为1.2mmol/L,室温避光贮藏,每天测1次,连续测5 d,以未添加金属离子的样品溶液为对照(CK),测定530 nm处吸光度值,并观测其吸收光谱变化。
1.3.8 防腐剂对紫色马铃薯花色苷稳定性的影响 取一定量的供试样品浓缩液,用pH 3.0柠檬酸-柠檬酸钠缓冲液稀释供试样品浓缩液50倍,分成若干份,其中添加苯甲酸钠和抗坏血酸,使苯甲酸钠的最终浓度分别为0.3、0.5、0.7 mg/mL,抗坏血酸的最终浓度分别为1、5、10 mg/mL,混匀后避光静置,每5 d取样,测 20 d,以未添加防腐剂的样品溶液为对照(CK),测定吸收光谱变化并计算其色泽保存率。
1.3.9 数据分析 采用Origin 8.5进行试验数据处理。
2 结果与分析
2.1 pH值对紫色马铃薯花色苷稳定性的影响
由表1可知,pH越低,溶液颜色越深,红色黄烊盐阳离子占优势,随着pH增加,反应向生成蓝色醌型碱的方向进行[11],溶液颜色逐渐变浅。随着pH增加,溶液可见λmax红移,CT和DI值先增加后减小。CI值和CD值先减小后增加,且所有转折均出现在pH值为6时,并且此时溶液颜色较淡,可能是此时由于形成的共振稳定醌型阴离子所导致,这说明紫色马铃薯花色苷在酸性条件下比较稳定。
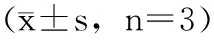
表1 pH值对紫色马铃薯花色苷吸收光谱和颜色的影响
由图1可知,室温避光条件下,紫色马铃薯花色苷在pH 2.0的缓冲溶液中降解速率最小,10 d后的保存率为90%,pH 4.0 和pH 5.0的缓冲溶液中降解较快,在pH 5.0 的缓冲溶液中2d已完全降解。pH 3.0的缓冲溶液中,10 d后的保存率为62%。可见紫色马铃薯花色苷的稳定性受pH值影响变化明显,在pH 2.0附近的稳定性最高。因此,紫色马铃薯花色苷加工、贮藏及运输过程中,应尽量选择酸性环境。
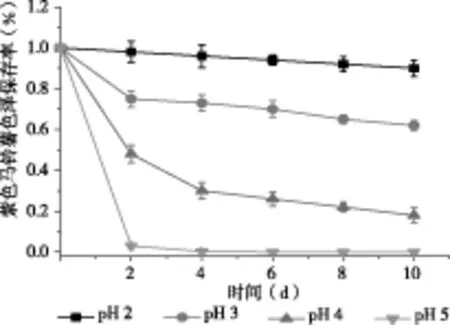
图1 pH值对紫色马铃薯花色苷保存率的影响
2.2 温度对紫色马铃薯花色苷稳定性的影响
由图2、图3可知,紫色马铃薯花色苷对热不稳定,80 ℃对花色苷的破坏作用尤为明显,加热时间越长花色苷保存率越低。无论从吸光度或保存率的角度,室温都优于其他温度但与4℃差值不明显,说明即使较低温度花色苷依然会发生降解。因此,在紫色马铃薯花色苷加工过程中,应尽量采用高温瞬时或低温长时间杀菌的方式,以减少花色苷的热降解。紫色马铃薯花色苷的贮藏,室温即可。
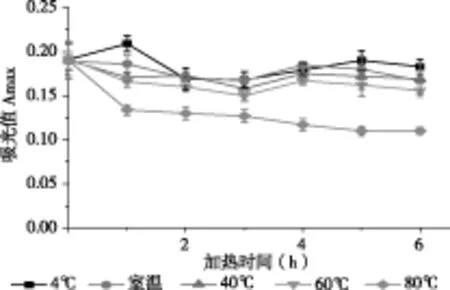
图2 温度对紫色马铃薯花色吸光度的影响
图3 温度对紫色马铃薯花色苷保存率的影响
2.3 光照条件对紫色马铃薯花色苷稳定性的影响
由图4可知,紫色马铃薯花色苷在光照条件下褪色快,在避光条件下褪色慢,这可能是由于紫色马铃薯花色苷在光照条件下引起价电子跃迁,导致花色苷结构发生改变,从而使花色苷稳定性下降。因此,紫色马铃薯花色苷应尽量在避光条件下贮藏和运输。
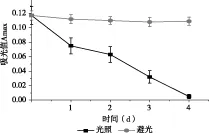
图4 光照条件对紫色马铃薯花色苷吸光度的影响
2.4 氧化剂还原剂剂对紫色马玲薯花色苷稳定性的影响
由图5可知,添加不同浓度的H2O2后紫色马铃薯花色苷溶液吸光度值均呈不同程度下降,且H2O2浓度越高,色素溶液吸光度值越低;当H2O2浓度达到0.02%后,随其浓度继续增大色素溶液吸光度值明显下降。可见,H2O2能对紫色马铃薯花色苷产生强烈的破坏作用,使花色苷迅速发生降解和褪色,且降解程度随H2O2浓度不同而有所差异。

图5 H2O2对紫色马铃薯花色苷吸光度的影响
由图6可知,添加Na2SO3后色素溶液吸光度值从开始就一直明显低于CK,相同Na2SO3浓度下,随时间延长样品溶液吸光度下降并不明显。不同浓度Na2SO3对样品溶液吸光度值的影响也无显著差异,且在加入Na2SO3瞬间,样品溶液立即变白。以上结果表明Na2SO3对紫色马铃薯花色苷色素有漂白作用。因此,应尽量避免紫色马铃薯花色苷与Na2SO3等还原剂接触。
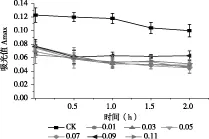
图6 Na2SO3对紫色马铃薯花色苷吸光度的影响
2.5 金属离子对紫色马铃薯花色苷稳定性的影响
由图7可知,5种金属离子对花色苷都有一定影响,其中Na+对样品溶液的影响尤为显著,在添加Na+的瞬间样品溶液变为无色。其次是添加Fe2+后,样品溶液逐步由粉色变为浅粉色、橘黄色、浅橘黄,最后变为黄色溶液。Mg2+、Mn2+、Cu2+对样品溶液有一定的辅色作用,可能是Mg2+、Mn2+、Cu2+与花色苷发生螯合作用,起到辅色效果。
2.6 防腐剂对紫色马铃薯花色苷稳定性的影响
由表2可知,CK在0、5、10 d的色泽保存率分别为98.49%、92.06%、59.86%,在20 d时样品溶液呈混悬液,出现絮状沉淀,无法准确测其吸光度值。与CK相比,随着时间的延长,添加苯甲酸钠样品溶液的保存率有所下降,但不是很明显,其中以0.5 mg/mL浓度的苯甲酸钠作为防腐剂效果最好,且样品溶液澄清透明,无混悬物出现。而添加抗坏血酸后样品溶液色泽保存率明显降低,在10 d时,样品溶液变为白色混悬液,且含絮状沉淀,无法准确测其吸光度值。以上分析表明苯甲酸钠的防腐效果较好,以0.5 mg/mL浓度最佳,对紫色马铃薯花色苷稳定性影响不大,而抗坏血酸则会致使紫色马铃薯花色苷逐渐褪色。
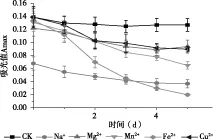
图7 金属离子对紫色马铃薯花色苷吸光度的影响
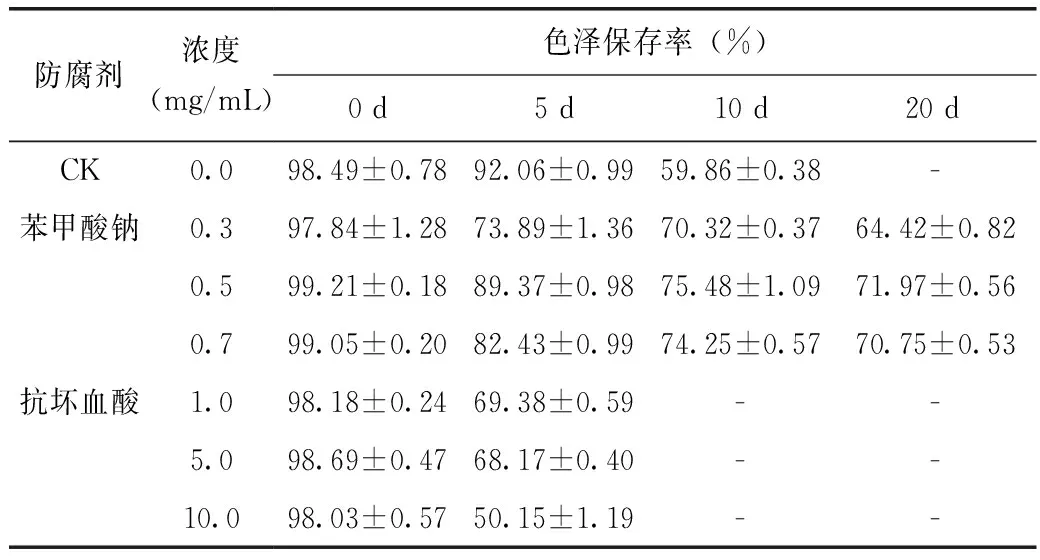
防腐剂浓度(mg/mL)色泽保存率(%)0d5d10d20dCK0.098.49±0.7892.06±0.9959.86±0.38-苯甲酸钠0.397.84±1.2873.89±1.3670.32±0.3764.42±0.820.599.21±0.1889.37±0.9875.48±1.0971.97±0.560.799.05±0.2082.43±0.9974.25±0.5770.75±0.53抗坏血酸1.098.18±0.2469.38±0.59--5.098.69±0.4768.17±0.40--10.098.03±0.5750.15±1.19--
3 结论
本研究以紫色马铃薯花色苷为材料,对影响其稳定性的主要因素进行了较全面的考察。结果表明:pH值对供试样品溶液的吸收光谱和颜色特征及稳定性影响很大,低温有利于花色苷贮藏,光照能使紫色马铃薯花色苷发生降解。因此低温、避光、酸性环境对紫色马铃薯花色苷稳定性最好。H2O2使花色苷降解和褪色,Na2SO3对其具有漂白作用,应尽量避免与这两类物质接触。Na+、Fe2+不仅无增色效果,还会导致花色苷褪色,Mg2+、Mn2+、Cu2+可与花色苷发生螯合作用,起到一定辅色效果。苯甲酸钠对花色苷稳定性影响不大,抗坏血酸具有减色作用。查阅相关文献,本研究结果[12-13]比较,发现River John Blue中花色苷的稳定性较好,可能与其富含的花色苷多具有酰基化结构有关。该研究结果对于保证紫色马铃薯的质量,为紫色马铃薯花色苷的深度研究与开发利用提供了实验依据与参考。◇
[1]王亚云,郭鲜蒲,袁锴.紫色马铃薯花色苷提取工艺的研究[J].中国食品添加剂,2016(3):122-126.
[2]王兰,邓放明,赵玲艳.紫色马铃薯保健功效及其利用研究进展[J].中国酿造,2015,34(7):117-120.
[3]肖继坪,王琼,白磊.彩色薯类花色苷功能研究及开发利用[J].食品研究与开发,2015,36(13):122-126.
[4]孙文娟.紫薯花色苷提取、脱味、稳定性及其结构初步鉴定[D].江苏无锡:江南大学,2015.
[5]Tibor Fuleki,Francis F J.Quantitative methods for anthocyanins,1,extranaction and determination of total anthocyanin in cranberries [J].Journal of Food Science,1968(33):72-77.
[6]Ferrari E,Foca G,Vignali M.Adulteration of the anthocyanin content of red wines:Perspectives for authentication by Fourier Transform-Near InfraRed and 1HNMR spectroscopies [J]. Analytica Chimica Acta,2011,701(2):139-151.
[7]Bellido G G,Beta T.Anthocyanin composition and oxygen radical scavenging capacity(ORAC)of milled and pearled purple,black,and common barley[J].Journal of Agricultural and Food Chemistry,2009,57(3):1022-1028.
[8]Kahkonen M P,Heinonen M.Antioxidant activity of anthocyanins and aglycons[J].Journal of Agricultural and Food Chemistry,2003,51(4):628-633.
[9]孙晓侠.紫甘薯花色苷结构鉴定及抗氧化、降血糖功能的研究[D].天津科技大学,2006.
[10]张玥,龙君,文云.紫色马铃薯花色苷定量分析方法的比较[J].湖南农业科学,2012(9):25-28.
[11]Candogan K,Wardlaw F B,Actonb J C.Effect of starter culture on proteolytic changes during processing of fermented beef sausages[J].Food Chemistry,2009,116(3):731-737.
[12]卢其能,杨清.马铃薯花色苷种类、含量和稳定性初步研究[J].安徽农业科学,2007,35(16):4811-4813.
[13]田密霞,胡文忠,李亚东.不同品种蓝莓花色苷稳定性的比较研究[J].食品工业科技,2015(13):60-65.
(责任编辑 李婷婷)
Study on Stability of Anthocyanins from Purple Potato
WANG Ya-yun1,2,XU Hua-rong1,2,YUAN Kai1,FAN Zhi-xia1,GUO Xian-pu1,RUAN Jin-lan1,2
(1School of Life Science,Wuchang University of Technology/Synergy Innovation Center of Biological Peptide Antidiabetics of Hubei Province,Wuhan 430223,China;2School of Chemical Engineering & Pharmacy,Wuhan Institute of Technology,Wuhan 430073,China)
The effect of pH,light,temperature,oxidants,reducing agent,metal ions,antiseptic substance on stability of anthocyanin from purple potato were discussed Results showed that only in acidic environments,the pigment had high stability.Anthocyanins had low fever and light stability.Oxidant and reductant had strong destructive effect to anthocyanin.Fe2+could destruct anthocyanin,but Mg2+、Mn2+、Cu2+had counterproductive.Sodium benzoate had little effect on the stability of anthocyanin,but ascorbic acid could make it fade,so it should choose the right environment when producing or storing the anthocyanin.
purple potato;anthocyanin;stability
王亚云(1990— ),女,硕士,研究方向:糖尿病生物药物。
阮金兰(1952— ),男,博士生导师,研究方向:糖尿病生物药物。
