一株猪流行性腹泻病毒S、M、N基因的遗传变异分析
2017-03-02易新健张翠翠臧传佼陈申秒
易新健,刘 准,张翠翠,臧传佼,徐 健,陈申秒
(山东滨州沃华生物工程有限公司,山东省动物病原微生物工程实验室,山东滨州 256600)
一株猪流行性腹泻病毒S、M、N基因的遗传变异分析
易新健,刘 准,张翠翠,臧传佼,徐 健,陈申秒*
(山东滨州沃华生物工程有限公司,山东省动物病原微生物工程实验室,山东滨州 256600)
为研究猪流行性腹泻病毒(PEDV)CV777疫苗毒株与流行毒株的遗传变异和抗原位点的差异性,以RT-PCR进行PEDV CV777疫苗株和JS2016流行株S、M、N 3个基因的克隆测序,进行PEDV S、M、N 3个基因的核酸序列同源性分析,并通过软件比对CV777与JS2016毒株在这3个基因上的抗原差异。S、M、N基因的同源性分析表明流行毒株与CV777存在变异,但同源性在93%以上;免疫原性预测结果显示2个毒株在S、M、N 3个基因上的抗原区域存在较小的差异。
猪流行性腹泻病毒;CV777;S基因;M基因;N基因
猪流行性腹泻病毒(Porcine epidemic diarrhoea virus,PEDV)是引起猪流行性腹泻(Porcine epidemic diarrhoea,PED)病原。该病最早于1971年在英国被发现,不久便在欧洲开始流行,并分离到病原,被命名为CV777。2010年后,猪流行性腹泻在全世界各国均出现大面积的流行[1-2]。我国也不例外,从南到北出现全面流行,特别是2013年以来,该病给我国养猪业造成了巨大经济损失[3-4]。目前,国内猪价持续高价运转,与PEDV在国内的流行有一定的关系。新毒株的出现导致现有疫苗CV777株疫苗的免疫保护效果受到质疑,本文就目前国内流行毒株的S、M、N 3个基因与CV777毒株进行遗传相关性和免疫原性分析,为相关研究提供参考。
1 材料与方法
1.1 材料
1.1.1 病料来源 病料来源于江苏某规模化猪场,3日龄仔猪出现严重的水样腹泻,采集肠道病料进行病原检测。
1.1.2 主要试剂 2×TaqPlus Master Mix(Dye Plus)、HiScript○RⅡ RT SuperMix for PCR,Vazyme公司产品;TRIzol○RReagent,Thermo Fisher Scientific公司产品。
1.2 方法
1.2.1 引物合成 根据文献[5]对S基因进行引物合成,M、N基因根据NCBI上SD2014 (GenBank:KX064280.1)和CV777(GenBank:AF353511.1)基因序列设计针对M、N全基因序列扩增的2对引物,引物由上海生工生物工程技术服务有限公司合成(表1)。
1.2.2 核酸提取 将采集的肠道病料用四抗PBS进行研磨,取200 μL研磨液加入指形管中,加入800μLTRIzol,充分摇匀静置15min后加入200 μL氯仿,剧烈振荡混匀,室温放置10 min,12 000 r/min离心15 min,取上清加入吸附柱套中12 000 r/min离心1 min,弃液体,加入400 μL Rinse A(8 mol/L盐酸胍)12 000 r/min离心1 min,弃液体,加入700 μL Rinse B(750 mL/L乙醇)12 000 r/min离心1 min(重复洗涤1遍),弃液体,12 000 r/min离心1 min,加入30 μL DEPC处理水,12 000 r/min离心1 min,即获得RNA模板。吸取2 μL RNA模板加入PCR管中,加入2 μL 5 × qRT SuperMix Ⅱ,加入6 μL DEPC水,进行反转录,37℃ 10 min,50℃ 30 min,85℃ 5 min,即获得cDNA模板。
1.2.3 PCR扩增与基因测序 PCR反应体系(50 μL):2 ×TaqPlus Master Mix(Dye Plus)25 μL,浓度为20 μmol/L的引物各1 μL,cDNA模板4 μL,然后加超纯水至50 μL。反应条件:94℃ 5 min;94℃ 45 s,55℃ 45 s,72℃延伸(延伸时间见表1),共30个循环;72℃ 10 min。将PCR扩增产物送南京金斯瑞生物工程有限公司进行基因测序。
1.2.4 S、M、N基因的遗传相关性与免疫原性分析 从NCBI上下载国内外流行毒株的基因序列与CV777毒株基因序列及所测样品序列(命名为JS2016)进行遗传相关性分析。根据现有研究CV777免疫原性位点[3-6]和软件预测的抗原位点与JS2016进行对比,查看是否出现较大的差异。

表1 PEDV S、M、N扩增引物
2 结果
2.1 S基因、M基因、N基因的核酸电泳图
对JS2016毒株的S基因、M基因、N基因进行核酸扩增后,进行琼脂糖凝胶电泳,获得凝胶电泳图(图1),样品1、2、3分别为 S基因的扩增产物,片段大小分别为2 107、1 441、1 495 bp;样品4为M基因的扩增产物,大小为863 bp;样品5为N基因的扩增产物,大小为1 426 bp。

M.DNA标准DL 2 000;1~3.S基因的扩增产物;4.M基因的扩增产物;5.N基因的扩增产物M.DNA Marker DL 2 000;1-3.S gene amplification products;4.M gene amplification products;5.N gene amplification products
2.2 S基因的遗传相关性与免疫原性分析
对S基因的同源性分析结果显示,JS2016与国内外2012年-2015年流行毒株之间的同源性在98%以上,而与CV777的同源性为93.8%,遗传进化树见图2。用DNA Star中的Protean软件分析PEDV疫苗毒CV777与流行毒株JS2016 S基因的免疫原性,2个毒株在100-200、260-280、300-350、630-635、761-771、1 260-1 270 aa 6个区域存在差异,其他区域均类似(图3)。根据文献[6-9]研究CV777 S基因共存在4个中和位点,分别为499-638、748-755、764-771、1 368-1 374 aa,CV777与JS2016在744-755 aa和1 368-1 374 aa 2个位点完全相同;在764-771 aa区域存在1个氨基酸差异765 aa D→S,这个氨基酸的变异使JS2016免疫原性在这个区域增强;在499-638 aa存在4个氨基酸的差异,分别为516 A→S、548 T→S、593 G→S、632 aa Q→E,其中516、548、593 aa的变异在免疫原性上没有明显的变化,593 aa变异使JS2016免疫原性在此区域减弱。

图2 S基因遗传进化树
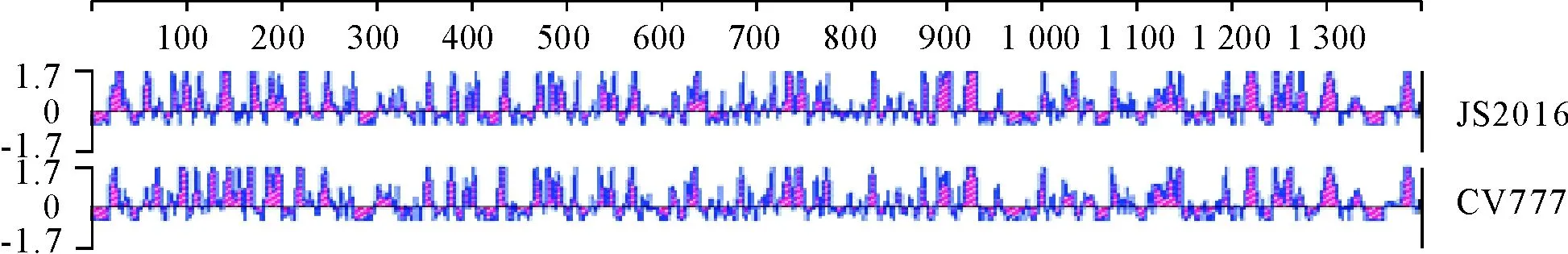
图3 CV777与JS2016毒株S基因的免疫原性分析
2.3 M基因的遗传相关性与免疫原性分析
对M基因同源性分析结果显示,JS2016与国内外2012年-2015年流行毒株之间的同源性在99%以上,而与CV777的同源性为97.7%,遗传进化树见图4。用DNA Star中的Protean软件分析PEDV疫苗毒CV777与流行毒株JS2016 M基因的免疫原性,2个毒株在5 F→S、13 E→Q、16 7aa D→N 3个位点的变异引起免疫原性改变,其他区域均相似(图5)。

图4 M基因遗传进化树

图5 CV777与JS2016毒株M基因的免疫原性分析
2.4 N基因的遗传相关性与免疫原性分析
对N基因同源性分析结果显示,JS2016与国内外2012年-2015年流行毒株之间的同源性在98%以上,而与CV777的同源性为95.8%,遗传进化树见图6。用DNA Star中的Protean软件分析PEDV疫苗毒CV777与流行毒株JS2016 M基因的免疫原性,2个毒株在380 aa I-K位点的变异使JS2016在该区域抗原性增强,其他区域均相似(图7)。
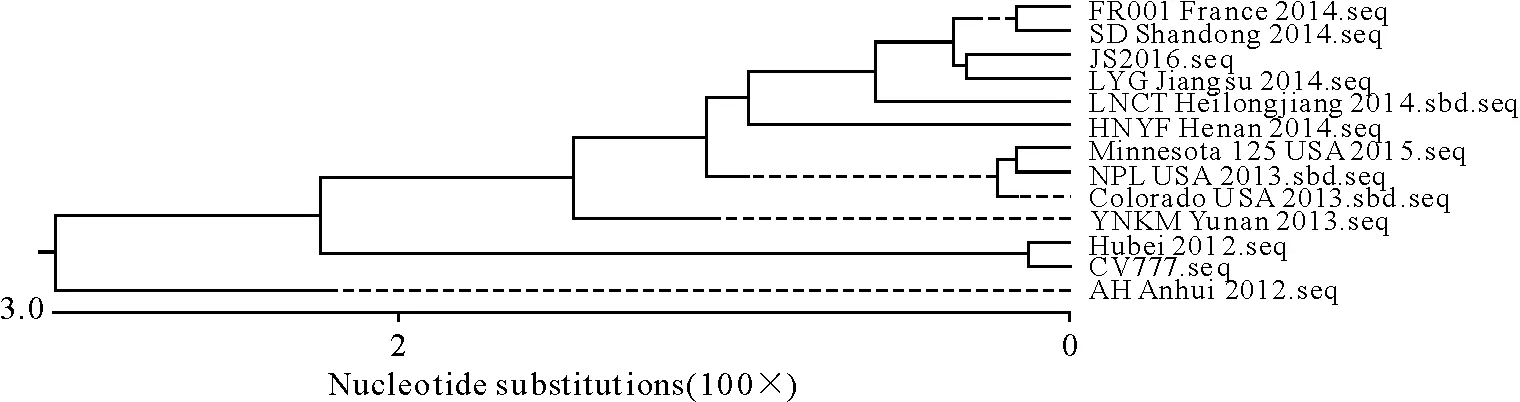
图6 N基因遗传进化树
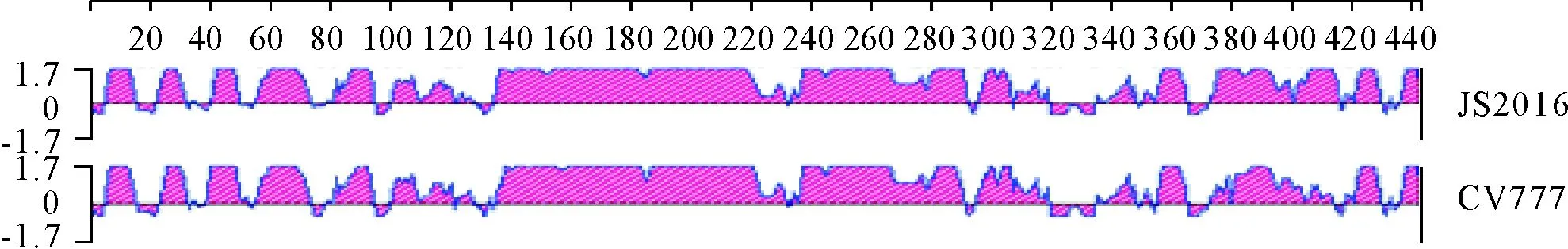
图7 CV777与JS2016毒株N基因的免疫原性分析
3 讨论
PEDV的S、M、N 3个基因同源性分析结果表明,目前的流行毒株与CV777存在变异,属于不同分支,但同源性在93%以上。Protean软件分析2个毒株的免疫原性结果显示,2个毒株在S、M、N 3个基因上的抗原区域基本相似,在S基因上已经报道的4个中和位点上,有2个区域完全一致,764-771 aa区域存在1个氨基酸差异,在499-638 aa存在4个氨基酸的差异。结果分析表明疫苗株CV777对流行毒株的具有一定的交叉免疫保护作用。
但养殖场近几年使用CV777疫苗后,反映效果达不到理想的免疫状态,这并不全是因为流行毒株变异的问题,主要原因是疫苗中病毒抗原含量不足[10]和如何免疫产生SIgA抗体的问题[11]。由于PEDV在体外的分离和培养难度非常之大,因此在疫苗生产过程中,PEDV高效培养是整个行业的瓶颈。另外,PEDV防控的关键是如何让母乳中产生较高的针对PEDV的SIgA抗体,不管是肌肉注射免疫还是后海穴免疫,母猪产生的抗体主要是IgG抗体,只有少量的SIgA抗体[12]。只有肠道黏膜免疫才能让母乳产生较高的SIgA抗体,仔猪通过采食初乳获得SIgA而产生对PEDV的被动免疫保护,这是防控仔猪PEDV的关键所在。目前,有不少养猪场通过返饲和自家组织苗进行PEDV的防控,能起到较好的免疫效果,这主要是返饲过程引起肠道黏膜免疫,产生较高的IgA抗体,再加上灭活组织苗的免疫,强化IgA抗体水平,但返饲过程容易出现生物安全问题,导致伪狂犬病病毒、猪蓝耳病病毒和圆环病毒在猪群的扩散,应引起足够的重视。
[1] Cheun-Arom T,Temeeyasen G,Tripipat T,et al.Full-length genome analysis of two genetically distinct variants of porcine epidemic diarrhea virus in Thailand[J].Infect Genet Evol,2016,44:114-121.
[2] Trujillo-Ortega M E,Beltran-Figueroa R,Hernandez-Villegas E N,et al.Isolation and characterization of porcine epidemic diarrhea virus associated with the 2014 disease outbreak in Mexico:case report[J].BMC Vet Res,2016,132(12):1-8.
[3] Li R F,Tian X Q,Liu Y,et al.Isolation and genetic analysis of a variant porcine epidemic diarrhea virus in China[J].Pol J Vet Sci,2016,19:65-73.
[4] Wang D,Fang L,Xiao S.Porcine epidemic diarrhea in China[J].Virus Res,2016,168(16):184-192.
[5] 孙东波,冯 力,陈建飞,等.猪流行性腹泻病毒CH/JL毒株S基因的克隆、序列分析及线性抗原表位区的鉴定[J].病毒学报,2007,23(3):224-229.
[6] Chang S H,Bae J L,Jang Y S,et al.Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J].Mol Cell,2002,14(2):295-299.
[7] Sun D B,Feng L,Shi H Y,et al.Identification of two novel B cell epitopes on porcine epidemic diarrhea virus spike protein [J].Vet Microbiol,2008,131(1):73-81.
[8] Cruz D J M,Kim C J,Shin H J.Phage displayed peptides having antigenic similarities with porcine epidemic diarrhea virus (PEDV) neutralizing epitopes[J].Virology,2006,354:28-34.
[9] Cruz D J M,Kim C J,Shin H J.The GPRLQPY motif located at the carboxy-terminal of the spike protein induces antibodies that neutralize porcine epidemic diarrhea virus[J].Virus Res,2008,132(1):192-196.
[10] 徐宏军,杨鹏程,何孔旺,等.猪流行性腹泻病毒灭活疫苗的制备及攻毒保护研究[J].动物医学进展,2015,36(1):35-39.
[11] Langel S N,Paim F C,Lager K M,et al.Lactogenic immunity and vaccines for porcine epidemic diarrhea virus (PEDV):Historical and current concepts[J].Virus Res,2016,168(16):215-220.
[12] 陈申秒,牛成明,何福庆,等.猪流行性腹泻病毒研究进展及疫苗应用前景[J].中国畜牧兽医,2014,41(3):223-229.
Genetic Correlation and Immunogenicity Analysis of S,M,N Genes of Porcine Epidemic Diarrhea Virus
YI Xin-jian,LIU Zhun,ZHANG Cui-cui,ZANG Chuan-jiao,XU Jian,CHEN Shen-miao
(ShandongBinzhouWohuaBiologicalEngineeringCompanyLimited,EngineeringLaboratoryofAnimalPathogenicMicroorganismsinShandongProvince,Binzhou,Shandong,256600,China)
To carry out the genetic variation and diversity of antigenic sites between CV777 vaccine strain and epidemic strain of porcine epidemic diarrhoea virus,RT-PCR was used to clone the S,M and N genes of PEDV CV777 vaccine strain and JS2016 strain,then the PCR products were sequenced for analyzing the nucleotide sequences and antigenic sites.The nucleotide sequence of CV777 vaccine strain had some variation compared to JS2016 strain,but the homology was higher than 93%.The prediction result of immunogenicity showed that less differences of antigenic sites of S,M and N genes exist between CV777 vaccine strain and JS2016 strain.
Porcine epidemic diarrhoea virus; CV777; S gene; M gene; N gene
2016-07-06
易新健(1988-),男,湖南长沙人,硕士研究生,主要从事动物传染病学研究。*通讯作者
S855.3
A
1007-5038(2017)02-0012-05
