貉源犬瘟热病毒血凝素基因的克隆及序列分析
2017-03-02焦绪娜吴佳琦李贝影闫晓敏
焦绪娜,吴佳琦,李贝影,闫晓敏,黄 娟,单 虎
(青岛农业大学动物科技学院,山东青岛 266109)
貉源犬瘟热病毒血凝素基因的克隆及序列分析
焦绪娜△,吴佳琦△,李贝影,闫晓敏,黄 娟*,单 虎*
(青岛农业大学动物科技学院,山东青岛 266109)
为了对1例貉源犬瘟热(CD)进行病毒检测并分析其血凝素H基因变异情况,本研究从1只疑似犬瘟热病死的貉采病料进行研磨,利用RT-PCR方法扩增犬瘟热病毒H基因,对扩增出的H基因片段进行克隆测序,并对得到的H基因序列进行分析。结果表明,该貉感染犬瘟热病毒,得到的H基因核苷酸和氨基酸序列与CDV野毒株同源性较高,分别为89.1%~98.0%和85.4%~97.5%。 遗传进化分析表明其属于Asia-1型野毒株,N连接糖基化位点分析结果表明,该毒株在542 aa处比参考野毒株多了1个潜在的N糖基化位点,在525 aa-550 aa间多出了1个抗原表位。
犬瘟热病毒;血凝素基因;N连接糖基化;进化分析
犬瘟热(Canine distemper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)引起的世界范围内流行的接触性传染病。目前犬瘟热已经在阿根廷、澳大利亚、巴西、德国、匈牙利、意大利、南非、南韩、中国、美国等多个国家都有发生[1]。犬瘟热病毒不仅能感染狐狸、貉子等毛皮动物,也能感染熊猫、猕猴[2]等,甚至有人从患 Pagrt’s 疾病(一种炎症性骨病)的病人组织中检测出 CDV核酸。犬瘟热流行时一般是貉先发病然后是狐狸,且该病有地方流行性。发病动物表现出严重的免疫抑制[3],病死率较高,对全世界的毛皮动物养殖业有重大的影响。
H蛋白基因序列构建系统发生树分析表明犬瘟热病毒包括America 1 、America 2、Arctic-like、Asia 1~4、South America 2~3、European、European wildlife、Rockborn-like、Africa等13个不同的基因型[4-6],在我国流行的多为Asia-1型[7-8]。对各病毒结构蛋白的单克隆抗体进行研究来分析疫苗株和野毒株病毒结构蛋白的变异情况,结果表明犬瘟热病毒中的H蛋白是所有结构蛋白中变异率最高的[9]。在免疫压力下,H蛋白抗原非常容易发生漂变,因而免疫过的水貂、貉子、狐狸等毛皮动物仍有发生犬瘟热的可能[10]。研究发现疫苗株和野毒株H蛋白的潜在天冬酸胺糖基化位点是不同的,疫苗株Convac及Onderstepoort株分别是7个和4个,而野毒株一般是8个~9个,其中309-311位的糖基化位点是野毒株所特有的,N连接糖基化位点的差异性能影响病毒的抗原性[11],所以这些遗传的差异可能是近年来暴发犬瘟热的重要原因。
本试验从山东荣成一养殖场送检的貉体内分离得到了犬瘟热病毒,利用RT-PCR 方法得到H基因片段,测序后进行同源性比对、系统进化分析、N糖基化位点的分析及对抗原表位进行预测分析。最后通过该病毒H基因与其他毒株比较分析该病毒株H蛋白发生的变异情况。
1 材料与方法
1.1 材料
1.1.1 待检病料、菌株和质粒 山东威海荣成某养殖场疑似感染犬瘟热病毒貉的鼻拭子眼分泌物、肺脏、肝脏、脾脏。大肠埃希菌株DH5α、质粒pMD19-T均购自宝生物工程(大连)有限公司。
1.1.2 参考毒株 参考毒株有Rong(2016) 、00-2601、007Lm、9L、14-CO 12、48-05、095Cr、324-03、Argentina 24、CDV3、HeB(09)3、HLJ1、NJ(11)2和Onderstepoort 14个。
1.1.3 主要试剂 DNA Marker DL 2 000、DNA Marker DL 5 000、rTaq聚合酶、T4 DNA连接酶、胶回收纯化试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0),宝生物工程(大连)有限公司产品;犬瘟热胶体金抗原检测试纸,青岛维尔福生物科技有限公司产品。
1.2 方法
1.2.1 病料的处理 荣成某养殖场部分貉表现为眼鼻有脓性分泌物,精神沉郁,食欲废绝,最后死亡,送样检测时用CDV胶体金抗原检测试纸检测其鼻拭子和眼睛分泌物结果为CDV阳性。剖检后发现肺脏和脾脏出血严重,采集肺脏、脾脏、肝脏放入研磨钵中用液氮研磨,研磨成粉状的病料装入10 mL离心管中加入适量的PBS。
1.2.2 RT-PCR
1.2.2.1 总RNA的提取 取250 μL病料悬液加上750 μLRNA裂解液,颠倒混匀6次~8次,室温放置10 min。12 000 r/min、4℃离心5 min后吸上清600 μL至新1.5 mL EP管中,加上三氯甲烷150 μL,振荡混匀,室温放置5 min。12 000 r/min、4℃离心15 min。然后吸上清600 μL至新1.5 mL EP管中,加入等量的异丙醇,在-20冰箱放置1 h,12 000 r/min、4℃离心10 min。弃掉上清,向管中加入1 mL 75 mL/L乙醇。7 500 r/min、4℃离心5 min。弃上清,干燥(将管倒置自然干燥)最后加入20 μL DEPC水混匀。
1.2.2.2 PCR引物 参考CDV Onderstepoort(AF305419)株基因序列, 利用Primer Premier 5软件在CDV H基因两端的相对保守区设计1对扩增H基因编码区的特异性引物,扩增长度为1 921 bp。引物由青岛擎科生物公司合成,用DEPC水稀释到20 μmol/L,放在-20℃保存备用。
CDV-H-F(7075-7095):5′-AACAATGCTCT- CCTACCAAGA-3′
CDV-H-R(8975-8895):5′-AATGCTAGAG- ATGGTTAATT-3′
1.2.2.3 RT-PCR扩增目的条带 以病毒总RNA为模板,应用特异引物扩增CDV H基因片段。RT-PCR反应的总体系为20 μL,其中dd H2O 5.5 μL,5×Reverse Transcriptase M-MLV buffer 4 μL,dNTP 2μL,上、下游引物各1 μL,RRI 0.5 μL,M-MLV 1 μL,RNA模板5 μL。反转录条件:42℃ 1 h,72℃10 min。PCR反应体系为25 μL,其中RT产物2 μL,dd水 8.5 μL,上、下游引物各1 μL,PremixTaqEX Taqversion2.0 12.5 μL。PCR反应条件为:95℃ 5 min;95℃ 30 s,52℃ 1 min,72℃ 2 min,35个循环;72℃ 10 min;4℃结束反应。
1.2.3 CDV H基因的克隆与鉴定 PCR产物经电泳后,切下特异性条带,用TaKaRa DNA Fragment Purification Kit回收,按常规方法与pMD18-T载体进行连接,基因与载体的比例为4∶1,反应体系为10 μL,16℃过夜然后并转化到感受态E.coliDH5α细胞中,涂布于含Amp(100 mg/L)的LB平板培养,待长出单菌落后挑单菌落接种于含100 μg/mL Amp的液体培养基中,37℃振荡培养过夜。菌液进行PCR鉴定,选取阳性克隆子送至青岛擎科测序,并利用DNA Star软件对所测定的H基因全长cDNA的核苷酸序列及推导的氨基酸序列进行编辑,与疫苗株Onderstepoort、CDV3株和CDV野毒株进行了序列分析、同源性比对、系统进化分析、N连接糖基化位点分析及抗原位点预测分析。
2 结果
2.1 CDV H基因的PCR扩增
以提取的病毒RNA为模板,用所设计的引物进行PCR反应扩增H基因,所获得的PCR产物经10 g/L琼脂糖凝胶电泳呈单一条带,大小与预期1 921 bp相符(图1)。将该毒株命名为Rong(2016)。
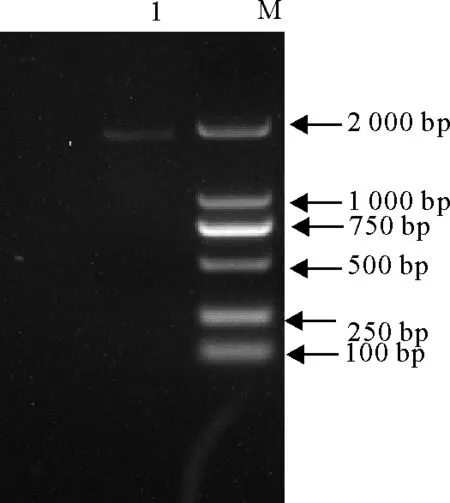
M.DNA标准DL 2 000;1.PCR产物
2.2 重组质粒的PCR鉴定
连接转化之后挑单菌落进行菌液PCR鉴定,得到了约为1 921 bp大小的片段,证明所挑取的克隆为正确的重组转化子(图2)。

M.DNA标准DL 5 000 1.阳性PCR结果;2、3.阴性PCR结果M.DNA Marker DL 5 000 1.Positive PCR results;2,3.Negative PCR results
2.3 Rong(2016) H序列分析
2.3.1 核苷酸同源性分析 将Rong(2016)与疫苗株和国内外各种犬瘟热病毒分离株进行序列分析和同源性比对。H基因核苷酸序列与野毒株同源性为89.1%~98.0%,其中与2006年日本得到的毒株095Cr 同源性最高达到了98.0%,其次是2009年在中国貉体内分离到的HeB(09)3,同源性为97.7%,与疫苗株Onderstppoort株、CDV3同源性分别为90.5%和90.9%(表1)。
2.3.2 推导氨基酸序列分析 氨基酸序列与野毒株同源性为85.4%~97.5%,与疫苗株Onderstepoort、CDV3核苷酸序列同源性分别为89.1%和90.8%(表1)。

表1 Rong(2016)H基因与参考株H基因核苷酸和氨基酸同源性分析
注:右上角为核苷酸比对结果,左下角为氨基酸比对结果。数字代表的毒株分别为:1.Rong(2016);2. 00-2601;3. 007Lm;4. 9L;5. 14-CO 12;6. 48-05;7. 095Cr;8. 324-03;9.Argentina 24;10.CDV3;11.HeB(09)3;12.HLJ1;13.NJ(11)2;14.Onderstepoort。
Note:The comparison of nucleotides is in the upper right, the comparison of amino acids is in the bottom left.The digits show different strains: 1.Rong(2016);2. 00-2601;3. 007Lm;4. 9L;5. 14-CO 12;6. 48-05;7. 095Cr;8. 324-03;9.Argentina 24;10.CDV3;11.HeB(09)3;12.HLJ1;13.NJ(11)2;14.Onderstepoort.
2.3.3 系统进化分析 参考毒株分别来自America1、America2、Arctic-like、Asia1~4、South America2~3、European、European wildlife、Rockborn-like、Africa等13个基因型,将测得的H基因序列与参考毒株核苷酸序列构建系统进化树, Rong(2016)与HeB(09)3、HLJ(07)1在同一个分支上,属于Asia-1(图3)。
2.4 N糖基化位点与部分毒株和疫苗株的比较
用糖基化位点预测网站http://www.cbs.dtu.dk/services/NetNGlyc/对Rong(2016)推导的氨基酸进行N糖基化位点的预测,并与其他毒株做比较。本试验所得序列氨基酸与野毒株特有的309-411中的N连接糖基化位点,与其他野毒株相比较在542处多了1个N连接糖基化位点(表2)。
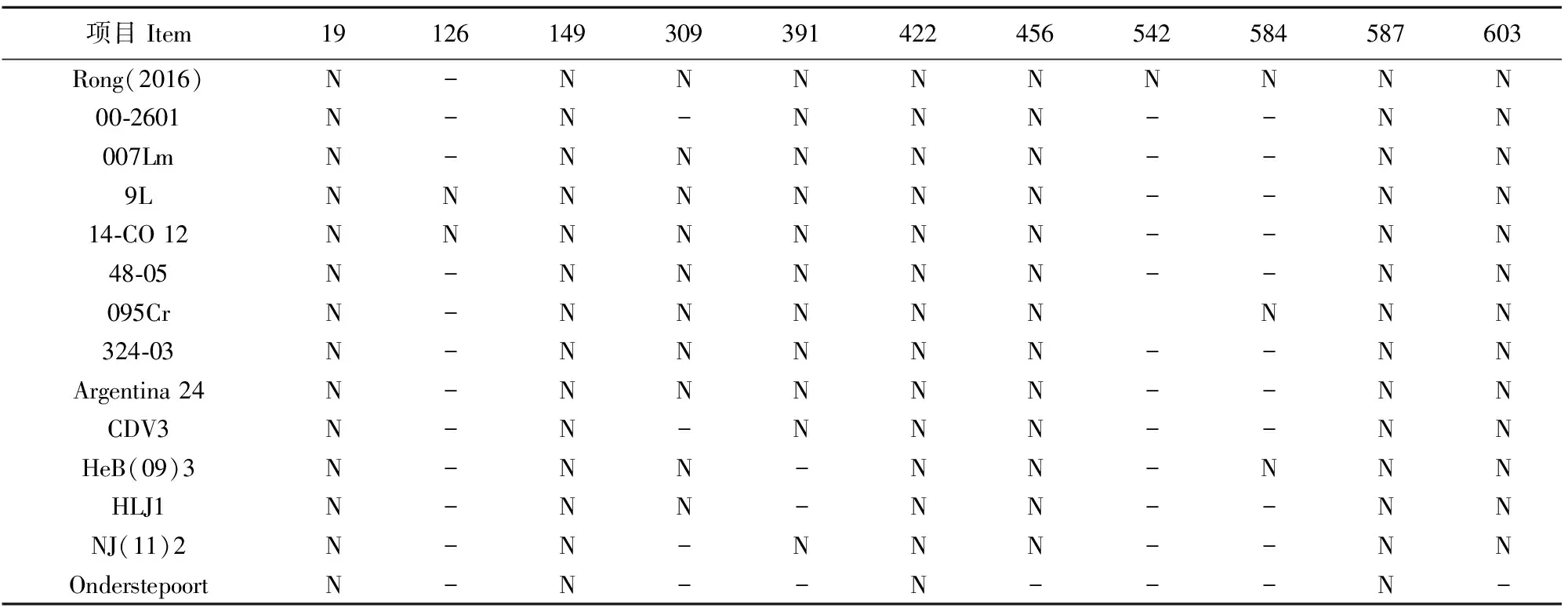
表2 Rong(2016)N连接糖基化位点与部分毒株和疫苗株的比较

图3 基于CDV H基因核苷酸序列构建的系统进化发生树
2.5 H蛋白抗原表位分析结果
利用Protean分子生物学软件,对本试验中得到的H蛋白进行抗原表位分析发现,Rong(2016)与其他野毒株和疫苗株相比,在525-550 aa处多了1个抗原表位(图4)。
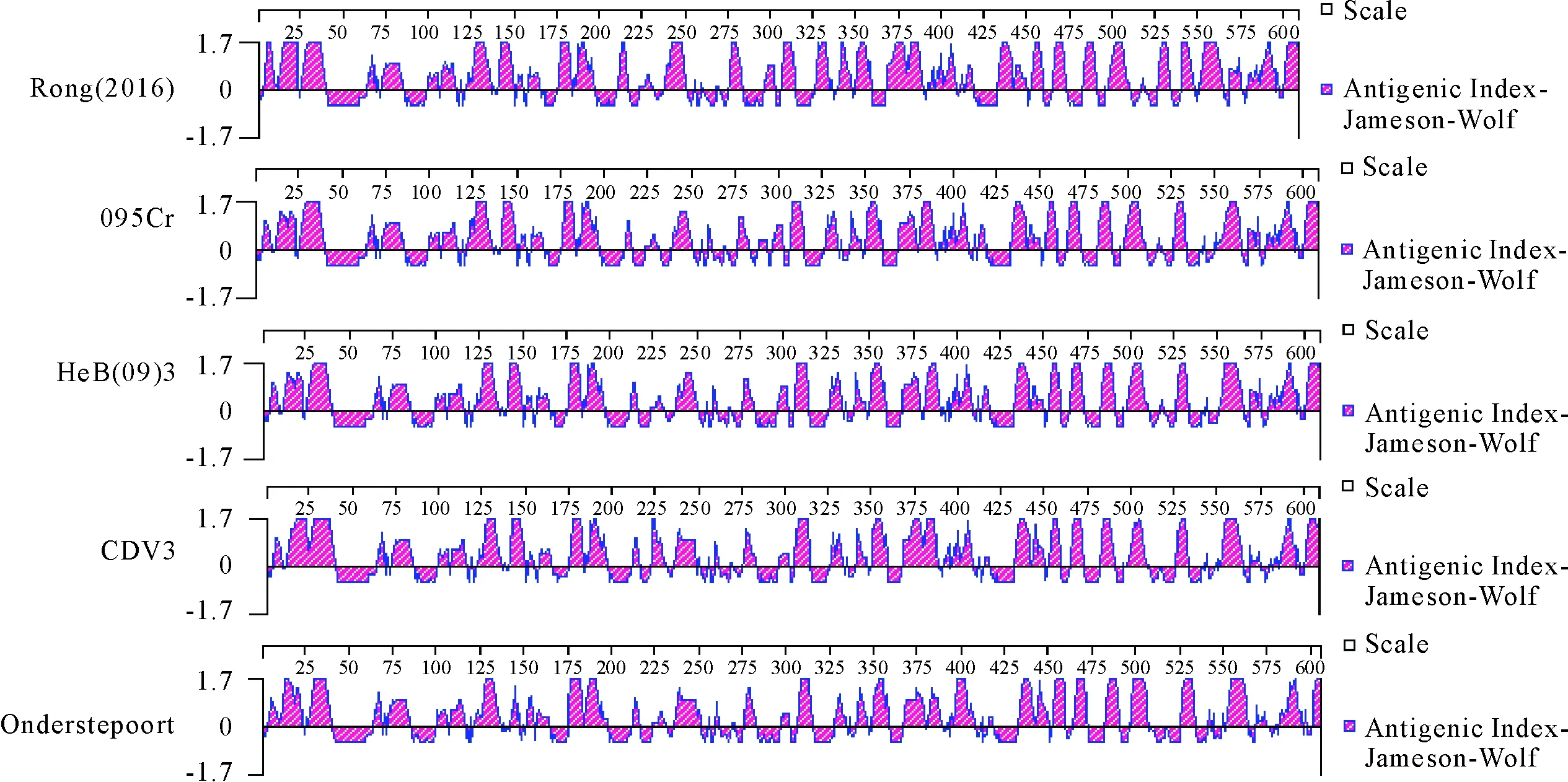
图4 Rong(2016)与野毒株和疫苗株抗原表位比对
3 讨论
基于H蛋白基因序列构建系统发生树可将犬瘟热病毒分13个不同的基因型[4-6]。本试验在进行氨基酸和核苷酸序列比对及系统进化树分析时,采用的不同参考株是文献报道的发现新病毒并进行分型时常用的参考毒株,有很强的参考价值和实际意义。犬瘟热病毒基因型的差异与病毒的地区分布有直接关系,在我国主要流行的是Asia-1型,本次从貉子体内分离的病毒也属于Asia-1型。
H蛋白潜在的N基化位点的增加可能会使CDV的毒力增强[11]。本试验得到的病毒H糖基化位点比一般野毒株还要多1个N连接糖基化位点,所以可以推测其毒性相较于其他野毒株毒性可能会更强,研究表明近年来我国山东等地区毛皮动物中发生CD,可能与该变异株的流行有关[12]。CDV与SLAM受体结合的重要区域包括H蛋白542-544位的氨基酸[13],它的变化会影响病毒入侵细胞、致病性等,而本试验得到的H蛋白中在542-544 aa正好形成了一个新的N连接糖基化位点,这或许导致CDV H蛋白的中和表位改变,使得病毒对疫苗株诱导的中和抗体的中和作用产生逃避。另一方面,得到的H蛋白在 525-550 aa间多了1个抗原表位,新毒株在抗原性和毒力上发生了变异,能够逃避疫苗免疫的保护,可能是临床免疫失败的原因。有研究表明疫苗株和野毒株膜蛋白抗原表位是不同的[14]。因此选择新分离的当地流行株作为CDV疫苗毒株尤为重要。
近年来,貉、水貂、狐狸等毛皮动物养殖场频繁发生犬瘟热,本试验的实验动物是荣成某养殖场送检的貉,经了解本养殖场免疫过犬瘟热疫苗但是还是发生了犬瘟热,本试验研究了从貉体内分离的CDV H基因个方面的变化,其抗原区域和N糖基化位点都比疫苗株多, 加强对临床上犬瘟热疫苗免疫失败的原因探究,有助于保护毛皮动物。另外,研发纯度高、安全性好、不含病原成分不能引起动物染病且诱导动物产生细胞免疫和体液免疫的新型疫苗刻不容缓。
[1] Panzera Y,Sarute N,Iraola G,et al.Molecular phylogeography of canine distemper virus:Geographic origin and global spreading[J].Mol Phylogenet Evol,2015,92(11):147-154.
[2] 薛向红,胡 博,赵建军,等.犬瘟热疫苗研究进展[J].动物医学进展,2015,36(10)85-89.
[3] Zhao J,Shi N,Sun Y,et al.Pathogenesis of canine distemper virus in experimentally infected raccoon dogs,foxes,and minks[J].Antiviral Res,2015,122(10):1-11.
[4] Ke G M,Ho C H,Chiang M J,et al.Phylodynamic analysis of the canine distemper virus hemagglutinin gene[J].BMC Vet Res,2015,25,11:164. doi: 10.1186/s12917-015-0491-9.
[5] Espinal M A,Diaz F J,Ruiz- Saenz J.Phylogenetic evidence of a new Canine distemper virus lineage among domestic dogs in Colombia South America[J].Vet Microbiol, 2014,172(1-2):168-176.
[6] Bi Z W,Wang Y S,Wang X L,et al.Phylogenetic analysis of canine distemper virus in domestic dogs in Nanjing,China[J].Arch Virol,2015,160(2):523-527.
[7] 孙彦刚,赵建军,史 宁,等.狐源犬瘟热病毒的分离鉴定及 H 基因遗传变异分析[J].中国预防兽医学报,2016,38(3):206-210.
[8] 黄 娟,隋晓梅,王怡男,等.犬瘟热病毒疫苗免疫逃逸株的血凝素基因变异研究[J].华北农学报,2016,31(2):231-238.
[9] 曾杨茹,王 娅,郗立新,等.犬瘟热病毒 H 基因变异及其细胞受体研究进展[J].动物医学进展,2016,37(2):70-74.
[10] 何洪彬,李金中,夏咸柱,等.熊猫等动物犬瘟热病毒附着蛋白基因的遗传多样性[J].病毒学报,2000,16(3):238-241.
[11] Sawatsky B,Von Messling V.Canine distemper viruses expressing a hemagglutinin without N-glycans lose virulence but retain immunosuppression[J].J Virol,2010,84(6):2753-2761.
[12] Zhao J,Zhang H,Bai X,et al.Emergence of canine distemper virus strains with two amino acid substitutions in the hemagglutinin protein detected from vaccinated carnivores in North-Eastern China in 2012-2013[J].Vet J,2014,200(1):191-194.
[13] Von MesslingV,Zimmer G,Herrler G,et al.The hemagglutinin of canine distemper virus determines tropism and cytopathogenicity[J].J Virol,2001,75(14):6418-6427.
[14] Iwatsuki K,Tokiyoshi S,Hirayama N,et al.Antigenic differences in the H proteins of canine distemper viruses[J].Vet Microbiol,2000,71(3/4):281-286.
Cloning and Sequence Analysis of Canine Distemper Virus Hemagglutinin Gene from Raccoon Dog
JIAO Xu-na,WU Jia-qi,LI Bei-ying,YAN Xiao-min,HUANG Juan,SHAN Hu
(CollegeofAnimalScience&VeterinaryMedicine,QingdaoAgriculturalUniversity,Qingdao,Shandong,266109,China)
In order to detect canine distemper virus (CDV) and analysis the genetic variation of hemagglutinin gene(H),samples were collected from a CDV-suspected raccoon dog and subjected to amplification of H gene by the method of reverse transcription-polymerase chain reaction(RT-PCR),PCR amplicon was cloned and sequenced,and the sequence of H gene was analyzed.The results indicated that the racoon dog was infected with CDV strain.The homologies of nucleotide and amino acid among sequence obtained from this experiment and reference strains are 89.1%-98.0% and 85.4%-97.5%,respectively.the CDV strain belong to Asia-1 wild strain based on phylogenetic analysis,the analysis of N-glycosylation sites showed that there was a more N-glycosylation site at the 524th amino acid,and there was a more antigenic epitope at 525-550 aa compared to other strains.
Canine distemper virus; hemagglutinin gene(H); N-glycosylation; phylogenetic analysis
2016-06-27
国家自然科学基金项目(31472196);青岛农业大学应用型人才培养特色名校工程2015年大学生科技创新项目
焦绪娜(1990-),女,山东烟台人,硕士研究生,主要从事动物传染病防制与生物制品学研究。△同等贡献作者 *通讯作者
S852.659.5;Q789
A
1007-5038(2017)02-0022-06
