脂多糖诱导哺乳期SD大鼠乳腺炎模型的建立
2017-03-02解颖颖胡学权崔京春李广兴张瑞莉
解颖颖,胡学权,崔京春,李广兴,葛 铭,张瑞莉*
(1.东北农业大学动物医学学院,黑龙江哈尔滨 150030;2.大连民族学院生命科学学院,辽宁大连 116600)
脂多糖诱导哺乳期SD大鼠乳腺炎模型的建立
解颖颖1,胡学权1,崔京春2,李广兴1,葛 铭1,张瑞莉1*
(1.东北农业大学动物医学学院,黑龙江哈尔滨 150030;2.大连民族学院生命科学学院,辽宁大连 116600)
本试验旨在建立脂多糖(LPS)诱导哺乳期SD大鼠乳腺炎病理模型,为后续治疗乳腺炎的深入研究奠定基础。SD大鼠30只,于产后72 h随机分为对照组(5只)和试验组(25只),试验组随机分为5组,各试验组大鼠经第4对乳头灌注LPS,剂量分别为10 、20、30、40、50 μg/侧,对照组灌注等量PBS。灌注后24 h观察记录各大鼠临床症状、乳腺组织病理学变化。结果发现,在各试验组大鼠第4对乳腺均可观察到不同程度的炎症反应,且与LPS剂量呈正比例关系。结果表明,成功建立了LPS诱导哺乳期SD大鼠乳腺炎模型。
SD大鼠;脂多糖;乳腺炎;病理模型
在世界各地,乳腺炎是一种影响乳用家畜和哺乳期妇女健康的重要疾病[1]。乳腺炎能导致哺乳期妇女、奶牛、绵羊、山羊、母猪、蜂王和母马乳腺的肿胀、疼痛、发红及发热[2]。该病不仅危害人类健康且为全球乳业带来了严重的损失。另外,乳腺炎对动物的繁殖性能也有严重影响,与健康的奶牛相比,乳腺炎患畜的受孕率较低[3]。
乳腺炎的致病因素复杂多样,通常由多种病原微生物感染引起。环境性致病菌以大肠埃希菌为代表,该菌引起的急性临床型乳腺炎约占本类型乳腺炎的40%~50%,而其中近25%的病例最终死亡或遭到淘汰[4]。大肠埃希菌具有很多毒力因子,包括内毒素(lipopolysaccharides,LPS)、荚膜、黏附素和外毒素等,其中LPS是大肠埃希菌主要的致病毒力因子,是被感染宿主识别的中心,其致病机理也被广泛研究,能够引起动物机体急性炎症过程。研究发现,LPS作用于乳腺诱发的乳腺炎与大肠埃希菌感染诱发的乳腺炎相似[5]。因此,本研究拟以哺乳期SD大鼠为实验动物,用5种不同剂量的LPS诱导其乳腺炎症,研究致病后24 h的乳腺眼观病理及组织学变化,以期建立适合乳腺炎研究的动物模型,为该疾病的发生机制、治疗方法和预防措施的深入研究提供科学的基础模型。
1 材料与方法
1.1 材料
1.1.1 试验动物 健康成年SD大鼠,雌性30只,体重250 g~280 g,均未孕;雄性15只,体重300 g~350 g。饲喂市售饲料,自由饮水。适应性饲养1周后,将雌鼠与雄鼠按2∶1比例同笼饲养,使之交配受孕。
1.1.2 主要试剂与仪器 脂多糖(LPS),Sigma公司产品,由O55:B5血清型大肠埃希菌分离提纯,灭菌PBS配成1 mg/mL,置-20℃避光保存备用;正置荧光显微镜,德国Leica公司产品。
1.2 方法
1.2.1 实验动物分组 30只健康SD孕鼠随机分为对照组(5只)和试验组(25只),试验组随机分为5组(T1组、T2组、T3组、T4组、T5组)。正常分娩后72 h,用犬眠宝(0.20 mL/kg~0.25 mL/kg)肌肉注射将母鼠麻醉、保定。用750 mL/L乙醇溶液对第4对乳腺区域(腹部乳区)进行消毒,然后用小镊子轻轻夹起乳头,用微量注射器轻轻刺破皮肤沿乳头管插入,分别灌注LPS 10 μg/侧(T1组)、20 μg/侧(T2组)、30 μg/侧(T3组)、40 μg/侧(T4组)和 50 μg/侧(T5组),对照组灌注等量的灭菌 PBS,每只鼠两侧乳头均灌注相同剂量,然后轻柔地按摩乳腺使灌注的溶液均匀分布。乳房灌注前的24 h将仔鼠与母鼠分离。
1.2.2 样品采集及处理 乳头灌注LPS后24 h观察并记录各组母鼠临床症状和乳腺局部变化。肌肉注射犬眠宝将母鼠麻醉,然后断颈处死。将其放于750 mL/L酒精中消毒后小心剪开腹部皮肤,暴露第4对乳腺,快速观察乳腺病理变化并将其剥离,于40 mL/L多聚甲醛中固定24 h。
1.2.3 病理组织学观察 取固定好的乳腺组织经梯度乙醇脱水、二甲苯透明、浸蜡、包埋、切片及HE染色后,进行病理组织学观察分析并采集图像。
2 结果
2.1 临床症状和眼观病理变化
灌注LPS 24 h后,与对照组相比,T1组和T2组母鼠采食饮水基本正常,但是活动量减少;T3组和T4组母鼠采食量和饮水量均减少、精神沉郁;T5组母鼠有3只死亡,2只未死亡的母鼠食欲明显下降、精神萎靡、弓背蜷缩。剖开腹部皮肤,眼观乳腺组织,对照组呈淡粉色,有光泽(图1A);T1组和T2组乳腺组织颜色较正常组大鼠暗、体积轻微增大、可见血管数量稍增多(图1B、图1C);T3组乳腺呈潮红色、可见血管数量明显增多(图1D);T4组乳腺呈灰白色、明显肿胀、可见血管数量多(图1E),且可见出血点和出血斑(图1E);T5组乳腺呈暗紫色、肿胀(图1F)。

A.对照组乳腺组织;B~F.试验组乳腺组织(B.灌注10 μg/侧LPS后24 h的乳腺组织;C.灌注20 μg/侧LPS后24 h的乳腺组织;D.灌注30 μg/侧LPS后24 h的乳腺组织;E.灌注40 μg/侧LPS后24 h的乳腺组织;F.灌注50 μg/侧LPS后24 h的乳腺组织)
A.Control group; B-F.Treatment groups (B.Mammary gland infused with 10 μg/side; C.Mammary gland infused with 20 μg/side; D.Mammary gland infused with 30 μg/side; E.Mammary gland infused with 40 μg/side; F.Mammary gland infused with 50 μg/side)
图1 灌注LPS后SD大鼠乳腺组织眼观病理变化
Fig.1 Grossly histopathological lesions in SD rat mammary gland infused with different amount LPS
2.2 病理组织学变化
光学显微镜下观察各组SD大鼠乳腺组织,分析组织炎症程度。
对照组:泌乳期SD大鼠乳腺小叶结构清晰,小叶间间隙小。腺泡结构完整,腺泡高度扩张,各个腺泡间无明显间隙,腺泡腔内乳汁充盈,染色呈粉紫色;乳腺上皮细胞成扁平状,胞核呈深蓝色(图2A)。
T1组和T2组:乳腺小叶结构清晰,小叶间间隙较对照组增宽,结缔组织稍有增多,T2组偶见粉色着染的渗出液。腺泡结构完整,相对增宽的各个腺泡间零星散在红细胞,腺泡腔内乳汁充盈但比较稀薄,乳汁呈粉紫色。腺泡腔内还散在有少量多形核中性粒细胞、淋巴细胞,少量乳腺上皮细胞轻微肿胀,核稍大而圆,也有个别乳腺上皮细胞坏死、脱落(图2B和图2C)。
T3组:乳腺小叶结构比较清晰,小叶间间隙明显增宽,结缔组织增多,小叶间血管内可见较多红细胞。腺泡结构相对完整,腺泡间散在有少量红细胞、多形核中性粒细胞,部分乳腺上皮细胞体积增大,有的坏死脱落。腺泡腔内乳汁减少、淡染呈絮状,且腔内散在少量坏死脱落的上皮细胞(图2D)。
T4组:乳腺小叶结构仍可辨认,但小叶间间隙相对T3组有减小趋势,小叶间及血管内可见多量红细胞,有时可见粉色着染的渗出物。乳腺腺泡结构不清晰,上皮细胞肿胀、排列疏松,腺泡腔内乳汁减少呈絮状,其间散在有脱落的上皮细胞。各个腺泡之间散在较多红细胞,小叶间、腺泡腔内可见一定数量的多形核中性粒细胞浸润(图2E)。
T5组:乳腺小叶结构被破坏,基本无法辨认,乳腺腺泡结构不完整甚至消失,有的小叶周围有结蹄组织增生,相对T3、T4组红细胞数量有所减少。乳腺上皮细胞肿胀明显,胞核大而圆,较多坏死脱落。脱落的上皮细胞间还可见散在较多的多形核中性粒细胞,腺泡间散在红细胞(图2F)。
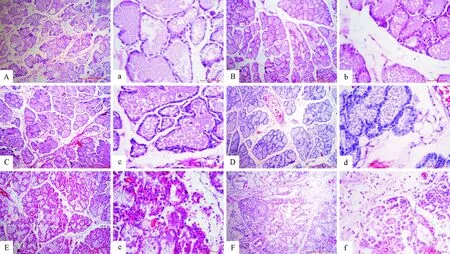
A、a.对照组乳腺组织;B~F和b~f.试验组乳腺组织(B、b.灌注10 μg/侧LPS的乳腺组织;C、c.灌注20 μg/侧LPS的乳腺组织;D、d.灌注30 μg/侧LPS的乳腺组织;E、e.灌注40 μg/侧LPS后的乳腺组织;F、f.灌注50 μg/侧LPS的乳腺组织)
A and a.Control group; B-F and b-f .Treatment groups (B,b.Mammary gland infused with 10 μg/side; C,c.Mammary gland infused with 20 μg/side; D,d.Mammary gland infused with 30 μg/side; E,e.Mammary gland infused with 40 μg/side; F,f.Mammary gland infused with 50 μg/side)
图2 灌注LPS后SD大鼠乳腺组织病理学变化
Fig.2 Microscopically histopathological lesions in SD rat mammary gland infused with different amount LPS
3 讨论
乳腺炎掣肘我国畜牧业,甚至危害人类健康。深入研究乳腺炎的发病机制、治疗方法和预防措施,需要规范化和标准化的动物模型。之前,已有报道用奶牛、奶山羊和兔等动物制作乳腺炎病理模型[6],从1970年首例小鼠乳腺炎模型出现开始[7],由于鼠的价格低廉且乳腺结构与乳用家畜相似,已成为该模型制作的首选动物。国内外建立乳腺炎模型较多采用小鼠作为试验动物,小鼠成本低、重复性好。但是小鼠体积小、乳腺组织供应少、乳房灌注操作困难。本研究采用SD大鼠作为乳腺炎病理模型研究的试验动物,大鼠体积大,相对小鼠操作简便,更易进行乳房灌注,而且便于确定穴位的位置,适合针刺研究。另外,在大鼠中,Wistar大鼠进行乳腺炎模型建立的相对较多,而本研究则选择了SD大鼠进行模型的建立。因SD大鼠生长发育较Wistar大鼠更快,繁育性能好,对性激素敏感性强[8]。研究表明激素对乳腺炎的发生及治疗有一定的作用[9],为了建立更适合激素、激素样作用的植物提取物或针刺治疗乳腺炎研究的模型,本文选择了SD大鼠作为实验动物。
金黄色葡萄球菌、大肠埃希菌等常作为乳腺炎模型制作的诱导细菌。张大松等[10]用高、低浓度金黄色葡萄球菌和大肠埃希菌联合诱导SD大鼠发生乳腺炎。大肠埃希菌是环境致病菌,通常引起乳用家畜的急性临床型乳腺炎,张书起等[11]通过在健康SD大鼠一侧乳区接种200 μL(107CFU/mL)大肠埃希菌悬液复制出乳房炎病理模型。但是,大肠埃希菌菌体结构复杂,与其相比,LPS能够表现出更好的一致性和重复性。LPS是大肠埃希菌细胞壁外膜中的主要成分,在体内可以通过细胞信号转导系统激活单核巨噬细胞、内皮细胞、上皮细胞等合成和释放多种细胞因子和炎性介质,进而引起机体一系列的反应[12],是引起乳腺炎的主要致病因子。LPS与大肠埃希菌全菌体引起的最初机体免疫反应相似[13],同样能引起红、肿、热、痛、全身机能障碍及产奶量下降等临床特征。为了复制出重复性更好、管理化更标准、操作更简易的急性临床型乳腺炎动物模型,目前倾向于采用LPS制作乳腺炎动物模型。然而不同剂量的LPS引起乳腺炎症的程度有何不同,详细报道较少。本研究选用哺乳期SD大鼠,根据钟凯等[14]报道,经乳头灌注不同剂量的LPS(分别为10 、20、30、40、50 μg/侧),制作相同时间点不同程度的乳腺炎病理模型。临床症状和眼观病理变化显示,与对照组相比,灌注LPS后24 h,各试验组大鼠乳腺均有不同程度的炎症反应和损伤,50 μg/侧剂量组出现母鼠死亡现象;与之相对应的病理组织学显示,试验组SD大鼠乳腺组织有不同程度的充血、出血和PMN浸润,乳腺小叶和腺泡结构有不同程度的破坏,乳汁产量及性状也有所改变,这些变化与LPS呈剂量依赖关系。与齐宏亮等[15]报道的临床型奶牛乳腺炎组织病理学类似,LPS诱导的SD大鼠乳腺炎也呈现出不同类型的乳腺炎,如浆液性、出血性、卡他性乳腺炎。根据本研究结果显示,乳头灌注50 μg/侧LPS会导致大鼠死亡,不宜进行乳腺炎治疗的相关研究;乳头灌注40 μg/侧LPS会出现明显的充血、出血、水肿和PMN浸润等炎症反应,适合乳腺炎发生机制及治疗效果研究。乳头灌注LPS量越少,炎症程度越轻。因此,在今后的研究中,可根据试验所需乳腺炎炎症程度的不同要求来选择不同剂量的LPS制作乳腺炎病理模型。
综上所述,SD大鼠体积大,便于确定穴位的位置,适合针刺研究,而且能通过控制LPS剂量诱导出批量重复性好的乳腺炎动物模型。故而本研究为后续针刺、艾灸、电针及中草药提取物、激素等治疗乳腺炎研究提供了可靠的动物模型,为动物乳腺炎治疗机制的深入研究奠定了基础。
不同剂量的LPS能诱导哺乳期SD大鼠不同程度的急性临床型乳腺炎,乳头灌注40 μg/侧LPS能引起明显的乳腺炎症且不会造成SD大鼠死亡。
[1] Zou S,Zhu W,Ma H,et al.β-Glucan modulates the lipopolysaccharide-induced innate immune response in rat mammary epithelial cells[J].Int Immunopharmacol,2013,15(2):457-465.
[2] Xiao H B,Wang C R,Liu Z K,et al.LPS induces pro-inflammatory response in mastitis mice and mammary epithelial cells:Possible involvement of NF-κB signaling and OPN[J].Pathol Biol,2015,63(1):11-16.
[3] Asaf S,Leitner G,Furman O,et al.Effects ofEscherichiacoli- andStaphylococcusaureus-induced mastitis in lactating cows on oocyte developmental competence[J].Reproduction,2013,147(1):33-43.
[4] Miao J F,Zhu Y M,Gu B B,et al.Evaluation of the changes of immune cells during lipopolysaccharide-induced mastitis in rats[J].Cytokine,2007,40(2):135-143.
[5] Gao X J,Guo M Y,Zhang Z C,et al.Bergenin plays an anti-Inflammatory role via the modulation of MAPK and NF-κB signaling pathways in a mouse model of LPS-induced mastitis[J].Inflammation,2014,38(3):1-9.
[6] 武瑞仙,楼丽华,赵 虹.实验性乳腺炎动物模型研究进展[J].浙江中西医结合杂志,2010,20(2):126-128.
[7] Chandler R L.Experimental bacterial mastitis in the mouse[J].J Med Microbiol,1970,3(2):273-282.
[8] 郑振辉.实用医学实验动物学[M].北京:北京大学医学出版社,2008.
[9] 寇明明,刘玉辉,刘 婧,等.奶牛乳腺炎治疗研究进展[J].动物医学进展,2015,36(6):126-129.
[10] 张大松,张源淑,邹思湘,等.两种病原菌联合诱导大鼠实验性乳腺炎研究[J].西北农林科技大学学报:自然科学版,2007(7):11-14.
[11] 张书起,于洪川.大鼠试验性乳房炎病理模型[J].农业科学研究,2006,27(4):27-31.
[12] 张晓音,吴 旻,李雨萌,等.脂多糖的效应及其机理研究进展[J].动物医学进展,2015,36(12):133-136.
[13] Hoeben D,Burvenich C,Trevisi E,et al.Role of endotoxin and TNF-alpha in the pathogenesis of experimentally induced coliform mastitis in periparturient cows[J].J Dairy Res,2000,67(4):503-514.
[14] 钟 凯,王艳玲,邹思湘,等.乳头管灌注内毒素诱发大鼠实验性乳腺炎模型的建立[J].农业生物技术学报,2005,13(5):654-658.
[15] 齐宏亮,李 婧,张 涌,等.乳房炎奶牛组织和血液病理学研究进展[J].动物医学进展,2014,35(8):99-102.
Establishment of LPS-induced Mastitis Model in Lactation SD Rats
XIE Ying-ying1,HU Xue-quan1,CUI Jing-chun2,LI Guang-xing1,GE Ming1,ZHANG Rui-li1
(1.CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin,Heilongjiang,150030,China; 2.CollegeofLifeSciences,DalianNationalitiesUniversity,Dalian,Liaoning,116600,China)
The present study aimed to make a pathological model of mastitis in SD rats,being the basis of further study of mastitis treatment.30 lactation rats were randomly divided into control group (5 rats) and 5 trial groups (5 rats each group) 72 h after parturition.10,20,30,40,50μg LPS was inoculated into the each side mammary gland through the forth pair of nipples of the rats in trial groups,compared to the control groups with the equal volume of PBS .Exactly 24 h after inoculation,the clinical symptoms of the rats and histopathological lesions of the mammary glands were observed and recorded.The results showed that different inflammatory responses were observed in the forth mammary glands of SD rats,and a dose-dependent correlation was detected between LPS and inflammatory response.The results indicated that LPS-induced mastitis model was successfully constructed in lactation SD rats.
SD rat; lipopolysaccharide; mastitis; pathological model
2016-07-11
国家自然科学基金项目(31272584)
解颖颖(1989-),女,河南开封人,硕士,主要从事兽医病理学研究。*通讯作者
S852.3
A
1007-5038(2017)02-0046-05
