福建省羊传染性脓疱病毒F1L、B2L和VIR基因的遗传变异分析
2017-03-02林裕胜江锦秀胡奇林
林裕胜,江锦秀,江 斌,游 伟,胡奇林
(福建省农业科学院畜牧兽医研究所,福建福州 350013)
研究论文
福建省羊传染性脓疱病毒F1L、B2L和VIR基因的遗传变异分析
林裕胜,江锦秀,江 斌,游 伟,胡奇林*
(福建省农业科学院畜牧兽医研究所,福建福州 350013)
为探明2014年-2015年在福建省流行的羊传染性脓疱病毒(ORFV)遗传变异情况,对10株ORFV流行毒株的F1L、B2L和VIR基因进行克隆、测序及分析。结果表明,10株ORFV F1L基因之间的核苷酸序列同源性为97.6%~100%,与国内株的核苷酸序列同源性为96.8%~99.7%,与NZ2参考株的核苷酸序列同源性为96.3%~97.1%;同NZ2参考株比较,FJ-YT2014缺失2个氨基酸;10株ORFV B2L基因之间核苷酸序列同源性为97.5%~99.9%,与国内株的核苷酸序列同源性为96.7%~99.5%,与NZ2参考株的核苷酸序列同源性为96.7%~97.7%;10株ORFV VIR基因之间的核苷酸序列同源性为95.8%~99.5%,与国内株的核苷酸序列同源性为94.6%~99.6%,与NZ2参考株的核苷酸序列同源性为94.6%~96.4%。基于基因核苷酸序列的遗传进化分析表明,10株ORFV F1L基因与福建省分离株、山西株和新疆株亲缘关系较近;10株ORFV B2L基因与新疆、山西、德国毒株亲缘关系较近;10株ORFV VIR基因与台湾、新疆株亲缘关系较近。结果提示,当前福建省流行的ORFV F1L、B2L和VIR基因尚未出现明显变异,但是其F1L、B2L和VIR基因核苷酸序列之间普遍存在异质性。
羊传染性脓疱病毒;F1L基因;B2L基因;VIR基因;变异分析
羊传染性脓疱(Orf)是由羊传染性脓疱病毒(Orf virus,ORFV)引起的羊接触性、嗜上皮性、人兽共患的传染病[1],各个年龄段的羊群都能感染发病,主要临床症状表现为嘴唇、口腔黏膜、外阴等出现丘疹或水疱,其中对羔羊的危害最严重。ORFV属于痘病毒科副痘病毒属成员,病毒的核酸为线性双股DNA,基因组全长约145 kb。F1L基因位于病毒基因组的中部,其编码产生的蛋白是病毒表面微管的成分之一,能够诱导宿主产生中和抗体和细胞免疫,是刺激机体产生免疫应答的主要免疫原蛋白[2-3]。B2L基因位于病毒基因组左末端的BamHⅠ/B片段上,其编码产生的蛋白是病毒囊膜的主要成分之一,可刺激机体产生强烈的抗体反应,是ORFV的保护性抗原之一[4-5]。VIR基因可抑制干扰素的抗病毒活性,不同分离株VIR基因编码的氨基酸序列同源性差异较大[6]。
近年来,福建省多地羊场普遍发生羊传染性脓疱[7-9],其发病率为10%~72.03%,病死率为10.5%~20%,传播迅速,给养羊户造成了较大经济损失[10-11]。2013年在永安市某奶山羊场出现了挤奶工感染羊传染性脓疱病毒的病例[12],影响了其身体健康。为了明确福建省流行的ORFV毒株是否发生变异,本研究选取2014年-2015年采自福建省具有代表性的ORFV阳性病料进行F1L、VIR和B2L基因克隆测序,在此基础上进行流行毒株的基因变异和遗传进化分析,以了解福建省ORFV流行毒株遗传变异情况,为科学防控羊传染性脓疱提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病料样品与毒株 收集2014年-2015年ORFV PCR检测为阳性的病料,从中选出具有代表性的10个毒株进行研究。根据样品采集的时间及地点,对选取的10株病毒分别命名为FJ-LJ2014(连江)、FJ-LJ2015(连江)、FJ-YT2014(永泰)、FJ-YT2015(永泰)、FJ-LY2014(罗源)、FJ-MH2015(闽侯)、FJ-TJ2014(台江)、FJ-TJ2015(台江)、FJ-JA2015(晋安)及FJ-BF2015(北峰)。
1.1.2 主要试剂 病毒DNA提取试剂盒,上海生工生物工程技术服务有限公司产品;PCR反应试剂、DNA Marker DL2 000,宝生物工程(大连)有限公司产品;Nucleanse-Free Water,Promega公司产品;胶回收试剂盒和质粒提取试剂,OMEGA公司产品。
1.2 方法
1.2.1 引物设计与合成 ORFV FIL、B2L和VIR基因引物设计参照文献[6],由上海生工生物工程技术服务有限公司合成。
1.2.2 ORFV DNA提取及ORFV FIL、B2L和VIR基因扩增 将采集的病羊嘴唇部痂皮无菌剪碎、研磨,加入0.01 mol/L pH 7.2 PBS,制成10%匀浆,加入双抗至终浓度分别为青霉素2 000 U/mL、链霉素2 mg/mL,置4℃冰箱作用3 h以上,以5 000 r/min离心20 min,取200 μL匀浆上清液加到1.5 mL离心管中,按DNA提取试剂盒提取ORFV 基因组DNA。PCR反应体系为:PremixTaq10 μL,上、下游引物各1 μL,DNA模板3 μL,双蒸水补足体积至20 μL。F1L基因PCR反应条件:95℃ 5 min;94℃ 50 s,62℃ 45 s,72℃ 90 s,40个循环;72℃ 10 min,4℃结束反应[6]。B2L基因PCR扩增条件:95℃ 5 min;94℃ 50 s,60℃ 45 s,72℃ 90 s,35个循环;72℃ 10 min,4℃结束反应[6]。VIR基因PCR扩增条件:95℃ 5 min;94℃ 50 s,55℃ 35 s,72℃ 90 s,40个循环;72℃ 10 min,4℃结束反应[6]。
1.2.3 ORFV FIL、B2L和VIR基因序列测定 用试剂盒回收各基因PCR产物,连接pMD18-T载体,转入大肠埃希菌DH5a菌株,重组质粒经10 g/L的琼脂糖凝胶电泳鉴定,阳性质粒送至上海生工生物工程技术服务有限公司进行序列测定。
1.2.4 ORFV FIL、B2L和VIR基因序列分析 使用DNA Star.Lasergene.v7.1软件对ORFV F1L、B2L和VIR基因的核苷酸及推导的氨基酸序列与GenBank代表性毒株(表1)进行序列比对,构建遗传进化树。
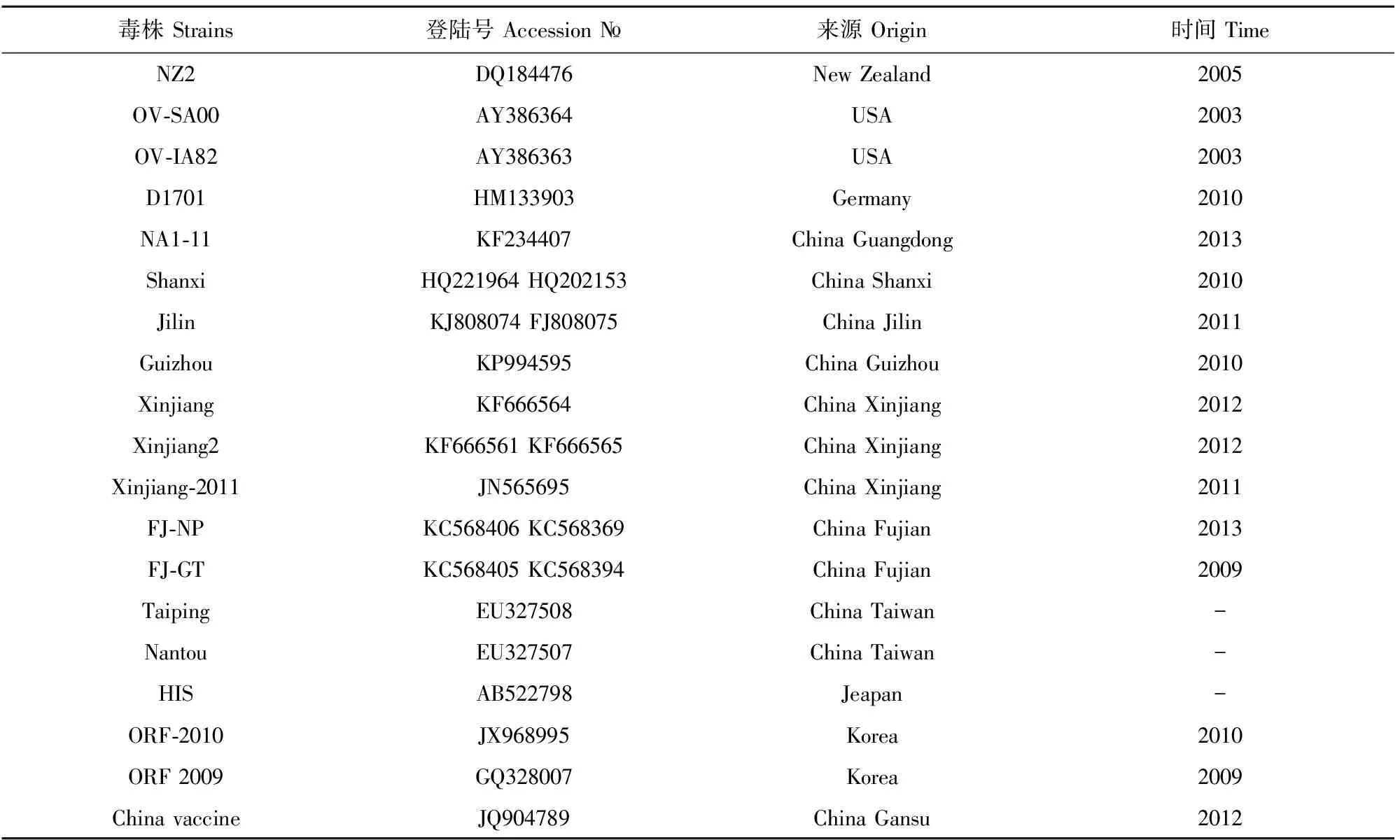
表1 ORFV参考毒株
2 结果
2.1 ORFV F1L基因核苷酸、推导的氨基酸序列同源性分析
FJ-BF2015(北峰)、FJ-TJ2014(台江)、FJ-TJ2015(台江)、FJ-JA2015(晋安)、FJ-LJ2014(连江)、FJ-LJ2015(连江)、FJ-LY2014(罗源)、FJ-MH2015(闽侯)、FJ-YT2014(永泰)、FJ-YT2015(永泰)的F1L基因序列已提交到GenBank,登录号分别为KU199833、KU199834、KU199835、KU199836、KU199837、KU199838、KU199839、KU199840、KU199841和KU199842。通过软件对比分析,发现10株ORFV的F1L基因除了FJ-YT2014株是由999个碱基组成,编码333个氨基酸外,其他9株均由1 029个核苷酸组成,编码343个氨基酸。10个ORFV毒株之间核苷酸和推导氨基酸序列同源性分别为97.6%~100%和97.2%~100%,它们与中国Guizhou、Jilin、Shanxi、Xinjiang2、FJ-GT、FJ-NP、NA1-11株核苷酸和推导的氨基酸序列的同源性分别为96.8%~99.7%和96.8%~98.9%,与美国OV-SA00、0VIA82株核苷酸和推导的氨基酸序列同源性分别为97.2%~98.3%和97.3%~98.5%,与德国D1701株核苷酸和推导的氨基酸序列同源性分别为96.2%~97.0%和96.1%~96.7%,与NZ2参考株的核苷酸和推导的氨基酸序列同源性分别为96.3%~97.1%和96.1%~96.7%。
2.2 ORFV F1L基因的遗传进化树分析
从图1遗传进化树可以看出,所有分离株与福建省分离株均处于同一分支上,其中 FJ-BF2015、FJ-LJ2014等4株ORFV福建分离株形成一个小分支,其与国内FJ-NP株亲缘关系较近,FJ-MH2015株与国内山西Shanxi株处于同一进化小分支上,FJ-TJ2015单独形成一个小分支;FJ-YT2014和FJ-YT2015聚成一个小分支;FJ-LJ2015和FJ-TJ2014聚集成一个小分支,10株ORFV福建分离株与德国D1701株、美国OV-IA82株和NZ2参考株亲缘关系较远。
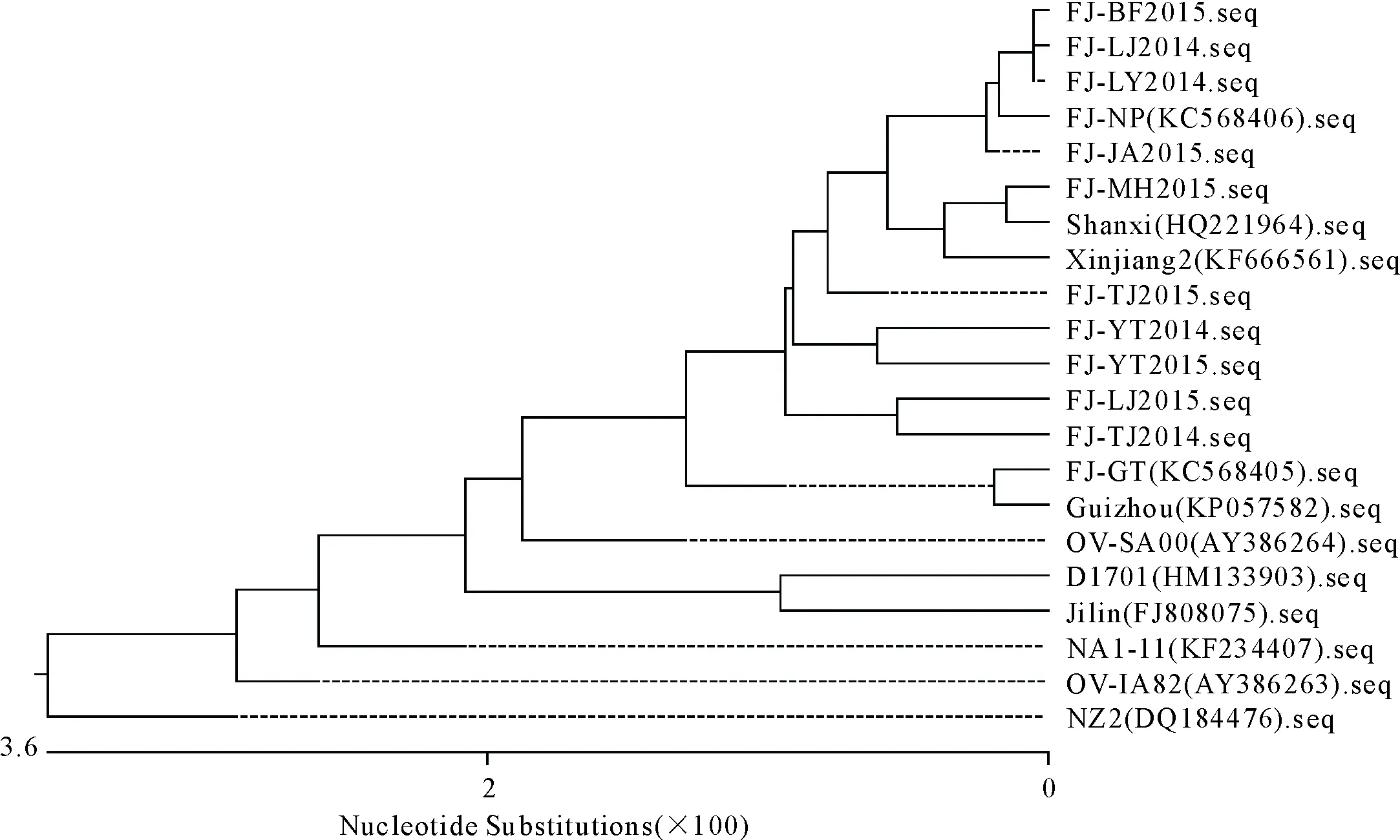
图1 F1L基因的遗传进化树
2.3 ORFV B2L基因核苷酸、推导的氨基酸序列同源性分析
FJ-BF2015(北峰)、FJ-TJ2014(台江)、FJ-TJ2015(台江)、FJ-JA2015(晋安)、FJ-LJ2014(连江)、FJ-LJ2015(连江)、FJ-LY2014(罗源)、FJ-MH2015(闽侯)、FJ-YT2014(永泰)、FJ-YT2015(永泰)的B2L基因序列已提交到GenBank,登录号分别为KU199823、KU199824、KU199825、KU199826、KU199827、KU199828、KU199829、KU199830、KU199831和KU199832。通过MegAlign软件对比分析,发现10株ORFV的B2L基因均由1137个核苷酸组成,编码379个氨基酸。10株ORFV毒株B2L基因之间核苷酸和推导氨基酸序列的同源性分别为97.5%~99.9%和97.3%~99.5%,它们与中国Guizhou、Jilin、Shanxi、Xinjiang2、FJ-GT、FJ-NP、NA1-11株的核苷酸和推导的氨基酸序列同源性分别为96.7%~99.5%和95.4%~98.9%,与美国OV-SA00、0V-IA82株的序列同源性分别为97.4%~98.3%和97.3%~98.5%,与德国D1701株的序列同源性分别为98.0%~99.1%和97.1%~98.7%,与NZ2参考株的序列同源性分别为96.7%~97.7%和96.1%~97.7%,与疫苗株的序列同源性分别为97.4%~98.2%和96.1%~97.5%。
2.4 ORFV B2L基因的遗传进化树分析
从图2遗传进化树可见,10株分离株构成三个分支,其中FJ-LJ2014、FJ-TJ2014株等4株构成一个分支,与新疆、山西毒株亲缘关系较近;FJ-BF2015、FJ-JA2015、FJ-YT2015等5株构成一个分支,其与德国D1701株亲缘关系较近;FJ-YT2014株单独构成一个分支,其与德国D1701亲缘关系较近。
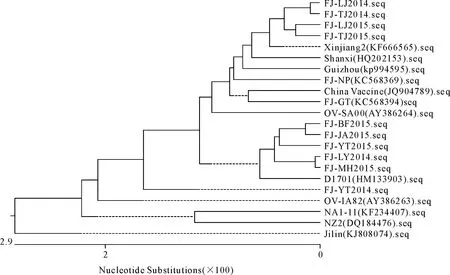
图2 B2L基因的遗传进化树
2.5 ORFV VIR基因核苷酸、推导的氨基酸序列同源性分析
FJ-BF2015(北峰)、FJ-TJ2014(台江)、FJ-TJ2015(台江)、FJ-JA2015(晋安)、FJ-LJ2014(连江)、FJ-LJ2015(连江)、FJ-LY2014(罗源)、FJ-MH2015(闽侯)、FJ-YT2014(永泰)、FJ-YT2015(永泰)的VIR基因序列已提交到GenBank,登录号分别为KU199843、KU199844、KU199845、KU199846、KU199847、KU199848、KU199849、KU199850、KU199851和KU199852。通过软件对比分析,发现10株ORFV的VIR基因均由552个核苷酸组成,编码184个氨基酸。10株ORFV毒株之间核苷酸和推导氨基酸序列的同源性分别为95.8%~99.5%和96.5%~99.1%,它们与中国NA1-11、Xinjiang、Xinjiang-2011、Nantou、Taiping的序列同源性分别为94.6%~99.6%和95.6%~99.4%,与韩国ORF-2010、ORF 2009株的序列同源性分别为95.5%~97.3%和95.7%~97.9%,与日本HIS株的序列同源性分别为94.9%~96.7%和94.6%~96.8%,与美国OV-SA00、0VIA82株的序列同源性分别为95.5%~97.3%和95.3~96.5%,与德国D1701株的序列同源性分别为93.3%~95.5%和94.2%~95.1%,与NZ2参考株的序列同源性分别为94.6%~96.4%和94.5%~95.7%。FJ-TJ2014与Xinjiang-2011核苷酸序列同源性为94.6%。
2.6 ORFV VIR基因的遗传进化树分析
从图3遗传进化树可以看出,10株ORFV福建分离株均处于同一进化分支,其中有2株与台湾Nantou株同属同一小分支,FJ-MH2015与新疆Xinjiang株同属一个小分支,余下7株分为两个小分支。10株福建分离株与NZ2参考株、美国OV-IA82株、德国D1701株亲缘关系较远。
3 讨论
羊传染性脓疱病是一种重要的人畜共患病,能导致绵羊、山羊、野生小反刍动物发病,人亦可感染发病,主要表现为丘疹和水泡。近10年来,福建省有大量关于该病发病的报道[7-9],尤其是2013年在福建省永安市某奶山羊场4个挤奶女工中有3人发生了羊传染性脓疱病毒的感染[12]。福建省羊场该病的发病率为10%~72.03%,病死率为10.5%~20%,已成为福建省羊场的一种主要疫病[10-11],给福建省养羊业造成了严重经济损失,同时,也威胁着人们的身体健康。因此,了解福建省羊传染性脓疱病毒的遗传变异情况具有重要意义。

图3 VIR基因的遗传进化树
研究表明,ORFV B2L基因和F1L基因是ORFV的主要保护性抗原基因,且非常保守,已被广泛用于ORFV分子检测、分子特征和进化分析[13-14]。本研究对来自福建省10个ORFV流行株的B2L和F1L基因进行了克隆、测序和遗传进化分析,结果显示,10个ORFV毒株F1L基因核苷酸和推导氨基酸序列同源性分别为97.6%~100%和97.2%~100%,仅FJ-LJ2014和FJ-LY2014株之间核苷酸序列同源性为100%;10个分离株与中国株的序列同源性分别为96.8%~99.7%和96.8%~98.9%。进化树分析显示,所有分离株与福建省内分离株均处于同一分支上,其中FJ-BF2015、FJ-LJ2014等4个ORFV分离株形成一个小分支,其与国内FJ-NP株亲缘关系较近,FJ-MH2015株与国内Shanxi株处于同一进化小分支上,FJ-TJ2015单独形成一个小分支;FJ-YT2014和FJ-YT2015聚集成一个小分支;FJ-LJ2015和FJ-TJ2014聚集成一个小分支,表明这10个分离株在F1L基因水平上没有明显变异,但各毒株F1L基因核苷酸序列之间普遍存在异质性。该结果与Chi X等[15]、Li H等[16]的研究结果一致。研究发现,FJ-YT2014株在160位开始缺失30个碱基,该结果与国内ORFV-HB-YX株一致[17],其生物学意义有待进一步研究。在ORFV B2L基因水平上,10个ORFV毒株B2L基因之间核苷酸和推导氨基酸序列的同源性分别为97.5%~99.9%和97.3%~99.5%,它们与中国株的序列同源性分别为96.7%~99.5%和95.4%~98.9%;进化树分析可见,10个分离株构成三个分支,FJ-LJ2014、FJ-TJ2014株等4株成一个分支,与新疆、山西毒株亲缘关系较近;FJ-BF2015、FJ-JA2015、FJ-YT2015等5株构成一个分支,其与德国D1701株亲缘关系较近;FJ-YT2014株单独构成一个分支,其亦与德国D1701株亲缘关系较近;多数毒株存在个别氨基酸的突变。表明虽然各分离株B2L基因核苷酸序列上普遍存在多样性,但B2L基因仍非常保守,没发生明显变异。该结果与Chi X等[15]、Chan K等[18]的结果一致。
VIR基因是ORFV的毒力基因之一,具有较大的变异性[19]。本研究结果显示,10个ORFV毒株VIR基因之间核苷酸和推导氨基酸序列的同源性分别为95.8%~99.5%和96.5%~99.1%,它们与中国NA1-11、Xinjiang、Xinjiang-2011、Nantou、Taiping的序列同源性分别为94.6%~99.6%和95.6%~99.4%;FJ-TJ2014与Xinjiang-2011株核苷酸序列同源性最低,为94.6%;进化树分析可见,10个ORFV福建分离株均处于同一进化分支,其中有2株与台湾Nantou株属于同一小分支,FJ-MH2015与新疆Xinjiang株同属一个小分支,余下7株分为两个小分支。结果说明,10个ORFV福建分离株未发生明显变异。该研究结果与Li H等[16]、Peralta A等[19]的结果一致。
本研究获得了10株2014年-2015年间福建省ORFV分离株B2L、F1L和VIR基因的遗传变异数据,有助于阐明ORFV的遗传变异规律,为今后有效防控福建省羊传染性脓疱提供了理论依据。
[1] Weber O,Siegling A,Friebe A,et al.Inactivated parapoxvirus ovis(Orf virus) has antiviral activity against hepatitis B virus and herpes simplex virus[J].J Gen Virol,2003,84(7):1843-1852.
[2] Oem J K,Roh I S,Lee K H,et al.Phylogenetic analysis and characterization of Korean orf virus from dairy goats:case report[J].Virol J,2009,6:167.
[3] Abrahao J S,Campos P K,Trindade G S,et al.Detection and phylogenetic analysis of Orf virus from sheep in Brazil:a case report[J].Virol J,2009,6:47.
[4] Gu S,Shi X,Shi Z,et al.Identification and phylogenetic analysis of Orf virus isolated from an out break in boer goat in Shanxi province[J].Agr Sci China,2011,10(6):946-953.
[5] McGuire M J,Johnston S A,Sykes K F.Novel immune-modulator identified by a rapid,functional screen of the parapoxvirus ovis(Orf virus) genome[J].Pro Sci,2012,10(1):4.
[6] Yang H,Meng Q,Qiao J,et al.Detection of genetic varitation in orf virus isolates epidemic in Xingjiang China[J].J Basic Microbiol,2014,54:1273-1278.
[7] 陈龙星,李奕梓,陈建梓,等.山羊传染性脓疱病的诊治[J].福建农业科技,2007(2):38-39.
[8] 魏国桢.羊传染性脓疱的诊治体会[J].中国畜禽种业,2010,11:106-107.
[9] 姜占绳.山羊传染性脓疱的诊治[J].福建畜牧兽医,2016,38(2):34-35.
[10] 王炳清.山羊口疮的诊治体会[J].畜牧兽医杂志,2008(4):124-126.
[11] 汤春胜.羊传染性脓疱性口炎的诊治报告[J].福建畜牧兽医,2014,36(4):60-61.
[12] 张家确,吴景央.一起人畜共患羊传染性脓疱病的调查[J].中国兽医杂志,2006,42(9):53-54.
[13] Zhao K,Song D,He W,et al.Identification and phylogenetic analysis of an Orf virus isolated from an outbreak in sheep in the Jinlin province of China[J].Vet Microbiol,2010,142:408-415.
[14] 张 瑜,高晶晖,张立强,等.杨凌某羊场羊口疮病毒的分离鉴定[J].动物医学进展,2015,36(1):61-65.
[15] Chi X,Zeng X,Hao W,et al.Heterogeneity among orf virus isolates from goats in Fujian province,southern China[J].PLoS One,2013,8(10):e66958.
[16] Li H,Zhu X,Zheng Y,et al.Phylogentic analysis of two Chinese orf virus isolates based on sequences of B2L and VIR genes[J].Arch Virol,2013,158:1477-1485.
[17] 郭 锐,田永祥,周丹娜,等.羊口疮病毒湖北株F1L基因克隆与遗传进化分析[J].中国草食动物科学,2015,35(6):31-34.
[18] Chan K W, Lin J W, Lee S H,et al.Identification and phylogenetic analysis of orf virus from goats in Taiwan[J].Virus Genes,2007,35:705-712.
[19] Peralta A,Robles C,Martinez A,et al.Identification and molecular characterization of orf virus in Argentina[J].Virus Genes,2015,50(3):381-388.
Genetic Variation Analysis of F1L,B2L and VIR Genes of Orf Virus in Fujian Province
LIN Yu-sheng,JIANG Jin-xiu,JIANG Bin,YOU Wei,HU Qi-lin
(InstituteofAnimalHusbandry&VeterinaryMedicine,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian,350013,China)
To investigate the variation in F1L,B2L and VIR genes of Orf virus(ORFV),a total of 10 ORFV F1L,B2L and VIR genes were cloned and sequenced from different farms in Fujian province during 2014-2015.The results showed that the nucleotide sequences of F1L gene shared 97.6%-100% similarities within them,shared 96.8%-99.7%similarities with domestic strains and shared 96.3%-97.1% similarities with NZ2 strain.Compared with NZ2 strain,there were 2 amino acids deletion.The nucleotide sequence of B2L gene shared 97.5%-99.9% similarities within them,shared 96.7%-99.5% similarities with domestic strains and shared 96.7%-97.7%similarities with NZ2 strain.The nucleotide sequence of VIR gene shared 95.8%-99.5% similarities with them,shared 94.6%-99.6%similarities with domestic strains and shared 94.6%-96.4% similarities with NZ2 strain.Phylogenetic analysis showed that F1L gene of the 10 ORFV strains had a closer relationship with the Fujian,Shanxi and Xinjiang strains; B2L gene of the 10 ORFV strains had a closer relationship with the Xinjiang,Shanxi and Germany strains;VIR gene of 10 ORFV strains had a closer relationship with the Taiwan and Xinjiang strains.The results indicated that 10 ORFV F1L,B2L and VIR genes have not a significant variation,but 10 ORFV F1L,B2L and VIR genes have widespread heterogeneity between nucleotide sequences.
Orf virus; F1L gene; B2L gene; VIR gene; variation analysis
2016-06-06
福建省科技计划项目(2014R1102);福建省公益性科研专项(2014R1101002-8)
林裕胜(1988-),男,福建漳州人,研究实习员,主要从事动物传染病研究。*通讯作者
S852.659.1;Q789
A
1007-5038(2017)02-0001-06
