胰岛素抵抗对大鼠海马及Aβ42代谢的影响
2017-02-22张晓曼李彦玲任月勤李艾凡张杰文
张晓曼 李彦玲 任月勤 李艾凡 张杰文
郑州市第一人民医院神经内科 郑州 450000
胰岛素抵抗对大鼠海马及Aβ42代谢的影响
张晓曼 李彦玲 任月勤 李艾凡 张杰文
郑州市第一人民医院神经内科 郑州 450000
目的 建立糖皮质激素所致阿尔茨海默病模型,观察胰岛素抵抗大鼠海马β-淀粉样蛋白42(Aβ42)的表达及对大鼠学习记忆的影响,探讨胰岛素抵抗在糖皮质激素所致阿尔茨海默病(AD)发病机制中的作用。方法 30只健康雄性SD大鼠,随机挑选10只作为空白组(CON)。余下的采用地塞米松腹腔注射21 d制作胰岛素抵抗模型,以稳态模型的胰岛素抵抗指数将其分为胰岛素抵抗组及对照组,Y迷宫测定大鼠造模后的学习记忆成绩,HE、Nissl染色观察海马组织形态学改变,免疫组化法及免疫印迹法观察Aβ42在海马CA1区神经元中的表达。结果 (1)Y迷宫试验显示,实验组记忆能力较空白组明显减退,差异有统计学意义(P<0.01)。实验组记忆能力对照组减退,差异有统计学意义(P<0.05),空白组、对照组2组间差异有统计学意义(P<0.05)。(2)Nissl染色:空白组海马CA1区细胞形态规则,排列整齐而密,实验组部分细胞形态欠规则,出现核固缩,坏死,细胞排列紊乱,表明有大量的神经元细胞死亡。对照组的病理结果则介于两者之间。(3)海马CA1 Aβ42免疫组化结果:空白组、对照组2组Aβ42阳性细胞表达相似且与实验组比较相对少,平均积分光密度值低,2组差异有统计学意义(P<0.05),实验组较对照组明显增多,平均积分光密度值增高,差异有统计学意义(P<0.05);(4)海马CA1区Aβ42免疫印迹检测示:实验组Aβ42表达水平较空白组上调,差异有统计学意义(P<0.01),实验组Aβ42表达水平较对照组上调,差异具有统计学意义(P<0.05)。空白组、对照组间差异无统计学意义(P<0.05)。结论 (1)糖皮质激素可致大鼠海马出现神经元损伤和病理学改变。出现胰脑岛素抵抗的大鼠表现尤为明显。但无明显的老年斑及神经原纤维缠结。(2)糖皮质激素可增加Aβ42的表达,胰岛素抵抗大鼠的改变更为明显,说明胰岛素抵抗参与了糖皮质激素所致阿尔茨海默病的发病机制。
胰岛素;胰岛素抵抗;Aβ42;阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性进行性中枢神经系统变性疾病,以渐进性记忆障碍、人格改变及语言障碍等神经精神症状为特征。流行病学资料显示,AD患病率呈现显著上升趋势,65岁以上人口发病率为5%~10%,75岁以上老年人口中则上升为20%以上[1]。随着人口预期生命延长,AD的发病率及病死率也在逐步提高,目前治疗方法仅能缓解症状,不能改变疾病病程,且无有效的预防及治愈措施[2-3]。可见,AD已成为威胁人类健康和发展的最严峻社会问题之一[4]。近年来,越来越多研究表明,糖皮质激素在阿尔茨海默病的发病及发展中发挥着极其重要的作用,在其发病的机制方面,尽管很多人做了很多的研究,包括糖皮质激素与β-淀粉样蛋白的产生、微管相关蛋白tau蛋白的异常磷酸化、神经的可塑性、氧化应激及钙紊乱之间的关系等。这些研究结果为阐明AD的发病机制提供新的视角,并为AD的临床用药提供新的潜在靶点,具有重要意义。但糖皮质激素与阿尔茨海默病之间的发病机制至今仍未完全清楚。
所谓胰岛素抵抗(IR)是指各种原因使体内胰岛素水平高于正常而其有效浓度及生物效能减低,导致胰岛素相对不足,可使细胞摄取和利用葡萄糖的生理效应减低。本课题拟通过应用糖皮质激素后,大鼠血糖、胰岛素水平与海马Aβ42的关系的研究,探讨糖皮质激素在AD发生中的作用机制,为阐明AD的发病机制及寻求新的治疗提供新的理论依据。
1 材料与方法
1.1 材料 健康雄性SD(Sprague-Dawley)大鼠,体质量(300±20)g(清洁级),许可证号:scxk(豫)2005-0001,由河南省实验动物中心提供。胰岛素放射免疫测定试剂盒(北京北方生物技术研究所),β-淀粉样肽抗体(Aβ42抗体)(美国Sigma公司),Bradford蛋白浓度测定试剂盒(Solarbio公司),免疫组化试剂盒(北京中杉公司)。
1.2 方法
1.2.1 动物的筛选及动物模型的制作及评价:动物由河南省实验动物中心提供,大鼠适应性喂养1周,随机分成正常空白组(CON)、地塞米松组。根据张芳林[5]地塞米松(dexamethasone,DEX)诱导方法建立胰岛素抵抗大鼠模型,大鼠内眦眼眶静脉丛穿刺取血,放射免疫法测定胰岛素,取血后继续给药。以稳态模型的胰岛素抵抗指数将其分为胰岛素抵抗组及对照组(空白对照组大鼠RI均数加3个标准差的视为胰岛素抵抗,每组10只)。
1.2.2 胰岛素抵抗指数评价:待血糖和胰岛素测定结果出来,以稳态模型的胰岛素抵抗指数计算公式HOMA-IR=FINs(IU/L)× FPG(mmol/L)/22.5[6]计算胰岛素抵抗指数(IRI),对各组大鼠作出IR程度评价。
1.2.3 行为学测试:行为学测试于造模后胰岛素抵抗程度评价结束后进行,用3等分Y-型电迷宫箱对所有的大鼠进行测试。
1.2.4 标本的制备:胰岛素抵抗程度评价及Y-迷宫测试结束后,采集标本。各组大鼠迅速断头取脑,沿正中矢状线将大脑分成两半,一半迅速放入—80 ℃液氮罐中冻存备行Western blot检测;另一半放入10%的甲醛溶液(pH 7.0)中,固定48 h,常规石蜡包埋,制作切片,备HE、Nissl染色、免疫组织化学染色检测。
1.2.5 Western blotting测定Aβ42酶蛋白的含量:根据使用量,按每1 mL RIPA裂解液加入10 μL的PMSF配置组织细胞裂解液。按200 μL/20 mg脑质量加入相当体积的组织细胞裂解液,冰上用匀浆器将组织研磨,然后在冰浴下超声波粉碎制成匀浆,取各组海马组织进行匀浆。选用20%的SDS-聚丙烯酰胺凝胶进行电泳,随后进行转膜、封闭、加入一抗(以TBST稀释1:200)、漂洗、加入二抗(以TBST按1:2 000稀释)、漂洗、DAB显色剂避光显色等步骤,待显色满意后放入TBS中终止反应。内参蛋白选用β-actin(以TBST按1:500稀释)。最后用凝胶图像分析仪对膜上条带进行分析。
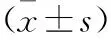
2 结果
2.1 大鼠空腹血糖、血浆胰岛素及胰岛素抵抗程度比较 实验测得空白组大鼠的胰岛素抵抗指数为5.0±1.9,由此将地塞米松喂养的大鼠胰岛素抵抗指数<10.7的为对照组,>10.7的为胰岛素抵抗组。
2.2 腹腔注射DEX对大鼠学习记忆能力的影响 与空白组比较胰岛素抵抗组学习记忆获得次数明显增加,学习记忆的正确反映率明显降低,学习记忆能力明显减退,差异有统计学意义(P<0.01)。胰岛素抵抗组与对照组、对照组与空白组比较,学习记忆次数稍有增加,正确反应率降低,差异有统计学意义(P<0.05)。见表1。

表1 各组大鼠Y迷宫试验的学习记忆成绩比较
2.3 大鼠海马CA1区HE染色结果 空白组和对照组大鼠海马CA1区锥体细胞形态规则,层次丰富,细胞线清晰,细胞排列整齐而密,胞核清晰,胞核大而圆,着色呈均匀淡蓝色或蓝色,细胞质丰富,胶质细胞散在分布,且空白组更明显;胰岛素抵抗组大鼠海马CA1区锥体细胞形态欠规则,锥体细胞排列松散,不整齐,海马内出现核固缩现象,细胞周围出现间隙,有胶质细胞浸润(见图1)。但无明显的老年斑及神经原纤维缠结。
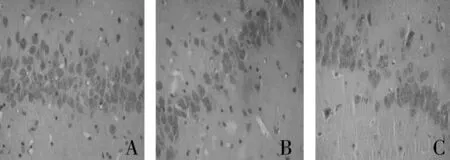
图1 海马CA1区HE染色(×400) A:空白对照组 B:对照组 C:胰岛素抵抗组
2.4 大鼠海马CA1区Nissl染色果比较 Nissl染色也是对脑组织海马CA1区锥体细胞进行形态学检测,空白组和对照组大鼠的海马锥体细胞胞浆内尼氏体丰富,细胞排列整齐;胰岛素抵抗组大鼠海马锥体细胞中尼氏体较空白组减少,有少数细胞核固缩深染,对照组介于两者之间(见图2)。
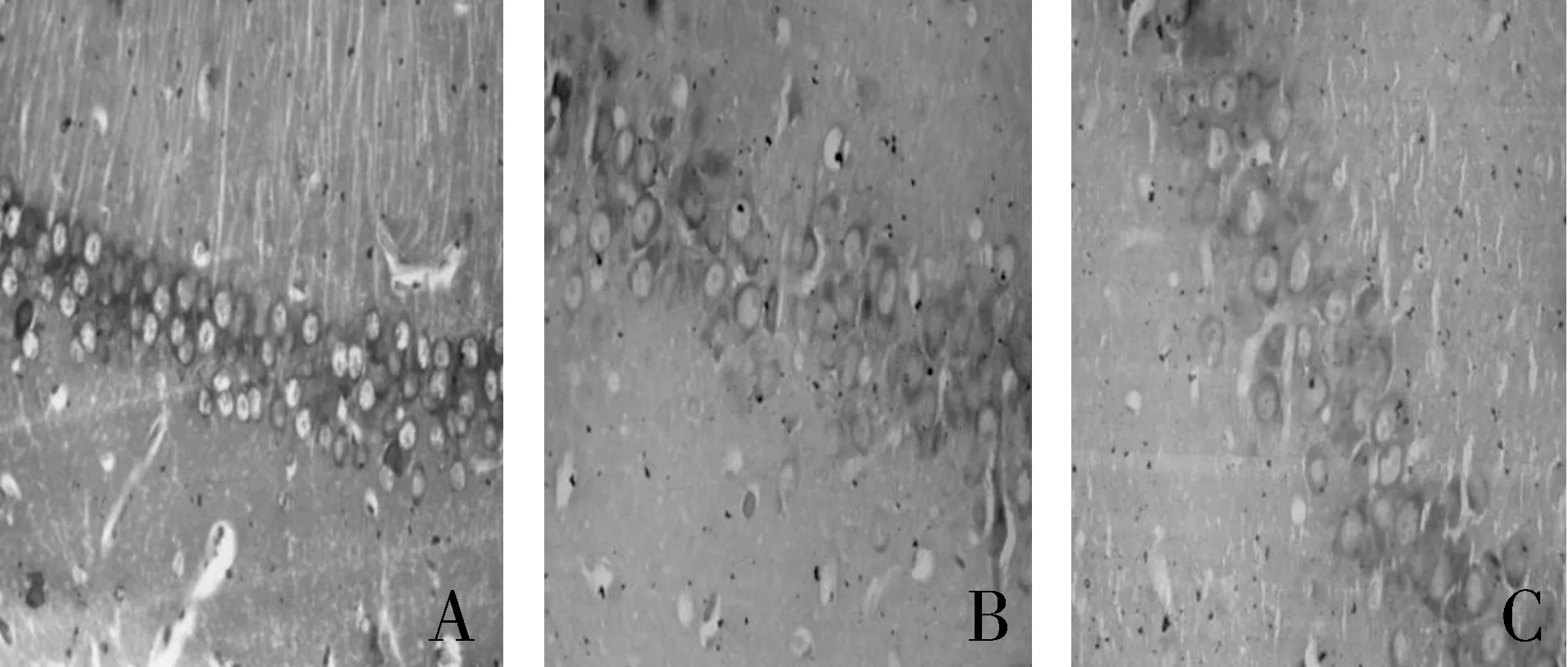
图2 海马Nissl染色结果(×400) A:空白对照组 B:对照组 C:胰岛素抵抗组
2.5 海马CA1区 Aβ42免疫组化结果分析 各组大鼠海马CA1区均可见阳性反应物,分布于神经元胞膜和胞浆,部分在细胞外间隙沉积,胰岛素抵抗组Aβ42阳性细胞较空白组明显增多,胞浆着色明显加深,且出现细胞外阳性着色。对照组病理结果介于胰岛素抵抗组与空白组之间。Biosens Digital Imaging System v1.6图象分析系统分析显示:胰岛素抵抗组与对照组、对照组与空白组比较差异有统计学意义(P<0.05),而胰岛素抵抗组与空白组显示差异有统计学意义(P<0.01)。见图3,表2。

图3 海马免疫组化结果(×400) A:空白对照组 B:对照组 C:胰岛素抵抗组

表2 各组大鼠海马CA1区免疫组化结果比较
注:与空白组与对照组比较,*P<0.05;与胰岛素抵抗与空白组比较,Aβ42阳性细胞数及平均积分光密度,**P<0.01
2.6 各组大鼠Western blot检测结果 各组大鼠海马组织进行匀浆,采用Western blot方法,用Aβ42抗体测海马组织Aβ42蛋白含量,见图4,表3。利用图像分析软件对Western blot印迹进行定量分析,PBS阴性对照组未出现条带影,其余各组在6~15 kD处皆出现一明显较宽条带,表明蛋白表达明显增加,胰岛素抵抗组与空白组OD值比较差异有统计学意义(P<0.01)。而胰岛素抵抗组与空白组、对照组,空白组与对照组比较差异有统计学意义(P<0.05)。见图4。

图4 Western blot结果(×400)

表3 各组大鼠Aβ42灰度值比较
注:与空白组与对照组比较,*P<0.05;与胰岛素抵抗与空白组比较,Aβ42灰度值比较,**P<0.01
3 讨论
阿尔茨海默病(AD)是一种以进行性认知功能减退为特征的中枢神经退行性疾病,其特征的病理学表现是Aβ在细胞外的沉积形成老年斑、tau蛋白过度磷酸化在细胞内形成神经原纤维缠结(NFT)、海马锥体细胞颗粒变性和神经元的缺失等。
DEX是糖皮质激素(glucocorticoids,GCs)类似物,GCs是一种公认的应激激素,是肾上腺皮质在下丘脑和垂体调节下分泌的一种物质,正常浓度的GCs能维持机体正常的生长发育、参与多种体内代谢过程及调节中枢神经系统功能。GCs可直接拮抗胰岛素作用和抑制胰岛素释放而使糖脂代谢紊乱,降低胰岛素敏感性引起IR。它不直接破坏β细胞,而是通过影响糖代谢,降低糖耐量出现IR特征。最近大量研究报道糖皮质激素与AD发病的关系密切。
很多的研究试验证实超过一定限度的GC水平介导与AD发病密切相关,且超过一定限度,随糖皮质激素量的增加,其导致AD的发病率也在增加,可能影响AD的产生、tau 蛋白的高度磷酸化、神经的可塑性及氧化应激、钙紊乱等[7-10]。导致AD发病的具体机制尚不完全清楚。
本实验中,光镜下HE及Nissl染色可见空白组大鼠海马CA1区神经元细胞形态规则、层次丰富、细胞排列整齐,Nissl染色胞浆内尼氏体丰富、周围胶质细胞散在分布;胰岛素抵抗组鼠海马CA1区神经元细胞形态欠规则、细胞排列松散、紊乱、有核固缩现象,许多细胞胞体缩小,HE染色胞浆呈淡蓝色,仅呈很淡的蓝色甚至蓝色消失、胞核固缩深染,Nissl染色大鼠的海马神经元细胞胞浆内尼氏体减少或缺如、胶质细胞浸润明显。而对照组的病理变化介于上述两者之间。Y型迷宫试验显示,胰岛素抵抗组学习记忆获得次数明显增加,学习记忆的正确反映率明显降低,胰岛素抵抗组与对照组、对照组与空白组比较差异有统计学意义(P<0.05),而胰岛素抵抗组与空白组比较差异更为明显(P<0.01)。本研究表明,给予糖皮质激素后有IR特征的大鼠海马神经元细胞受到的损伤最明显,进而影响大鼠的记忆、认知功能,使认知能力受损。
本实验中,海马CA1区 Aβ42免疫组化结果及免疫印迹检测结果,胰岛素抵抗组与对照组、对照组与空白组比较差异有统计学意义(P<0.05),而胰岛素抵抗组与空白组比较差异更为明显(P<0.01),表明糖皮质激素诱发胰岛素抵抗大鼠的大脑海马中Aβ42表达增多,该结果与镜下结果一致。由此本实验证实,给予糖皮质激素诱发胰岛素抵抗导致大脑海马中Aβ42表达增多,是导致阿尔茨海默病的原因之一。
至于病理学检测未发现明显的老年斑及神经原纤维缠结,考虑其原因为在正常生理情况下,机体是一个整体,多种因素相互作用使内部环境处于一个相对稳定的动态环境中,脑内可持续产生Aβ,机体可通过有效的清除措施抑制其聚集,两者一定程度上维持一定的平衡。胰岛素抵抗仅是影响Aβ42表达增多的因素之一,其在短时间内不一定出现导致胰岛素抵抗大鼠出现病理学上的明显改变。
研究表明,海马神经元中含有大量糖皮质激素受体(glucocorico- ids receptor,GR)[11],而且海马区GR最大结合能力均高于其他脑区,因此,海马是GCs最为敏感的神经靶位之一,也是AD病理损害最严重的脑区之一[12]。高浓度下,其还可通过血脑屏障进入脑内,危害中枢神经系统,引起海马萎缩、突触丢失、神经元凋亡[13-14]。也有研究表明,GC与大脑学习记忆的神经调节机制呈“U”型相关,低剂量可促进大脑的学习记忆,高剂量则抑制大脑的学习记忆,但机制并不清楚。但在本实验中胰岛素抵抗组与对照组相比较,胰岛素抵抗组的变化较为明显,表明胰岛素抵抗也是GCs引起海马损伤的机制之一。
另外,已有研究表明,SAD的发生是多因素造成的。本实验也仅仅说明糖皮质激素所诱导的胰岛素抵抗参与了AD的发病,是导致其发病的原因之一。但糖皮质激素参与AD发病的机制也可能是多方面的,其具体机制有待我们进一步研究。
[1] Salloway S,Mintzer J,Weiner MF,et al.Disease-modifying theraoies in Alzheimer’s disease[J].Alzheimer’s Dement,2008,4(2):65-79.
[2] Kisser S,Hotte SD,Lankers D,et al.Impact of vascular pathology on survival times 173 dementia patients-Hachinski’s ischemic score as a predictive tool for clinical purposes[J].Z Gerontol Geriatr,2008,41(1):51-55.
[3] Josephs KA,Whitwell JL,Duffy JR,et al.Progressive aphasis secondary to Alzheimer disease vs FTLD pathology[J].Neurology,2008,70(1):25-34.
[4] Ramsden CM,Kinsella GJ,Ong B,at el.Performance of everyday actions in mild Alzheimer’s disease[J].Neuropsychology,2008,22(1):17-26.
[5] 张芳林,刘小莺,林益川,等.地塞米松诱发的大鼠胰岛素抵抗模型[J].Chin Appl Physiol,2002,18(1):98-100.
[6] Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[7] Green KN,Billings LM,Roozendaal B,et al.Glucocorticoids increase amyloid-beta and tau pathology in a mouse model of a lzheimer's disease[J].J Neurosci,2006,26(35):9 047- 9 056.
[8] Dong H,Yuede CM,Yoo HS,et al.Corticosterone and related recept or expression are associated with increased beta-amyloid plaques in isolated Tg2576 mice[J].Neuroscience,2008,155(1):154-163.
[9] Lee KW,Kim JB,Seo JS,et al.Behavioral stress accelerates plaque pathogenesis in the brain of Tg 2576 mice via generation of metabolic oxidative stress[J].J Neurochem,2009,108(1):165-175.
[10] Li WZ,Li WP,Yao YY,et al.Glucocorticoids increase impairments in learning and memory due to elevated amyloid precursor protein expression and neuvonal apoptosis in 12-month old mice[J].Eur J Pharmacol,2010,628(1-3):108-115.
[11] Höschl C,Hajek T.Hippocampal damage mediated by corticosteroidsa Neuropsy-chiatric research challenge[J].Eur Arch Psychiatry Clin Neurosci,2001,251(Supl 2):1 181-1 188.
[12] Lupien SJ,Wilkinson CW,Brière S,et al.Acute modulation of aged human memory by pharmacological manipulation of glucocorticoids[J].J Clin Endocrinol Metab,2002,87(8):3 798-3 807.
[13] McEwen BS.Effects of adverse experiences for brain structure and function[J].Biol Psychiatry,2000,48(8):721-731.
[14] Fogarty MP,Downer EJ,Campbell V.A role for c-Jun N-terminal kinase 1(JNK1),But not JNK2,in the beta-amyloid-mediated stabilization of protein p53 and induction of the apoptotic cascade in cultured cortical neurons[J].Biochem J,2003,371(Pt3):789-798.
(收稿2016-11-17)
R-332
A
1673-5110(2017)02-0026-04
